Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Caractérisation et Application des échantillonneurs passifs pour la surveillance des pesticides dans l'eau
Dans cet article
Résumé
A protocol about the characterization and application of five different passive sampling devices is presented.
Résumé
Cinq échantillonneurs passifs d'eau différents ont été étalonnés dans des conditions de laboratoire pour la mesure de 124 héritage et les pesticides utilisés en cours. Cette étude fournit un protocole pour la préparation de l'échantillonneur passif, étalonnage, méthode d'extraction et d'analyse instrumentale. Taux d'échantillonnage (R S) et passifs des coefficients de partage échantillonneur-eau (K PW) ont été calculées pour le caoutchouc de silicone, polaire organique intégrative chimique sampler POCIS-A, POCIS-B, SDB-RPS et C 18 disque. L'absorption des composés sélectionnés dépendait de leurs propriétés physico - chimiques, à savoir, le caoutchouc de silicone a montré une meilleure absorption des composés plus hydrophobes (log coefficient de partage octanol-eau (K OW)> 5.3), alors que POCIS-A, POCIS-B et SDB- RPS disque était plus approprié pour les composés hydrophiles (log K OW <0,70).
Introduction
Les pesticides sont introduits en continu dans le milieu aquatique et peuvent présenter un risque pour les organismes aquatiques 1. La surveillance des pesticides dans l'environnement aqueux est généralement réalisée en utilisant l' échantillonnage ponctuel, cependant, cette technique d'échantillonnage n'a pas pleinement compte des variations temporelles des concentrations dues aux fluctuations des entrées de débit ou épisodiques (par exemple, les précipitations, les débordements d'égouts unitaires, lagune d' eaux usées libération) 2 , 3. Ainsi, les méthodes de surveillance doivent être améliorées pour une meilleure estimation des risques environnementaux associés aux pesticides. L' échantillonnage passif permet une surveillance continue sur une longue période de temps avec un minimum d' infrastructures et de faibles concentrations de contaminants 4,5.
Les échantillonneurs passifs se sont révélés être un outil précieux pour la surveillance dans les eaux souterraines 6, l' eau douce 7-10, les eaux usées et les eaux marines 11 12. Outre des fins de surveillance 13,14, échantillonneurs passifs ont également été utilisés pour l' analyse non-cible 15, tests de toxicologie 16,17, et comme une alternative à la biosurveillance dans les sédiments et 18. Les échantillonneurs passifs accumulent les produits chimiques en continu de l' eau et fournissent le temps moyen pondéré (TWA) concentrations 14. L'absorption du contaminant dépend de la fréquence d'échantillonnage (R S) et coefficient de partage échantillonneur-eau passive (K PW), qui dépend de la conception passive de l' échantillonneur, le matériel d'échantillonnage, les propriétés physico - chimiques du contaminant, et les conditions environnementales (par exemple, l' eau turbulence, température) 13,14,19,20.
La vidéo détaillée vise à montrer comment calibrer et appliquer des échantillonneurs passifs pour les pesticides dans l'eau. Les objectifs spécifiques inclus i) pour effectuer la préparation, l' extraction et l' analyse instrumentale pour 124 pesticides individuels en utilisant cinq types de sampl passive différentsteurs, y compris le caoutchouc de silicone, polaire organique intégrative chimique échantillonneur (POCIS) -A, POCIS-B, SDB-RPS et C 18 disque, ii) d'évaluer R S et K PW pour les pesticides dans une étude en laboratoire d'absorption, et iii) pour montrer comment sélectionner l'échantillonneur passif appropriée du composé d'intérêt et de la façon de calculer les concentrations TWA pour l'échantillonneur passif respective cible.
Normes de référence et dispositifs échantillonneurs passifs
Les composés cibles comprenaient 124 l' héritage et les pesticides actuellement utilisés , y compris les herbicides, les insecticides et les fongicides (tableau 1). Mélange standard interne (IS mélange) inclus fénoprop (2,4,5-TP), la clothianidine-D 3, éthion et terbuthylazine-D 5. D'autres produits chimiques utilisés comprennent le méthanol (MeOH), l'acétonitrile (ACN), l'acétone (ACE), le dichlorométhane (DCM), le cyclohexane (CH), l'acétate d'éthyle (EA), le pétrole etelle (PE), le 2-propanol, une solution d'ammoniaque à 25%, d'acide acétique (HAc) et d'acide formique (FA). Cinq dispositifs différents d'échantillonnage passif ont été caractérisés, y compris le caoutchouc de silicone, POCIS-A et POCIS-B, SDB-RPS, et C 18 disque 1,21.
Tableau 1. Taux d'échantillonnage de l' échantillonneur passif (R 'S, L jour -1), les coefficients de partage échantillonneur-eau (K' PW, L kg -1) et les équations (Eq.) Utilisés pour le calcul des concentrations dans les échantillons de terrain pour particuliers les pesticides a. (Reproduit de Journal of Chromatography A, 1405, Lutz Ahrens, atlasi Daneshvar, Anna E. Lau, Jenny Kreuger, Caractérisation des cinq dispositifs d'échantillonnage passif pour la surveillance des pesticides dans l'eau, 1-11, Copyright (2015), avec la permission d'Elsevier .) 22 S'il vous plaît cliquer ici pour télécharger ce fichier.
Protocole
1. Passif Sampler Conception et préparation
- Des feuilles de caoutchouc de silicone
- Découper les feuilles de caoutchouc de silicone (600 mm x 600 mm, 0,5 mm d'épaisseur) en bandes de 2,5 mm x 600 mm et 2,5 mm x 314 mm en utilisant un outil de coupe en acier inoxydable et les relier au moyen d'un rivet aveugle en acier inoxydable (3,2 mm x 10 mm ) avec un pistolet à rivet pour obtenir une taille totale échantillonneur de bande de 2,5 mm x 914 mm (surface = 457 cm 2, la masse de sorbants = 15,6 g, volume = 22,9 cm 3).
- Placer les caoutchoucs de silicone dans une chambre d'extraction de Soxhlet. Ajouter 50 ml EA dans la chambre d'extraction et ajoutez 250 ml EA et trois pierres d'ébullition dans un ballon rond de la bouteille de 500 ml.
- Relier la chambre d'extraction avec le flacon de la bouteille et d'un condenseur. Nettoyer les caoutchoucs de silicone par extraction Soxhlet pendant 96 heures à environ 80 ° C, et les sécher ensuite sous azote gazeux doux.
- Fixez les stri en caoutchouc de siliconepe d'un porte-échantillon croisillon en acier inoxydable par enroulement de la bande de caoutchouc de silicone autour des tiges sur le support (figure 1). Fixer chaque extrémité de la bande de caoutchouc de silicone à une tige sur le support à l'aide des attaches de câbles.

Figure 1. Schéma de caoutchouc de silicone. Échantillonneur passif schématique pour le caoutchouc de silicone montrant la fixation de la bande de caoutchouc de silicone à un acier inoxydable échantillon d'araignée porte - A) du haut et B) la vue de côté. S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
- POCIS-A et POCIS-B
- Pour POCIS-A, placer 220 mg de HLB sorbant en vrac (surface = 1,78 x 10 6 cm 2) entre deux 9,0 cm par 9,0 cm square polyéthersulfone (PES) membranes (figure 2).
- Pour POCIS-B, placer 220 mg d'un mélange adsorbant ( par exemple, une résine hydroxylée de polystyrène-divinylbenzène (80%) et d' un adsorbant carboné dispersé sur un copolymère de styrène et de divinylbenzène (20%)) (surface spécifique = 2,82 x 10 6 cm 2) entre deux membranes PES (figure 2).
- Comprimer le sorbant et deux PES entre deux anneaux en acier inoxydable manuellement (Ø intérieur = 5,4 cm) et le fixer sur un porte-échantillon d'acier inoxydable (Figure 2).

Figure 2. Schéma de disques de l' échantillonneur passif. Échantillonneur passif schématique pour POCIS A, B POCIS, SDB-RPS disque et C 18 disque montrant A) l'assemblage de l'échantillonneur passif en utilisant des anneaux en acier inoxydable, polyéthersulfone (PES) Membranes, et la phase de réception, et B) l'assemblage sur un porte-échantillon en acier inoxydable. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- SDB-RPS disque et C 18 disque
- Placez la (surface = 35 cm 2, de masse de sorbants = 0,34 g, volume = 1,7 cm 3) SDB-RPS et C 18 disques (surface = 35 cm 2, la masse de sorbants = 0,58 g, volume = 1,7 cm 3) entre deux membranes PES (figure 2). Compresser les disques et les deux PES entre deux anneaux en acier inoxydable manuellement (Ø intérieur = 5,4 cm) et le fixer sur un porte-échantillon d'acier inoxydable (Figure 2).
2. Des expériences de laboratoire Uptake
NOTE: Les expériences d'absorption de laboratoire ont été effectuées pour caractériser quantitativement l'absorption kinetics pour 124 pesticides individuels pour cinq dispositifs échantillonneurs passifs différents dans des conditions contrôlées.
- Mener l'étude de l' absorption dans des récipients en verre rectangulaires (chaque ~ 95 L): Réservoir 1) caoutchouc de silicone (n = 16), le réservoir 2) POCIS-A (n = 16), POCIS-B (n = 16), et le réservoir 3 ) SDB-RPS disque (n = 16), C 18 disque (n = 16). Remplir d'eau naturelle dans les trois réservoirs.
- Effectuer toutes les expériences à une température constante de l' eau (~ 20 ° C) et dans des conditions turbulentes à l'eau (~ 10 cm sec -1) à l' aide de deux pompes électriques fixées au mur de chaque côté. Effectuer les expériences dans l'obscurité afin de minimiser l'effet de la photodégradation.
- De Spike chaque récipient en verre avec un mélange standard de pesticides contenant 124 pesticides à l' aide d' une seringue en verre (c ≈ 400 ng L -1 pour les pesticides individuels dans le réservoir d'eau). Extraire les échantillonneurs passifs manuellement à partir des cuves, à des intervalles de 5, 11, 20 et 26 days, afin de déterminer les taux des pesticides d'échantillonnage.
- Surveiller les concentrations des pesticides dans chaque réservoir en recueillant des échantillons de 100 ml d'eau aux jours 0, 5, 11, 20 et 26. L'analyse des échantillons d'eau est effectuée 21 comme décrit par ailleurs.
- Pour le contrôle de la qualité, d'exposer des échantillons blancs à l'air ambiant pendant 1 h au jour 0 et ensuite stocker et les traiter comme des échantillons réels. Stocker tous les extraits, ainsi que 100 ml d'échantillons d'eau prélevés dans les réservoirs à -18 ° C jusqu'à analyse ultérieure.
Extraction 3. Sample
- Le caoutchouc de silicone
- Avant extraction, sécher la bande de caoutchouc de silicone sous un courant de haute pureté de l'azote gazeux.
- Pour chromatographie-spectrométrie de masse de gaz (GC-MS) analyse, effectuer l'extraction solide-liquide par extraction Soxhlet 22.
- Placer le caoutchouc de silicone dans l'extracteur Soxhlet. Ajouter 250 ml PE / ACE (50/50, v / v) et 3 boipierres ling dans le ballon de bouteille ronde.
- Spike du caoutchouc de silicone avec 100 ul d'un mélange IS (c = 5 ng ml - 1) à l' aide d' une seringue en verre. Ajouter 50 ml de PE / AS (50/50, v / v) dans l'extracteur Soxhlet. Allumer l'appareil et exécuter l'extraction Soxhlet pendant 19 heures, puis éteindre le chauffage.
- Concentrer les extraits par évaporation rotative suivie d'azote doux purge à 1 ml. Échanger le solvant de CH / AS (90/10, v / v), en ajoutant trois fois 1 ml de CH / AS (90/10, v / v) pendant la purge d'azote à 1 ml.
- Pour la chromatographie liquide-spectrométrie de masse tandem (LC-MS / MS) analyse, effectuer l'extraction par extraction Soxhlet 22.
- Placer le caoutchouc de silicone dans l'extracteur Soxhlet. Ajouter 250 ml de MeOH et 3 pierres d'ébullition dans le ballon de bouteille ronde et 50 ml de MeOH dans l'extracteur Soxhlet. Spike du caoutchouc de silicone avec 100 ul d'un mélange IS (c = 5 ng ml - 1) en utilisant un verre syringe.
- Allumer l'appareil et exécuter l'extraction Soxhlet pendant 19 heures, puis éteindre le chauffage. Concentrer les extraits par évaporation rotative suivie d'azote doux purge à 1 ml. Remplacez le solvant ACN en ajoutant 1 ml ACN pendant l'azote purge à 1 ml.
- POCIS-A et POCIS-B
- Ouvrez l'échantillonneur POCIS soigneusement et transférer le sorbant avec de l'eau ultrapure en utilisant un entonnoir dans un solide extraction en phase (SPE) cartouche vide de polypropylène pré-nettoyée (6 ml) contenant deux polyéthylène (PE) frittes. Sécher le sorbant sous vide pour éliminer l'eau. Enregistrer le poids de la cartouche SPE vide et emballé pour contrôler le poids de la matière sorbante. S'il vous plaît noter que les différentes cartouches sont utilisées pour GC-MS et l'analyse LC-MS / MS.
- Avant l'élution, spike sorbant avec 100 ul d'un mélange IS (c = 5 ng ml - 1) à l' aide d' une seringue en verre. sorbants Eluer POCIS-A et POCIS-B à l'aide de 5ml EA pour GC-MS 22.
- Concentrer les extraits à 1 ml par de l'azote doux purge. Échanger le solvant de CH / AS (90/10, v / v), en ajoutant trois fois 1 ml de CH / AS (90/10, v / v) pendant la purge d'azote à 1 ml.
- Les cartouches éluer POCIS-A et B-POCIS à l' aide de 1,5 ml de MeOH puis par 8 ml de DCM / MeOH (80/20; v / v) pour analyse par LC-MS / MS 22. Concentrer les extraits à 1 ml par de l'azote doux purge. Remplacez le solvant ACN en ajoutant 1 ml ACN pendant l'azote purge à 1 ml.
- SDB-RPS et C 18 disque
- Transfert des disques individuels de SDB-RPS et C 18 disques dans un bêcher en verre et les sécher sous azote gazeux. Spike les disques avec 100 ul d'une IS mélange (c = 5 ng ml - 1) à l' aide d' une seringue en verre et sonication eux deux fois dans un récipient en verre à la température ambiante, d' abord avec 5 ml d'AE pendant 10 min, puis avec 3 ml d'EA pendant 10 min.
- Transfert boextraits e dans un tube de verre, se concentrent les 2 ml par soufflage d'azote douce vers le bas, et les diviser en deux fractions de 1 ml (pour GC-MS et l'analyse LC-MS / MS, respectivement).
- Concentrer les extraits à 0,5 ml par de l' azote doux purge et échanger le solvant CH / ACE (90/10, v / v) pour l' analyse GC-MS 22. Concentrer les extraits à 0,5 ml par de l' azote doux purge et échanger le solvant à ACN pour l' analyse LC-MS / MS 22.
4. Les échantillons d'eau
- Spike échantillon de 20 ml d'eau avec 100 ul d'une IS mélange (c = 5 ng ml - 1) en utilisant une seringue en verre, ajouter 3 ml de DCM, vortex pendant 3 minutes et transvaser dans un séparateur de phases pour l' analyse GC-MS 22.
- Après que les deux phases sont séparées, la phase percoler DCM dans un tube de verre. Répéter l'extraction en utilisant 3 ml de DCM, et rincer le tube avec 2 ml de DCM. Enfin, concentrer les extraits à 0,5 ml par de l'azote doux purge et exchange du solvant à CH / AS (90/10, v / v).
- Analyser les échantillons d'eau à l' aide de l' injection de grand volume, analogue à la méthode décrite par ailleurs par LC-MS / MS 21.
5. Analyse instrumentale
- L'analyse par CG-SM
- Effectuer l'analyse instrumentale des extraits CH / ECA en utilisant des systèmes GC-MS à ionisation électronique (EI) et le mode ionisation chimique négative (NCI), respectivement 22.
- Pour la méthode GC-MS en utilisant IE, injecter aliquotes de 1 pl avec la méthode d'injection de splitless sur une colonne HP-5ms UI (30 m, 0,25 mm de diamètre intérieur, 0,25 um film).
- Pour la méthode utilisant GC-MS CI, injecter aliquotes de 3 pi sur une colonne HP-5ms UI (30 m, 0,25 mm de diamètre intérieur, 0,25 um film).
- L'analyse HPLC-MS / MS
- Effectuer l'analyse instrumentale de l'ACN extraits par HPLC-MS / MS interfacé avec une source d'ionisation électrospray en négatif ((-) ESI) et ions positifs mode ((+) ESI) 22.
- Pour ESI (+), on dilue 100 ul de l'extrait d'ACN avec 900 ul d'eau ultrapure ajusté à pH 5 en utilisant FA.
- Pour ESI (-), dilué 100 ul d'ACN extrait avec 900 ul de solution de 1% FA dans de l'eau ultrapure.
- Pour ESI (+), en utilisant un gradient binaire constitué de 2-propanol / méthanol / 10 mM de formiate d' ammonium (02/06/92, v / v / v) et du MeOH à un débit de 0,3 ml min -1 d'écoulement.
- Pour ESI (-), utiliser un gradient binaire constitué d'ACN / eau ultrapure 0,1% HAc et ACN + 0,1% HAc à un débit de 0,3 ml min -1 d'écoulement.
- Injecter tous les échantillons en utilisant une grande injection de volume de 500 ul en utilisant deux colonnes en ligne SPE ( à la fois 20 x 2 mm id et 20-25 granulométriques um) et une colonne analytique (C18, 100 x 3 mm, 3,5 pm) 21.
6. Théorie sur l'échantillonnage passif
NOTE: Le profil absorption de la substance chimique à l'échantillonneur mediu passivem (PSM) est divisé en trois sections: linéaire, curviligne et équilibre (figure 3).
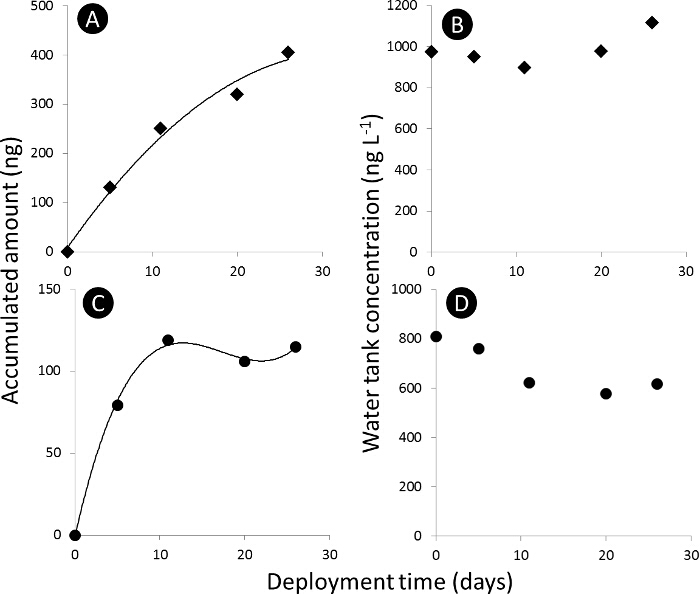
Figure 3. Passif courbe échantillonneur d'absorption. A) et C) courbe absorption pour le montant cumulé de l' acétamipride et le diméthoate, respectivement, dans les échantillonneurs passifs (N t) en ng absolue, et B) et D) la concentration du réservoir d'eau de l' acétamipride et le diméthoate, respectivement, en ng L - 1. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Calculer le volume d'eau équivalent (V eq L) pour un échantillonneur passif en divisant le montant cumulé des composés cibles dans l'échantillonneur passif après t jours d'exposition (N 't , ng) par la concentration dans la phase aqueuse en utilisant grab et échantillonnage actif intégré de temps (c w, ng L -1).
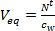 (1)
(1) - Calculer le taux d'échantillonnage (R S, L jour -1) à partir de la phase d'absorption linéaire du profil d'absorption, en prenant la pente de l' équation V en fonction du temps de déploiement.
- Calculez le K PW (L kg -1) pour les pesticides individuels en utilisant l' équation. 2.
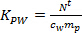 (2)
(2)
où m p est la masse de sorbants par échantillonneur (ng). - Dans la phase d'absorption linéaire, calculer la concentration TWA de l'analyte dans l' eau dérivée par l'échantillonneur passif (c TWA, ng L -1) en utilisant l' équation. 3.
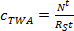 (3)
(3)
où R S est le saTaux de mpling (L jour -1) et T est le temps de déploiement (jours). - Dans la phase curviligne, calculer c TWA en utilisant l' équation. 4.
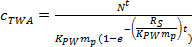 (4)
(4) - Dans la phase d'équilibre, calculer c TWA en utilisant l' équation. 5.
 (5)
(5)
7. Analyse statistique des données
- Testez la distribution non normale des données à l' aide d' un test de Shapiro-Wilk 23. Utilisez non-paramétrique de corrélation des rangs de Spearman pour K PW et R S vs propriétés physico - chimiques des pesticides testés (le rho de Spearman compris entre -1 et 1) 24.
Résultats
Cinq techniques de l' échantillonneur passif différentes ont été comparés pour l'absorption de 124 héritage et les pesticides utilisés en cours , y compris le caoutchouc de silicone (Figure 1), et POCIS A, B POCIS, SDB-RPS et C 18 disque (Figure 2). La performance du procédé d'extraction et d'analyse instrumentale a été optimisée. Les résultats des expériences d'absorption de laboratoire peut être utilisé po...
Discussion
Pour le contrôle de la qualité, comme procédure standard, blancs de laboratoire, les limites de détection (LOD), les recouvrements et la répétabilité ont été examinées 23. Quelques pesticides ont été détectés dans les échantillons témoins à des concentrations faibles. LOD ont été définies comme la valeur du point le plus bas sur la courbe d'étalonnage qui répond aux critères d'un rapport signal sur bruit 3. Les LODs moyennes étaient de 8,0 pg absolue injecté sur la colonne pou...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
matériels
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 ml | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 ml | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
Références
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon