JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
물에 농약의 모니터링을위한 특성화 및 패시브 샘플러의 응용 프로그램
요약
A protocol about the characterization and application of five different passive sampling devices is presented.
초록
다섯 가지 물 패시브 샘플러 (124) 기존의 측정 및 현재 사용되는 농약에 대한 실험실 조건에서 보정 하였다. 이 연구는 패시브 샘플러 준비, 교정, 추출 방법 및 기기 분석을위한 프로토콜을 제공합니다. 샘플링 레이트 (R 용 S) 및 수동 샘플러 - 물 분배 계수 (K PW)는 실리콘 고무, 극성 유기 화학 통합 샘플러 POCIS-A, POCIS-B, SDB-RPS 및 C (18)의 디스크에 대해 계산 하였다. 선택된 화합물의 흡수가 자신의 물리 화학적 특성에 의존, 즉, 실리콘 고무 POCIS-A 반면, POCIS-B 및 SDB-을, (옥탄 올 - 물 분배 계수 (K OW)> 5.3 로그) 소수성 화합물에 대한 더 나은 이해를 보여 주었다 RPS 디스크는 친수성 화합물 (K OW <0.70를 기록)에 더 적합했다.
서문
살충제는 지속적으로 수생 환경 소개 및 수생 생물 1에 위험을 초래할 수 있습니다. 수성 환경에서 농약의 모니터링은 전형적으로 흐름 또는 일시적인 입력 (예를 들면, 침전, 결합 하수 오버 플로우, 하수 라군 자료) (2)의 변동에 잡아 샘플링 그러나,이 샘플링 기술은 완전히 농도의 시간적 변화를 고려하지 않습니다 사용하여 수행됩니다 3. 따라서, 모니터링 방법은 살충제와 관련된 환경 위험의 더 나은 추정을 개선 할 필요가있다. 수동 샘플링은 최소한의 인프라와 낮은 오염 물질 농도 4,5와 오랜 기간에 걸쳐 지속적으로 모니터링 할 수 있습니다.
패시브 샘플러는 지하수 (6) 모니터링, 신선한 물 7-10, 폐수 (11)와 해수 (12)에 대한 유용한 도구가 될 것으로 나타났다. 모니터링 목적 외에 13, 14는 패시브 샘플러는 비 표적 분석 15 일 독성 시험 (16, 17)에 이용되어 있고, 대안으로서 sediment- 18을하는 생체 모니터링. 패시브 샘플러는 물에서 지속적으로 화학 물질을 축적 가중 평균 (TWA)이 14 농도의 시간을 제공합니다. 오염 물질의 흡수는 수동 샘플러 설계 샘플러 물질, 오염물의 물리 화학적 특성 및 환경 조건 (예를 들면, 물에 따라 샘플링 레이트 (R S)와 패시브 샘플러 - 물 분배 계수 (K PW)에 따라 난류, 온도) 13,14,19,20.
자세한 동영상은 교정과 물에 농약에 대한 패시브 샘플러를 적용하는 방법을 보여하는 것을 목표로하고있다. 구체적인 목적은 i)는 수동 SAMPL의 다섯 가지 유형을 사용하여 124 개별 농약에 대한 준비, 추출 및 기기 분석을 수행하기 위해 포함실리콘 고무를 포함, ERS, 극성 유기 화학 통합 샘플러 (POCIS) -A, POCIS-B, SDB-RPS와 C (18) 디스크, ⅱ) 실험실 흡수 연구에서 농약에 대한 R S와 K PW을 평가하고 ⅲ) 관심 방법과 각각의 패시브 샘플러에 대한 TWA 농도를 계산하는 대상 화합물의 적절한 패시브 샘플러를 선택하는 방법을 설명합니다.
참조 표준 및 패시브 샘플러 장치
표적 화합물 124 레거시 및 제초제, 살충제 및 살 진균제 (표 1)을 포함하여 현재 사용되는 살충제를 포함했다. 내부 표준 혼합물 (혼합물 IS) 페 노프 로프 (2,4,5-TP), clothianidin-D 3, ethion 및 terbuthylazine-D (5)를 포함. 기타 사용되는 화학 물질이 메탄올 (메탄올), 아세토 니트릴 (ACN), 아세톤 (ACE), 디클로로 메탄 (DCM), 시클로 헥산 (CH), 에틸 아세테이트 (EA)를 포함 석유 외그녀 (PE), 2- 프로판올, 25 % 암모니아수, 아세트산 (HAC) 및 포름산 (FA). 다섯 가지 수동 샘플링 장치는 실리콘 고무 POCIS-A 및 B-POCIS, SDB-RPS 및 C (18)의 디스크 1,21 포함한 것을 특징으로 하였다.
표 1. 패시브 샘플러 샘플링 속도 (R 'S, L 일 -1), 샘플러 - 물 분배 계수 (K'PW, L kg -1)과 방정식 (식.) 개인에 대한 현장 시료 농도의 계산에 사용 살충제가. (엘스 비어의 허가, 물, 1-11, 저작권 (2015)에서 농약의 모니터링을위한 크로마토 그래피 (A)의 저널, 1405, 루츠 렌스, Atlasi Daneshvar, 안나 E. 라우, 제니 Kreuger, 오 수동 샘플링 장치의 특성에서 재판 .) (22) 이 파일을 다운로드하려면 여기를 클릭하십시오.
프로토콜
1. 패시브 샘플러 설계 및 제조
- 실리콘 고무 시트
- (3.2 mm × 10 mm를 스테인리스 절단기를 사용하여 스테인리스 블라인드 리벳을 사용하여 연결 × 600 mm 2.5 mm 2.5 mm X 314mm의 줄무늬로 실리콘 고무 시트를 절단 부 (600 mm × 600 mm, 0.5 mm 두께) ) × 914mm 2.5 mm (면적 = 457cm 2 흡착제 집합체 = 15.6 g, 총 부피 샘플러 스트라이프 크기를 얻기 위해 리벳과 총 = 22.9 cm 3).
- 속 슬렛 장치의 추출 실에서 실리콘 고무를 놓습니다. 추출 실에 50 ㎖의 EA를 추가하고 250 ML의 EA와 500ml의 둥근 병 플라스크에 세 끓는 돌을 추가합니다.
- 병 플라스크 및 냉각기를 추출 챔버를 연결한다. 약 80 ° C에서 96 시간 동안 속 슬렛 추출하여 실리콘 고무를 청소하고 부드러운 질소 가스 하에서 그 후 그들을 건조.
- 실리콘 고무 스트를 부착홀더 (도 1)의로드 주위에 실리콘 고무를 배치하여 스트라이프 스테인리스 거미 샘플 홀더 퍼가기. 케이블 타이를 이용하여 홀더에로드에 실리콘 고무 스트라이프의 각 끝을 연결합니다.

실리콘 고무의 그림 1. 도식. 상단과 B) 측면보기에서 스테인리스 거미 샘플 홀더 (A)에 실리콘 고무 스트라이프의 부착)를 도시 실리콘 고무에 대한 패시브 샘플러 개략적 인. 의 더 큰 버전을 보려면 여기를 클릭하십시오 이 그림.
- POCIS-A 및 POCIS-B
- POCIS-A의 경우, 9.0 cm squar에 의해이 9.0 cm 사이 HLB 벌크 흡수제 (표면적 = 1.78 × 106 cm 2)의 220 mg의 배치전자 폴리 에테르 설폰 (PES) 멤브레인 (그림 2).
- POCIS-B의 경우, 흡착제 혼합물을 220 mg의 배치 (즉, 하이드 록 실화 폴리스티렌 - 디 비닐 벤젠 수지 (80 %) 및 스티렌 - 디 비닐 벤젠 공중 합체에 분산 된 탄소 흡착제 (20 %)) (면적 = 2.82 × 106 cm2로) 둘 사이의 PES 멤브레인 (그림 2).
- 흡착제 수동 개의 스테인레스 스틸 링 사이 개의 PES (내부 Ø = 5.4 cm)를 압축하여 스테인리스 샘플 홀더 (도 2)에 고정.

패시브 샘플러 디스크 그림 2. 회로도. POCIS A에 대한 패시브 샘플러 설계도, B, SDB-RPS 디스크와 스테인레스 스틸 링, 폴리 에테르 설폰 사용) 패시브 샘플러의 조립을을 보여주는 C (18) 디스크 (PES) membran을 POCISES 및 수신 단계, 및 B) 스테인레스 스틸 샘플 홀더에 조립. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- SDB-RPS 디스크와 C (18) 디스크
- SDB-RPS (면적 = 35cm 2, 흡착제의 질량 = 0.34 g, 볼륨 = 3 1.7 cm)와 C (18) 디스크 (표면적 = 35cm 2, 흡착제의 질량 = 0.58 g, 부피 = 1.7 cm 3) 사이에 배치 이 PES 멤브레인 (그림 2). 디스크 수동 개의 스테인레스 스틸 링 사이 개의 PES (내부 Ø = 5.4 cm)를 압축하여 스테인리스 샘플 홀더 (도 2)에 고정.
2. 연구소 통풍 관 실험
참고 : 실험실 흡수 실험을 정량적으로 흡수 K의 특성을 실시 하였다통제 된 조건에서 다섯 가지 패시브 샘플러 장치에 대한 124 개별 농약에 대한 inetics.
- (N = 16) (N = 16), POCIS-B 탱크 1) 실리콘 고무 (N = 16)가 탱크 (2)) POCIS-A 및 조 3 : 직사각형 유리 용기 흡수 연구 (각 ~ 95 L)을 실시 ) SDB-RPS 디스크 (N = 16), C (18) 디스크 (N = 16). 세 개의 탱크에 자연 물을 채 웁니다.
- 일정한 수온 (~ 20 ° C)에서 각면의 벽에 부착 된 두 개의 전기 펌프를 사용하여 난류 물 상태 (~ 10cm의 초 -1)에서 모든 실험을 수행합니다. 광분해 효과를 최소화하기 위해 암에 실험을 수행한다.
- 유리 주사기를 사용하여 124 농약을 포함하는 농약 표준 혼합물로 각 유리 용기 스파이크 (c 400 NG의 L ≈ -1 수조 개별 살충제의 경우). 시간 간격의 5에서 탱크에서 수동으로 11, 20, 26 d의 패시브 샘플러를 꺼내AYS는 농약의 샘플링 속도를 결정합니다.
- 다른 21 바와 같이 물 샘플의 분석 일 0, 5, 11, 20에서 100 ㎖의 물 샘플을 수집하여, 각 탱크 내의 농약의 농도를 모니터링하고, (26)이 수행된다.
- 품질 관리, 일 0에서 1 시간 동안 실내 공기에 빈 샘플을 노출하고 저장하고 실제 샘플로 취급합니다. 모든 추출물뿐만 아니라 추가 분석 할 때까지 -18 ℃에서 탱크에서 수집 된 100 ml의 물 샘플을 저장합니다.
3. 샘플 추출
- 실리콘 고무
- 추출에 앞서, 고순도 질소 기류 하에서 실리콘 고무 스트라이프 건조.
- 가스 크로마토 그래피 질량 분석 (GC-MS) 분석을 위해, 속 슬레 추출 (22)을 사용하여 고체 - 액체 추출을 수행한다.
- 속 슬레 추출기에 실리콘 고무를 놓습니다. 250 ml의 PE / ACE를 추가 (50/50, v / v)의 3 BOI둥근 병 플라스크에 넣고 링 돌입니다.
- 100 ㎕로 실리콘 고무 스파이크 것은 유리 주사기를 사용하여 혼합물 (c = 5 ml의 NG-1)이다. 속 슬레 추출기에 50 ml의 PE / ACE를 (50/50, v / v)로 추가합니다. 히터에 전환하고 19 시간 동안 속 슬레 추출을 실행 한 후 히터를 끄고.
- 1 ml의에 부드러운 질소 블로우 다운 다음에 회전 증발에 의해 추출물을 집중한다. 1 ml의에 질소 블로우 다운 동안 세 번 1 ML의 CH / ACE (90/10를, v / v)의 추가 / ACE를 (90/10, v / v)의 CH하는 용매 교환한다.
- 액체 크로마토 그래피 탠덤 질량 분석법 (LC-MS / MS) 분석을 위해, 속 슬레 추출 (22)을 사용하여 추출을 수행한다.
- 속 슬레 추출기에 실리콘 고무를 놓습니다. 속 슬레 추출기에 250 ML의 메탄올과 둥근 병 플라스크에 넣고 3 끓는 돌과 50 ㎖의 메탄올을 추가합니다. 혼합물 (c = 5 ml의 NG-1) 유리 SYR를 사용하는 100 ㎕와 실리콘 고무 스파이크인게.
- 히터에 전환하고 19 시간 동안 속 슬레 추출을 실행 한 후 히터를 끄고. 1 ml의에 부드러운 질소 블로우 다운 다음에 회전 증발에 의해 추출물을 집중한다. 1 ml의에 질소 블로우 다운 중 1 ml의 ACN을 추가하여 ACN에 용매를 교환한다.
- POCIS-A 및 POCIS-B
- 주의 POCIS 샘플러를 열고이 폴리에틸렌 (PE) 프릿을 함유하는 예비 세정 빈 프로필렌 고체 상 추출 (SPE) 카트리지 (6 mL)에 깔때기를 사용하여 초순수로 흡착제를 옮긴다. 물을 제거하기 위해 진공 흡착제를 건조. 흡착재의 중량을 제어 할 비어 충전 SPE 카트리지의 중량을 기록한다. 다른 카트리지 GC-MS 및 LC-MS / MS 분석을 위해 사용되는주의하시기 바랍니다.
- 용출에 앞서, 유리 주사기를 사용하여 100 ㎕로 흡착제를 혼합물 (c = 5 ml의 NG -1)는 스파이크. (5)을 사용하여 용출 POCIS-A 및 POCIS-B 흡착제GC-MS 22 ml의 EA.
- 부드러운 질소 블로우 다운에 의해 1 ml의에 추출물을 집중한다. 1 ml의에 질소 블로우 다운 동안 세 번 1 ML의 CH / ACE (90/10를, v / v)의 추가 / ACE를 (90/10, v / v)의 CH하는 용매 교환한다.
- 8 ml의 DCM / 메탄올 다음에 1.5 ml의 메탄올 사용하여 용출 POCIS-A 및 POCIS-B 카트리지 (20 분의 80을, v / v)의 LC-MS / MS 분석 22. 부드러운 질소 블로우 다운에 의해 1 ml의에 추출물을 집중한다. 1 ml의에 질소 블로우 다운 중 1 ml의 ACN을 추가하여 ACN에 용매를 교환한다.
- SDB-RPS와 C (18) 디스크
- 유리 비커에 SDB-RPS와 C (18) 디스크의 개별 디스크를 전송하고 질소 가스에서 그들을 건조. 3 ㎖의 다음 10 분간 EA 5 ㎖ 먼저, 혼합물 (c = 5 NG ml의 -1) 유리 주사기를 사용하여, 실온에서 유리 비이커들을 두 번 초음파 처리 된 100 ㎕와 디스크 스파이크 및 10 분 동안 EA의.
- 전송 보한 유리관에 제 추출물을 아래 부드러운 질소 블로우에 의해이 용액으로 농축하고 (GC-MS 및 LC-MS / MS 분석을 위해 각각)이 1 ml의 분획물로 분할.
- 부드러운 질소 블로우 다운 0.5 ml의의 추출물을 농축 및 CH / ACE에 용매를 교환 (90/10, v / v)의 GC-MS 분석 22. 부드러운 질소 블로우 다운 0.5 ml의의 추출물을 농축 및 LC-MS / MS 분석 22 ACN에 용매를 교환한다.
4. 물 샘플
- , 혼합물을 유리 주사기를 사용하여 (c = 5 NG ml의 -1) 인 100 ㎕와 20 ml의 물 샘플 스파이크 3 분 동안 DCM 3 ㎖, 소용돌이를 추가하고, GC-MS 분석 (22) 상 분리기로 가만히 따르다.
- 두 상을 분리 한 후, 유리 튜브에 DCM 상 삼출액. 3 ml의 DCM을 사용하여 추출을 반복하고, 2 mL의 DCM으로 튜브를 헹군다. 마지막으로, 부드러운 질소 블로우 다운 및 exchan 0.5 ml의 추출물을 집중GE의 CH하는 용매 / ACE (90/10, v / v)로.
- LC-MS / MS (21)에 의해 다른 곳에 기재된 방법과 유사한 대량 주사를 이용한 물 샘플을 분석한다.
5. 기기 분석
- GC-MS 분석
- 전자 이온화 (EI)과 부정적인 화학 이온화 (NCI) 모드로, 각각 22 GC-MS 시스템을 사용하여 CH / ACE 추출물의 기기 분석을 수행합니다.
- EI를 이용하여 GC-MS 법 들어, HP-5MS UI 열에 비분 주입법 1 μL (30m, 0.25 mm의 내경, 0.25 ㎛의 막)의 분취 액을 주입.
- GC의-MS 방법을 사용하여 CI를 들어, HP-5MS UI 열 3 μL (30m, 0.25 mm 내경, 0.25 μm의 필름)의 분취 액을 주입.
- HPLC-MS / MS 분석
- (-) ESI ()와 긍정적 인 이온 m ACN의 기기 분석을 수행하여 추출물 HPLC-MS / MS는 전기 분무 부정적인 이온화 소스와 인터페이스ODE ((+) ESI) 22.
- ACN은 FA를 사용하여 pH를 5로 조정 한 900 μL의 초순수로 추출물을 (+) ESI 들어, 100 ㎕의 희석.
- (-)의 경우 ESI 상기 ACN 100 ㎕ 초순수 1 % FA 900 ㎕의 용액으로 추출하여 묽은.
- (+) ESI 들어, 0.3 ml의 분 -1의 유속 2- 프로판올 / 메탄올 / 10 mM의 암모늄 포르 메이트 (6/2/92, V / V / V) 및 메탄올로 이루어진 바이너리 구배를 사용한다.
- (-) ESI 들어, 0.3 ml의 분 -1의 유속 ACN / 초순수 0.1 % HAC 및 ACN + 0.1 % HAC 이루어진 바이너리 구배를 사용한다.
- 두 온라인 SPE 칼럼 (20 × 2mm ID 및 20 내지 25 ㎛의 입자 크기 모두), 및 분석 컬럼 (C (18), 100 × 3mm, 3.5 μm의) (21)를 사용하여 500 μL 대량 주사를 사용하여 모든 샘플을 주입한다.
수동 샘플링 6. 이론
참고 : 패시브 샘플러 mediu에 화학 물질의 흡수 프로필직선, 곡선 및 평형 (그림 3) : m (PSM)의 세 부분으로 나누어 져 있습니다.
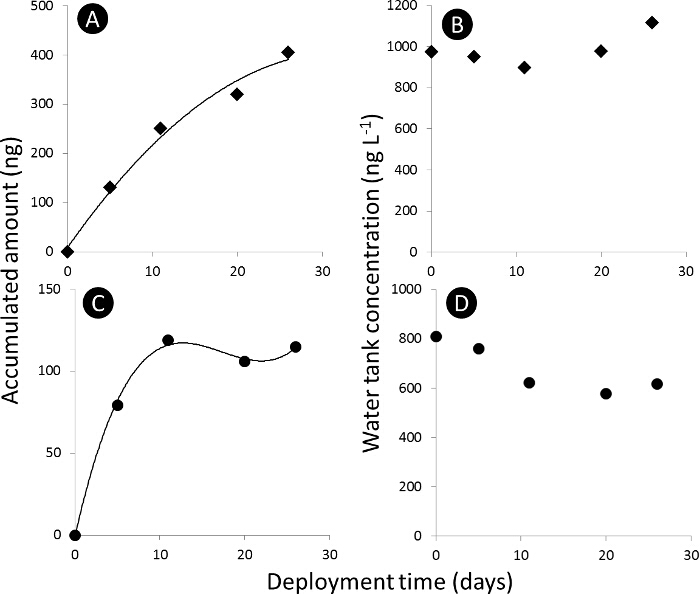
3. 패시브 샘플러 흡수 곡선을 그림. A) 및 C) 흡수 절대 ng를에서 수동 샘플러 (N의 t) 각각 아세 타미 프리드 및 디 메토 에이트의 축적 된 양 곡선 및 B) 및 D) 겨 L 각각 아세 타미 프리드 및 디 메토 에이트, 물 탱크 농도 - 1. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- (노광 t 일 후 패시브 샘플러 N 't를 표적 화합물의 축적량 나누어 패시브 샘플러 동등 물의 양 (V의 이퀄라이저 L)를 계산 L-1, w 다 잡아와 시간 통합 활성 샘플링을 사용하여 수상의 농도에 의해 P>, NG).
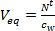 (1)
(1) - 전개 시간 대 V의 당량의 기울기를 고려하여, 흡수 프로파일의 선형 흡수 단계에서, 샘플링 레이트 (R S, L 일 -1)를 도출.
- K 개의 PW 식을 사용하여 개별 살충제 (-1 L의 kg)을 계산합니다. 2.
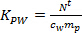 (2)
(2)
m P가 샘플러 당 흡착제 집합체이고 (ng를). - 선형 흡수 단계에서 (TWA, NG의 L-1 C) 식을 이용하여 패시브 샘플러에 의해 도출 된 물에서 분석 물의 TWA 농도를 계산한다. 삼.
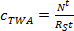 (삼)
(삼)
여기서 R의 S는 sa입니다mpling 속도 (L 일 -1), t는 배포 시간 (일)입니다. - 곡선 형 위상 식을 사용 TWA c를 구한다. 4.
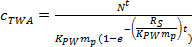 (4)
(4) - 평형 단계에서는 수학 식을 이용 TWA c를 구한다. 5.
 (5)
(5)
7. 통계 데이터 분석
- 샤피로-Wilk 검사 (23)를 사용하여 데이터의 비 정규 분포를 테스트합니다. 시험 농약의 물리 화학적 특성 (24) (-1에서 1 사이의 스피어의 RHO) 대 K PW 및 R S 비 파라 메트릭 스피어 만의 순위 상관 관계를 사용합니다.
결과
다섯 가지 패시브 샘플러 기술은 124 유산의 흡수와 실리콘 고무 (그림 1) POCIS A, POCIS B, SDB-RPS와 C (18) 디스크 (그림 2)을 포함하여 현재 사용되는 농약에 대해 비교 하였다. 추출 방법 및 기기 분석의 성능을 최적화 하였다. 실험실 흡수 실험의 결과는 PW 값 개별 살충제 (도 3)에 대한 흡수 프로파일에 기초하여
토론
품질 관리, 표준 절차, 실험실 공백으로 검출 (LOD), 복구 및 반복성의 한계 (23)을 조사 하였다. 몇 살충제 낮은 농도 수준에서 블랭크 샘플에서 검출되었다. LOD를는 평균 LOD를 실리콘 고무 POCIS-A 1.7 PG 절대 1.6 열 분사 8.0 PG 절대했다 (3)의 잡음 비율로 신호의 조건에 맞는 검정 곡선의 최저점의 값으로 설정된 페이지 POCIS-B, SDB-RPS 디스크 3.0 페이지 절대 및 C (18) 디스크 절대 1.6 페...
공개
The authors have nothing to disclose.
감사의 말
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
자료
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 ml | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 ml | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
참고문헌
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유