Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Характеристика и применение пассивных пробоотборников для мониторинга пестицидов в воде
В этой статье
Резюме
A protocol about the characterization and application of five different passive sampling devices is presented.
Аннотация
Пять различных водных пассивных пробоотборников были откалиброваны в лабораторных условиях для измерения 124 наследия и текущих используемых пестицидов. Данное исследование предоставляет протокол для подготовки пассивного пробника, калибровка, метод экстракции и инструментального анализа. Частота дискретизации (R S) и пассивные коэффициенты распределения пробоотборник воды (K PW) были рассчитаны для силиконового каучука, полярного органического химического интегративный сэмплер POCIS-A, POCIS-B, SDB-RPS и C 18 диска. Поглощение выбранных соединений зависит от их физико - химических свойств, т.е., силиконовая резина показала лучшее поглощение для более гидрофобных соединений (логарифм коэффициента распределения октанол-вода (K OW)> 5,3), в то время как POCIS-A, B-POCIS и SDB- RPS диска были более пригодны для гидрофильных соединений (Log K OW <0,70).
Введение
Пестициды непрерывно вводят в водную среду и может представлять опасность для водных организмов 1. Мониторинг пестицидов в водной среде , как правило , осуществляется с использованием выборки захвата, однако, этот метод выборки не в полной мере учитывает временные вариации в концентрации из - за колебаний расхода или эпизодических входов (например, осадки, комбинированные канализационные переполняется, канализация лагуны релиз) 2 , 3. Таким образом, методы мониторинга должны быть улучшены для лучшей оценки экологических рисков, связанных с пестицидами. Пассивный отбор проб позволяет непрерывный контроль в течение продолжительного периода времени с минимальной инфраструктурой и низкой концентрацией загрязнителя 4,5.
Пассивные пробоотборники было показано , что является ценным инструментом для мониторинга подземных вод в 6, пресной воды, сточных вод 7-10 11 и 12 морских вод. Кроме того, в целях мониторинга 13,14, пассивные пробоотборники также используются для нецелевых анализа 15, токсикологии тестирования 16,17, а в качестве альтернативы sediment- и биомониторинга 18. Пассивные пробоотборники накапливаются химические вещества непрерывно из воды и обеспечивают время средневзвешенный (СВЗ) концентрации 14. Поглощение загрязнителя зависит от частоты дискретизации (R S) и пассивный коэффициент распределения пробоотборник воды (K PW), которая зависит от пассивного конструкции пробника, пробник материала, физико - химических свойств загрязняющего вещества, а также условий окружающей среды (например, воды турбулентность, температура) 13,14,19,20.
Подробное видео имеет целью показать, как калибровать и применять пассивные пробоотборники для пестицидов в воде. Конкретные цели включали я) для выполнения подготовки, экстракции и инструментального анализа для 124 отдельных пестицидов с использованием пяти различных типов пассивных SAMPLERS, в том числе из силиконового каучука, полярный органический химический интегративный пробоотборник (POCIS) -А, POCIS-B, SDB-RPS и C 18 диска, б) для оценки R S и K PW для пестицидов в исследовании лаборатории поглощения, и III) чтобы продемонстрировать, как выбрать соответствующий пассивный пробник целевого соединения, представляющего интерес и как рассчитать концентрации TWA для соответствующего пассивного пробоотборника.
Эталоны и пассивные устройства пробоотборник
Целевые соединения включены 124 унаследованных и используемые в настоящее время пестицидов , включая гербициды, инсектициды и фунгициды (таблица 1). Внутренний стандарт смесь (IS смеси) включены фенопроп (2,4,5-TP), клотиандин-D 3, ethion и тербутилазин-D 5. Другие используемые химикаты включали метанол (MeOH), ацетонитрил (ACN), ацетон (АСЕ), дихлорметан (ДХМ), циклогексан (СН), этилацетат (ЭА), петролейный ЕТона (ПЭ), 2-пропанола, 25% -ный раствор аммиака, уксусной кислоты (HAC) и муравьиной кислоты (FA). Пять различных устройств пассивной выборки были охарактеризованы, в том числе из силиконового каучука, POCIS-A и POCIS-B, SDB-RPS и C 18 диска 1,21.
Таблица 1. Пассивный пробник частота дискретизации (R 'S, L день -1), коэффициенты распределения пробоотборник воды (K' PW, L кг -1) и уравнения (уравнение.) , Используемый для расчета концентраций в пробах на местах для индивидуального пестициды а. (Перепечатано из журнала хроматографии A, 1405, Lutz Аренс, Атласи Данешвар, Анна Е. Лау, Дженни Kreuger, характеристика пяти пассивных устройств отбора проб для контроля содержания пестицидов в воде, 1-11, авторские права (2015 г.), с разрешения Elsevier .) 22 Пожалуйста , нажмите здесь , чтобы загрузить этот файл.
протокол
1. Пассивный Sampler Проектирование и подготовка
- Силиконовые резиновые листы
- Нарезать силиконовой резины листов (600 мм х 600 мм, толщиной 0,5 мм) на полосы 2,5 мм х 600 мм и 2,5 мм х 314 мм с помощью ножа из нержавеющей стали и соединяют их с помощью Заклепка из нержавеющей стали (3,2 мм х 10 мм ) с заклепок , чтобы получить общий размер пробоотборник полоса 2,5 мм х 914 мм (площадь поверхности = 457 см 2, сорбционной массы = 15,6 г, объем = 22,9 см 3).
- Поместите силиконовые каучуки в экстракционной камере прибора Сокслета. Добавить 50 мл ЕА в экстракционной камере и добавляют 250 мл ЕА и три Кипелки в 500 мл круглодонную колбу бутылки.
- Подключите камеру экстракции с колбы бутылки и конденсатором. Очистить силиконовые каучуки путем экстракции в аппарате Сокслета в течение 96 ч при температуре около 80 ° С, и после этого высушить их при осторожном газообразным азотом.
- Приложить силиконовый каучук StrIре к нержавеющей стали паука держатель образца обертыванием из силиконового каучука полоса вокруг стержней на держателе (Рисунок 1). Прикрепите каждый конец силиконовой резины полосой к стержню на держателе с помощью кабельных стяжек.

Рисунок 1. Схема из силиконового каучука. Пассивный пробник Схема для силиконового каучука , показывающий прикрепление силиконовой резины полосой для нержавеющей стали образца паук держатель A) от верхней и B) вид сбоку. Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версию эта фигура.
- POCIS-A и B-POCIS
- Для POCIS-A, место 220 мг HLB сыпучего сорбента (площадь поверхности = 1,78 × 10 6 см 2) между двумя 9,0 см на 9,0 см Squarе полиэфирсульфон (ПЭС) мембран (рисунок 2).
- Для POCIS-B, место 220 мг сорбента смеси (т.е. гидроксилированные полистирол-дивинилбензола смолу (80%) и углеродсодержащего адсорбент рассыпают по стирола дивинилбензола (20%)) (площадь поверхности = 2,82 × 10 6 см 2) между двумя ПЭУ мембраны (рисунок 2).
- Сжать сорбент и два ПЭУ между двумя кольцами из нержавеющей стали вручную (внутренний диаметр = 5,4 см) и закрепите его на нержавеющей стали держатель образца (рисунок 2).

Рисунок 2. Схема пассивных дисков сэмплера. Пассивный пробник Схема для POCIS A, B, POCIS SDB-RPS диск и C 18 диска , показывающий) сборку пассивного пробоотборника с помощью кольца из нержавеющей стали, полиэфирсульфон (PES) MEMBRANэс, а фаза приема и В) монтаж на нержавеющей стали держателя образца. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- SDB-RPS диск и C 18 диска
- Поместите SDB-RPS (площадь поверхности = 35 см 2, сорбент масса = 0,34 г, объем = 1,7 см 3) и C 18 дисков (площадь поверхности = 35 см 2, сорбент масса = 0,58 г, объем = 1,7 см 3) между две мембраны ПЭС (рисунок 2). Сжатие дисков и два ПЭУ между двумя кольцами из нержавеющей стали вручную (внутренний диаметр = 5,4 см) и закрепите ее на держателе образца из нержавеющей стали (Рисунок 2).
2. Лабораторные эксперименты о поглощении
Примечание: Эксперименты поглощения Лабораторные проводили количественно охарактеризовать К поглощениеinetics для 124 отдельных пестицидов для пяти различных пассивных пробоотборников устройств в контролируемых условиях.
- Провести исследование поглощения в прямоугольных стеклянных контейнеров (каждый ~ 95 л): Tank 1) силиконовый каучук (п = 16), бак 2) POCIS-A (N = 16), POCIS-В (п = 16), и бак 3 ) SDB-РПС диск (п = 16), С 18 диска (п = 16). Заполните естественную воду в трех танков.
- Выполните все эксперименты при постоянной температуре воды (~ 20 ° C) , а также в условиях турбулентности воды (~ 10 см сек -1) с помощью двух электронасосов , прикрепленных к стене на каждой стороне. Выполните эксперименты в темноте, чтобы минимизировать эффект фотостарения.
- Шип каждый стеклянный контейнер с пестицидом стандартной смеси , содержащей 124 пестицидов с использованием стеклянного шприца (C ≈ 400 нг л -1 для отдельных пестицидов в баке для воды). Выньте пассивные пробники вручную из резервуаров, с временными интервалами 5, 11, 20, 26 и дAYS, чтобы определить частоту дискретизации пестицидов.
- Мониторинг концентрации пестицидов в каждом резервуаре путем сбора 100 мл пробы воды на 0, 5, 11, 20 и 26. Анализ проб воды осуществляется , как описано в другом месте 21.
- Для контроля качества, подвергать холостых проб в комнатном воздухе в течение 1 ч при 0-й день, а затем хранить и рассматривать их в качестве реальных образцов. Хранить все экстракты, а также 100 мл проб воды из резервуаров при температуре минус 18 ° С до дальнейшего анализа.
3. Пример извлечения
- Резинка
- До экстракции, сухой силиконовой резины полоса под потоком высокой чистоты газообразного азота.
- Для газовой хроматографии-масс - спектрометрии анализа (ГХ-МС), осуществляют твердой и жидкой экстракции с использованием Сокслета экстракции 22.
- Поместите силиконовую резину в экстрактор Сокслета. Добавить 250 мл PE / ACE (50:50, об / об) и 3 Boiлин камни в круглую колбу бутылки.
- Шип силиконового каучука с 100 мкл раствора IS смеси (с = 5 нг мл -1) с использованием стеклянного шприца. Добавить 50 мл PE / ACE (50:50, об / об) в экстрактор Сокслета. Включите отопительный прибор и запустить добычу Сокслета в течение 19 ч, а затем выключить обогреватель.
- Концентрат экстрактов с помощью роторного испарителя с последующим пологий азота продувкой до 1 мл. Обмен растворитель для CH / ACE (90/10, об / об), добавляя в три раза 1 мл CH / ACE (90/10, об / об) в течение азота продувкой до 1 мл.
- Для жидкостной хроматографии-тандемной масс - спектрометрии анализа (LC-MS / MS), осуществляют экстракцию с использованием Сокслета экстракции 22.
- Поместите силиконовую резину в экстрактор Сокслета. Добавить 250 мл MeOH и 3 Кипелки в круглую колбу бутылки и МеОН 50 мл в экстрактор Сокслета. Спайк силиконового каучука с 100 мкл ап смеси (с = 5 нг мл -1) с помощью стеклянной SYRИнге.
- Включите отопительный прибор и запустить добычу Сокслета в течение 19 ч, а затем выключить обогреватель. Концентрат экстрактов с помощью роторного испарителя с последующим пологий азота продувкой до 1 мл. Обмен растворителя к ACN путем добавления 1 мл ACN в течение азота продувкой до 1 мл.
- POCIS-A и B-POCIS
- Осторожно откройте POCIS пробоотборник и перенесите сорбент сверхчистой водой, используя воронку в предварительно очищенное пустой полипропиленовой твердофазной экстракции (SPE) картридже (6 мл), содержащей два полиэтилена (ПЭ) фритт. Высушить сорбент с помощью вакуума, чтобы удалить воду. Регистрируют вес пустого и упакованного SPE патроне, чтобы контролировать вес сорбентом. Пожалуйста, обратите внимание, что различные картриджи используются для ГХ-МС и анализа ЖХ-МС / МС.
- До начала элюции, шип сорбент с помощью 100 мкл смеси ап (с = 5 нг мл -1) с использованием стеклянного шприца. сорбенты Элюировать POCIS-A и POCIS-B с использованием 5мл EA для ГХ-МС 22.
- Концентрат экстрактов до 1 мл путем осторожного азота продувкой. Обмен растворитель для CH / ACE (90/10, об / об), добавляя в три раза 1 мл CH / ACE (90/10, об / об) в течение азота продувкой до 1 мл.
- Элюировать POCIS-A и B-POCIS картриджи с использованием 1,5 мл MeOH с последующим 8 мл ДХМ / MeOH (80/20, об / об) для анализа ЖХ-МС / МС 22. Концентрат экстрактов до 1 мл путем осторожного азота продувкой. Обмен растворителя к ACN путем добавления 1 мл ACN в течение азота продувкой до 1 мл.
- SDB-RPS и C 18 диска
- Передача отдельных дисков SDB-RPS и C 18 диска в стеклянный стакан и высушить их под газообразным азотом. Шип дисков с помощью 100 мкл смеси ап (с = 5 нг мл -1) с использованием стеклянного шприца и разрушать ультразвуком их два раза в стеклянном стакане при комнатной температуре, сначала с помощью 5 мл ЕА в течение 10 мин , а затем с 3 мл ЕА в течение 10 мин.
- Передача Ьой экстракты в одну стеклянную трубку, концентрируют их до 2 мл путем осторожного продувать азотом вниз, и разделить их на две 1 мл фракции (для ГХ-МС и анализа ЖХ-МС / МС, соответственно).
- Концентрат экстрактов до 0,5 мл путем осторожного азота продувкой и обмена растворителем для CH / ACE (90/10, об / об) для анализа ГХ-МС 22. Концентрат экстрактов до 0,5 мл путем осторожного азота продувкой и обмена растворителем для ACN для анализа ЖХ-МС / МС 22.
4. Образцы воды
- Шип 20 мл пробы воды с помощью 100 мкл смеси ап (с = 5 нг мл -1) с помощью стеклянного шприца, добавляют 3 мл ДХМ, вихревое течение 3 мин, и после декантации в фазовый сепаратор для анализа ГХ-МС 22.
- После того, как две фазы разделяют, процеживают фазу хлористого метилена в стеклянную трубку. Повторите экстракции с использованием 3 мл хлористого метилена, и промыть трубку с 2 мл ДХМ. Наконец, концентрат экстрактов до 0,5 мл путем осторожного азота продувкой и валюGE растворитель для CH / АСЕ (90/10, об / об).
- Анализ проб воды с использованием больших инъекции объем, аналогичный методу , описанному в другом месте с помощью LC-MS / MS 21.
5. Инструментальный анализ
- Анализ методом ГХ-МС
- Выполните инструментальный анализ CH / ACE экстрактов с использованием систем ГХ-МС в электронной ионизации (EI) и режиме отрицательной химической ионизации (NCI), соответственно 22.
- Для метода ГХ-МС с использованием EI, вводят аликвоты 1 мкл с инъекционным методом без деления на колонке HP-5MS UI (30 м, 0,25 мм внутреннего диаметра, пленки 0,25 мкм).
- Для метода с использованием CI ГХ-МС, вводят аликвоты по 3 мкл на колонке HP-5MS UI (30 м, 0,25 мм внутренний диаметр, пленки 0,25 мкм).
- Анализ с помощью ВЭЖХ-МС / МС
- Выполните инструментальный анализ ACN экстрактов с помощью ВЭЖХ-МС / МС сопряжен с источником ионизации электрораспылением в отрицательной ((-) ESI) и положительных ионов тода ((+) ESI) 22.
- Для получения (+) ESI, разбавленных 100 мкл ACN, экстракты с 900 мкл сверхчистой воды доводили до рН 5 с помощью FA.
- Для получения (-) ESI, разбавленных в 100 мкл ACN экстрактов с 900 мкл 1% раствора FA в сверхчистой воде.
- Для получения (+) ESI, использовать двоичный градиент , состоящий из 2-пропанола / метанол / 10 мМ формиат аммония (6/2/92, об / об / об) и MeOH при скорости потока 0,3 мл мин - 1.
- Для получения (-) ESI, использовать двоичный градиент , состоящий из ACN / сверхчистой воды 0,1% НАс и ACN + 0,1% HAc при скорости потока 0,3 мл мин - 1.
- Вводят все образцы с использованием большого инъекции объемом 500 мкл с использованием двух онлайновых колонок SPE (как 20 х 2 мм Идентификатор и мкм размер частиц 20-25), а также аналитическую колонку (С 18, 100 х 3 мм, 3,5 мкм) 21.
6. Теория по пассивной отбору проб
Примечание: Поглощение профиль химического вещества к пассивному сэмплер mediuм (PSM) делится на три секции: Линейная, криволинейные и равновесие (рисунок 3).
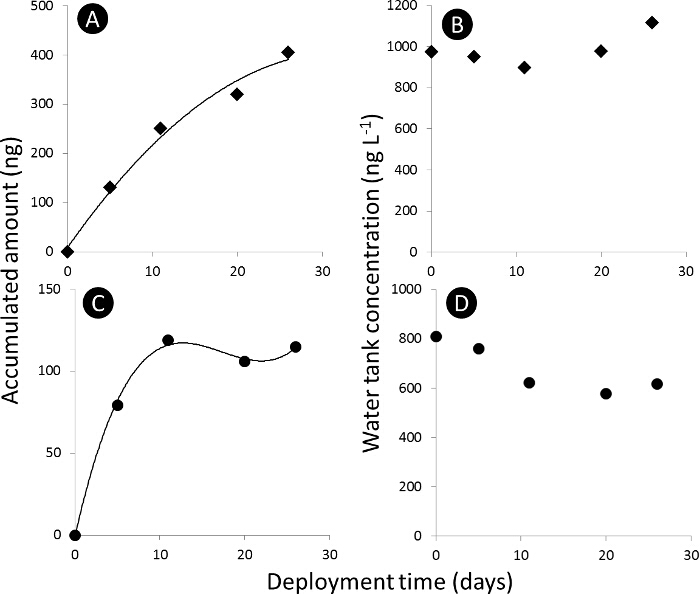
Рисунок 3. Пассивное кривую поглощения пробник. А) и С) поглощение кривая накопленной суммы ацетамиприда и диметоата, соответственно, в пассивных пробников (N T) в нг абсолютной, и В) и D) концентрация бак для воды из ацетамиприда и диметоата, соответственно, в нг L - 1. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Рассчитать эквивалентный объем воды (V экв L) для пассивного пробоотборника путем деления накопленного количества целевых соединений в пассивном пробоотборник после т дней воздействия (N 'T , нг) по концентрации в водной фазе с использованием захвата и времени интегрированный активный отбор проб (с ш, нг л -1).
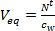 (1)
(1) - Выведите частоту дискретизации (R S, L день -1) от линейной фазы поглощения профиля поглощения, принимая наклон V экв в зависимости от времени развертывания.
- Вычислить K PW (L кг -1) для отдельных пестицидов с использованием уравнения. 2.
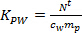 (2)
(2)
где т р сорбент масса на пробоотборник (нг). - В линейной фазе поглощения, вычислить концентрацию TWA анализируемого вещества в воде , полученной с помощью пассивного пробоотборника (с TWA, нг л -1) по формуле. 3.
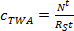 (3)
(3)
где R S является саСкорость mpling (L день -1), и т время развертывания (дни). - В криволинейной фазе, вычислить с помощью формулы TWA. 4.
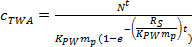 (4)
(4) - В равновесной фазы, вычисляют с помощью уравнения TWA. 5.
 (5)
(5)
7. Анализ статистических данных
- Проверьте , не нормальное распределение данных с помощью теста Шапиро-Wilk 23. Используйте непараметрический ранговой корреляции Спирмена для K PW и R S против физико - химических свойств исследуемых пестицидов (Rho Спирмена в пределах от -1 до 1) 24.
Результаты
Пять различных пассивных методов пробоотборник сравнивали для поглощения 124 наследия и в настоящее время используемых пестицидов , включая силиконового каучука (рисунок 1), и POCIS A, B, POCIS SDB-RPS и C 18 диска (Рисунок 2). Производительность способа экст?...
Обсуждение
Для контроля качества, в качестве стандартной процедуры, лабораторных заготовок, пределы обнаружения (LOD), восстановлений и воспроизводимости были исследованы 23. Несколько пестицидов были обнаружены в пустых образцах при низких уровнях концентрации. LODs были установлены в качест...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
Материалы
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 ml | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 ml | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
Ссылки
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены