Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Suda Pestisitlerin İzleme Karakterizasyonu ve Pasif Numune Uygulama
Bu Makalede
Özet
A protocol about the characterization and application of five different passive sampling devices is presented.
Özet
Beş farklı su pasif numune 124 mirası ölçümü ve mevcut kullanılan pestisitler için laboratuvar koşullarında kalibre edildi. Bu çalışma, pasif örnekleyici hazırlama, kalibrasyon, ekstraksiyon yöntemi ve enstrümantal analiz için bir protokol sağlar. Örnekleme oranları (R ve S) ve pasif örnekleyici-su bölünme katsayısı (K PW), silikon kauçuk, polar organik kimyasal birleştirici örnekleyici POCIS-A, POCIS-B, uykuda solunum bozukluğu-RPS ve C 18 disk için hesaplanmıştır. Seçilmiş bileşiklerin alımı fizikokimyasal özelliklerine bağlı, yani, silikon kauçuk POCIS-A ise POCIS-B ve SDB- (oktanol-su bölünme katsayısına (K OW)> 5.3 log) daha fazla hidrofobik bileşikler için, daha iyi bir alımının gösterdi RPS diski hidrofilik bileşiklerin (K ow <0.70 log) için daha uygun idi.
Giriş
Pestisitler sürekli su ortamında tanıtıldı ve Sucul organizmalar 1 için risk teşkil edebilir. Sulu bir ortamda pestisit izlenmesi tipik olarak akış ya da epizodik girdiler (örneğin, çökeltme, kombine kanalizasyon taşmaları, kanalizasyon lagün salım) 2 dalgalanmalar kapmak örnekleme, ancak bu örnekleme tekniği tamamen konsantrasyonlarda zamansal farklılıkları hesaba gelmez kullanılarak yapılır 3. Böylece, izleme yöntemleri pestisitler ile ilgili çevresel risklerin daha iyi bir tahmini için geliştirilmiş olması gerekir. Pasif örnekleme minimum altyapı ve düşük kirletici konsantrasyonları 4,5 ile uzun bir süre boyunca sürekli olarak izlenmesine olanak verir.
Pasif numune yeraltı 6 izleme, tatlı su 7-10, atıksu 11 ve deniz suları 12 için değerli bir araç olduğu gösterilmiştir. izleme amacıyla yanında 13,14, pasif numune de hedef olmayan analizi 15, toksikoloji testleri 16,17 kullanılmaktadır, ve bir alternatif olarak sediment- ve 18 biyoizleme için. Pasif numune sudan sürekli kimyasallar birikir ve ağırlıklı ortalama (TWA) 14 konsantrasyonlar zamanı sağlar. Kirletici alımı pasif örnekleyici tasarım, örnekleyici malzeme, kirletici fizikokimyasal özellikleri ve çevresel koşullara (örneğin, su bağlıdır örnekleme hızı (R ve S) ve pasif örnekleyici-su dağılım katsayısı (K PW) bağlıdır türbülans, sıcaklık) 13,14,19,20.
ayrıntılı video kalibre ve su pestisitlerin pasif numune nasıl uygulanacağına göstermeyi amaçlıyor. Özel hedefler i) pasif sampl beş farklı türleri kullanarak 124 farklı böcek ilacı için hazırlık, çıkarma ve enstrümantal analiz gerçekleştirmek için dahilsilikon kauçuk içeren, ERS polar organik kimyasal birleştirici örnekleyici (POCIS) -A, POCIS-B, uykuda solunum bozukluğu-RPS ve C 18 diski, ii) Bir laboratuar alımının etüd pestisit R, S ve K, PW değerlendirmek ve iii) ilgi ve nasıl kendi pasif örnekleyici için TWA konsantrasyonlarının hesaplamak için hedef bileşiğin uygun pasif örnekleyici seçmek için nasıl göstermek için.
Referans standartları ve pasif örnekleyici cihazları
Hedef bileşikler, 124 mirası ve herbisit, insektisit ve fungisit (Tablo 1) de dahil olmak üzere şu anda kullanılan böcek ilaçları dahildir. Iç standart karışım (karışım IS) fenoprop (2,4,5-TP), klotiyanidin-D 3, etion ve terbutilazin-D 5 dahil. Diğer kullanılan kimyasallar metanol (MeOH), asetonitril (ACN), aseton (ACE), diklorometan (DCM), sikloheksan (CH), etil asetat (EA) dahil, petrol veOnunla (PE), 2-propanol,% 25 amonyak çözeltisi, asetik asit (HAc) ve formik asit (FA). Beş farklı pasif örnekleme cihazlar, silikon kauçuk, POCIS-A ve POCIS-B, SDB-RPS ve C18 diski 1,21 da dahil olmak üzere karakterize edilmiştir.
Tablo 1. Pasif örnekleyici örnekleme hızı (R 'S, L gün -1), örnekleyici-su dağılım katsayıları (K' PW, L kg-1) ve denklemler (Denklem.) Bireysel saha örneklerinde konsantrasyonlarının hesaplanması için kullanılan pestisitler a. (Elsevier izni ile, su, 1-11, Telif Hakkı (2015) pestisit izlenmesi için Kromatografi A Journal, 1405, Lutz Ahrens, Atlasi Daneshvar, Anna E. Lau, Jenny Kreuger, beş pasif örnekleme cihazlarının Karakterizasyonu yayımlanmaktadır .) 22 Bu dosyayı indirmek için tıklayınız.
Protokol
1. Pasif Sampler Tasarım ve Hazırlama
- Silikon kauçuk levhalar
- (3.2 mm x 10 mm paslanmaz çelik kesici kullanılarak ve bir paslanmaz çelik kör perçin kullanarak bağlayın x 600 mm 2.5 mm ve 2.5 mm x 314 mm şeritler halinde silikon kauçuk levha kesti (600 mm x 600 mm, 0,5 mm kalınlığında) ) x 914 mm 2,5 mm (yüzey alanı = 457 cm2, emici kütle = 15.6 g, hacmi, toplam numune şerit boyutunu elde etmek için bir perçin tabancası = ile 22.9 cm3).
- bir Soxhlet tertibatının bir ekstraksiyon bölmesi silikon kauçukları yerleştirin. ekstraksiyon odası içinde 50 mi EA ekleyin ve 250 ml EE ve 500 ml'lik yuvarlak şişe bir şişe üç kaynatma taşı ekleyin.
- Şişe bir şişeye bir kondansatör ile özütleme odası bağlayın. yaklaşık 80 ° C 'de 96 saat boyunca Soxhlet ekstre alması ile silikon kauçukları temizleyin ve yumuşak bir azot gazı altında daha sonra kurutun.
- silikon kauçuk Şeritleri takıntutucu (Şekil 1) çubuklar etrafında silikon kauçuk şerit sararak bir paslanmaz çelik örümcek numune sahibine pe. kablo bağları kullanarak tutucu bir çubuğa silikon kauçuk şerit her bir ucunu takın.

Silikon kauçuk Şekil 1. şematik. Üst ve B) yan görünümden bir paslanmaz çelik örümcek numune tutucu A silikon kauçuk şerit eki) gösteren silikon kauçuk için pasif örnekleyici şematik. Büyük halini görmek için tıklayınız bu figür.
- POCIS-A ve POCIS-B
- POCIS-A için, 9.0 cm squar iki 9.0 cm arasında HLB dökme sorbent (yüzey alanı = 1.78 x 10 6 cm2) 220 mg koyune polyethersulfone (PES) membranlar (Şekil 2).
- POCIS-B, bir sorbent karışımının 220 mg yer (örneğin, hidroksillenmiş polistiren-divinilbenzen reçine (% 80) ve bir stiren divinilbenzen kopolimer dağılmış bir karbonlu adsorban (% 20)) (yüzey alanı = 2.82 x 10 6 cm2) iki arasındaki PES membranlar (Şekil 2).
- Sorbent ve elle iki paslanmaz çelik halkalar arasında iki PES (iç Ø = 5.4 cm) sıkıştırmak ve paslanmaz çelik numune tutucu (Şekil 2) üzerine sabitleyin.

Pasif örnekleyici disklerin Şekil 2. şematik. POCIS A Pasif örnekleyici şematik, B, SDB-RPS disk ve paslanmaz çelik yüzük, polyethersulfone kullanarak) pasif örnekleyici montajını A gösteren C18 Disk (PES) zarı POCISes ve alıcı aşaması, ve B) paslanmaz çelik numune tutucu montaj. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- SDB-RPS diski ve C 18 Disk
- SDB-RPS (yüzey alanı = 35 cm2, emici kütle = 0.34 g, hacim = 3 1.7 cm) C18 diskler (yüzey alanı = 35 cm2, emici kütle = 0.58 g, hacim = 1.7 cm3) arasında meydana iki PES membranlar (Şekil 2). Diskler ve elle iki paslanmaz çelik halkalar arasında iki PES (iç Ø = 5.4 cm) sıkıştırmak ve paslanmaz çelik numune tutucu (Şekil 2) üzerine sabitleyin.
2. Laboratuar emilme deneyleri
NOT: Laboratuvar alımı deneyleri kantitatif alım k karakterize etmek için yapılmıştırkontrollü şartlar altında beş farklı pasif örnekleyici cihazlar için 124 farklı böcek ilacı için inetics.
- (N = 16) (N = 16), POCIS-B Tankı 1) silikon kauçuk (n = 16), tank 2) POCIS-A, ve tank 3: dikdörtgen cam kaplarda alımının etüd edilmesi (her ~ 95 L) Davranış ) SDB-RPS diski (n = 16), C18 diski (n = 16). Üç tanklarına doğal su doldurun.
- Sabit su sıcaklığı (~ 20 ° C) ve her iki tarafta duvara iliştirilmiş iki elektrikli pompalarla çalkantılı su koşullarında (~ 10 cm sn -1) altındaki tüm deneyler. fotodegredasyona etkisini en aza indirmek için karanlıkta deneyleri.
- Bir cam şırınga kullanarak 124 pestisit içeren bir pestisit standart karışımı ile her bir cam kabı Spike (c 400 ng L ≈ -1 su tankında bireysel pestisitler için). , Zaman aralıklarında 5 de, tanklar elle 11, 20, ve 26 d pasif örnekleyicilerinin çıkarıpays, pestisitlerin örnekleme oranlarını belirlemek için.
- Başka bir yerde, 21 tarif edilen şekilde su örneklerinin analizi 0, 5, 11, 20, 100 mi su örnekleri toplayarak her tankta pestisitler Monitör ve 26 gerçekleştirilir.
- kalite kontrolü için, 0. günde 1 saat oda havasına boş örnekleri ortaya çıkarmak ve daha sonra depolamak ve gerçek örneklerin gibi davranarak. Tüm özler yanı sıra analiz zamanına kadar -18 ° C 'de tank toplanan 100 mi su örnekleri saklayın.
3. Numune Çıkarma
- Silikon lastik
- ekstraksiyon öncesinde, yüksek saflıkta bir azot gazı akımı altında silikon kauçuk şerit kurutun.
- Gaz kromatografisi-kütle spektrometrisi (GC-MS) analizi için, Soxhlet ekstraksiyonu 22 kullanılarak katı-sıvı özütleme gerçekleştirmek.
- Soxhlet özütleme cihazına silikon kauçuk yerleştirin. 250 ml PE / ACE ekleme (50/50; h / h) ve 3 boiyuvarlak şişe şişe içine ling taşları.
- Bir 100 ul silikon kauçuk başak bir cam şırınga kullanılarak karışımı (c = 5 ng mi -1) 'dir. Soxhlet özütleme cihazına 50 ml PE / ACE (50/50; h / h) ekleyin. ısıtıcı açın ve 19 saat Soxhlet ekstraksiyon çalıştırın ve sonra ısıtıcıyı kapatın.
- 1 ml yumuşak azot istim boşaltma, ardından döner buharlaştırma ile ekstreler konsantre. 1 ml azot istim boşaltma üç kere 1 mi CH / ACE (90/10, hacim / hacim) ilave edilerek / ACE (90/10, v / v) CH solvent alış veriş.
- Sıvı kromatografisi-tandem kütle spektrometresi (LC-MS / MS) analizi için, Soxhlet ekstraksiyonu 22 kullanarak bir özütleme gerçekleştirmek.
- Soxhlet özütleme cihazına silikon kauçuk yerleştirin. Soxhlet çıkarıcı içine 250 ml MeOH ve yuvarlak şişe balona 3 kaynama taşları ve 50 ml MeOH ekleyin. Karışım (c = 5 ng mi-1), bir cam Syr kullanarak bir 100 ul silikon kauçuk başakinge.
- ısıtıcı açın ve 19 saat Soxhlet ekstraksiyon çalıştırın ve sonra ısıtıcıyı kapatın. 1 ml yumuşak azot istim boşaltma, ardından döner buharlaştırma ile ekstreler konsantre. 1 ml azot darbe aşağı sırasında 1 ml ACN ekleyerek ACN çözücü alışverişi.
- POCIS-A ve POCIS-B
- dikkatle POCIS Örnekleyici açınız ve iki polietilen (PE) cam hamuru içeren bir ön temizleme boş polipropilen, katı faz ekstraksiyonu (SPE), kartuşun (6 mi) bir huni kullanılarak ultra saf su ile sorbent aktarın. suyu çıkarmak için vakum ile sorbent kurulayın. Sorbent malzemenin ağırlığını kontrol etmek için boş ve dolu SPE kartuşu ağırlığını kaydedin. Farklı kartuşlar GC-MS ve LC-MS / MS analizi için kullanılan unutmayın.
- Elüsyondan önce, bir cam şırınga kullanılarak bir 100 ul ile sorbent karışımı (c = 5 ng mi-1) sivri uç. 5 kullanarak Zehir POCIS-A ve POCIS-B sorbentGC-MS 22 ml EA.
- yumuşak azot darbe-down 1 ml özleri konsantre. 1 ml azot istim boşaltma üç kere 1 mi CH / ACE (90/10, hacim / hacim) ilave edilerek / ACE (90/10, v / v) CH solvent alış veriş.
- 8 mi DCM / MeOH, ardından, 1.5 ml MeOH kullanılarak Elute POCIS-A ve POCIS-B kartuşlar (80/20, v / v), LC-MS / MS analizi için 22. yumuşak azot darbe-down 1 ml özleri konsantre. 1 ml azot darbe aşağı sırasında 1 ml ACN ekleyerek ACN çözücü alışverişi.
- SDB-RPS ve C 18 Disk
- Bir cam behere SDB-RPS ve C 18 diskin tek tek diskler aktarın ve azot gazı altında kurutun. 3 ml, daha sonra 10 dakika boyunca EA 5 ml ilk karışım (c = 5 ng mi-1), bir cam şırınga kullanılarak ve oda sıcaklığında, bir cam beher iki kez sonikasyon IS bir 100 ul diskleri başak ve 10 dakika süre ile EA.
- aktarım boBir cam tüp içine inci ekstreler aşağı yumuşak azot darbe 2 ml bunları konsantre ve (GC-MS ve LC-MS / MS analizi için sırasıyla) iki adet 1 ml'lik kısımlar içine bölündü.
- Yumuşak bir azot istim boşaltma 0.5 ml özler konsantre edilir ve CH / ACE solvent alış veriş (90/10, v / v) GC-MS analizi için 22. Yumuşak bir azot istim boşaltma 0.5 ml özler konsantre edilir ve LC-MS / MS analizi için 22 ACN çözücü değişimi.
4. Su Örnekleri
- Karışım, bir cam şırınga kullanılarak (c = 5 ng mi -1) 'nin bir 100 ul ile 20 mi su örneği başak 3 dakika boyunca DCM 3 ml, girdap ekleyin ve GC-MS analizi 22 için bir faz ayırıcı içine aktarın.
- İki faz ayrıldıktan sonra, bir cam tüp içine DCM fazı percolate. 3 ml DCM kullanılarak ekstre tekrarlayın ve 2 mi DCM ile tüp yıkayın. Son olarak, yumuşak azot darbe aşağı ve Exchan 0.5 ml özler konsantrege CH çözücü / ACE (90/10; hac / hac).
- LC-MS / MS 21 başka yerlerde tarif edilen yönteme benzer şekilde, büyük hacimli enjeksiyon, kullanma suyu örnekleri analiz edin.
5. Enstrümental Analiz
- GC-MS analizi
- Elektron iyonizasyon (EI) ve negatif kimyasal iyonizasyon (NCI) modunda, sırasıyla 22 GC-MS sistemleri kullanılarak CH / ACE özleri enstrümantal analiz gerçekleştirin.
- EI kullanarak GC-MS yöntemi için bir HP-5MS UI kolonunda Splitless enjeksiyon yöntemi ile 1 ul (30 m, 0,25 mm iç çapı, 0.25 mikron film) hacimde enjekte edilir.
- GC-MS metodu kullanılarak CI için, HP-5MS UI kolonunda 3 ul (30 m, 0,25 mm iç çapı, 0.25 mikron film) hacimde enjekte edilir.
- HPLC-MS / MS analizi
- (-) ESI () ve pozitif iyon m ACN enstrümantal analiz gerçekleştirin kullanarak ekstrelerinden HPLC-MS / MS bir elektro negatif iyonlaşma kaynağı ile arabirimode ((+) ESI) 22.
- ACN FA ile pH 5'e ayarlanmış 900 ul ultra-saf su ile özleri (+) ESI, 100 ul seyreltilmiş.
- (-) ESI, ACN 100 ul ultra-saf su içinde% 1 FA 900 ul çözeltisi ile özleri seyreltin.
- (+) ESI için, 0.3 ml dak-1 olan bir akış oranında 2-propanol / metanol / 10 mM amonyum format (6/2/92, hacim / hacim / hacim) ve MeOH içeren bir ikili gradyan kullanın.
- (-) ESI, 0.3 mi dak-1 bir akış oranında ACN / ultra saf su,% 0.1 HAC ACN +% 0.1 HAc oluşan bir ikili gradyan kullanın.
- İki çevrimiçi SPE sütunu (20 x 2 mm ID 20-25 um parçacık boyutu) ve bir analitik sütun (C18, 100 x 3 mm, 3.5 um) 21 ile 500 ul bir büyük hacimli enjeksiyon kullanarak tüm numune enjekte edilir.
Pasif Örnekleme 6. Teorisi
NOT: Pasif örnekleyici Mediu'nun için kimyasal alımı profiliDoğrusal, eğrisel ve denge (Şekil 3): m (PSM) üç bölüme ayrılmıştır.
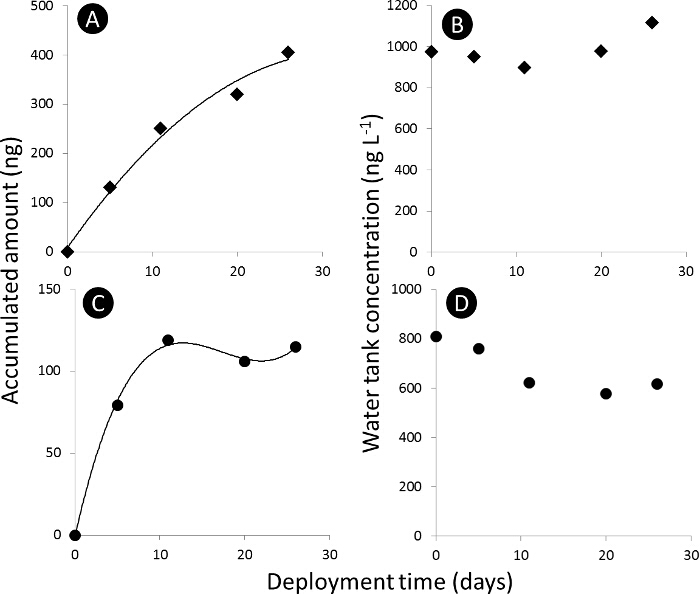
3. Pasif örnekleyici alımı eğrisi Şekil. A) ve C) alımı mutlak ng pasif örnekleyicilerin (N t) sırasıyla asetamiprid ve dimethoate'nin, birikmiş miktarı için eğri, ve B) ve D) ng L sırasıyla asetamiprid ve dimethoate'nin, su deposu konsantrasyonu - 1. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- (Maruziyet t gün sonra pasif Örnekleyicideki N 't hedef bileşiklerin birikmiş miktarda bölerek pasif örnekleyici için eşdeğer su hacmi (V eq L) hesaplayın -1, w c kepçe ve zaman entegre aktif örnekleme yöntemiyle su fazında konsantrasyonu p> ng).
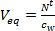 (1)
(1) - Dağıtım zamana karşı V eq eğimini alarak, alım profilin lineer alımı aşamasından örnekleme hızı (R S, L gün -1) türevi.
- K PW denklem kullanılarak farklı böcek ilacı için (-1 L kg) hesaplayın. 2.
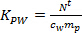 (2)
(2)
m p örnekleyici başına sorbent kütlesi olduğu (ng). - Lineer alım aşamasında, (TWA, ng L -1 c) nolu denklem kullanılarak pasif örnekleyici tarafından türetilen suda analitin TWA konsantrasyonunu hesaplamak. 3..
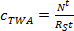 (3)
(3)
burada R, S sampling oranı (L gün -1) ve t dağıtım süresi (gün). - Eğrisel aşamada, eşitlik kullanılarak TWA c hesaplayın. 4.
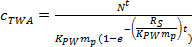 (4)
(4) - Denge aşamasında, eşitlik kullanılarak TWA c hesaplayın. 5.
 (5)
(5)
7. İstatistiksel Veri Analizi
- Bir Shapiro-Wilk testi 23 kullanarak veri olmayan normal dağılım test edin. Test pestisitlerin fizikokimyasal özellikleri 24 (-1 1 arasında değişen Spearman rho) vs K PW ve R S parametrik olmayan Spearman sıra korelasyonu kullanın.
Sonuçlar
Beş farklı pasif örnekleyici teknikleri 124 mirasının alımı ve silikon kauçuk (Şekil 1) ve POCIS A, POCIS B, SDB-RPS ve C 18 diskte (Şekil 2) dahil olmak üzere mevcut kullanılan pestisitlerin için karşılaştırıldı. ekstraksiyon yöntemi ve enstrümantal analiz performansı optimize edildi. Laboratuar alım deneylerinin sonuçları PW değerleri farklı böcek ilacı (Şekil 3) için alım ...
Tartışmalar
Kalite kontrolü için, standart prosedür, laboratuvar boşlukları olarak, algılama (LOD), kurtarma ve tekrarlanabilirlik sınırları 23 incelenmiştir. Birkaç böcek ilaçları, düşük konsantrasyon seviyelerinde boş örneklerde tespit edildi. LODs ortalama LODs silikon kauçuk, POCIS-A için 1.7 pg mutlak 1.6 sütun üzerine enjekte 8.0 pg mutlak 3. Bu gürültü oranına bir sinyal kriterlerini karşılayan kalibrasyon eğrisine en alçak noktası değeri olarak belirlendi pg POCIS-B, SDB-RPS disk ...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 mL | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 mL | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
Referanslar
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır