A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אפיון ויישום של דוגמים פסיביים עבור ניטור של דברה במים
In This Article
Summary
A protocol about the characterization and application of five different passive sampling devices is presented.
Abstract
חמישה דוגמים פסיביים שונים מים כוילו בתנאי מעבדה למדידת 124 מורשת וחומרי הדברה בשימוש נוכחית. מחקר זה מספק פרוטוקול לעריכת סמפלר פסיבית, כיול, שיטת החילוץ וניתוח אינסטרומנטלי. שיעורי דגימה (R S) ומקדמי מחיצה סמפלר-מים פסיביים (K PW) חושבו עבור גומי סיליקון, POCIS-סמפלר אינטגרטיבי כימי הקוטבי אורגני, POCIS-B, SDB-RPS ודיסק 18 C. הספיגה של התרכובות שנבחרו תלוי מאפייני physicochemical שלהם, כלומר, גומי סיליקון הראה ספיגה טובה יותר עבור תרכובות הידרופובי יותר (יומן מקדם חלוקת octanol-מים (K OW)> 5.3), ואילו POCIS-A, POCIS-B ו- SDB- דיסק RPS היה יותר מתאים תרכובות הידרופיליות (יומן K OW <0.70).
Introduction
דברה הם הציגו ברציפות בסביבה המימית ועלולה לסכן את אורגניזמים ימיים 1. ניטור של חומרי הדברה בסביבה המימית טיפוסי מבוצע דגימה לתפוס, לעומת זאת, טכניקת דגימה זו אינה מסבירה במלואה את הווריאציות זמניות בריכוזים בשל תנודות בתשומות זרימה או אפיזודי (למשל, משקעים, גלישות ביוב בשילוב, הלגונה ביוב שחרור) 2 , 3. לפיכך, שיטות ניטור צריכות להשתפר עבור אמידה טובה יותר של סיכונים סביבתיים הקשורים חומרי הדברה. דגימה פסיבית מאפשר ניטור רציף על פני תקופה ארוכה של זמן עם תשתית מינימלית וריכוזי מזהמים נמוכה 4,5.
דוגמים פסיביים הוכחו להיות כלי רב ערך עבור הניטור מי תהום 6, מים מתוקים 7-10, שפכי 11 ו במי אוקיינוס 12. מלבד מעקב אחר מטרות 13,14, סמפלרים פסיבי גם שימשו לניתוח יעד שאינו 15, בדיקות הרעלים 16,17, ו כחלופה sediment- ו מסויים מופעל 18. דוגמים פסיביים לצבור כימיקלים ברציפויות ממים ולספק זמן ממוצע משוקלל (TWA) ריכוזים 14. את הספיגה של חומר המזהם תלוי קצב הדגימה (R S) ואת מקדם חלוקת סמפלר-מים פסיבי (K PW), אשר תלוי בעיצוב סמפלר הפסיבי, חומר סמפלר, מאפייני physicochemical של חומר המזהם, ותנאים סביבתיים (למשל, מים מערבולת, טמפרטורה) 13,14,19,20.
הסרטון המפורט שמטרתו להראות כיצד לכייל ולהחיל דוגמים פסיביים הדברה במים. היעדים הספציפיים הכלולים i) כדי לבצע הכנה, מיצוי וניתוח אינסטרומנטלי עבור 124 חומרי הדברה בודדים באמצעות חמישה סוגים שונים של sampl פסיביers, כולל גומי סיליקון, סמפלר אינטגרטיבי כימיים אורגניים קוטבי (POCIS) -A, POCIS-B, SDB-RPS ו- C 18 דיסק, ii) להעריך R S ו- K PW עבור חומרי הדברה במחקר ספיגת מעבדה, ו- III) כדי להדגים כיצד לבחור את סמפלר הפסיבית המתאימה של מתחם היעד של עניין וכיצד לחשב ריכוזי TWA עבור סמפלר הפסיבית בהתאמה.
התייחסות לסטנדרטים והתקנים סמפלר פסיבי
תרכובות יעד כללו 124 מורשת וכיום חומרי הדברה בשימוש כולל קוטלי עשבים, קוטלי חרקים וקוטלי פטריות (טבלה 1). תערובת פנימית סטנדרטית (IS תערובת) כללה fenoprop (2,4,5-TP), clothianidin 3-D, ethion ו terbuthylazine-D 5. כימיקלים המשמשים אחרות כללו מתנול (MeOH), אצטוניטריל (ACN), אצטון (ACE), dichloromethane (DCM), cyclohexane (CH), אתיל אצטט (EA), et נפטלה (PE), 2-propanol, פתרון אמוניה 25%, חומצה אצטית (HAC) וחומצה פורמית (FA). חמישה מכשירים דגימה פסיבית שונות התאפיינו, כולל גומי סיליקון, POCIS-A ו- POCIS-B, SDB-RPS, ו 1,21 דיסק 18 C.
טבלה 1. קצב הדגימה סמפלר פסיבי (ר 'S, L יום -1), מקדמי החלוקה סמפלר-מים (K' PW, L ק"ג -1) ומשוואות (Eq.) המשמש לחישוב ריכוזים בדגימות שדה לאדם חומרי הדברה א. (נדפס מן ביומן של כרומטוגרפיה, 1405, לוץ אהרנס, Atlasi Daneshvar, אנה א לאו, ג'ני Kreuger, אפיון חמישה מכשירי דגימה פסיבית לניטור של חומרי הדברה במים, 1-11, כל הזכויות שמורות (2015), באישור Elsevier .) 22 אנא לחץ כאן כדי להוריד את הקובץ.
Protocol
1. עיצוב דגם פסיבי הכנה
- יריעות גומי סיליקון
- חותכים את יריעות סיליקון גומי (600 מ"מ x 600 מ"מ, 0.5 מ"מ עובי) לתוך פסים של 2.5 מ"מ x 600 מ"מ ו -2.5 מ"מ x 314 מ"מ, בעזרת סכין נירוסטה ולחבר אותם באמצעות מסמרת עיוורת נירוסטה (3.2 מ"מ x 10 מ"מ עם) רובה מסמרות להשיג גודל הרצועה סמפלר כולל של 2.5 מ"מ x 914 מ"מ (שטח פנים = 457 ס"מ 2, המוני sorbent = 15.6 גרם, נפח = 22.9 ס"מ 3).
- מניחים את גומי סיליקון בתא החילוץ של מנגנון Soxhlet. להוסיף EA 50 מ"ל בתא החילוץ ולהוסיף 250 מ"ל EA ושלושה אבנים רותחים בבקבוק בקבוק 500 מ"ל עגול.
- חבר את תא החילוץ עם בקבוק הבקבוק מעבה. נקו את גומי סיליקון על ידי מיצוי Soxhlet למשך 96 שעות על כ 80 מעלות צלזיוס, ומייבשים אותם לאחר מכן תחת גז חנקן עדין.
- צרף את stri גומי סיליקוןpe לבעל מדגם עכביש נירוסטה ידי לפף פס גומי סיליקון סביב מוטה על הבעל (איור 1). צרף בכל קצה של פס גומי סיליקון מוט על הבעל באמצעות קשרי כבל.

איור 1. סכמטי של גומי סיליקון. סכמטי סמפלר פסיבי עבור גומי סיליקון מראה את החיבור של פס סיליקון גומי על בעל מדגם עכביש נירוסטה) מלמעלה ו- B) את התצוגה בצד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- POCIS-A ו- POCIS-B
- לקבלת POCIS-A, להציב 220 מ"ג של sorbent בתפזורת HLB (שטח פנים = 1.78 x 10 6 ס"מ 2) בין שני 9.0 ס"מ על 9.0 ס"מ squarממברנות דואר polyethersulfone (PES) (איור 2).
- לקבלת POCIS-B, להציב 220 מ"ג של תערובת sorbent (כלומר, שרף פוליסטירן-divinylbenzene hydroxylated (80%) לבין בעלי כושר ספיגה פחמני התפזרו על קופולימר סטירן divinylbenzene (20%)) (שטח פנים = 2.82 x 10 6 ס"מ 2) בין שני קרומי PES (איור 2).
- לדחוס את הסופג ושני PES בין שתי טבעות נירוסטה ידני (O פנימי = 5.4 ס"מ) ולאבטח אותו על בעל מדגם נירוסטה (איור 2).

איור 2. סכמטי של דיסקים סמפלר פסיביים. סכמטי סמפלר הפסיבי עבור POCIS A, B POCIS, דיסק SDB-RPS ודיסק C 18 מראה א) להרכבה של סמפלר הפסיבית באמצעות טבעות נירוסטה, polyethersulfone (PES) membranes, ואת השלב המקבל, ו- B) להרכבה על בעל מדגם נירוסטה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- SDB-RPS דיסק ו- C 18 דיסק
- מניחים את (שטח פנים = 35 ס"מ 2, המוני sorbent = 0.34 גרם, נפח = 1.7 ס"מ 3) SDB-RPS ודיסקים 18 C (שטח פנים = 35 ס"מ 2, המוני sorbent = 0.58 גרם, נפח = 1.7 ס"מ 3) בין שתי ממברנות PES (איור 2). לדחוס את הדיסקים ושני PES בין שתי טבעות נירוסטה ידנית (O הפנימי = 5.4 סנטימטרים) ולאבטח אותו על בעל מדגם נירוסטה (איור 2).
2. ניסויים ספיגת מעבדה
הערה: הניסויים הספיגים המעבדה בוצעו כדי לאפיין את k הספיגה כמותיתinetics עבור 124 חומרי הדברה בודדות עבור חמישה מכשירי סמפלר פסיביים שונים בתנאים מבוקרים.
- לביצוע המחקר ספיגת במיכלי זכוכית מלבני (כל ~ 95 L): טנק 1) גומי סיליקון (n = 16), מיכל 2) POCIS-A (n = 16), POCIS-B (n = 16), ואת הטנק 3 דיסק SDB-RPS) (n = 16), דיסק 18 C (n = 16). מלאו מים טבעיים לתוך שלושה טנקים.
- בצע את כל הניסויים בטמפרטורת מים קבוע (~ 20 ° C) ובתנאי מים סוערים (~ 10 סנטימטרי שניות -1) באמצעות שתי משאבות חשמליות מחוברות לקיר בכל צד. בצע את הניסויים בחושך כדי למזער את ההשפעה של photodegradation.
- ספייק כל מיכל זכוכית עם תערובת תקן הדברה המכילים 124 חומרי הדברה באמצעות מזרק זכוכית (ג ≈ 400 ננוגרם ל -1 עבור חומרי הדברה הפרט במיכל המים). קח את הדוגמים הפסיביים ידניים מהטנקים, במרווחי זמן של 5, 11, 20, ו -26 דays, כדי לקבוע את שיעורי דגימה של חומרי הדברה.
- לפקח על ריכוזים של חומרי הדברה בכל טנק על ידי איסוף 100 מ"ל דגימות מים ביום 0, 5, 11, 20, ו 26. ניתוח של דגימות המים מתבצעת כמתואר במקום אחר 21.
- עבור בקרת איכות, לחשוף דגימות ריקות לאוויר חדר למשך שעה 1 ביום 0 ולאחר מכן לאחסן ולהתייחס אליהם כאל דוגמאות אמיתיות. אחסן את כל תמציות כמו גם דגימות מים 100 מ"ל שנאספו מהטנקים ב -18 ° C עד לניתוח נוסף.
הפקה לדוגמא 3.
- גומי סיליקון
- לפני החילוץ, לייבש את פס גומי סיליקון תחת זרם של גז חנקן טוהר גבוהה.
- עבור ספקטרומטריית כרומטוגרפיה-מסת הגז (GC-MS) ניתוח, לבצע את החילוץ מוצק נוזלי באמצעות מיצוי Soxhlet 22.
- מניחים את גומי סיליקון לתוך חולץ Soxhlet. הוסף 250 מ"ל PE / ACE (50/50, נ / V) ו -3 ווראבני לינג לתוך בקבוק הבקבוק העגול.
- ספייק גומי סיליקון עם 100 μl של IS תערובת (c = 5 ng מיליליטר -1) באמצעות מזרק זכוכית. הוסף 50 מ"ל PE / ACE (50/50, נ / V) לתוך חולץ Soxhlet. הפעילו את החימום ולהפעיל את החילוץ Soxhlet במשך 19 שעות ולאחר מכן לכבות את החימום.
- לרכז את התמציות על ידי אידוי סיבובי ואחריו מטה-מכת חנקן העדין עד 1 מיליליטר. להחליף הממס CH / ACE (90/10, נ / V) על ידי הוספת שלוש פעמים 1 מ"ל CH / ACE (90/10, נ / V) במהלך למטה-מכה חנקן 1 מ"ל.
- עבור ספקטרומטריית מסה כרומטוגרפיה-טנדם נוזלי (LC-MS / MS) ניתוח, לבצע את החילוץ באמצעות מיצוי Soxhlet 22.
- מניחים את גומי סיליקון לתוך חולץ Soxhlet. הוסף 250 מ"ל MeOH ו -3 אבנים רותחים לתוך הבקבוק בקבוק עגול 50 מ"ל MeOH לתוך חולץ Soxhlet. ספייק הגומי סיליקון עם 100 μl של IS תערובת (c = 5 ng מ"ל -1) בעזרת כוס SYRאינגה.
- הפעילו את החימום ולהפעיל את החילוץ Soxhlet במשך 19 שעות ולאחר מכן לכבות את החימום. לרכז את התמציות על ידי אידוי סיבובי ואחריו מטה-מכת חנקן העדין עד 1 מיליליטר. להחליף הממס ACN על ידי הוספת 1 מ"ל ACN במהלך מכה למטה חנקן 1 מ"ל.
- POCIS-A ו- POCIS-B
- פתח את סמפלר POCIS בזהירות ולהעביר את הסופג עם מים ultrapure באמצעות משפך לתוך מיצוי שלב ריק מראש לנקות פוליפרופילן מוצק (SPE) מחסנית (6 מ"ל) המכיל שני פוליאתילן פריץ (PE). ייבש את הסופג ידי ואקום כדי להסיר מים. רשום את המשקל של מחסנית SPE ריק וארזה לשלוט משקל החומר הסופג. יש לציין כי מחסניות שונות משמשות עבור GC-MS ו LC-MS / MS ניתוח.
- לפני elution, ספייק sorbent עם 100 μl של IS תערובת (c = 5 ng מ"ל -1) באמצעות מזרק זכוכית. Elute POCIS-A ו- סופגים POCIS-B באמצעות 5מ"ל EA עבור GC-MS 22.
- לרכז את תמציות עד 1 מ"ל על ידי מכה למטה חנקן עדין. להחליף הממס CH / ACE (90/10, נ / V) על ידי הוספת שלוש פעמים 1 מ"ל CH / ACE (90/10, נ / V) במהלך למטה-מכה חנקן 1 מ"ל.
- Elute POCIS-A ו- מחסניות POCIS-B באמצעות 1.5 מ"ל MeOH ואחריו 8 מ"ל DCM / MeOH (80/20, נ / V) לניתוח LC-MS / MS 22. לרכז את תמציות עד 1 מ"ל על ידי מכה למטה חנקן עדין. להחליף הממס ACN על ידי הוספת 1 מ"ל ACN במהלך מכה למטה חנקן 1 מ"ל.
- SDB-RPS ו- C 18 דיסק
- העבר דיסקים בודדים של SDB-RPS ו- C 18 דיסק לתוך כוס זכוכית ומייבשים אותם תחת גז חנקן. ספייק הדיסקים עם 100 μl של IS תערובת (c = 5 ng מ"ל -1) באמצעות מזרק זכוכית sonicate אותם פעמיים בכוס זכוכית בטמפרטורת החדר, הראשון עם 5 מ"ל של EA במשך 10 דקות ולאחר מכן עם 3 מ"ל של EA במשך 10 דקות.
- העברת boתמציות ה לתוך שפופרת זכוכית אחד, לרכזם 2 מ"ל ידי מכה חנקן תירגע, ולפצל אותם לשתי 1 מ"ל שברים (עבור MS ו- GC LC-MS / MS ניתוח, בהתאמה).
- לרכז את תמציות 0.5 מ"ל על ידי מכה למטה חנקן עדין להחליף הממס CH / ACE (90/10, נ / V) עבור ניתוח GC-MS 22. לרכז את התמציות 0.5 מיליליטר על ידי מטה-מכת חנקן עדין להחליף ממס ACN לניתוח LC-MS / MS 22.
4. דגימות מים
- ספייק 20 מ"ל דגימת מים עם 100 μl של IS תערובת (c = 5 ng מ"ל -1) באמצעות מזרק זכוכית, להוסיף 3 מ"ל של DCM, מערבולת במשך 3 דקות, למזוג לתוך מפריד שלב לניתוח GC-MS 22.
- לאחר שני שלבי מופרדים, לחלחל בשלב DCM לתוך צינור זכוכית. חזור על החילוץ באמצעות 3 מ"ל DCM, ולשטוף את הצינור עם 2 מ"ל DCM. לבסוף, לרכז את תמציות 0.5 מ"ל ידי למטה מכה חנקן עדין exchange הממס CH / ACE (90/10, נ / V).
- ניתוח דגימות המים באמצעות הזרקת כמות גדולה, דומה לשיטה תארה במקום ב -21 LC-MS / MS.
5. ניתוח אינסטרומנטלי
- ניתוח GC-MS
- בצעו אנליזה של תמציות CH / ACE באמצעות מערכות-MS GC ב יינון אלקטרון (EI) ו יינון כימי שלילית (NCI) מצב, בהתאמה 22.
- לקבלת השיטה GC-MS באמצעות EI, להזריק aliquots של 1 μl עם שיטת הזרקת splitless על עמודה UI HP-5ms (30 מ ', 0.25 מ"מ קוטר פנימי, 0.25 מיקרומטר הסרט).
- עבור CI בשיטה GC-MS, להזריק aliquots של 3 μl על עמודה UI HP-5ms (30 מ ', 0.25 מ"מ קוטר פנימי, 0.25 מיקרומטר הסרט).
- ניתוח HPLC-MS / MS
- לבצע את הניתוח האינסטרומנטלי של ACN תמציות באמצעות HPLC-MS / MS להתממשק עם מקור יינון electrospray ב שלילית ((-) ESI) ו- m חיובי-יוןאודה ((+) ESI) 22.
- לקבלת (+) ESI, לדלל 100 μl של ACN מחלץ עם מים ultrapure 900 μl מותאם pH 5 באמצעות FA.
- לקבלת (-) ESI, לדלל 100 μl של ACN מחלץ עם 900 פתרון μl של 1% FA במים ultrapure.
- לקבלת (+) ESI, להשתמש שיפוע בינארי בהיקף של 2-propanol / מתנול / 10 מ"מ formate אמוניום (6/2/92, נ / V / V) ו MeOH בקצב זרימה של 0.3 מ"ל דקות -1.
- לקבלה (-) ESI, להשתמש שיפוע בינארי מורכב מי ACN / ultrapure 0.1% HAC ו ACN + 0.1% HAC בקצב זרימה של 0.3 מיליליטר דקות -1.
- להזריק כל הדגימות באמצעות הזרקת כמות גדולה של 500 μl באמצעות שתי עמודות SPE מקוון (הן id מ"מ 20 x 2 ו 20-25 גודל החלקיקים מיקרומטר), ואת טור אנליטי (18 C, 100 x 3 מ"מ, 3.5 מיקרומטר) 21.
תורת 6. על דגימה פסיבית
הערה: הפרופיל הספיג של הכימיקל אל mediu סמפלר הפסיבימ '(PSM) מחולק לשלושה חלקים: בשכבות, curvilinear ושיווי משקל (איור 3).
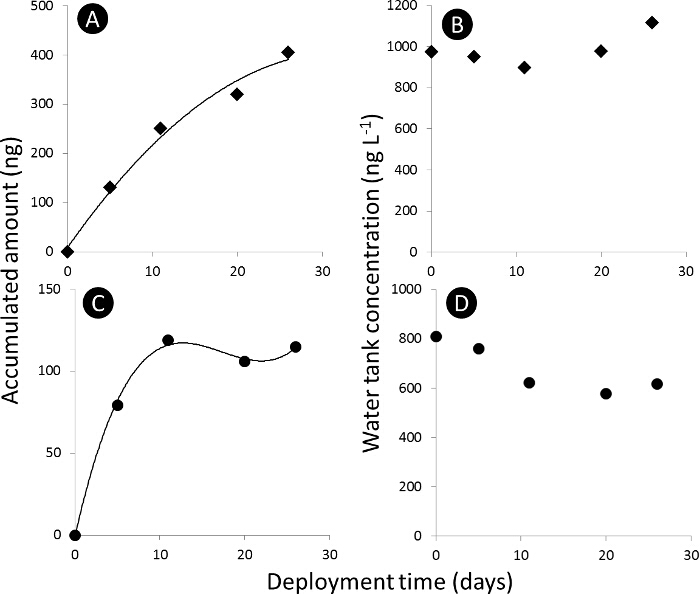
איור 3. עקומת סמפלר ספיגה פסיבית. א) ו- C) עקום ספיג עבור הסכום המצטבר של Acetamiprid ו dimethoate, בהתאמה, סמפלרים הפסיבי (N t) ב ng מוחלט, ו- B) ו- D) ריכוז מיכל מים של Acetamiprid ו dimethoate, בהתאמה, ב L ng - 1. נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- חשבתי את נפח מים השווה ערך (V EQ L) עבור סמפלר פסיבי על ידי חלוקת הסכום המצטבר של תרכובות יעד סמפלר הפסיבי לאחר ימי t חשיפה (t 'N , נ"ג) על ידי הריכוז בשלב המים באמצעות לתפוס דגימה פעילה משולבת זמן (ג w, ng ל -1).
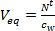 (1)
(1) - לגזור את קצב הדגימה (R S, L יום -1) מהשלב ספיגת ליניארי של הפרופיל ספיגת, על ידי לקיחת המדרון של V EQ לעומת זמן הפריסה.
- חשב את K PW (L ק"ג -1) עבור חומרי הדברה בודדים באמצעות Eq. 2.
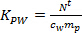 (2)
(2)
כאשר m p היא המסה sorbent לכל סמפלר (ng). - בשלב הספיג ליניארי, לחשב את ריכוז TWA של אנליטי במים שמפיקים סמפלר הפסיבית (ג TWA, ng ל -1) באמצעות Eq. 3.
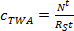 (3)
(3)
כאשר R S הוא saשיעור mpling (L יום -1), ו- t הוא זמן הפריסה (ימים). - בשלב curvilinear, לחשב ג TWA באמצעות Eq. 4.
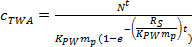 (4)
(4) - בשלב שיווי משקל, לחשב ג TWA באמצעות Eq. 5.
 (5)
(5)
7. ניתוח נתונים סטטיסטיים
- בחן את ההפצה הלא נורמלית של הנתונים באמצעות מבחן שפירא-וילק 23. השתמש הלא פרמטרית מתאם דרגה של ספירמן עבור K PW ו- R S vs מאפייני physicochemical של חומרי הדברה שנבדקו (Rho של ספירמן החל מ -1 עד 1) 24.
תוצאות
חמש טכניקות סמפלר פסיביות שונות הושוו עבור הספיגה של 124 מורשת וחומרי הדברה בשימוש הנוכחית כולל גומי סיליקון (איור 1), ו POCIS A, B POCIS, SDB-RPS ו- C 18 דיסק (איור 2). המופע של שיטת החילוץ וניתוח אינסטרומנטלי היה מותאם. התוצאה של הניסויים הס?...
Discussion
עבור בקרת איכות, כמו נוהל מקובל, חסר מעבדה, מגבלות של גילוי (לוד), החלמה, ואת הדירות נבדקו 23. כמה חומרי דברה התגלו בדגימות הריקות ברמות ריכוז נמוכות. LODs נקבעו כערך של הנקודה הנמוכה ביותר על עקומת כיול אשר עונה על הקריטריונים של יחס אות לרעש של 3. LODs הממוצע היו 8.0 pg מו?...
Disclosures
The authors have nothing to disclose.
Acknowledgements
The Swedish EPA (Naturvårdsverket) (agreement 2208-13-001) and Centre for Chemical Pesticides (CKB) are gratefully acknowledged for funding this project. We thank Märit Peterson, Henrik Jernstedt, Emma Gurnell and Elin Paulsson at the OMK-lab, SLU, for skillful assistance with analytical support and supply of pesticide standards.
Materials
| Name | Company | Catalog Number | Comments |
| Methanol | Merck Millipore | 1.06035.2500 | |
| Acetonitrile | Merck Millipore | 1.00029.2500 | |
| Acetone | Merck Millipore | 1.00012.2500 | |
| 2-propanol | Merck Millipore | 1.00272.2500 | |
| Dichloromethane | Merck Millipore | 1.06054.2500 | |
| Ammoniak | Merck Millipore | 1.05428.1000 | Purity 25% |
| Formic acid | Sigma-Aldrich | 94318-50ML-F | Purity ~98% |
| Ethyl acetate | Sigma-Aldrich | 31063-2.5L | for pesticide residue analysis |
| Petroleum ether | Sigma-Aldrich | 34491-4X2.5L | for pesticide residue analysis |
| Acetic acid | Sigma-Aldrich | 320099-500ML | Purity ≥99.7% |
| Cyclohexane | Fisher Chemicals | C/8933/17 | for residue analysis |
| Empty polypropylene SPE Tube with PE frits, 20 μm porosity, volume 6 ml | Supelco | 57026 | |
| Empore SPE Disks, C18, diam. 47 mm | Supelco | 66883-U | Passive sampler |
| Empore SPE Disks, SDB-RPS (Reversed-Phase Sulfonate), diam. 47 mm | Supelco | 66886-U | Passive sampler |
| POCIS-A | EST | POCIS-HLB | Passive sampler |
| POCIS-B | EST | POCIS-Pesticide | Passive sampler |
| Polyethersulfone (PES) membranes | EST | PES | |
| Silicone rubber sheet | Altec | 03-65-4516 | Passive sampler |
| Agilent 5975C | Agilent Technologies | 5975C | GC-MS |
| HP-5MS UI | J&W Scientific | HP-5MS | Analytical column for GC-MS |
| Agilent 6460 | Agilent Technologies | 6460 | HPLC-MS/MS |
| Strata C18–E, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata C18–E | Online SPE column for LC-MS/MS |
| Strata X, 20 x 2 mm id and 20–25 μm particle size | Phenomenex | Strata X | Online SPE column for LC-MS/MS |
| Zorbax Eclipse Plus C18 | Agilent Technologies | Zorbax Eclipse Plus C18 | Analytical column for LC-MS/MS |
| Isolute phase separator, 25 ml | Biotage | 120-1907-E | |
| Stainless steel blind rivet, 3.2x10 mm | Ejot & Avdel | 951222 |
References
- Rodney, S. I., Teed, R. S., Moore, D. R. J. Estimating the toxicity of pesticide mixtures to aquatic organisms: A review. Hum. Ecol. Risk Assess. 19 (6), 1557-1575 (2013).
- Kreuger, J. Pesticides in stream water within an agricultural catchment in southern Sweden, 1990-1996. Sci. Total Environ. 216 (3), 227-251 (1998).
- Carlson, J. C., Challis, J. K., Hanson, M. L., Wong, C. S. Stability of pharmaceuticals and other polar organic compounds stored on polar organic chemical integrative samplers and solid-phase extraction cartridges. Environ. Toxicol. Chem. 32 (2), 337-344 (2013).
- Alvarez, D. A., et al. Development of a passive, in situ, integrative sampler for hydrophilic organic contaminants in aquatic environments. Environ. Toxicol. Chem. 23 (7), 1640-1648 (2004).
- Vrana, B., et al. Passive sampling: An effective method for monitoring seasonal and spatial variability of dissolved hydrophobic organic contaminants and metals in the Danube river. Environ. Pollut. 184, 101-112 (2014).
- Dougherty, J. A., Swarzenski, P. W., Dinicola, R. S., Reinhard, M. Occurrence of herbicides and pharmaceutical and personal care products in surface water and groundwater around Liberty Bay, Puget Sound, Washington. J. Environ. Qual. 39 (4), 1173-1180 (2010).
- Muñoz, I., Martìnez Bueno, M. J., Agüera, A., Fernández-Alba, A. R. Environmental and human health risk assessment of organic micro-pollutants occurring in a Spanish marine fish farm. Environ. Pollut. 158 (5), 1809-1816 (2010).
- Wille, K., et al. Rapid quantification of pharmaceuticals and pesticides in passive samplers using ultra high performance liquid chromatography coupled to high resolution mass spectrometry. J. Chromatogr. A. 1218 (51), 9162-9173 (2011).
- Poulier, G., et al. Estimates of pesticide concentrations and fluxes in two rivers of an extensive French multi-agricultural watershed: application of the passive sampling strategy. Environ. Sci. Pollut. Res. 22 (11), 8044-8057 (2015).
- Moschet, C., Vermeirssen, E. L. M., Singer, H., Stamm, C., Hollender, J. Evaluation of in-situ calibration of chemcatcher passive samplers for 322 micropollutants in agricultural and urban affected rivers. Water Res. 71, 306-317 (2015).
- Petty, J. D., et al. An approach for assessment of water quality using semipermeable membrane devices (SPMDs) and bioindicator tests. Chemosphere. 41 (3), 311-321 (2000).
- Metcalfe, C. D., et al. Contaminants in the coastal karst aquifer system along the Caribbean coast of the Yucatan Peninsula, Mexico. Environ. Pollut. 159 (4), 991-997 (2011).
- Allan, I. J., et al. Field performance of seven passive sampling devices for monitoring of hydrophobic substances. Environ. Sci. Technol. 43 (14), 5383-5390 (2009).
- Vrana, B., et al. Passive sampling techniques for monitoring pollutants in water. TrAC - Trend. Anal. Chem. 24 (10), 845-868 (2005).
- Allan, I. J., Harman, C., Ranneklev, S. B., Thomas, K. V., Grung, M. Passive sampling for target and nontarget analyses of moderately polar and nonpolar substances in water. Environ. Toxicol. Chem. 32 (8), 1718-1726 (2013).
- Escher, B. I., et al. Evaluation of contaminant removal of reverse osmosis and advanced oxidation in full-scale operation by combining passive sampling with chemical analysis and bioanalytical tools. Environ. Sci. Technol. 45, 5387-5394 (2011).
- Pesce, S., Morin, S., Lissalde, S., Montuelle, B., Mazzella, N. Combining polar organic chemical integrative samplers (POCIS) with toxicity testing to evaluate pesticide mixture effects on natural phototrophic biofilms. Environ. Pollut. 159 (3), 735-741 (2011).
- Booij, K., Smedes, F., Van Weerlee, E. M., Honkoop, P. J. C. Environmental monitoring of hydrophobic organic contaminants: The case of mussels versus semipermeable membrane devices. Environ. Sci. Technol. 40 (12), 3893-3900 (2006).
- Harman, C., Allan, I. J., Vermeirssen, E. L. M. Calibration and use of the polar organic chemical integrative sampler-a critical review. Environ. Toxicol. Chem. 31 (12), 2724-2738 (2012).
- Jonker, M. T. O., Der Heijden, S. A. V. a. n., Kotte, M., Smedes, F. Quantifying the effects of temperature and salinity on partitioning of hydrophobic organic chemicals to silicone rubber passive samplers. Environ. Sci. Technol. 49 (11), 6791-6799 (2015).
- Jansson, C., Kreuger, J. Multiresidue analysis of 95 pesticides at low nanogram/liter levels in surface waters using online preconcentration and high performance liquid chromatography/tandem mass spectrometry. J. AOAC Int. 93 (6), 1732-1747 (2010).
- Ahrens, L., Daneshvar, A., Lau, A. E., Kreuger, J. Characterization of five passive sampling devices for monitoring of pesticides in water. J. Chromatogr. A. 1405, 1-11 (2015).
- Royston, P. Approximating the Shapiro-Wilk W-test for non-normality. Stat. Comput. 2 (3), 117-119 (1992).
- Gauthier, T. D. Detecting trends using Spearman's rank correlation coefficient. Environ. Forensics. 2 (4), 359-362 (2001).
- Morin, N., Miège, C., Coquery, M., Randon, J. Chemical calibration, performance, validation and applications of the polar organic chemical integrative sampler (POCIS) in aquatic environments. TrAC - Trend. Anal. Chem. 36, 144-175 (2012).
- . Water Quality - Sampling - Part 23: Guidance on Passive Sampling in Surface Waters. ISO 5667-23:2011. , (2011).
- Morin, N., Camilleri, J., Cren-Olivé, C., Coquery, M., Miège, C. Determination of uptake kinetics and sampling rates for 56 organic micropollutants using "pharmaceutical" POCIS. Talanta. 109, 61-73 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved