A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
يبلوع الهجرة والسرعة تقاس في لايف الابتدائية الضامة الإنسان المصابة بفيروس نقص المناعة البشرية-1
In This Article
Summary
We describe a method to measure the velocity of phagosomes moving towards the cell center in living cells infected with or without the human immunodeficiency virus (HIV) type 1, using spinning disk confocal fluorescence microscopy to identify fluorescent infected cells and bright field microscopy to detect phagosomes.
Abstract
Macrophages are phagocytic cells that play a major role at the crossroads between innate and specific immunity. They can be infected by the human immunodeficiency virus (HIV)-1 and because of their resistance to its cytopathic effects they can be considered to be persistent viral reservoirs. In addition, HIV-infected macrophages exhibit defective functions that contribute to the development of opportunistic diseases.
The exact mechanism by which HIV-1 impairs the phagocytic response of macrophages was unknown. We had previously shown that the uptake of various particulate material by macrophages was inhibited when they were infected with HIV-1. This inhibition was only partial and phagosomes did form within HIV-infected macrophages. Therefore, we focused on analyzing the fate of these phagosomes. Phagosome maturation is accompanied by migration of these compartments towards the cell center, where they fuse with lysosomes, generating phagolysosomes, responsible for degradation of the ingested material. We used IgG-opsonized Sheep Red Blood Cells as a target for phagocytosis. To measure the speed of centripetal movement of phagosomes in individual HIV-infected macrophages, we used a combination of bright field and fluorescence confocal microscopy. We established a method to calculate the distance of phagosomes towards the nucleus, and then to calculate the velocity of the phagosomes. HIV-infected cells were identified thanks to a GFP-expressing virus, but the method is applicable to non-infected cells or any type of infection or treatment.
Introduction
Macrophages play a major role in the innate immune system and in homeostasis. They are professional phagocytes that internalize and eliminate pathogens and debris by a process called phagocytosis 1,2. The phagosome, the closed compartment that forms after the engulfment of particulate material, undergoes a series of fusion and fission events with endocytic compartments, leading to a degradative compartment called the phagolysosome. This compartment has an acidic pH, due to the acquisition of proton-pumping v-ATPases, contains hydrolytic enzymes and is enriched in lysosomal-associated membrane proteins (LAMPs). The maturation of phagosomes is accompanied by their migration on microtubules 3,4 towards the cell center to reach a perinuclear location where lysosomes are accumulated.
Many pathogens have been reported to hijack phagosome maturation, including bacteria with intracellular lifestyles that modify the vacuolar environment where they reside 5. The Human Immunodeficiency Virus (HIV)-1 targets macrophages in addition to T cells. As macrophages are resistant to the cytopathic effects of the virus, unlike T cells, they can be considered as a reservoir for the virus. In addition, macrophages infected with HIV-1 show defective phagocytic functions and contribute to the emergence of opportunistic diseases. In particular, severe invasive non-typhoidal Salmonella disease caused by Salmonella Typhimurium ST313 has been prevalent for the last three decades in sub-Saharan African children or adults infected with HIV 6. It has been estimated that the risk of developing tuberculosis is more than 20 times greater in people living with HIV than among those without HIV infection.
For all these reasons, it is important to better define the molecular mechanisms underlying the phagocytic defects in HIV-infected macrophages. We have shown that the uptake of particulate material, opsonized particles, bacteria or fungi, was inhibited in HIV-infected macrophages 7. Given that this inhibition is partial, we then set out to analyze the fate of the internalized phagosomes in HIV infected human macrophages 8. Because phagosome maturation is tightly connected with migration to the cell center and fusion with lysosomes, a defect in phagosomal maturation can be due to modifications of the trafficking modalities in the infected cell. The method described here uses IgG-opsonized Sheep Red Blood Cells (IgG-SRBCs) as a model to target receptor-mediated phagocytosis and in particular receptors for the Fc portion of immunoglobulins (FcR). These particles are easier to image in bright field (BF) than latex beads because extracellular and intracellular SRBCs show different refraction properties 9. To measure the velocity of phagosomes moving towards the nucleus in HIV-infected macrophages, we used a fluorescent virus 10 and set up a simple manual tracking method that is described here. The method does not require advanced programming and simply uses ImageJ. It is amenable to adherent cells and any type of particle or pathogen that can be visualized with bright field microscopy or with fluorescent imaging.
Protocol
بروتوكول لابد من تنفيذها بما يتفق تماما مع التشريعات الوطنية والدولية واللوائح المحلية. وقد تم الحصول على الدم من المتبرعين الأصحاء التي أعطت موافقتها على التبرع بالدم لأغراض البحث من مراكز نقل الدم التي وقعت المؤسسات الاتفاق. يجب أن تؤخذ حماية خاصة عند استخدام الدم البشري. تجارب مع HIV-1 يجب ان تتم في مستوى السلامة الحيوية 3 أو 2 (BSL-3 أو 2) مختبر وفقا للتشريعات المحلية.
1. إعداد الضامة الوحيدات المستمدة-الإنسان (hMDMs) من خلال التدرج الكثافة الطرد المركزي واختيار من التصاق
- تبدأ مع دماء جديدة من المتبرعين الأصحاء (9 مل). تمييع كامل حجم دماء جديدة مع 1X العقيمة الفوسفات مخزنة المالحة (PBS) دون الكالسيوم والمغنيسيوم 2+ 2+ للحصول على الحجم النهائي من 70 مل وإضافة بلطف الدم المخفف إلى قسمين أنابيب مخروطية 50 مل (35 مل لكل أنبوب) ، وعلى رأس 15 مل منeutral، تشعبت للغاية، عالية الشامل، السكاريد ماء في حل بالفعل في كل أنبوب.
- أجهزة الطرد المركزي كل من أنابيب الدم في 537 x ج لمدة 20 دقيقة عند 20 درجة مئوية دون فرامل. ثم جمع الخلايا وحيدة النواة الدموية المحيطية (PBMCs) الواردة في عصابة خلية غائم في واجهة ونقلها إلى أنبوب 50 مل جديدة تحتوي على 15 مل من برنامج تلفزيوني 1X دون الكالسيوم والمغنيسيوم 2+ 2+.
- الطرد المركزي الخلايا في 218 x ج لمدة 5 دقائق عند 20 درجة مئوية و resuspend بيليه في 45 مل من برنامج تلفزيوني 1X دون الكالسيوم والمغنيسيوم 2+ 2+.
- الطرد المركزي الخلايا في 218 x ج لمدة 5 دقائق عند 20 درجة مئوية، Resuspend وبيليه في 10 مل من برنامج تلفزيوني 1X دون الكالسيوم والمغنيسيوم 2+ 2+، والاعتماد على الخلايا عن طريق تمييع لتخفيف النهائي من 1/200 في التريبان الأزرق.
- الطرد المركزي الخلايا في 218 x ج لمدة 5 دقائق عند 20 درجة مئوية و resuspend بيليه في RPMI (روزويل معهد الحديقة التذكارية) 1640 المتوسطة تستكمل مع 2 مم L-الجلوتامين و 100 ميكروغرام / مل penicillin-الستربتومايسين لديك 7 × 10 6 PBMCs لكل بئر في 2 مل من المتوسط في كل بئر من بئر لوحة 6.
- احتضان لوحات عند 37 درجة مئوية مع 5٪ CO 2 لمدة 2 ساعة. بعد 2 ساعة وانضمت حيدات إلى البلاستيك.
- للسماح حيدات المعزولة حديثا لتفرق في hMDMs، نضح المتوسطة واستبدالها مع 2 مل hMDM المتوسطة (RPMI 1640، 10٪ decomplemented الجنين العجل المصل (FCS)، 2 مم L-الجلوتامين و 1٪ البنسلين ستربتومايسين) تستكمل مع المؤتلف الإنسان بلعم مستعمرة عامل تحفيز (RHM-CSF) بتركيز نهائي من 10 نانوغرام / مل.
- احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO 2 لمدة 11 يوما (الشكل 1).
- في يوم 11 إزالة المتوسطة وغسل 2 مرات مع 2 مل من المتوسط hMDM البارد لكل بئر. التالي غسل كل بئر 2 مرات مع 1 مل من البرد برنامج تلفزيوني 1X.
- لفصل hMDMs متباينة تماما، وغسل كل مرة بشكل جيد 1 مع 1 مل من البرد برنامج تلفزيوني 1X مع 2 مم حمض ethylenediaminetetraacetatic (EDTA) واحتضان الخلايا في 2 مل من البرد برنامج تلفزيوني 1X مع 2 مم EDTA لكل بئر ل15-60 دقيقة على 4 درجات مئوية.
ملاحظة: طرق بديلة لفصل الخلايا موجودة (على سبيل المثال، التربسين أو الأنشطة مثل التربسين) التي قد تعطي نتائج جيدة 11. - بعد انفصال (أنجزت من قبل pipetting بلطف صعودا وهبوطا في البئر)، وجمع الخلايا ووضعها في أنبوب 50 مل على الجليد التي تحتوي على 10 مل من المتوسط hMDM البارد.
- الطرد المركزي الخلايا في 218 x ج لمدة 5 دقائق عند 20 درجة مئوية، Resuspend وبيليه في 10 مل من المتوسط hMDM البارد، والاعتماد على الخلايا عن طريق تمييع 1/20 في التريبان الأزرق.
- البذور الخلايا في 1 × 10 6 hMDMs في 35 مم المجهر الصف الزجاج طبق أسفل واحتضان لوحات عند 37 درجة مئوية مع 5٪ CO 2 لمدة 1 يوم.
2. الإنتاج النوعي والكمي لفيروس نقص المناعة البشرية-1 أسهم الفيروسية
ملاحظة: NLR4.3 HIV-1 الكمامة-iGFP (الأخضر بروتين فلوري) يحمل مظروفا R5-الاستوائية، هدية من السيد Schindlيستخدم إيه 10 إلى إصابة الضامة ورؤية الخلايا المصابة في الوقت الحقيقي.
- إنتاج مخزونات الفيروسية التي ترنسفكأيشن من الخلايا الجنينية البشرية 293T الكلى (2 × 10 6 في 100 طبق مم) مع 6 ميكروغرام من الحمض النووي proviral المقابلة باستخدام كاشف ترنسفكأيشن التجاري.
- قياس العدوى من مخزونات فيروس باستخدام خلايا مؤشر هيلا تزم-BL (تحمل الجين ß غالاكتوزيداز تحت سيطرة HIV-1 LTR) باستخدام التخفيفات المسلسل من الأسهم الفيروسية تليها تلوين ß غالاكتوزيداز من الخلايا والعد خلايا الزرقاء 12.
3. العدوى من hMDMs مع HIV-1
- إضافة الفيروس في عدد وافر من العدوى (وزارة الداخلية) 0،02-0،03 في 1 مل من hMDM المتوسطة إلى hMDMs (خلايا مطلي في 1.13). للسيطرة على آبار إضافة 1 فقط مل من hMDM المتوسطة واحتضان الأطباق عند 37 درجة مئوية مع 5٪ CO 2 ل 2 أيام (الشكل 1).
- في يوم 2 غسل الخلايا مع hMDM ميدالبوتاسيوم 3 مرات وإضافة 1 مل من المتوسط hMDM جديدة لكل طبق. احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO 2 لمدة 6 أيام (الشكل 1).
4. طهاية الأغنام خلايا الدم الحمراء
- لإعداد 7 × 10 6 SRBCs في طبق، وغسل SRBCs مرتين في 100 ميكرولتر من محلول يحتوي على 0.1٪ الأبقار مصل الزلال (BSA) في برنامج تلفزيوني 1X مع الطرد المركزي في 600 x ج لمدة 4 دقائق.
- Resuspend وSRBCs غسلها في 500 ميكرولتر برنامج تلفزيوني 1X / BSA 0.1٪ مع أرنب مفتش مكافحة SRBCs بتركيز-التصاق الفرعية في 5 ميكرولتر من SRBCs واحتضان مع التناوب في RT لمدة 30 دقيقة.
ملاحظة: لتحديد تركيز-التصاق الفرعية معاداة SRBCs مفتش، وإعداد التخفيفات المسلسل من مفتش (تركيز الأسهم بنسبة 13.1 ملغ / مل) من 1/50 إلى 1/25600 في 20 ميكرولتر في لوحة 96-جيدا. إضافة 2 × 10 6 SRBCs في 20 ميكرولتر في كل بئر ووضع لوحة في غرفة مظلمة خلال عدة ساعة. تركيز دون التصاق هوالتخفيف من البئر قبل البئر مع تراص (مفتش + SRBCs تشكيل شبكة). - بعد دوران، الطرد المركزي، SRBCs opsonized مفتش-في 600 x ج لمدة 4 دقائق ويغسل مع 100 ميكرولتر من برنامج تلفزيوني 1X / BSA 0.1٪ مع الطرد المركزي في 600 x ج لمدة 4 دقائق.
- Resuspend و-SRBCs opsonized مفتش في متوسطة الفينول الحمراء الخالية RPMI استعد قبل أن تستكمل مع 2 مم L-الجلوتامين و 1٪ البنسلين ستربتومايسين (1 مل / طبق).
5. الخلية الحية فيديو المجهر البلعمة الفحص
- استخدام نظام التصوير متحد البؤر مثل نظام القرص الغزل مجهزة غرفة التدفئة عند 37 درجة مئوية مع CO 2 يمر زجاجة مع الماء لترطيب.
- بدوره على غرفة التدفئة قبل التجربة لمرحلة المجهر عند 37 درجة مئوية قبل بداية الفحص البلعمة. بدوره على المجهر والكمبيوتر، وتحميل برامج التصوير.
- تحسين إعدادات التصوير مثل سرعة المسح الضوئي، وتعظمأيون، والقرار، وما إلى ذلك ليكون خلية واحدة على الأقل لكل حقل وصورة إطار واحد كل دقيقة ما بين 60 إلى 120 دقيقة.
ملاحظة: هنا، هو تصوير العينة إطار واحد كل دقيقة خلال 60 دقيقة مع 63X عدسة. - ضع صحن التصوير على المسرح المجهر. ضبط التركيز والموقع إلى العثور على واحد فقط كله HIV-1 بلعم المصابين في هذا المجال. استخدام إعدادات الإثارة / الانبعاثات المناسبة بناء على نظام التصوير المستخدمة والتحقيق. تشمل قناة مشرق الميدان (BF) لمراقبة جسم بلعمي (الشكل 1ii). تحسين مظهر الصور قناة مختلفة عن طريق ضبط نسبة تنتقل وقت الضوء والتعرض.
ملاحظة: وهنا، كان NLR4.3 HIV-1 الكمامة-iGFP متحمس باستخدام الليزر 491 نانومتر مع 50 ميللي ثانية من التعرض لفترة مع 20٪ من الليزر (الشكل 1I). - إزالة الطبق التصوير وإضافة 1 مل من تعليق SRBC في 7 × 10 6 SRBCs / مل إلى الطبق (الشكل 1).
- أجهزة الطرد المركزي في 500 x ج ل2 دقيقة في RT لمزامنة البلعمة، وتسجيل الوقت في نهاية هذا الطرد المركزي وعودة الطبق إلى المرحلة.
- تحسين التركيز والتقاط GFP والصور BF في Z-مداخن (طوال سمك الخلية مع خطوة مسافة 0.3 ميكرون - عادة 20 طائرة) كل دقيقة على الأقل 1 ساعة. حفظ الفيديو في الوقت الفاصل بين الأصلي الملفات شكل نظام التصوير المستخدمة.
ملاحظة: هنا، وحفظ الوقت الفاصل بين الأفلام في تنسيق أصلي، * ملفات .stk.
6. تحليل أفلام الوقت الفاصل
- لتحرير الفيديو، انقر على القائمة المنسدلة "تطبيقات" وعلى علامة التبويب "مراجعة متعدد الأبعاد بيانات" في برامج تحرير الفيديو.
- لفتح الملف، اضغط على "ملف قاعدة الاختيار" ثم على "تحديد دليل". في "مجموعات البيانات"، حدد الحصول على تحليل (في شكل .nd) وانقر على "إرسال". يتم تمثيل البيانات في الجدول مع الوقت في عمودد Z-الخطة في الخط.
- لتمثيل العدوى في Z-الإسقاط (الشكل 2، لوحات اليسار)، وحدد 491 نانومتر الطول الموجي في خانة "موجات" وانقر على "Z إسقاط" علامة التبويب مع "كل الطائرات".
- لتحليل التسلسل الزمني، حدد BF الطول الموجي في خانة "موجات" واختيار الطائرة المثلى على المحور Z لتمييز SRBCs الخارجية (الشكل 2، رأس السهم الأحمر)، SRBCs الداخلية (الشكل 2، دائرة حمراء) والنواة ( الرقم 2، الدائرة الزرقاء).
- لحفظ مونتاج الفيديو، اضغط على "اختيار [إكس]" علامة التبويب، ثم على "تحميل صورة (الصورة)". وأخيرا، حفظ الصور المحملة في. TIF شكل وفتحها المقبل على برنامج ImageJ.
- استخدام البرنامج المساعد "تتبع يدوي" على برنامج ImageJ لقياس موقف نواة وجسم بلعمي المختلفة التي لوحظت في قناة BF (الشكل 3).
- داوnload "دليل تتبع" المساعد على موقع يماغيج. على يماغيج، فتح البرنامج المساعد وتسلسل الصور ليتم تحليلها (الشكل 3، الخطوة 1 و 2).
- إدخال الضبط مثل "الفاصل الزمني" الذي يمثل مقدار الوقت بين الإطارات المجاورة، و "س / ص المعايرة" التي تمثل المسافة لكل بكسل (الشكل 3، الخطوة 3).
ملاحظة: هنا، حفظ تسلسل الصور مع فاصل زمني من 1 دقيقة بين كل إطار وس / ص معايرة 0.205 ميكرون لأنه يتم استخدام التكبير 63X وكاميرا مع حجم بكسل 6.45 س 6.45 ميكرون 2. - لبدء تتبع، انقر على "أضف المسار" (الشكل 3، الخطوة 4) وانقر على مركز SRBC في المرة الأولى عندما المنضوية ذلك. يظهر الإطار التالي تلقائيا.
- مواصلة الضغط على مركز SRBC في جميع الأطر لديهما مواقف مختلفة خلال الفترة (الشكل 3، الخطوة 6 في مربع أحمر).
- البدء في تتبع نواة لمكانتها في جميع الأطر من خلال النقر على وسطها. التالي تتبع جسم بلعمي (بالنقر على مركزها) واحدا تلو الآخر في ذلك الوقت (الإطار) من استيعاب، ومختلف في وظيفة SRBCs. لراحة لرؤية SRBC على قناة BF، استخدام إطار "السطوع والتباين" خلال تتبع (الشكل 3، الخطوة 5).
- بين كل تتبع SRBC، انقر على "أضف المسار" (الشكل 3، الخطوة 4) أن يكون مسار جديد. سيتم تغيير عدد تتبع في العمود الثاني، "المسار رقم" من جدول النتائج (الشكل 3، الخطوة 6).
- حفظ البيانات في جداول للمتابعة إلى الخطوة التالية من التحليل.
- استخدام برنامج جداول البيانات لحساب المسافة المقطوعة من جسم بلعمي تحتوي على SRBCs نحو النواة وسرعة للجسم بلعمي خلال دقائق 5 الأولى بعد استيعاب SRBCs (فايجوري 4).
- فتح جدول البيانات وملف جدول جديد. نقل إلى هذا الملف الجديد المعلمات التالية فقط، والوقت، وX- وY- تنسيق النواة وجميع SRBCs الشكل (4A).
- لحساب المسافة بين SRBCs والنواة مع الإحداثيات الخاصة بها فقط، والنظر في نواة وSRBC في-XY تنسيق الطائرة (الشكل 4B).
ملاحظة: المسافة بين نقطتين هو طول المسار الذي يربط بينها. في الطائرة، ونظرا للمسافة بين SRBC والنواة التي كتبها نظرية فيثاغورس.- إذا ج (المسافة بين النواة وSRBC) يدل على طول الوتر وأ و ب للدلالة على أطوال الجانبين الآخرين، والتعبير عن نظرية فيثاغورس 'كما معادلة فيثاغورس:

ملاحظة: في الوقت نفسه، على المتعامدة المعيرة، والمسافة الأفقيةوهو (خ نواة -x SRBC) والمسافة ب الرأسية (ذ نواة -y SRBC). - وهكذا، وحساب المسافة بين النواة وSRBC (الشكل 4A، مربع الأرجواني) من خلال:
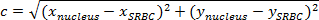
ملاحظة: مضاعفة قيمة المسافة التي تم الحصول عليها (بالبكسل) من س / ص المعايرة لديك المسافة في ميكرون. هنا، معايرة س / ص هو 0.205 ميكرون. - في كل مرة، طرح المسافة بين النواة وSRBC لبعد المسافة الأولى (الشكل 4C).
- رسم قياس ضد الساعة لمدة 5 دقائق الأولى. تطبيق خط الاتجاه الخطي (الشكل 5A) في المؤامرة وتحديد المنحدر من خط الاتجاه الخطي الذي يمثل سرعة يبلوع نحو النواة خلال دقائق 5 الأولى بعد استيعاب SRBC.
- جمع البيانات لحساب الخطأ العادي والإحصائي للقيم السرعة ومؤامرة لهم في شكل ملائم باستخدام البرنامج المناسب (الشكل 5B).
- إذا ج (المسافة بين النواة وSRBC) يدل على طول الوتر وأ و ب للدلالة على أطوال الجانبين الآخرين، والتعبير عن نظرية فيثاغورس 'كما معادلة فيثاغورس:
النتائج
FCR بوساطة البلعمة من قبل hMDMs المصابة بفيروس نقص المناعة البشرية (1) وغير المصابين يوصف هنا باستخدام SRBCs opsonized مفتش-كأهداف نموذج (الشكل 1). الخطوات الحاسمة لهذا البروتوكول هي إعداد hMDMs والإصابة بفيروس HIV-1. والواقع أن المحصول وجودة الضامة متباينة...
Discussion
هذه التقنية لديها العديد من الخطوات الحاسمة. أولا، إعداد hMDMs والعدوى بفيروس نقص المناعة البشرية-1 هو في غاية الأهمية لأن نسبة الإصابة هي من المانحين التابع. وتجدر الإشارة، قررنا استخدام الضامة التي لم يتم الاستقطاب في المختبر قبل الإصابة، لأن الوضع الضامة يحتمل ...
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Dr Jamil Jubrail for reading the manuscript. This work was supported by grants from CNRS, Inserm, Université Paris Descartes, Agence Nationale de la Recherche (2011 BSV3 025 02), Fondation pour la Recherche Médicale (FRM DEQ20130326518 including a doctoral fellowship for GLB) and Agence Nationale de Recherche sur le SIDA et les hépatites virales (ANRS, including a post-doctoral fellowship for CD) to FN. A. Dumas was supported by doctoral fellowships from Université Paris Descartes and Sidaction.
Materials
| Name | Company | Catalog Number | Comments |
| Falcon 100mm TC-Treated Cell Culture Dish | Corning | 353003 | For viral production |
| Glass Bottom Dishes 35 mm uncoated 1.5 | MatTek corporation | P35G-1.5-14-C Case | For acquisition |
| Falcon Tissue Culture Plates 6-well | Thermo Fischer Scientific | Corning. Inc. 353934 | For human monocyte-derived macrophages |
| Ficoll-Plaque PLUS | Dominique Dutscher | 17-1440-03 | a neutral, highly branched, high-mass, hydrophilic polysaccharide in solution for density centrifugation |
| DPBS, no calcium, no magnesium | Thermo Fischer Scientific | 14190-094 | Room temperature |
| Dulbecco's Modified Eagle Medium (DMEM) 1X, liquid (High Glucose) | GIBCO, Molecular probes | 31966-021 | Conserved at 4°C ; for HEK cells culture |
| RPMI 1640 medium GLUTAMAX Supplement | Life technologies | 61870-010 | Conserved at 4°C; for hMDMs culture |
| Fœtal Calf Serum (FCS) | Eurobio | CVFSVF0001 | Conserved at -20°C ; decomplemented |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fischer Scientific | 15140-122 | Conserved at -20°C ; for hMDMs culture |
| RPMI 1640 medium, no phenol red (10x500 ml) | Life technologies | 11835-105 | Warm in 37°C water bath before use ; for phagocytosis assay |
| FuGENE6 Transfection Reagent | Promega | E2692 | Conserved at 4°C ; for viral production |
| Sheep red blood cells (SRBCs) | Eurobio | DSGMTN00-0Q | Conserved in Alsever buffer at 4°C before use |
| Anti-sheep red blood cells IgG | MP Biomedicals | 55806 | Conserved at 4°C |
| Bovine Serum Albumin heat shock fraction, pH 7, ≥98% | Sigma | A7906 | Conserved at -20°C |
| Inverted microscope DMI600 | Leica | ||
| Confocal Spinning Disk Unit CSU-X1M1 | Yokogawa | ||
| 491 nm 50mW laser | COBOLT CALYPSO | ||
| HCX PL APO CS Objectif | Leica | Objective lens ; Magnification 100x ; Numerical aperture 1.40 ; Immersion oil | |
| CoolSnap HQ2 (FireWire) Camera | Photometrics | Pixel size 6.45 x 6.45 µm ; Definition 1392 x 1040 ; Encoding the image in 14 Bit | |
| Metamorph 7.7.5 software | Molecular Devices | For the control of the microscope | |
| GraphPad Prism software | For the statistics analysis |
References
- Flannagan, R. S., Jaumouille, V., Grinstein, S. The cell biology of phagocytosis. Annu. Rev. Pathol. 7, 61-98 (2012).
- Niedergang, F. . Encyclopedia of Cell Biology. 2, 751-757 (2016).
- Blocker, A., Griffiths, G., Olivo, J. C., Hyman, A. A., Severin, F. F. A role for microtubule dynamics in phagosome movement. J Cell Sci. 111 (Pt 3), 303-312 (1998).
- Blocker, A., et al. Molecular requirements for bi-directional movement of phagosomes along microtubules. J Cell Biol. 137, 113-129 (1997).
- Flannagan, R. S., Cosio, G., Grinstein, S. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies. Nat Rev Microbiol. 7, 355-366 (2009).
- Feasey, N. A., Dougan, G., Kingsley, R. A., Heyderman, R. S., Gordon, M. A. Invasive non-typhoidal salmonella disease: an emerging and neglected tropical disease in Africa. Lancet. 379, 2489-2499 (2012).
- Mazzolini, J., et al. Inhibition of phagocytosis in HIV-1-infected macrophages relies on Nef-dependent alteration of focal delivery of recycling compartments. Blood. 115, 4226-4236 (2010).
- Dumas, A., et al. The HIV-1 protein Vpr impairs phagosome maturation by controlling microtubule-dependent trafficking. J Cell Biol. 211, 359-372 (2015).
- Greenberg, S., el Khoury, J., Kaplan, E., Silverstein, S. C. A fluorescence technique to distinguish attached from ingested erythrocytes and zymosan particles in phagocytosing macrophages. J. Immunol. Methods. 139, 115-122 (1991).
- Koppensteiner, H., Banning, C., Schneider, C., Hohenberg, H., Schindler, M. Macrophage internal HIV-1 is protected from neutralizing antibodies. J Virol. 86, 2826-2836 (2012).
- Gartner, S. The macrophage and HIV: basic concepts and methodologies. Methods Mol Biol. 1087, 207-220 (2014).
- Wei, X., et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob Agents Chemother. 46, 1896-1905 (2002).
- Harrison, R. E., Bucci, C., Vieira, O. V., Schroer, T. A., Grinstein, S. Phagosomes fuse with late endosomes and/or lysosomes by extension of membrane protrusions along microtubules: role of Rab7 and RILP. Mol Cell Biol. 23, 6494-6506 (2003).
- Toyohara, A., Inaba, K. Transport of phagosomes in mouse peritoneal macrophages. J Cell Sci. 94 (Pt 1), 143-153 (1989).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved