このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
HIV-1に感染したライブ初代ヒトマクロファージで測定ファゴソームの移行と速度
要約
We describe a method to measure the velocity of phagosomes moving towards the cell center in living cells infected with or without the human immunodeficiency virus (HIV) type 1, using spinning disk confocal fluorescence microscopy to identify fluorescent infected cells and bright field microscopy to detect phagosomes.
要約
Macrophages are phagocytic cells that play a major role at the crossroads between innate and specific immunity. They can be infected by the human immunodeficiency virus (HIV)-1 and because of their resistance to its cytopathic effects they can be considered to be persistent viral reservoirs. In addition, HIV-infected macrophages exhibit defective functions that contribute to the development of opportunistic diseases.
The exact mechanism by which HIV-1 impairs the phagocytic response of macrophages was unknown. We had previously shown that the uptake of various particulate material by macrophages was inhibited when they were infected with HIV-1. This inhibition was only partial and phagosomes did form within HIV-infected macrophages. Therefore, we focused on analyzing the fate of these phagosomes. Phagosome maturation is accompanied by migration of these compartments towards the cell center, where they fuse with lysosomes, generating phagolysosomes, responsible for degradation of the ingested material. We used IgG-opsonized Sheep Red Blood Cells as a target for phagocytosis. To measure the speed of centripetal movement of phagosomes in individual HIV-infected macrophages, we used a combination of bright field and fluorescence confocal microscopy. We established a method to calculate the distance of phagosomes towards the nucleus, and then to calculate the velocity of the phagosomes. HIV-infected cells were identified thanks to a GFP-expressing virus, but the method is applicable to non-infected cells or any type of infection or treatment.
概要
Macrophages play a major role in the innate immune system and in homeostasis. They are professional phagocytes that internalize and eliminate pathogens and debris by a process called phagocytosis 1,2. The phagosome, the closed compartment that forms after the engulfment of particulate material, undergoes a series of fusion and fission events with endocytic compartments, leading to a degradative compartment called the phagolysosome. This compartment has an acidic pH, due to the acquisition of proton-pumping v-ATPases, contains hydrolytic enzymes and is enriched in lysosomal-associated membrane proteins (LAMPs). The maturation of phagosomes is accompanied by their migration on microtubules 3,4 towards the cell center to reach a perinuclear location where lysosomes are accumulated.
Many pathogens have been reported to hijack phagosome maturation, including bacteria with intracellular lifestyles that modify the vacuolar environment where they reside 5. The Human Immunodeficiency Virus (HIV)-1 targets macrophages in addition to T cells. As macrophages are resistant to the cytopathic effects of the virus, unlike T cells, they can be considered as a reservoir for the virus. In addition, macrophages infected with HIV-1 show defective phagocytic functions and contribute to the emergence of opportunistic diseases. In particular, severe invasive non-typhoidal Salmonella disease caused by Salmonella Typhimurium ST313 has been prevalent for the last three decades in sub-Saharan African children or adults infected with HIV 6. It has been estimated that the risk of developing tuberculosis is more than 20 times greater in people living with HIV than among those without HIV infection.
For all these reasons, it is important to better define the molecular mechanisms underlying the phagocytic defects in HIV-infected macrophages. We have shown that the uptake of particulate material, opsonized particles, bacteria or fungi, was inhibited in HIV-infected macrophages 7. Given that this inhibition is partial, we then set out to analyze the fate of the internalized phagosomes in HIV infected human macrophages 8. Because phagosome maturation is tightly connected with migration to the cell center and fusion with lysosomes, a defect in phagosomal maturation can be due to modifications of the trafficking modalities in the infected cell. The method described here uses IgG-opsonized Sheep Red Blood Cells (IgG-SRBCs) as a model to target receptor-mediated phagocytosis and in particular receptors for the Fc portion of immunoglobulins (FcR). These particles are easier to image in bright field (BF) than latex beads because extracellular and intracellular SRBCs show different refraction properties 9. To measure the velocity of phagosomes moving towards the nucleus in HIV-infected macrophages, we used a fluorescent virus 10 and set up a simple manual tracking method that is described here. The method does not require advanced programming and simply uses ImageJ. It is amenable to adherent cells and any type of particle or pathogen that can be visualized with bright field microscopy or with fluorescent imaging.
プロトコル
プロトコルは、国内および国際的な法律や地方条例に厳密に従って行わなければなりません。研究目的のために献血をする彼らの同意を与えた健康なドナーからの血液は、機関が契約を締結していると輸血センターから得られています。ヒトの血液を使用した場合には、特別な保護がとられなければなりません。 HIV-1を用いた実験では現地の法律に従って、バイオセーフティーレベル3または2(BSL-3または2)実験室で行われなければなりません。
接着によって密度勾配遠心と選択によるヒト単球由来マクロファージ(hMDMs)の調製
- 健康なドナー(9ミリリットル)からの新鮮な血液で起動します。 70 mlの最終容積を得ることが2+ の Ca 2+およびMgなしの滅菌1×リン酸緩衝生理食塩水(PBS)を用いて、新鮮な血液の全体積を希釈し、穏やかに(50ml×2回)コニカルチューブ(チューブにつき35 mL)に希釈された血液を追加、の15ミリリットルの上eutralは、非常に各チューブに既に溶液中に、高質量の親水性多糖分岐します。
- ブレーキなしで20℃で20分間、537×gでの血液の遠心分離は、両方の管。次に界面で濁ったセル環に 含まれる末梢血単核細胞(PBMC)を収集およびCa 2+及びMg 2+なしで、1×PBS 15 mlを含む新しい50mlチューブに移します。
- 遠心分離機20℃で5分間、218×gで細胞およびCa 2+およびMgなしで1×PBSの45ミリリットル中にペレットを再懸濁2+。
- 20℃で5分間、218×gで遠心分離した細胞は、2+ の Ca 2+およびMgなしで1×PBS 10mlにペレットを再懸濁し、トリパンブルーで1/200の最終希釈に希釈することによって細胞をカウントします。
- 20℃で5分間、218×gで細胞を遠心し、1640培地は、2mMのL-グルタミンおよび100μg/ mlのpenicを補充したRPMI(ロズウェルパーク記念研究所)でペレットを再懸濁illin -ストレプトマイシン6ウェルプレートの各ウェルに培地2ml中、ウェルあたり7×10 6個のPBMCを有すること。
- 2時間、5%CO 2、37℃でプレートをインキュベートします。 2時間後、単球をプラスチックに付着しているでしょう。
- 新たに単離した単球が、hMDMsに分化培地を吸引し、2mlでhMDM培地に交換できるようにする(RPMI 1640、10%ウシ胎児血清(FCS)、2mM L-グルタミンおよび1%ペニシリン - ストレプトマイシンをdecomplemented)を補充し組換えヒトマクロファージコロニー刺激因子(RHM-CSF)を10ng / mlの最終濃度で。
- 11日目( 図1)、5%CO 2で37℃で細胞をインキュベートします。
- 11日目で培地を除去し、ウェルあたり冷たいhMDM培地2mlで2回洗浄します。次の冷1×PBS 1mlで各ウェルを2回洗浄します。
- (2 mMのethylenediaminetetraacetatic酸と冷たい1×PBSの1ミリリットルで、各ウェル1時間を洗って、完全に分化しhMDMsを切り離すにはEDTA)と4℃で15から60分間、ウェルあたり2 mMのEDTA冷1×PBSの2ミリリットルで細胞をインキュベートします。
注:細胞が存在して剥離する別の方法( 例えば、トリプシンまたはトリプシン様活性)良い結果11を与えるかもしれません。 - (上下十分で静かにピペッティングすることにより完成)剥離した後、細胞を回収し、冷hMDM培地10mlを含む氷上で50mlチューブに入れ。
- 20℃で5分間、218×gで遠心分離した細胞は、冷たいhMDM培地10mlにペレットを再懸濁し、トリパンブルーで1/20に希釈することによって細胞をカウントします。
- 35ミリメートル顕微鏡グレードのガラスボトムディッシュあたり1×10 6 hMDMsで細胞をシードし、1日間、5%CO 2で37℃で培養します。
HIV-1ウイルスストックの2生産および定量
注:M. SchindlからR5向性エンベロープを運ぶNLR4.3 HIV-1のGag-iGFP(緑色蛍光タンパク質)、ギフトER 10は、マクロファージを感染させるために、リアルタイムで感染細胞を見るために使用されます。
- 商業トランスフェクション試薬を用いて対応するプロウイルスDNAの6μgの持つヒト胚性腎臓293T細胞(2×10 6 100 mmディッシュ)のトランスフェクションによりウイルスストックを生成します。
- 細胞計数のβ-ガラクトシダーゼ着色が続くウイルスストックの連続希釈液を用いて、(HIV-1 LTRの制御下でβ-ガラクトシダーゼ遺伝子を有する)HeLa細胞TZM-BL指標細胞を用いたウイルスストックの感染力を定量化12青色の細胞の。
HIV-1とhMDMs 3.感染
- hMDMs(1.13でプレートした細胞)に感染多重度(MOI)hMDM培地の1ミリリットル中に0.02から0.03でウイルスを追加します。ウェルはhMDM媒体の唯一の1ミリリットルを追加制御し、2日間( 図1)、5%CO 2、37℃で皿をインキュベートします。
- 2日目にhMDM MEDで細胞を洗浄イウム3回と皿当たり新鮮hMDM培地の1ミリリットルを追加します。 6日目( 図1)、5%CO 2で37℃で細胞をインキュベートします。
ヒツジ赤血球の4オプソニン
- 皿当たり7×10 6 SRBCをの調製のために、4分間600×gで遠心分離すると、1×PBS中の0.1%ウシ血清アルブミン(BSA)を含む溶液100μlにSRBCを2回洗浄します。
- SRBCを5μlの当たりのサブ凝集濃度でウサギのIgG抗SRBCを含むPBS / BSA 0.1%、1×500μlの洗浄SRBCをを再懸濁し、室温で30分間回転させながらインキュベートします。
注:、抗SRBCをIgGのサブ凝集濃度を決定し、96ウェルプレート中の20μlの1/50から1/25600へのIgGの連続希釈物(13.1 mg / mlとでストック濃度)を調製しました。各ウェル中の20μlの2×10 6 SRBCを追加し、いくつかの時間の間、暗い部屋でプレートを置きます。サブ凝集濃度であります直前よく凝集抗体(IgG + SRBCを、ネットワークを形成する)とウェルの希釈。 - 回転の後、4分間600×gでのIgGオプソニン化-SRBCをを遠心分離し、4分間、600×gの遠心分離で1×PBS / BSA 0.1%の100μlで洗います。
- 2mMのL-グルタミンおよび1%ペニシリン - ストレプトマイシン(1ミリリットル/皿)を補充した予め温めたフェノールレッドを含まないRPMI培地中のIgGオプソニン化-SRBCを再懸濁。
5.ライブセルビデオ顕微鏡食作用アッセイ
- 例えばCO 2は、加湿のために水でボトルを通過し、37℃で加熱室を備えた回転ディスクシステムのような共焦点イメージングシステムを使用してください。
- 食作用アッセイの開始前に37℃で顕微鏡ステージを持つように、実験前に加熱室をオンにします。顕微鏡とコンピュータの電源を入れ、およびイメージングソフトウェアをロードします。
- このような走査速度、マニフィカ等の撮像設定を最適化イオン、解像度等が 60〜120分の間、毎分ごとにフィールドと、一つのフレーム画像に、少なくとも一つのセルを持っています。
注:ここでは、サンプルは63Xレンズと60分の間に1フレーム分毎に結像されます。 - 顕微鏡ステージ上のイメージング皿を置きます。フィールドに一つだけの全体のHIV-1感染したマクロファージを見つけるために、フォーカスと位置を調整します。使用される撮像システムとプローブに基づいて適切な励起/発光の設定を使用します。ファゴソームを観察する明視野(BF)のチャンネルを含める( 図1II)。透過光及び露光時間の割合を調整することにより、異なるチャネルの画像の外観を最適化します。
注:ここでは、NLR4.3 HIV-1のGag-iGFPは、レーザの20%( 図1I)で長時間露光の50ミリ秒と491 nmのレーザーを使用して興奮していました。 - イメージング皿を外し、皿( 図1)に7×10 6 SRBCを/ mlでSRBC懸濁液1mlを追加します。
- 500×gで遠心分離RTで2分間は、食作用を同期この遠心分離の終わりに時間を記録し、ステージに皿を返します。
- フォーカスを最適化し、(0.3ミクロンのステップ距離とセルの厚さを通して - 通常20面)のZスタックにGFPとBF画像を取り込む少なくとも1時間、毎分。使用される撮像システムのネイティブファイル形式でタイムラプスビデオを保存します。
注:ここでは、タイムラプス動画は、ネイティブ形式、* .STKファイルに保存されていました。
タイムラプスビデオの6.分析
- ビデオ編集ソフトの「レビュー多次元データ」ビデオ編集のために、ドロップダウンメニューをクリックして「アプリ」タブ上。
- ファイルを開くには、「ディレクトリの選択」にし、「ベースファイルを選択」をクリックしてください。 「データ設定」ボックスで、(.nd形式)を分析し、「表示」をクリックして取得を選択します。データが列ANに時間を持つテーブルで表現されています行中のd Z-計画。
- Z-突起( 図2、左パネル)に感染を表すために、「波長」ボックスに491 nmの波長を選択し、「すべての面」と「Z投影」タブをクリックします。
- (、時系列を分析する「波長」ボックスにBF波長を選択して、外部のSRBCを( 図2、赤矢印)、内部SRBCを( 図2、赤い円)と核を区別するために、Z軸上での最適な平面を選択するには図2、青丸)。
- ビデオモンタージュを保存するには、「選択[Xの]」タブで、次に「イメージのロード(S)」をクリックしてください。最後に、tifファイル形式で読み込んだ画像を保存し、ImageJソフトウェア上で次のそれらを開きます。
- 核の位置とBFチャネル( 図3)で観察された異なるファゴソームを測定するためにImageJソフトウェア上のプラグイン「マニュアルトラッキング"を使用してください。
- ダウImageJのウェブサイトの「マニュアルトラッキング」プラグインをnload。 ImageJのでは、解析すべきプラグインと画像シーケンス( 図3、ステップ1および2)を開きます。
- このような隣接するフレーム間の時間の量を表す「時間間隔」、および画素あたりの距離を表す「X / Yのキャリブレーション」( 図3、ステップ3)などの設定を入力します。
注:6.45のx 6.45μmの2のピクセルサイズを持つ63Xズームとカメラが使用されているので、ここでは、各フレームと0.205ミクロンのX / Yのキャリブレーションの間に1分の時間間隔で画像シーケンスを保存します。 - 追跡を開始するには、「トラックを追加」( 図3、ステップ4)をクリックして、それが内在化される最初の時間でSRBCの中心をクリックしてください。次のフレームが自動的に表示されます。
- 時間の間に位置が異なるために、すべてのフレームでSRBC中央をクリックし続けます( 図3、赤いボックスのステップ6)。
- その中心をクリックして、すべてのフレームでの地位を持っている核を追跡するために開始します。次回SRBCをの関数で異なるそれらの内在化(フレーム)で1ずつ(その中心をクリックして)ファゴソームを追跡します。 BFチャネルでSRBCを参照するには便宜上、トラッキング( 図3、ステップ5)の間に「明るさとコントラスト」ウィンドウを使用します。
- 各SRBC追跡の間に、新しいトラックを持っている( 図3、ステップ4)、「トラックを追加」をクリックしてください。追跡の数が第2の列に変更されます、結果テーブルの「トラックのn°」( 図3、ステップ6)。
- 分析の次のステップに進み、スプレッドシート内のデータを保存します。
- (核とSRBCをの内在化後の最初の5分の間にファゴソームの速度に向かってSRBCを含有ファゴソームの走行距離を計算するためFiを提供して表計算ソフトを使用して、グレ4)。
- スプレッドシートテーブルと新しいスプレッドシートファイルを開きます。この新たな次のパラメータファイルのみ、時間、x軸に移し、核およびすべてのSRBCを( 図4A)のy座標。
- SRBCをのみそれらの座標と核の間の距離を計算するために、核とXY座標平面( 図4B)でSRBCを検討してください。
注:2点間の距離は、それらを接続する経路の長さです。平面では、SRBCと核との間の距離は、ピタゴラスの定理により与えられます。- C(核とSRBCとの間の距離)を斜辺とAの長さを示し、B、他の2辺の長さを表す場合は、ピタゴラスの式のようにピタゴラスの定理を表現します:

注:同時に、正規直交上、水平距離(X 核 -x SRBC)であり、垂直距離bは (SRBC -y Y 核 )です。 - このように、核とSRBC( 図4A、紫色のボックス)によるとの間の距離を計算します。
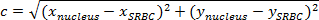
注:μm単位の距離を持っているのx / yのキャリブレーションによって(ピクセル単位)得られた距離値を乗算します。ここで、X / Yのキャリブレーションは0.205μmです。 - 各時点で、核および初期距離( 図4C)にSRBCとの間の距離を引きます。
- 最初の5分間の時間に対する測定値をプロットします。プロットに線形トレンドライン( 図5A)を適用し、SRBC内在化後の最初の5分の間に核に向かってファゴソーム速度を表す線形トレンドラインの傾きを決定します。
- の平均値と統計誤差を計算するためにデータを照合速度値と適切なソフトウェア( 図5B)を使用して、適切な形式でそれらをプロットします。
- C(核とSRBCとの間の距離)を斜辺とAの長さを示し、B、他の2辺の長さを表す場合は、ピタゴラスの式のようにピタゴラスの定理を表現します:
結果
HIV-1感染および非感染hMDMsによる食作用をのFcR媒介性は、モデル標的としてのIgGオプソニン化SRBCを( 図1)を使用してここで説明されています。このプロトコルの重要なステップは、hMDMsの準備とHIV-1の感染です。確かに、分化したマクロファージの収量と品質は、ドナーの間で変化するだけでなく、10から40%の範囲の効率で感染率。これは破片としての代...
ディスカッション
この技術は、いくつかの重要なステップがあります。感染の割合がドナー依存しているため、まず、HIV-1によるhMDMsの製造およびそれらの感染が重要です。注目すべきは、我々は潜在的に生体内でウイルスが遭遇したマクロファージの状態がよく、これまでに特徴付けされていないため、感染前に、in vitroで偏光されていないマクロファージを使用することを決定しました。我々?...
開示事項
The authors have nothing to disclose.
謝辞
We thank Dr Jamil Jubrail for reading the manuscript. This work was supported by grants from CNRS, Inserm, Université Paris Descartes, Agence Nationale de la Recherche (2011 BSV3 025 02), Fondation pour la Recherche Médicale (FRM DEQ20130326518 including a doctoral fellowship for GLB) and Agence Nationale de Recherche sur le SIDA et les hépatites virales (ANRS, including a post-doctoral fellowship for CD) to FN. A. Dumas was supported by doctoral fellowships from Université Paris Descartes and Sidaction.
資料
| Name | Company | Catalog Number | Comments |
| Falcon 100mm TC-Treated Cell Culture Dish | Corning | 353003 | For viral production |
| Glass Bottom Dishes 35 mm uncoated 1.5 | MatTek corporation | P35G-1.5-14-C Case | For acquisition |
| Falcon Tissue Culture Plates 6-well | Thermo Fischer Scientific | Corning. Inc. 353934 | For human monocyte-derived macrophages |
| Ficoll-Plaque PLUS | Dominique Dutscher | 17-1440-03 | a neutral, highly branched, high-mass, hydrophilic polysaccharide in solution for density centrifugation |
| DPBS, no calcium, no magnesium | Thermo Fischer Scientific | 14190-094 | Room temperature |
| Dulbecco's Modified Eagle Medium (DMEM) 1X, liquid (High Glucose) | GIBCO, Molecular probes | 31966-021 | Conserved at 4°C ; for HEK cells culture |
| RPMI 1640 medium GLUTAMAX Supplement | Life technologies | 61870-010 | Conserved at 4°C; for hMDMs culture |
| Fœtal Calf Serum (FCS) | Eurobio | CVFSVF0001 | Conserved at -20°C ; decomplemented |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fischer Scientific | 15140-122 | Conserved at -20°C ; for hMDMs culture |
| RPMI 1640 medium, no phenol red (10x500 ml) | Life technologies | 11835-105 | Warm in 37°C water bath before use ; for phagocytosis assay |
| FuGENE6 Transfection Reagent | Promega | E2692 | Conserved at 4°C ; for viral production |
| Sheep red blood cells (SRBCs) | Eurobio | DSGMTN00-0Q | Conserved in Alsever buffer at 4°C before use |
| Anti-sheep red blood cells IgG | MP Biomedicals | 55806 | Conserved at 4°C |
| Bovine Serum Albumin heat shock fraction, pH 7, ≥98% | Sigma | A7906 | Conserved at -20°C |
| Inverted microscope DMI600 | Leica | ||
| Confocal Spinning Disk Unit CSU-X1M1 | Yokogawa | ||
| 491 nm 50mW laser | COBOLT CALYPSO | ||
| HCX PL APO CS Objectif | Leica | Objective lens ; Magnification 100x ; Numerical aperture 1.40 ; Immersion oil | |
| CoolSnap HQ2 (FireWire) Camera | Photometrics | Pixel size 6.45 x 6.45 µm ; Definition 1392 x 1040 ; Encoding the image in 14 Bit | |
| Metamorph 7.7.5 software | Molecular Devices | For the control of the microscope | |
| GraphPad Prism software | For the statistics analysis |
参考文献
- Flannagan, R. S., Jaumouille, V., Grinstein, S. The cell biology of phagocytosis. Annu. Rev. Pathol. 7, 61-98 (2012).
- Niedergang, F. . Encyclopedia of Cell Biology. 2, 751-757 (2016).
- Blocker, A., Griffiths, G., Olivo, J. C., Hyman, A. A., Severin, F. F. A role for microtubule dynamics in phagosome movement. J Cell Sci. 111 (Pt 3), 303-312 (1998).
- Blocker, A., et al. Molecular requirements for bi-directional movement of phagosomes along microtubules. J Cell Biol. 137, 113-129 (1997).
- Flannagan, R. S., Cosio, G., Grinstein, S. Antimicrobial mechanisms of phagocytes and bacterial evasion strategies. Nat Rev Microbiol. 7, 355-366 (2009).
- Feasey, N. A., Dougan, G., Kingsley, R. A., Heyderman, R. S., Gordon, M. A. Invasive non-typhoidal salmonella disease: an emerging and neglected tropical disease in Africa. Lancet. 379, 2489-2499 (2012).
- Mazzolini, J., et al. Inhibition of phagocytosis in HIV-1-infected macrophages relies on Nef-dependent alteration of focal delivery of recycling compartments. Blood. 115, 4226-4236 (2010).
- Dumas, A., et al. The HIV-1 protein Vpr impairs phagosome maturation by controlling microtubule-dependent trafficking. J Cell Biol. 211, 359-372 (2015).
- Greenberg, S., el Khoury, J., Kaplan, E., Silverstein, S. C. A fluorescence technique to distinguish attached from ingested erythrocytes and zymosan particles in phagocytosing macrophages. J. Immunol. Methods. 139, 115-122 (1991).
- Koppensteiner, H., Banning, C., Schneider, C., Hohenberg, H., Schindler, M. Macrophage internal HIV-1 is protected from neutralizing antibodies. J Virol. 86, 2826-2836 (2012).
- Gartner, S. The macrophage and HIV: basic concepts and methodologies. Methods Mol Biol. 1087, 207-220 (2014).
- Wei, X., et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob Agents Chemother. 46, 1896-1905 (2002).
- Harrison, R. E., Bucci, C., Vieira, O. V., Schroer, T. A., Grinstein, S. Phagosomes fuse with late endosomes and/or lysosomes by extension of membrane protrusions along microtubules: role of Rab7 and RILP. Mol Cell Biol. 23, 6494-6506 (2003).
- Toyohara, A., Inaba, K. Transport of phagosomes in mouse peritoneal macrophages. J Cell Sci. 94 (Pt 1), 143-153 (1989).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved