A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
باستخدام شعري الكهربائي لقياس الأحماض العضوية من الأنسجة النباتية: حالة اختبار فحص
In This Article
Summary
تقدم هذه المقالة طريقة للكشف وتقدير الأحماض العضوية من المواد النباتية باستخدام برنامج منطقتين الكهربائي الشعري. مثال على إمكانية تطبيق هذه الطريقة، وتحديد الآثار المترتبة على تخمير الثانوي على مستويات حمض عضوي في بذور القهوة، وتقدم.
Abstract
الأحماض الكربوكسيلية هي الأحماض العضوية التي تحتوي على واحد أو أكثر من محطة الكربوكسيل (COOH) مجموعات وظيفية. سلسلة قصيرة من الأحماض الكربوكسيلية (SCCAs، الأحماض الكربوكسيلية التي تحتوي على 3-6 الكربونات)، مثل مالات وسترات، حاسمة لحسن سير العمل في العديد من الأنظمة البيولوجية، حيث أنها تعمل في التنفس الخلوي، ويمكن أن تكون بمثابة مؤشرات الصحة الخلية. في الأطعمة، يمكن أن محتوى حمض عضوي يكون لها تأثير كبير على الذوق، مع زيادة مستويات سوروس مما أدى إلى الذوق "حامض" الحامض أو. وبسبب هذا، طرق تحليل السريع للمستويات حمض عضوي ذات أهمية خاصة بالنسبة لصناعات الأغذية والمشروبات. ولكن للأسف، فإن معظم الطرق المستخدمة لسوروس الكمي تعتمد على بروتوكولات تستغرق وقتا طويلا يتطلب اشتقاق من العينات مع الكواشف الخطرة، تليها الكروماتوغرافي مكلفة و / أو الطيفي الشامل يحلل. تفاصيل هذه الطريقة أسلوب بديل للكشف وتقدير من غزالهالأحماض القرآنية من المواد النباتية والعينات الغذائية باستخدام برنامج منطقتين الكهربائي الشعرية (تشيكيا)، وأحيانا مجرد يشار إلى الكهربائي الشعرية (CE). يوفر تشيكيا وسيلة فعالة من حيث التكلفة لقياس SCCAs مع الحد الأدنى للكشف عن (0.005 ملغ / مل). تفاصيل هذه المقالة استخراج وتقدير من SCCAs من العينات النباتية. بينما يركز طريقة المقدمة على قياس SCCAs من حبوب البن، يمكن تطبيق الطريقة التي قدمت إلى عدة مواد الغذائية ذات الأصل النباتي.
Introduction
Carboxylic acids are organic compounds containing one or more terminal carboxyl functional groups, each attached to an R-group containing one or more carbons (R-C[O]OH). Short chain, low molecular weight carboxylic acids (short chain carboxylic acids, SCCAs) containing between one and six carbons, are essential components of cellular respiration, and function in several biochemical pathways necessary for cell growth and development. SCCAs play critical roles in cellular metabolism1, cell signaling2, and organismal responses to the environment (such as antibiosis3). Because of this, SCCAs can serve as useful indicators of disruptions to cellular metabolism, plant stress responses4,5, and fruit quality6,7. To date, SCCAs have been quantified primarily through chromatographic techniques such as high performance liquid chromatography (HPLC) or gas chromatography-mass spectroscopy (GC-MS). While these methods, are capable of achieving very low limits of detection, they can be expensive, require the derivatization of target SCCAs using caustic and/or toxic reagents, and include lengthy separation runs on the GC or HPLC. Because of this, interest in the use of free zonal capillary electrophoresis (CZE), which does not require sample derivatization, to quantify organic acids has steadily increased8.
Free zonal capillary electrophoresis (CZE) is a chromatographic separation methodology that, due to its high number of theoretical plates, speed, and relative ease-of-use, is increasingly replacing both GC-MS and high-pressure liquid chromatography as an analytical method for the quantification (particularly for quality control purposes) of anions, cations, amino acids, carbohydrates, and short chain carboxylic acids (SCCAs)8,9,10. CZE-based separation of small molecules, including SCCAs, is based two primary principles: the electrophoretic movement of charged ions in an electrical field established across the buffer filling the capillary; and the electro-osmotic movement of the entire buffer system from one end of the capillary to the other, generally towards the negative electrode. In this system, small molecules move towards the negative electrode at varying speeds, with the speed of each molecule determined by the ratio of the net charge of the molecule to the molecular mass. As the movement of each individual molecule in this system is dependent on the charge state of the molecule and the overall rate of electro-osmotic flow (which is itself based on the ion content of the buffer used to fill the capillary), the buffer pH and ionic composition heavily impact the degree to which molecules can be efficiently separated using CZE. Because of this, SCCAs, with their relatively high charge-to-mass ratios, are ideal targets for CZE-based separation. Metabolites separated using CZE can be detected using a variety of methods, including UV absorbance, spectral absorbance (which is generally performed using a photo-diode array [PDA]), and/or mass spectroscopy (CE-MS or CE-MS/MS)8. The diversity of separation and detection methods provided by CZE makes it an extremely flexible and adaptable technique. Because of this, CZE has been increasingly applied as a standard method of analysis in the areas of food safety and quality11,12, pharmaceutical research13, and environmental monitoring13,14.
Capillary electrophoresis has been used to detect and quantify short chain carboxylic acids for nearly two decades13. The resolving power (particularly for small, charged molecules), short run time, and low per sample cost of CZE analyses make CZE an ideal technique for the separation and quantification of SCCAs13. This method presents a protocol to utilize CZE to measure the concentration of organic acids from plant tissues. Example data was generated through the successful implementation of this protocol to measure the change in organic acid levels in coffee seeds following a secondary fermentation treatment. The protocol details the critical steps and common errors of CZE-based separation of SCCAs, and discusses the means by which this protocol can be successfully applied to quantify SCCAs in additional plant tissues.
Protocol
التحضير 1. عينة
- تجميع العينات لسلسلة قصيرة حمض الكربوكسيلية (سوروس) الاستخراج. إعداد 1.0 غرام من بذور القهوة في وقت لضمان أن عينة كافية ستبقى بعد المعالجة.
- إذا تم تجميد العينات قبل عملية الطحن، والحفاظ على الأنسجة المجمدة في جميع أنحاء تجهيز لمنع تجميد / الضرر ذوبان والأكسدة العينة. إزالة عينة من الفريزر أو دون الصفر تخزين فقط حسب الحاجة لطحن.
- فلاش تجميد عينات جديدة في النيتروجين السائل مباشرة قبل أخذ عينات طحن. للحد من التعامل مع العينة، وعينات تجميد فلاش عن طريق وضعها في هاون معبأة سلفا مع النيتروجين السائل.
- تحليل العينات السائلة مباشرة بعد جيل، أو تجميد فلاش في النيتروجين السائل وتخزينه في -20 درجة مئوية أو -80 درجة مئوية حتى التحليل. قبل التحليل، وإزالة العينات المجمدة من تخزين والسماح لذوبان الجليد. للعينات السائلة انتقل إلى الخطوة (3.5) للمعالجة.
- ارتداء APPROمعدات الحماية الشخصية priate (بما في ذلك النظارات الواقية، والقفازات، ومعطف المختبر) قبل ان يعمل مع النيتروجين السائل.
- عينات الأنسجة الثلاثي طحن الى مسحوق ناعم بشكل موحد (أي من موحدة حجم الجسيمات) في النيتروجين السائل باستخدام هاون ومدقة السيراميك.
ملاحظة: بلوغ حجم الجسيمات موحدة أمر ضروري لتحقيق أقصى قدر من الكفاءة سوروس الاستخراج.- قبل البرد هاون ومدقة مع النيتروجين السائل قبل إضافة العينة. إبقاء هاون مليئة كمية صغيرة من النيتروجين السائل كما يتم إضافة عينة.
- استخدام مغرفة، إضافة ما يكفي من النيتروجين السائل لالهاون لغمر تماما العينة.
- إضافة عينات الأرض بسهولة، مثل الأوراق أو البن المحمص، إلى النيتروجين السائل وسحق باستخدام طحن حركة دائرية. تبدأ لطحن عينات عندما انخفض مستوى النيتروجين السائل لدرجة أنها تغطي بالكاد العينات.
- إضافة بجد لطحن العينات، مثل هذاق بذور البن الخام، والنيتروجين السائل والسماح لهم تجميد لمدة 10-30 ثانية (أو حتى النيتروجين السائل يتوقف عن الغليان بقوة) قبل طحن. كسر الأنسجة إلى أجزاء أصغر باستخدام حركة سحق العمودية، والأنسجة ثم كاملة طحن باستخدام طحن حركة دائرية.
- كرر الخطوات 1.3.2-1.3.4 مرتين أكثر، بحيث يتم تأريض عينات ما مجموعه ثلاث مرات. عادة، سوف ثلاث جولات متتالية من طحن لحد من العينات إلى مسحوق مع مثل الاتساق الدقيق.
- وإذا لم يتم التوصل إلى مثل الاتساق الدقيق، كرر الخطوات 1.3.2-1.3.4 حتى يتم تخفيض العينات إلى مسحوق حجم الجسيمات الصغيرة بشكل موحد (كفاءة استخراج تتناسب عكسيا مع حجم الجسيمات).
- نقل مسحوق لقوارير الزجاج أو 1.5 مل أنابيب microcentrifuge. بدء التجهيز النهائي مباشرة بعد طحن (مستحسن)، أو عينات مخزن في -80 درجة مئوية حتى عينات مستعدون لاستخراج.
- إذا يجب أن يتم تخزين العينات قبلتحليل، وتقسيم العينة إلى 500 ملغ قسامات (أو 500 مكل للعينات السائلة) وتقسيم بين أنابيب متعددة للتخزين. تجنب تعريض العينات لدورات تجميد / الذوبان المتكررة، وهذه قد يغير تركيبة العينة وتؤثر سلبا قياسات العينات في المستقبل.
2. العضوية إعداد ستاندرد حمض
- تجميع معايير حقيقية لSCCAs من الفائدة. وسوف تستخدم هذه لإيجاد حلول معيار الداخلية والخارجية لاستخدامها في تحديد التركيزات سوروس. لتشمل عينات القهوة الستريك، الماليك، حمض الخليك، وحامض اللبنيك مثل الأحماض المصالح وحمض الأديبيك كمعيار داخلي.
- ضمان التأكد من أن المعيار الداخلي المحدد لا بطبيعة الحال وجدت في العينة، وهذا المعيار لا يشترك في أزل مع قمم أخرى في ملف تعريف العينة.
- تشغيل المنحنيات القياسية لكل سوروس من الفائدة، وتحديد مدى استجابة خطية لكل سوروس (انظر القسم 4 لتشغيل معاهدبالهياج). تأكد من تشغيل المنحنيات القياسية لكل سوروس أن تقاس في العينة.
ملاحظة: يمكن تشغيل المنحنيات القياسية في أي العازلة أو الخلفية من العينة أن يعاير. في الحالة الثانية ( "بالإضافة القياسية")، وسيتم تحديد قيم الذروة مساحة كل نقطة في منحنى القياسية من خلال طرح بعيدا خلفية العينة. - قبل تسمية جميع الأنابيب والأواني الزجاجية اللازمة مع اسم سوروس الحمضية، والتركيز، وتاريخ الفحص.
- إعداد حلول الأوراق المالية لكل مستوى بتركيز معلوم (10 ملغ / مل) باستخدام قارورة حجمية لضمان الدقة أثناء إعداد القياسية.
- حل المعايير سوروس الصلبة (حمض الستريك وحمض الماليك) في الماء عالى النقاء (18.2 MΩ) لتحقيق التركيز المطلوب للمحلول المخزون.
- إنشاء 10 ملغ / مل حل الأسهم بإضافة 100 ملغ من مستوى إلى 10 مل قارورة حجمية. ملء قارورة حجمية إلى خط 10 مل مع الماء عالى النقاء لدissolve الحامض.
- إنشاء تركيز أقل من مستوى الحمضية أو بلطف تسخين قوارير لدفع يصعب حل المعايير سوروس، مثل حمض الأديبيك، إلى حل.
- تمييع المعايير حمض الطور السائل (حمض الخليك وحمض اللاكتيك) في الماء عالى النقاء لتحقيق التركيز المطلوب.
- قبل ملء قارورة حجمية مع 5 مل من الماء عالى النقاء. إضافة حمض الكافي لإعداد حل 10 ملغ / مل (محسوبة باستخدام كثافة حمض المقدمة من قبل البائع) إلى القارورة، ثم إضافة كمية كافية من الماء لجلب الحجم النهائي من الحل إلى 10 مل.
- حل المعايير سوروس الصلبة (حمض الستريك وحمض الماليك) في الماء عالى النقاء (18.2 MΩ) لتحقيق التركيز المطلوب للمحلول المخزون.
- نقل كل المحلول إلى أنبوب زجاجي 15 مل نظيفة، مع تترافلوروإيثيلين (PTFE) مبطنة كأب، وختم مع فيلم البارافين البلاستيك. حلول الأسهم يمكن تخزينها في أنابيب مغلقة في 4 درجة مئوية لمدة 1 أسبوع.
- تأكد من أن المعايير سوروس لم عجل من حل قبل الاستخدام إذا تم تبريدها حلول الأوراق المالية بعد preparأوجه. محرك يترسب مرة أخرى إلى حل عن طريق التسخين اللطيف.
- إعداد الحل استخراج سوروس. تشمل معيار الداخلية في تركيز كاف للكشف في عينات (0.05 ملغ / مل). يعد حل ما يكفي لاستخراج جميع العينات.
- تجهيز 50 مل من سوروس حل الاستخراج عن طريق تمييع الحل الأسهم القياسية الداخلي إلى 0.05 ملغ / مل في الماء عالى النقاء. إضافة 250 ميكرولتر من محلول المخزون القياسي الداخلي (10 ملغ / مل) إلى 49.75 مل من الماء.
- إذا احتاج استخراج إلى أن تضعف، وضبط تركيز القياسي الداخلي في حل استخراج بحيث التركيز النهائي سوف تقع ضمن حدود الكمي (إعطاء كشفها، ولكن لم تنته مشبعة، ذروتها، انظر 5.2.2 أدناه) لل نظام CE بعد تخفيفه (0.05 ملغ / مل).
- يعد حل استخراج جديدة لكل سلسلة من عمليات الاستخراج (أي لكل سلسلة التجريبية).
- تحضير عينات منحنى القياسية(سلسلة من التخفيفات المناسبة) لSCCAs من الفائدة، وذلك باستخدام الحد الأدنى لا يقل عن 5 نقاط. وتركيزات منحنى القياسية المستخدمة تحتاج إلى أن تكون في مدى استجابة خطية لسوروس معين، وتمتد على تركيزات سوروس المتوقع في العينات.
- تشمل معيار الداخلية مختارة في الحلول منحنى القياسية للسماح الكمي لمعيار الداخلية في العينات. سيتم استخدام معيار داخلي للمساعدة في ذروة تحديد وحساب كفاءة الاستخراج (المادة 6).
- تمييع كل سوروس لتركيزات تحدد فوق (0.01، 0.02، 0.04، 0.06، 0.08 ملغ / مل، وانظر أعلاه، 2.4.2) في أنابيب microcentrifuge جديدة (واحد لكل / نقطة منحنى القياسية تركيز) باستخدام الماء عالى النقاء. إعداد 1 مل من محلول لكل نقطة تركيز منحنى القياسية. تأكد من أن كل نقطة تركيز على كافة مستويات حمض الأربعة ومعيار الداخلية في التركيز الصحيح.
- إعداد نقاط منحنى القياسية جديدة لكل مجموعةمن عينات ليتم تشغيلها على نظام الشعرية الكهربائي. عقد العينات القياسية منحنى سوروس في 4 درجة مئوية حتى التحليل، والتي سوف تحدث بعد استخراج SCCAs من الأنسجة المستهدفة (القسم 3).
3. العضوية حمض استخراج
- قبل تسمية أنابيب العينات، وإعداد أنبوب واحد على الأقل لكل عينة لاستخراج.
- إزالة عينات لالمستخرجة من تخزين ووضعها على الجليد بينما وزنها من المواد اللازمة لاستخراج.
- تزن من 100 ملغ من عينة لاستخراج سوروس.
- بعد وزنها كل عينة، ونقل الأنسجة لأنبوب microcentrifuge 1.5 مل نظيف. قياس من أصل كمية من العينة أقرب إلى كتلة الهدف ممكن للحد من التباين.
- تتبع كتلة كل عينة تقاس، كما سيتم تطبيع مبالغ SCCAs الكشف باستخدام كتلة عينة (انظر 6.5.2 أدناه).
- بعد وزنها جميع العينات، إضافة 1 مل من محلول الاستخلاص (لتوفير المياهص + خليط القياسي الداخلي من الخطوة 2.4) إلى كل من أنابيب العينات. الحفاظ على نسبة من حل استخراج لكتلة الأنسجة نفسها في جميع الاستخراج (في هذه الحالة 1 مل لمدة 100 ± 5 الأنسجة ملغ). مزيج جيد من قبل دوامة لمدة 10 ثانية.
- السماح للعينات للجلوس في درجة حرارة الغرفة لمدة 1 ساعة. خلال هذه الساعة، خلط كل أنبوب كل 15 دقيقة كما في الخطوة 3.4.
- بعد 1 ساعة من الاستخراج، ومزج العينات مرة أخيرة واحد ونقل أنابيب العينات إلى microcentrifuge ل. عينات الطرد المركزي في 4 درجات مئوية، 10000 x ج لمدة 10 دقيقة لترسيب المواد الصلبة (جدران الخلايا، الجسيمات، وما إلى ذلك).
- عند معالجة عينات السائل، إضافة التركيز المناسب من معيار الداخلية، مزيج لفترة وجيزة وأجهزة الطرد المركزي. بعد الطرد المركزي، وعلاج العينات السائلة مماثل لاستخراج عينات من الصلبة.
- تحقق من الرقم الهيدروجيني للعينات للتأكد من أنها متوافقة مع مجموعة والرقم الهيدروجيني للعازلة تعمل في عدة كشف (الخطوة 4.6) أو المخزن المؤقت النظام كونها خطة الإدارة البيئيةloyed. إذ بلغ حجم العينة وعادة ما تكون صغيرة جدا، ويمكن رصد درجة الحموضة باستخدام ورقة الرقم الهيدروجيني.
- إعداد لتصفية العينات باستخدام مرشحات القرص محمولة على حقنة (3.8).
ملاحظة: منع فقدان العينة من خلال ضمان أن كل مرشح يرد بشكل صحيح إلى حقنة قبل نقل طاف. تحضير حقنة واحدة مجهزة مرشح القرص لكل عينة لتحليلها (بما في ذلك عينات منحنى قياسي). - بعد الطرد المركزي العينات وإعداد المرشحات المحاقن، ونقل طاف من كل عينة لحقنة 3 مل مجهزة مرشح حقنة 0.2 ميكرون. استخدام فلتر جديد وحقنة لكل عينة. تصفية جميع العينات، بما في ذلك عينات منحنى القياسية والضوابط العازلة، قبل أن يعمل على نظام CE.
- تصفية العينة مباشرة إلى أنبوب microcentrifuge نظيفة. بعد الترشيح، وإغلاق الأنبوب الذي يحتوي الترشيح وتجاهل جهاز حقنة / فلتر.
- وضع العينات التي تمت تصفيتها على الفورفي نظام CE للكشف سوروس. أو عينات تخزين عند 4 درجات مئوية خلال الليل. إذا عينات ليتم تخزينها بين عشية وضحاها، وختم الأنابيب مع فيلم البارافين البلاستيك لمنع تبادل الغازات وعينة التبخر.
- إذا يجب أن يتم تخزين العينات لفترة أطول من يوم واحد بعد تصفية وعصائر فلاش التجميد في النيتروجين السائل أو التجميد عند درجة حرارة -20 درجة مئوية. بعد ذوبان الجليد، ومع ذلك، تأكد من أن كل عينة يتم فحص لتشكيل متهور وتصفية إذا لزم الأمر (كما في الخطوة 3.6).
4. إعداد كشف سوروس تشغيل
- راجع دليل المستخدم CE للحصول على تفاصيل البرامج الخاصة programming- والسيطرة.
- إعداد الشعرية الكهربائي (CE) قارورة عينة للكشف سوروس. وصفت ضمان قارورة بشكل صحيح ونظيفة وخالية من العيوب.
- غسل وتجفيف قبعات من قارورة CE قبل الاستخدام.
- غسل أغطية من قبل غمر في الماء عالى النقاء والسماح لهم نقع بين عشية وضحاها. بعد تمرغ القبعات، وتجاهل نقعجي الحل وشطف قبعات مرتين أكثر مع الماء عالى النقاء.
- نقل تشطف قبعات على سطح تجفيف نظيفة تصطف مع أنسجة خالية من الوبر والسماح لهم الهواء الجاف. ضمان قبعات جافة تماما قبل استخدامها لتجنب الفشل الضغط.
- نقل 1 مل من العينة إلى كل قارورة CE، والحرص على تجنب قصد الرش العينة إلى عنق القارورة. بعد نقل، وضع سقف CE على كل قارورة.
- إذا كانت هناك حاجة لتخفيف، يخفف من عينات البذور القهوة 1:10 أو 1: 100 مباشرة في قارورة CE باستخدام الماء عالى النقاء. لالتخفيفات أكبر من 1: 100، إنشاء التخفيف الأوسط لتفادي الأخطاء pipetting ل.
- إعداد قارورة واحدة لكل نقطة في منحنى القياسية من خلال نقل الحلول منحنى القياسية (1.0 مل) من الخطوة 2.5 إلى قارورة م. سقف كل أنبوب بعد التحويل.
- إعداد محلول 0.1 M من هيدروكسيد الصوديوم (هيدروكسيد الصوديوم) وذلك بإضافة 0.04 غرام من هيدروكسيد الصوديوم إلى دورق يحتوي على 90 مل من الماء عالى النقاء والسماح للالكريات رس حل. نقل الحل 0.1 M هيدروكسيد الصوديوم إلى 100 قارورة حجمية مل وجلب الحجم الإجمالي إلى 100 مل.
- إضافة 1 مل من 0.1 حل M هيدروكسيد الصوديوم إلى قارورة CE نظيفة والغطاء.
- إعداد قارورة عازلة CE لكل دفعة من عينات ليتم تشغيلها على نظام CE. تتوفر مجموعات الانفصال أو مخازن مخصصة يمكن استخدام 13.
- إعداد 1 فيال مع 1 مل من بدء حل العازلة والغطاء.
- إعداد ثلاث قوارير مع 1 مل كل من يعمل حل العازلة والغطاء. استبدال المخزن المؤقت قيد التشغيل قبل كل دفعة من العينات ونقاط منحنى القياسية، أو بعد 35 عينات، أيهما أسبق.
- ملء ثلاثة قنينات إضافية مع 1 مل من الماء عالى النقاء وتتويج كل قارورة.
- إعداد 1 فارغة "النفايات" قنينة مع غطاء.
- بعد إعداد قارورة هو موضح في الخطوة 4.8، تحميل قارورة تحتوي على مخازن والمياه، فضلا عن قارورة النفايات (من الخطوات 4.8.2-5) في علبة عازلة للتميز الكلية الشعرية الكهربائيتيم، وفقا لتعليمات الشركة المصنعة 15. يجب الانتباه إلى موقف كل قنينة للبرمجة لصناعة السيارات في العينات.
- تحميل قارورة تحتوي على نقاط منحنى القياسية وقارورة تحتوي على عينات ليعاير في علبة عينة مدخل، كما هو موضح في تعليمات الشركة الصانعة. لاحظ موقف كل قنينة للبرمجة السيارات العينات (انظر الخطوات 4.11.1 أدناه).
- إعداد تكييف وطرق الفصل العينة (يتم توفير برامج لهذه في الجدولين 1 و 2 على التوالي)، والكتابة ملف تسلسل عينة وفقا للتعليمات التي تعمل الصك. استخدام طريقة فصل تفصيلا في الجدول 2: شطف العمود مع البادئ (20 رطل) 0.2 دقيقة. شطف مع مسرع (20 رطل) 0.5 دقيقة، حقن عينات (0.5 رطل) على عمود 0.09 دقيقة، وعينات منفصلة في 20 كيلو فولت لمدة 12 دقيقة، شطف مع هيدروكسيد الصوديوم (20 رطل) 0.5 دقيقة، وشطف أخيرا مع الماء ( 20 رطل) 0.5 دقيقة.
- باليودنانوغرام برنامج حاسوبي لمراقبة CE، كتابة عينة تشغيل تسلسل (أي worklist، ملف قائمة تتضمن تفاصيل عن الترتيب الذي سيتم تحليل العينات، والطريقة التي ستستخدم للفصل بين كل عينة) باستخدام "تسلسل" واجهة البيانات. وكل صف في جدول البيانات تتوافق مع تشغيل عينة وينتج ملف بيانات واحد.
- تأكد من أن عند كتابة ملف تسلسل، ويتم تحديد العينات باستخدام الموضع الصحيح في علبة أخذ العينات. تأكد من أن كل ملف البيانات له اسم فريد لمنع البرنامج من الكتابة فوق الملفات السابقة. برنامج CE يعمل تكييف الشعرية كتسلسل منفصل قبل تشغيل تسلسل تحتوي على طريقة فصل العينة.
- بدء تسلسل عينة تشغيل مع حلول منحنى القياسية، تليها عينات سوروس، وتنتهي الجولة الثانية من الحلول منحنى القياسية. وهذا سوف يسمح لحساب درجة من أي خسارة إشارة تحدث خلال تحليل عينة.

الجدول 1: برنامج طريقة تكييف المستخدمة في إعداد الشعرية لفصل حمض الكربوكسيلية قصيرة السلسلة عبر الشعرية الكهربائي ل.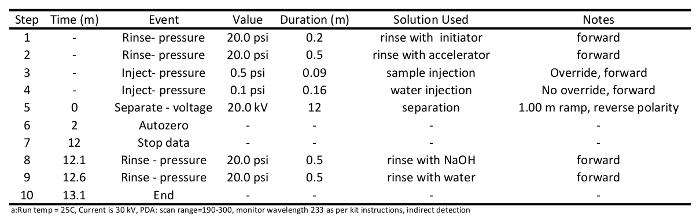
الجدول 2: برنامج طريقة الفصل المستخدمة لتحليل سلسلة قصيرة من الأحماض الكربوكسيلية عن طريق الشعيرات الدموية الكهربائي ل.5. كشف سوروس تشغيل تنفيذ وجمع البيانات
- بدء تشغيل تكييف الشعرية. نتوقع أن شرط الشعرية مرتين أو ثلاث مرات قبل العمود جاهز للفصل العينة. يجب أن يتم تنفيذ تكييف العمود كما هو موضح في الجدول رقم 1 لفترة وجيزة، وشطف العمود مع 0.1 M هيدروكسيد الصوديوم (20 رطل) لمدة 1 دقيقة ثم يشطف بالماء (20 رطل) ل1 دقيقة، شطف مع البادئ (20 رطل) 0.5 دقيقة، شطف مع مسرع (20 رطل) 0.5 دقيقة، مسرع منفصل في 30 كيلو فولت لمدة 10 دقيقة، شطف العمود مع 0.1 M هيدروكسيد الصوديوم (20 رطل) 0.5 دقيقة، وأخيرا شطف العمود بالماء (20 رطل) 0.5 دقيقة.
- شرط الشعرية قبل كل تسلسل عينة التشغيل. تحقيق تكييف مناسب عن طريق الحفاظ على الجهد الانفصال هو ثابت في جميع أنحاء تشغيل ومراقبة خط الأساس شقة على التتبع الضوئي مجموعة.
- بعد تكييف، والشروع في فصل عينة عن طريق فتح "السيطرة" القائمة في البرنامج واختيار (أي صفحة) على "تشغيل تسلسل." مراقبة التتبع الضوئي مجموعة (PDA) لضمان الفصل السليم.
- مراقبة التتبع الأول وضمان أن لديها خط الأساس شقة وحلها نظيفة (القرار الأساس)، قمم حمض الفردية. والإفراط في تحميل عينات تظهر ذيول ذروة طويلة، أو ذروة المخلفات، وسوف تحتاج إلى أن تضعف (الشكل 1).

الشكل 1: مقارنة بين PDA آثار تسليط الضوء على عينة زائد كما يزيد من تركيز تحليلها، قد تبدأ الفردية ذروة الهندسة لتصبح غير المتماثلة. في (أ) 0.05 ملغ / مل، ويعرض حمض الخليك واضحة المعالم، ذروة متناظرة ثنائيا. وحيث أن تركيز زيادة حمض الخليك إلى (ب) 0.07 ملغ / مل و (ج) 0.10 ملغ / مل، وأشكال ذروة الذيل (السهام). هذه الذروة المخلفات هو مؤشر جيد على أن العينة طاقتها. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.- وفي ختام المدى تسلسل، وفتح ملفات البيانات في وقت واحد في برامج التحليل م، ودمج القمم.
- دمج قمم العينة.
- فتح الملف الأولوتعيين خطوات التكامل التلقائي لاستبعاد 3 دقيقة الأولى من الشوط (حيث الجهد، وبالتالي فإن اتجاه تدفق العمود، هو مقلوب كما هو موضح في الجدول رقم 1). في نفس القائمة، وضع معايير اختيار الذروة إلى الذروة عرض الحد الأدنى من 50 وحدة ومنطقة الذروة من 100 وحدة (أو الإعدادات الافتراضية للمصنع) لتوفير مستوى عال نسبيا من الانتقائية، التي تفصل القمم حمض من الضوضاء في الخلفية في التتبع.
- التحقق يدويا حدود الذروة وخطوط الأساس لكل أثر المساعد الشخصي الرقمي لضمان ذروة التكامل السليم. قمم متكاملة بشكل غير صحيح (أي ذروة SSCA غير المتكافئة قليلا أن تم دمجها عن اثنين من قمم منفصلة من قبل برامج الحاسوب الآلي) سوف تحتاج إلى إعادة دمج يدويا.
- دمج قمم العينة.
- بعد الاندماج، عرض التقرير منطقة في المئة، ثم تسليط الضوء على ونسخ التقرير منطقة في المئة ولصقه في جدول منفصل. كرر لكل عينة لبناء تشغيل كامل ذروة التقرير!ر مع كل صف يمثل ذروة واحدة (أي، يجب أن تحتوي كل الذروة مركب واحد إذا كان يعمل الفصل أيضا).
تحليل 6. البيانات
- إعداد البيانات للتحليل باستخدام جداول البيانات التي شيدت في (5.4). يبدأ التحليل وصفها المعايير الحامضية لكل من نقاط منحنى القياسية، بما في ذلك معيار الداخلية.
- حساب مؤشر الاحتفاظ لكل الذروة من خلال تقسيم الوقت الاحتفاظ لكل الذروة في العينة في الوقت الإبقاء على مستوى الداخلي في تلك العينة. فرز البيانات تلاه مؤشر الاحتفاظ مما أدى المقرر أن تحديد قمم الفائدة في كل عينة.
- بعد تحديد الذروة لكل حمض الفائدة، وبناء منحنيات القياسية لكل حمض باستخدام نقاط منحنى معيار خارجي.
- توليد منحنى مستوى (تركيز) لكل معيار سوروس عن طريق تحديد منطقة ذروة لكل تركيز من المعايير سوروس، والتآمر التركيز على XAxis مقابل ذروة منطقة تقع على المحور الصادي. رسم الانحدار الخطي لكل المنحنى القياسي سوروس وتحديد معادلة الانحدار (ص = م × + ب).
- تأكد من أن R 2 قيم الانحدار الخطي هي 0.90 أو أعلى كما يتم تنفيذ التحديد الكمي الأكثر دقة في مجموعة خطية من المنحنى القياسي.
- حساب تركيز الحمض لسوروس معين في عينة باستخدام منطقة ذروة ومعادلة انحدار للخط الانحدار الخطي المنحنى القياسي (المحسوبة في 6.3.2 أعلاه). لفترة وجيزة، وتقسيم ذروة المنطقة المرصودة للحمض التي قدمها المنحدر من خط الانحدار لمنحنى القياسية حمض ل.
- تصحيح قيم تركيز الخام المحسوبة في الخطوة 6.4 لفقدان العينة أثناء معالجة باستخدام معيار الداخلي (الخطوة 6.5).
- حساب معامل التصحيح لكل عينة باستخدام معيار الداخلية.
- تقسيم التركيز الفعلي للمعيار الداخلية (أي كنوكمية سفل وأضاف في بداية التجربة) من قيمة تمت ملاحظتها على مستوى الداخلي في العينة (أي المبلغ المحسوب باستخدام معادلة انحدار منحنى القياسية لمعيار داخلي). مضاعفة قيم تركيز الخام من كل سوروس في عينة من هذا معامل التصحيح.
- تقسيم معيار داخلي تصحيح تركيز سوروس من قبل كتلة العينة المستخدمة لاستخراج لتصحيح أي اختلاف في كتلة العينة. هذا الحساب ينتج كمية الحليلة في كتلة العينة (ملغ سوروس في ملغ البن المطحون في هذا المثال)، ومن ثم يمكن تحويلها إلى وحدات مناسبة لدراسة معينة (ملغم / ملغ، ملغ / ز، ز / ز، الخ ).
- بعد حساب تركيزات سوروس (تطبيع إما إلى كتلة [لعينات صلبة أو سائلة] أو حجم [للعينات السائلة])، واستخدام هذه القيم للتحليل الإحصائي وفقا لمتطلبات التصميم التجريبي والمسائل ذات الاهتمام.
- باليودنانوغرام برنامج حاسوبي لمراقبة CE، كتابة عينة تشغيل تسلسل (أي worklist، ملف قائمة تتضمن تفاصيل عن الترتيب الذي سيتم تحليل العينات، والطريقة التي ستستخدم للفصل بين كل عينة) باستخدام "تسلسل" واجهة البيانات. وكل صف في جدول البيانات تتوافق مع تشغيل عينة وينتج ملف بيانات واحد.
النتائج
وقد استخدم هذا البروتوكول بنجاح لقياس الآثار المترتبة على معاملة البذور على محتوى سوروس من بذور البن الخضراء. في هذه التجربة، كانت العلاجات ستة: تعليق الميكروبية المشبعة من النستقة pseudomesenteroides سلالة GCP674 في متوسطة النمو (1)، وهو تعليق مائي من GCP674 ...
Discussion
كما هو الحال مع أي تقنية تحليلية، وهناك العديد من العوامل الحاسمة التي يمكن أن تؤثر بشكل كبير على نوعية وموثوقية البيانات التي تم إنشاؤها. أولا، من المهم معالجة عينات بكفاءة، مع حد أدنى من دورات تجميد / الذوبان. تكرار التجميد والذوبان يمكن أن تعرض للخطر التركيب الكيم?...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The authors would like to acknowledge the financial support of this project by The J.M. Smucker company.
Materials
| Name | Company | Catalog Number | Comments |
| Ceramic Moarter and Pestle | Coorstek | 60310 | |
| Beckman Coulter P/ACE MDQ CE system | Beckman Coulter | Various | |
| Glass sample vials | Fisher Inc. | 033917D | |
| 1.5 ml microcentrifuge tubes | Fisher Inc. | 02-681-5 | |
| LC/MS grade water | Fisher Inc. | W6-1 | Milli-Q water (18.2 MΩ.cm) is also acceptable |
| 15 ml glass tube/ Teflon lined cap | Fisher Inc. | 14-93331A | |
| Parafilm M | Fisher Inc. | 13-374-12 | |
| CElixirOA detection Kit pH 5.4 | MicroSolv | 06100-5.4 | |
| BD Safety-Lok syringes | Fisher Inc. | 14-829-32 | |
| 17 mm Target Syringe filter, PTFE | Fisher Inc. | 3377154 | |
| 32 Karat, V. 8.0 control software | Beckman Coulter | 285512 | |
| capillary electrophoresis (CE) sample vials | Beckman Coulter | 144980 | |
| caps for CE vials | Beckman Coulter | 144648 | |
| Liquid Nitrogen | N/A | N/A | Liquid nitrogen is available from most facilities services |
References
- Araújo, W. L., Nunes-Nesi, A., Nikoloski, Z., Sweetlove, L. J., Fernie, A. R. Metabolic Control and Regulation of the Tricarboxylic Acid Cycle in Photosynthetic and Heterotrophic Plant Tissues: TCA Control and Regulation in Plant Tissues. Plant Cell Environ. 35 (1), 1-21 (2012).
- Finkemeier, I., Konig, A. C., et al. Transcriptomic Analysis of the Role of Carboxylic Acids in Metabolite Signaling in Arabidopsis Leaves. Plant Physiol. 162 (1), 239-253 (2013).
- Doyle, M. P., Buchanan, R. . Food Microbiology: Fundamentals and Frontiers. , (2013).
- Tůma, P., Samcová, E., Štulìk, K. Determination of the Spectrum of Low Molecular Mass Organic Acids in Urine by Capillary Electrophoresis with Contactless Conductivity and Ultraviolet Photometric Detection-An Efficient Tool for Monitoring of Inborn Metabolic Disorders. Anal Chim Acta. 685 (1), 84-90 (2011).
- López-Bucio, J., Nieto-Jacobo, M. F., Ramı́rez-Rodrı́guez, V., Herrera-Estrella, L. Organic Acid Metabolism in Plants: From Adaptive Physiology to Transgenic Varieties for Cultivation in Extreme Soils. Plant Sci. 160 (1), 1-13 (2000).
- Cebolla-Cornejo, J., Valcárcel, M., Herrero-Martìnez, J. M., Rosellò, S., Nuez, F. High Efficiency Joint CZE Determination of Sugars and Acids in Vegetables and Fruits: CE and CEC. Electrophoresis. 33 (15), 2416-2423 (2012).
- Rosello, S., Galiana-Balaguer, L., Herrero-Martinez, J. M., Maquieira, A., Nuez, F. Simultaneous Quantification of the Main Organic Acids and Carbohydrates Involved in Tomato Flavour Using Capillary Zone Electrophoresis. J Sci Food Agr. 82 (10), 1101-1106 (2002).
- Wasielewska, M., Banel, A., Zygmunt, B. Capillary Electrophoresis in Determination of Low Molecular Mass Organic Acids. Int J Environ Sci Dev. 5 (4), 417-425 (2014).
- Galli, V., Garcìa, A., Saavedra, L., Barbas, C. Capillary Electrophoresis for Short-Chain Organic Acids and Inorganic Anions in Different Samples. Electrophoresis. 24 (1213), 1951-1981 (2003).
- Klampfl, C. W. Determination of Organic Acids by CE and CEC Methods. Electrophoresis. 28 (19), 3362-3378 (2007).
- Kenney, B. F. Determination of Organic Acids in Food Samples by Capillary Electrophoresis. J Chromatogr A. 546, 423-430 (1991).
- Galli, V., Barbas, C. Capillary Electrophoresis for the Analysis of Short-Chain Organic Acids in Coffee. J Chromatogr A. 1032 (1-2), 299-304 (2004).
- Schmitt-Kopplin, P. Capillary Electrophoresis: Methods and Protocols. Methods in Molecular Biology. , 384 (2008).
- Nollet, L. . Chromatographic analysis of the environment 3rd ed. , (2006).
- . . ElixerOA Organic Acids/Anions Operating and Instruction Manual, MicroSolv Technology Corperation. , (2001).
- Dahlen, J., Hagberg, J., Karlsson, S. Analysis of low molecular weight organic acids in water with capillary zone electrophoresis employing indirect photometric detection. Fresenius J. Anal. Chem. 366 (5), 488-493 (2000).
- Ibanez, A. B., Bauer, S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectroscopy. Biotech. For Biofuels. 7 (145), (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved