Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Mit Hilfe der Kapillarelektrophorese organischen Säuren aus Pflanzengewebe zu beziffern: ein Test Untersuchen
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt eine Methode zum Nachweis und zur Quantifizierung von organischen Säuren aus Pflanzenmaterial frei zonale Kapillarelektrophorese. Ein Beispiel für die mögliche Anwendung dieses Verfahrens, um die Auswirkungen einer Nachgärung auf organischen Säure Ebenen in Kaffeesamen zu bestimmen, vorgesehen.
Zusammenfassung
Carbonsäuren sind organische Säuren einen oder mehrere endständige Carboxyl (COOH) funktionelle Gruppen enthält. Kurzkettige Carbonsäuren (SCCAs; Carbonsäuren mit drei bis sechs Kohlenstoffatomen), wie Malat und Citrat, sind entscheidend für das reibungslose Funktionieren vieler biologischer Systeme, in denen sie in der Zellatmung funktionieren und können als Indikatoren für die Zellgesundheit dienen. In Lebensmitteln kann Gehalt an organischer Säure erhebliche Auswirkungen auf den Geschmack haben, mit einer erhöhten SCCA Ebenen, was zu einem sauren oder "Säure" Geschmack. Wegen dieses Verfahren für die schnelle Analyse von organischen Säurewerte sind von besonderem Interesse für die Lebensmittel- und Getränkeindustrie. Leider jedoch sind die meisten Methoden zur Quantifizierung SCCA sind zeitraubend Protokollen abhängig erfordern analysiert die Derivatisierung der Proben mit gefährlichen Reagenzien, gefolgt durch aufwendige chromatographische und / oder massenspektrometrischen. Dieses Verfahren Informationen ein alternatives Verfahren zum Nachweis und zur Quantifizierung von organic Säuren aus Pflanzenmaterial und Lebensmittelproben frei zonale Kapillarelektrophorese (CZE) mit, manchmal einfach als Kapillarelektrophorese (CE). CZE stellt ein kostengünstiges Verfahren für SCCAs mit einer niedrigen Nachweisgrenze (0,005 mg / ml) zu messen. Dieser Artikel beschreibt die Extraktion und Quantifizierung von SCCAs von Pflanzenproben. Während das Verfahren auf der Messung der SCCAs von Kaffeebohnen vorgesehen konzentriert, kann das Verfahren bereitgestellt, um mehrere auf pflanzlicher Basis Nahrungsmittelmaterialien angewendet werden.
Einleitung
Carboxylic acids are organic compounds containing one or more terminal carboxyl functional groups, each attached to an R-group containing one or more carbons (R-C[O]OH). Short chain, low molecular weight carboxylic acids (short chain carboxylic acids, SCCAs) containing between one and six carbons, are essential components of cellular respiration, and function in several biochemical pathways necessary for cell growth and development. SCCAs play critical roles in cellular metabolism1, cell signaling2, and organismal responses to the environment (such as antibiosis3). Because of this, SCCAs can serve as useful indicators of disruptions to cellular metabolism, plant stress responses4,5, and fruit quality6,7. To date, SCCAs have been quantified primarily through chromatographic techniques such as high performance liquid chromatography (HPLC) or gas chromatography-mass spectroscopy (GC-MS). While these methods, are capable of achieving very low limits of detection, they can be expensive, require the derivatization of target SCCAs using caustic and/or toxic reagents, and include lengthy separation runs on the GC or HPLC. Because of this, interest in the use of free zonal capillary electrophoresis (CZE), which does not require sample derivatization, to quantify organic acids has steadily increased8.
Free zonal capillary electrophoresis (CZE) is a chromatographic separation methodology that, due to its high number of theoretical plates, speed, and relative ease-of-use, is increasingly replacing both GC-MS and high-pressure liquid chromatography as an analytical method for the quantification (particularly for quality control purposes) of anions, cations, amino acids, carbohydrates, and short chain carboxylic acids (SCCAs)8,9,10. CZE-based separation of small molecules, including SCCAs, is based two primary principles: the electrophoretic movement of charged ions in an electrical field established across the buffer filling the capillary; and the electro-osmotic movement of the entire buffer system from one end of the capillary to the other, generally towards the negative electrode. In this system, small molecules move towards the negative electrode at varying speeds, with the speed of each molecule determined by the ratio of the net charge of the molecule to the molecular mass. As the movement of each individual molecule in this system is dependent on the charge state of the molecule and the overall rate of electro-osmotic flow (which is itself based on the ion content of the buffer used to fill the capillary), the buffer pH and ionic composition heavily impact the degree to which molecules can be efficiently separated using CZE. Because of this, SCCAs, with their relatively high charge-to-mass ratios, are ideal targets for CZE-based separation. Metabolites separated using CZE can be detected using a variety of methods, including UV absorbance, spectral absorbance (which is generally performed using a photo-diode array [PDA]), and/or mass spectroscopy (CE-MS or CE-MS/MS)8. The diversity of separation and detection methods provided by CZE makes it an extremely flexible and adaptable technique. Because of this, CZE has been increasingly applied as a standard method of analysis in the areas of food safety and quality11,12, pharmaceutical research13, and environmental monitoring13,14.
Capillary electrophoresis has been used to detect and quantify short chain carboxylic acids for nearly two decades13. The resolving power (particularly for small, charged molecules), short run time, and low per sample cost of CZE analyses make CZE an ideal technique for the separation and quantification of SCCAs13. This method presents a protocol to utilize CZE to measure the concentration of organic acids from plant tissues. Example data was generated through the successful implementation of this protocol to measure the change in organic acid levels in coffee seeds following a secondary fermentation treatment. The protocol details the critical steps and common errors of CZE-based separation of SCCAs, and discusses the means by which this protocol can be successfully applied to quantify SCCAs in additional plant tissues.
Protokoll
1. Probenvorbereitung
- Montieren Sie Proben für die kurzkettigen Carbonsäure (SCCA) Extraktion. Bereiten 1,0 g Kaffee Saatguts zu einer Zeit, die ausreichend Probe sicherzustellen wird nach der Verarbeitung verbleiben.
- Wenn Proben vor dem Schleifprozess eingefroren wurden, halten Sie die während der Verarbeitung gefroren Gewebe Frost / Tau-Schäden und Probe Oxidation zu verhindern. Entfernen Sie die Probe aus dem Kühl- oder unter Null Lagerung nur zum Schleifen erforderlich.
- Blitzeis frische Proben in flüssigem Stickstoff unmittelbar vor Schleifen zu probieren. Probenhandhabung, Flash-Freeze-Proben zu minimieren, indem sie in einem Mörser vorgefüllt mit flüssigem Stickstoff platzieren.
- Analysieren von flüssigen Proben unmittelbar nach der Erzeugung oder Blitzeis in flüssigem Stickstoff und bei -20 ° C oder -80 ° C bis zur Analyse. Vor der Analyse zu entfernen gefrorenen Proben aus dem Lager und damit aufzutauen. Für flüssige Proben gehen (3.5) für die Verarbeitung zu Schritt.
- tragen Sie approfalls persönliche Schutzausrüstung (einschließlich Schutzbrille, Handschuhe und Laborkittel), bevor sie mit flüssigem Stickstoff zu arbeiten.
- Triple-grind Gewebeproben zu einer gleichmäßig feinen Pulver (dh einheitlicher Partikelgröße) in flüssigem Stickstoff mit einem Mörser und Pistill Keramik verwendet wird .
HINWEIS: Größe einer einheitlichen Partikel Erreichen ist von wesentlicher Bedeutung für SCCA Extraktionseffizienz zu maximieren.- Pre-kühlen Sie den Mörser und Stößel mit flüssigem Stickstoff vor der Zugabe der Probe. Halten den Mörtel mit einem geringen Volumen von flüssigem Stickstoff gefüllt, während die Probe zugegeben wird.
- Mit Hilfe einer Schöpfkelle, fügen Sie genug von flüssigem Stickstoff zu dem Mörtel die Probe vollständig versenken.
- Fügen Sie leicht Bodenproben, wie Blätter oder gerösteten Kaffee, zu dem flüssigen Stickstoff und zerquetschen eine kreisförmige Schleif Bewegung. Beginnen Proben zu mahlen, wenn der flüssige Stickstoff Niveau bis zu dem Punkt abgenommen hat, wo er gerade noch die Proben umfasst.
- In harten Proben zu schleifen, wie eins Rohkaffee Samen, zu flüssigem Stickstoff und lassen sie für 10 bis 30 Sekunden (oder bis der flüssige Stickstoff nicht mehr kräftig siedendem) vor dem Mahlen zu frieren. Brechen Sie das Gewebe in kleinere Fragmente eine vertikale Bewegung Brech- verwenden und dann komplette Gewebe Schleifen einer Rundschleifen Bewegung.
- Wiederholen Sie die Schritte 1.3.2-1.3.4 noch zweimal, so dass die Proben insgesamt dreimal gemahlen werden. Typischerweise werden drei aufeinanderfolgende Runden der Schleifproben mit einem mehlartigen Konsistenz zu einem Pulver reduzieren.
- Wenn eine mehlartige Konsistenz nicht erreicht, Schritte wiederholen, bis 1.3.2-1.3.4 Proben zu einem Pulver einheitlich kleinen Teilchengröße verringert werden (Extraktionswirkungsgrad umgekehrt proportional zur Partikelgröße).
- Übertragen Pulver zu Glasfläschchen oder 1,5 ml Mikrozentrifugenröhrchen. Initiieren Weiterverarbeitung unmittelbar nach dem Schleifen (empfohlen) oder Lagerung von Proben bei -80 ° C bis Proben sind bereit für die Extraktion.
- Wenn Proben müssen vor gespeichert werdenAnalyse, teilen Sie die Probe in 500 mg Aliquots (oder 500 & mgr; l-Aliquots für flüssige Proben) und unter mehreren Rohren für die Lagerung aufgeteilt. Vermeiden Proben wiederholt Frost / Tau-Zyklen unterworfen wird, da diese Probenzusammensetzung verändern können und sich negativ auf zukünftige Probenmessungen auswirken.
2. Organische Säuren Standardpräparat
- Montieren Sie authentischen Standards für die SCCAs von Interesse. Diese werden eingesetzt, um eine externe und interne Standardlösungen zur Verwendung bei der Bestimmung, SCCA-Konzentrationen. Für Kaffeeproben umfassen Zitronensäure, Apfelsäure, Essigsäure und Milchsäure als Säuren von Interesse und Adipinsäure als interner Standard.
- Stellen Sie sicher, sicher, dass der interne Standard ausgewählt ist, nicht natürlich in der Probe festgestellt, und dass der Standard zusammen eluierte nicht mit anderen Peaks im Musterprofil.
- Führen Standardkurven für jedes SCCA von Interesse, und bestimmen Sie die lineare Reaktion Bereich für jeden SCCA (siehe Abschnitt 4 für die Ausführung von instructions). Stellen Sie sicher, Standardkurven für jedes SCCA zu laufen in der Probe gemessen werden.
HINWEIS: Die Standardkurven in betrieben werden kann entweder Puffer oder der Hintergrund der Probe untersucht werden. Im zweiten Fall ( "Standardaddition"), Werte für den Spitzenbereich jedes Standardkurve Punkt wird durch Subtraktion entfernt den Hintergrund der Probe bestimmt werden. - Pre-Label alle Rohre und Gläser mit dem Säure Namen SCCA erforderlich, die Konzentration und das Datum des Tests.
- Stocklösungen für jeden Standard bei einer bekannten Konzentration (10 mg / ml) einen Messkolben mit Genauigkeit bei der Standard-Vorbereitung zu gewährleisten.
- Man löst feste SCCA-Standards (Zitronensäure und Apfelsäure) in Reinstwasser (18,2 M & Omega;), um die gewünschte Konzentration für die Stammlösung zu erreichen.
- Erstellen Sie eine 10 mg / ml Stammlösung durch Zugabe von 100 mg Standard in einen 10 ml Messkolben. Füllen Sie den Messkolben bis zur 10 ml Linie mit Reinstwasser bis dissolve die Säure.
- Erstellen Sie eine niedrigere Konzentration von Säure-Standard oder sanft die Kolben Wärme zum Antrieb SCCA Normen schwierig zu lösen, wie Adipinsäure, in Lösung.
- Verdünnte flüssige Phase Säure-Standards (Essigsäure und Milchsäure) in Reinstwasser, um die gewünschte Konzentration zu erreichen.
- einen Messkolben mit 5 ml Reinstwasser vorfüllen. Fügen Sie genug Säure, um eine 10 mg / ml Lösung herzustellen (berechnet die Säuredichte des Verkäufers verwendet wird) in den Kolben, und dann genug Wasser fügen Sie das endgültige Volumen der Lösung auf 10 ml zu bringen.
- Man löst feste SCCA-Standards (Zitronensäure und Apfelsäure) in Reinstwasser (18,2 M & Omega;), um die gewünschte Konzentration für die Stammlösung zu erreichen.
- Bringen Sie jede Stammlösung in einen sauberen 15 ml Glasrohr mit einem Polytetrafluorethylen (PTFE) ausgekleideten Deckel und Dichtung mit Kunststoff Paraffinfilm. Stammlösungen können in verschlossenen Röhrchen bei 4 ° C für 1 Woche gelagert werden.
- Stellen Sie sicher, dass SCCA Normen nicht von Lösung vor der Verwendung ausgefällt, wenn Stammlösungen wurden nach prepar gekühlt wordenation. Laufwerk ausfällt in Lösung durch leichtes Erwärmen wieder.
- Bereiten Sie die SCCA Extraktionslösung. Umfassen die internen Standards in einer ausreichenden Konzentration zur Detektion in den Proben (0,05 mg / ml). Bereiten Sie genügend Lösung für alle Proben zu extrahieren.
- Bereiten Sie 50 ml SCCA Extraktionslösung durch den internen Standard-Stammlösung auf 0,05 mg / ml in Reinstwasser verdünnt wird. In 250 ul der internen Standard-Stammlösung (10 mg / ml) auf 49,75 ml Wasser.
- Wenn der Extrakt verdünnt werden muss, stellen Sie die interne Standardkonzentration in der Extraktionslösung, so dass die endgültige Konzentration innerhalb der Grenzen der Quantifizierung fallen wird (ein nachweisbares zu geben, aber nicht über gesättigt, Spitze, siehe 5.2.2 unten) von der CE-System nach Verdünnung (0,05 mg / ml).
- Bereiten Sie frische Extraktionslösung für jede Reihe von Extraktionen (dh für jede Versuchsreihe).
- Bereiten Standardkurvenproben(Eine Reihe von geeigneten Verdünnungen) für SCCAs von Interesse, ein Minimum von mindestens 5 Punkten. Die Standardkurve Konzentrationen eingesetzt werden müssen, für eine gegebene SCCA im linearen Antwortbereich zu werden, und die in den Proben erwartet SCCA Konzentrationen überspannen.
- Fügen Sie den ausgewählten internen Standards in der Standardkurve Lösungen in Proben Quantifizierung des internen Standards zu ermöglichen. Der interne Standard wird verwendet werden, in Spitzen Identifizierung und Berechnung der Extraktionseffizienz (Abschnitt 6) zu unterstützen.
- Verdünnen Sie jede SCCA zu den Konzentrationen oberhalb bestimmt (0,01, 0,02, 0,04, 0,06, 0,08 mg / ml, siehe oben, 2.4.2) in neue Mikrozentrifugenröhrchen (eine für jede Konzentration / Standardkurve Punkt) Reinstwasser verwenden. Bereiten Sie 1 ml Lösung für jede Standardkurve Konzentrationspunkt. Stellen Sie sicher, dass jeder Konzentrationspunkt enthält alle vier Säure-Standards und den internen Standard in der richtigen Konzentration.
- Bereiten Sie neue Standardkurvenpunkte für jeden Satzvon Proben auf die Kapillar-Elektrophorese-System ausgeführt werden. Halten Sie die Standardkurve SCCA Proben bei 4 ° C bis zur Analyse, die nach der Extraktion von SCCAs von Zielgewebe (Abschnitt 3) auftreten wird.
3. Organische Säureextraktion
- Pre-label Probenröhrchen, mindestens ein Rohr für jede Probe extrahiert werden vorbereitet.
- Entfernen Proben aus dem Lager entnommen werden, und legen Sie sie auf Eis, während Material für die Extraktion Auswiegen.
- Man wiegt 100 mg Probe für SCCA-Extraktion.
- Nachdem jede Probe mit einem Gewicht, übertragen Gewebe auf ein sauberes 1,5 ml Mikrozentrifugenröhrchen. Messen Sie eine Menge der Probe möglichst nahe an der Zielmasse wie möglich Variabilität zu reduzieren.
- Verfolgen Sie die Masse jeder Probe gemessen, wie die Mengen an SCCAs erkannt wird die Probenmasse normalisiert werden (siehe 6.5.2, unten).
- Nachdem alle Proben mit einem Gewicht, 1 ml der Extraktionslösung (die water + internen Standardgemisches aus Schritt 2.4) zu jedem der Probenröhrchen. Halten Sie das Verhältnis von Extraktionslösung zu Gewebemasse derselben in allen Extraktionen (in diesem Fall 1 ml für 100 ± 5 mg Gewebe). Gut mischen durch Vortex für 10 Sekunden.
- Erlauben Proben für 1 Stunde bei Raumtemperatur stehen. Während dieser Stunde mischen jedes Röhrchen alle 15 min, wie in Schritt 3.4.
- Nach 1 Stunde der Extraktion, mischen Sie die Proben ein letztes Mal und Probenröhrchen zu einer Mikro übertragen. Zentrifuge Proben bei 4 ° C, 10.000 xg für 10 min feste Material (Zellwände, Partikel, etc.) auszufällen.
- Bei flüssigen Proben verarbeiten, fügen Sie die entsprechende Konzentration des internen Standards, kurz und Zentrifuge mischen. Nach der Zentrifugation behandeln flüssigen Proben identisch mit dem Extrakt aus festen Proben.
- Den pH-Wert der Proben, um zu bestätigen, dass sie mit dem pH-Bereich der Laufpuffer in dem Nachweiskit kompatibel sind (Schritt 4.6) oder Puffersystem emp wobeiloyed. Da die Volumina der Probe in der Regel sehr klein sind, können pH pH Papier überwacht.
- Bereiten Sie zum Filtern von Proben unter Verwendung von Spritzen-Scheibenfilter (3.8).
HINWEIS: Verhindern Verlust Probe, indem sichergestellt wird, dass jeder Filter richtig an einer Spritze befestigt ist, vor Überstand zu übertragen. Bereiten einer Spritze mit einem Scheibenfilter ausgestattet für jede Probe (einschließlich Standardkurvenproben) analysiert werden. - Nach Zentrifugation der Proben und Vorbereitung der Spritzenfilter, den Überstand von jeder Probe auf eine 3 ml-Spritze mit einer 0,2 & mgr; m Spritzenfilter ausgestattet. Verwenden Sie einen neuen Filter und Spritze für jede Probe. Filtern Sie alle Proben, einschließlich Standardkurvenproben und Pufferkontrollen, bevor sie auf dem CE-System ausgeführt wird.
- Filtern Sie die Probe direkt in ein sauberes Reaktionsgefäß. Nach dem Filtern, schließen Sie die Spritze / Filtervorrichtung, die das Röhrchen, das Filtrat und entsorgen.
- Unmittelbar danach gefiltert Probenin das CE-System für SCCA-Erkennung; oder Lagerung von Proben bei 4 ° C über Nacht. Wenn Proben über Nacht gelagert werden sollen, versiegeln Sie die Rohre mit Kunststoff Paraffinfilm um einen Gasaustausch und Probenverdampfung zu verhindern.
- Wenn Proben müssen als einen Tag nach der Filterung gespeichert länger werden, Flash-Freeze-Extrakte in flüssigem Stickstoff oder Einfrieren bei -20 ° C. jedoch sicher, nach dem Auftauen, dass jede Probe auf Niederschlagsbildung untersucht und Filter, falls erforderlich (wie in Schritt 3.6).
4. Einrichten des SCCA-Erkennungslauf
- Lesen Sie die CE Bedienungsanleitung für Programmier- und Steuerungssoftware spezifische Details.
- Bereiten Sie die Kapillarelektrophorese (CE) Probenfläschchen für SCCA-Erkennung. Stellen Sie sicher, Fläschchen ordnungsgemäß gekennzeichnet sind, sauber und frei von Mängeln.
- Waschen und die Kappen der CE-Fläschchen vor dem Gebrauch trocknen.
- Waschen Sie Kappen von ihnen in Reinstwasser eingetaucht und es ihnen ermöglicht, über Nacht einweichen. Nachdem die Kappen Einweichen, verwerfen die einweichening Lösung und spülen Sie die Kappen zweimal mit Reinstwasser.
- Transfer gespült Kappen auf eine saubere Trocknungsoberfläche mit einem fusselfreien Tuch ausgekleidet und es ihnen ermöglichen, an der Luft trocknen. Stellen Sie sicher, Kappen vollständig trocken sind vor dem Gebrauch Druck Ausfälle zu vermeiden.
- 1 ml der Probe zu jedem CE Fläschchen, vorsichtig aus Versehen zu vermeiden, dass die Probe in den Hals des Fläschchens spritzt. Nach der Übertragung setzen auf jedem Fläschchen eine CE-Kappe.
- Wenn eine Verdünnung erforderlich ist, verdünnt den Kaffeesamenproben 1.10 oder 1: 100 direkt in der CE-Fläschchen Reinstwasser verwenden. Für Verdünnungen von mehr als 1: 100, schaffen eine Zwischenverdünnung Pipettierfehler zu vermeiden.
- Bereiten Sie ein Fläschchen für jede Standardkurve Punkt durch Standardkurve Lösungen übertragen (1,0 ml) aus Schritt 2,5 bis CE Fläschchen. Cap jedes Rohr nach der Übertragung.
- Bereiten einer 0,1 M Lösung von Natriumhydroxid (NaOH) durch Zugabe von 0,04 g NaOH in ein Becherglas mit 90 ml Reinstwasser und damit die Pellets to auflösen. Übertragen, die 0,1 M NaOH-Lösung in einen 100 ml Meßkolben und bringt das Gesamtvolumen auf 100 ml.
- 1 ml 0,1 M NaOH-Lösung auf eine saubere Phiole CE und Kappe.
- Bereiten Sie CE Puffer Fläschchen für jede Charge von Proben auf dem CE-System ausgeführt werden. Die Trennung Kits sind verfügbar oder benutzerdefinierte Puffer können 13 verwendet werden.
- Bereiten Sie 1 Fläschchen mit 1 ml Ausgangspufferlösung und Kappe.
- Bereiten Sie drei Fläschchen mit je 1 ml Laufpuffer-Lösung und Kappe. Ersetzen Sie den Laufpuffer vor jeder Charge von Proben und Standardkurvenpunkte, oder nach 35 Proben je nachdem, welcher Fall zuerst eintritt.
- Füllen Sie drei weitere Fläschchen mit 1 ml Reinstwasser und jedes Fläschchen verschließen.
- Bereiten 1 leer "Abfall" Fläschchen mit Kappe.
- Nach der Herstellung der in Schritt beschrieben Fläschchen 4.8, laden die Fläschchen, die Puffer und Wasser, sowie die Abfallgefäße (aus den Schritten 4.8.2-5) in die Pufferwanne der Kapillarelektrophorese sys enthälttem, gemäß den Anweisungen des Herstellers 15. Beachten Sie sorgfältig die Position jedes Fläschchen für Autosampler-Programmierung.
- Laden die Fläschchen, die Standardkurve Punkte enthält, und die Fläschchen, die Proben enthalten, in die Einlaßprobentablett getestet werden, wie in den Anweisungen des Herstellers beschrieben ist. Notieren Sie sich die Position jedes Fläschchen für Autosampler-Programmierung (siehe Schritte 4.11.1 unten).
- Bereiten Sie Anlage und Probentrennverfahren (Programme für diese vorgesehen sind in den Tabellen 1 bzw. 2), und schreiben Sie eine Probensequenz Datei als pro Instrument Betriebsanleitung. Verwenden Sie das Trennverfahren detailliert in Tabelle 2: Spülen der Säule mit Initiator (20 psi) für 0,2 min; Spülen mit Beschleuniger (20 psi) für 0,5 min, injizieren Proben (0,5 psi) auf die Säule für 0,09 min, getrennte Proben bei 20 kV für 12 min, Spülen mit NaOH (20 psi) für 0,5 min und schließlich mit Wasser spülen ( 20 psi) für 0,5 min.
- Using der CE - Steuerungssoftware, schreiben Sie die Probe laufenden Sequenz (dh den Arbeitsvorrat, um jede Probe zu trennen , um eine Liste Datei , um die Reihenfolge , in der detailliert die Proben analysiert werden, und das Verfahren verwendet werden) unter Verwendung der "Sequenz" Arbeitsblatt - Schnittstelle. Jede Zeile in der Tabelle wird zu einem Probelauf entsprechen und eine einzelne Datendatei erzeugen.
- Stellen Sie sicher, dass, wenn die Sequenzdatei schreiben, Proben identifiziert werden in der Probenschale die richtige Position mit. Stellen Sie sicher, dass jede Datendatei einen eindeutigen Namen, die Software überschreibt vorherige Dateien zu verhindern hat. Programm CE Kapillar Anlage läuft als separate Sequenz vor der Sequenz Lauf der Probentrennverfahren enthalten.
- Beginnen Sie mit der Probensequenz mit den Standardkurve Lösungen laufen, gefolgt von SCCA-Proben, und am Ende mit einem zweiten Lauf der Standardkurve Lösungen. Dies wird eine Berechnung des Grades der jedem Signalverlust ermöglichen, die während Probenanalysen.

Tabelle 1: Konditionierungsverfahren Programm verwendet , um die Kapillare für kurzkettige Carbonsäure Trennung über Kapillare vorzubereiten Elektrophorese ein.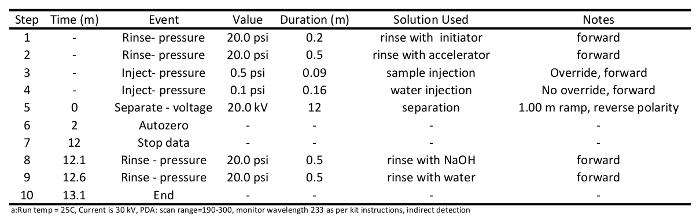
Tabelle 2: Trennverfahren Programm verwendet kurzkettige Carbonsäuren Analysen über Kapillare eine Elektrophorese.5. SCCA-Erkennungslauf Ausführung und Datenerfassung
- Initiieren Kapillare Anlage läuft. Erwarten, dass die Kapillare zwei- oder dreimal zu konditionieren, bevor die Spalte für die Probentrennung bereit ist. Konditionierung sollte wie in Tabelle 1 beschrieben durchgeführt werden. Kurz gesagt, spülen Säule mit 0,1 M NaOH (20 psi) für 1 min mit Wasser spülen (20 psi) für1 min, Spülen mit Initiator (20 psi) für 0,5 min, spült mit Beschleuniger (20 psi) für 0,5 min, separater Beschleuniger bei 30 kV für 10 Minuten, spülen Säule mit 0,1 M NaOH (20 psi) für 0,5 min und schließlich spülen Sie die Säule mit Wasser (20 psi) für 0,5 min.
- Erhaltung der Kapillare vor jedem Probensequenz laufen. richtige Konditionierung erreichen, indem die Trennspannung zu halten, ist konstant über die gesamte Auflage und eine flache Basislinie auf dem Photodiodenarray Spur zu beobachten.
- Nach der Konditionierung initiieren Probentrennung das Menü "Steuerung" in der Software durch Öffnen und Auswählen (dh einen Klick auf) "Ablaufreihenfolge." Überwachen Sie die Photodiodenarray (PDA) Spur korrekte Trennung zu gewährleisten.
- Beachten Sie die erste Spur und stellen Sie sicher, dass es eine flache Basislinie hat und sauber aufgelöst (Basisauflösung), individuelle Säurespitzen. Über belasteten Proben werden lange Spitzen Schwänze zeigen, oder Peaktailing und müssen verdünnt werden (Abbildung 1).

Abb . 1: Ein Vergleich der PDA eine überladene Probe Spuren markieren Als Analyt - Konzentration zunimmt, können einzelne Spitzengeometrie beginnen asymmetrisch zu werden. Bei (a) 0,05 mg / ml, präsentiert Essigsäure eine wohldefinierte, bilateral symmetrischer Peak. Als die Konzentration an Essigsäure steigt auf (b) 0,07 mg / ml und (c) 0,10 mg / ml, ein Peak tail Formen (Pfeile). Dieser Peaktailing ist ein gutes Indiz dafür , dass die Probe überlastet. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.- Am Ende der Sequenz auszuführen, öffnen Sie die Datendateien, ein zu einer Zeit in der Analyse-Software CE und integrieren die Spitzen.
- Integrieren Probenpeaks.
- Öffnen Sie die erste Dateiund stellen die automatischen Integrationsschritte der ersten 3 min des Durchlaufs auszuschließen (wo die Spannung und somit die Richtung der Säule fließen, umgekehrt ist , wie in Tabelle 1 beschrieben). Im gleichen Menü eingestellt Spitzenauswahlkriterien auf ein Minimum Spitzenbreite von 50 Einheiten und Peakfläche von 100 Einheiten (oder die Standardeinstellungen des Herstellers) eine mäßig hohe Selektivität zu liefern, Säurespitzen von Hintergrundrauschen in der Spur zu trennen.
- Von Hand überprüfen Spitzengrenzen und Grundzüge für jeden PDA Spur richtige Peak-Integration zu gewährleisten. Unsachgemäß integrierten Spitzen (dh eine leicht asymmetrische SSCA Spitze , die als zwei getrennte Peaks durch die automatisierte Software integriert wurde) müssen manuell neu integriert werden.
- Integrieren Probenpeaks.
- den prozentualen Bereich Bericht, dann markieren und kopieren Sie den Prozentbereich Bericht Nach der Integration, anzeigen und in eine separate Tabelle einfügen. Wiederholen Sie für jede Probe die volle Lauf Spitze repor zu konstruierent , wobei jede Zeile einen einzelnen Peak darstellt (dh., sollte jeder Peak eine einzige Verbindung enthalten , wenn die Trennung gut funktioniert).
6. Datenanalyse
- Bereiten Sie Daten für die Analyse mit Hilfe der Kalkulationstabelle aufgebaut ist (5.4). Beginnen Sie die Analyse durch die Säure Normen Kennzeichnung für jede der Standardkurvenpunkte, einschließlich des internen Standards.
- Berechnen für jede Spitze einen Retentionsindex in dieser Probe durch die Retentionszeit des internen Standards für jeden Peak in der Probe, die Retentionszeit durch Dividieren. Sortieren Sie die durch den resultierenden Retentionsindex eingestellten Daten, die Spitzen von Interesse in jeder Probe zu identifizieren.
- die Spitze für jede Säure von Interesse Nach der Identifizierung, konstruieren Standardkurven für jede Säure die externen Standardkurve Punkten.
- Erzeugen Sie eine Standard (Konzentration) Kurve für jeden SCCA-Standard durch den Spitzenbereich der Bestimmung für jede Konzentration der SCCA-Standards und Plotten Konzentration auf die xaxis vs. Peakfläche auf der y-Achse. Zeichnen Sie die lineare Regression für jede SCCA Standardkurve und bestimmen die Steigung der Gleichung (y = mx + b).
- Sicherzustellen , dass die R 2 Werte der linearen Regressionen sind 0,90 oder höher ist als die Quantifizierungen sind am genauesten in den linearen Bereich der Standardkurve durchgeführt.
- Berechnen der Säurekonzentration für eine gegebene SCCA in einer Probe die Peakfläche unter Verwendung von und die Steigung der Gleichung für die lineare Regressionslinie der Standardkurve (berechnet in 6.3.2 oben). Kurz gesagt, teilen die beobachtete Peakfläche für eine gegebene Säure durch die Steigung der Regressionsgeraden für diese Standardkurve der Säure.
- Korrigieren Sie die Rohwerte Konzentration berechnet in Schritt 6.4 für die Probenverlust während der Verarbeitung des internen Standards (Schritt 6.5) verwendet wird.
- Berechnen des Korrekturfaktors für jede Probe den internen Standard.
- Teilen Sie die aktuelle Konzentration des internen Standards (dh die known Wert zu Beginn des Experiments zugegeben) von dem beobachteten Wert des internen Standards in der Probe (dh die Menge der Steigungsgleichung der Standardkurve für den internen Standard berechnet). Multiplizieren die rohen Konzentrationswerte jedes SCCA in der Probe mit diesem Korrekturfaktor.
- Teilen Sie den internen Standard korrigiert SCCA-Konzentration durch die Masse der zur Extraktion verwendeten Probe für jede Veränderung der Probenmasse zu korrigieren. Diese Berechnung ergibt Menge an Analyt pro Masse der Probe (mg SCCA pro mg gemahlenem Kaffee in diesem Beispiel), die dann an die entsprechenden Einheiten für die gegebene Studie (mg / mg, mg / g überführt werden, g / g, usw. ).
- SCCA-Konzentrationen (normiert auf entweder die Masse [für feste oder flüssige Proben] oder Volumen [für flüssige Proben]), verwenden Sie diese Werte für die statistische Analyse gemäß den Anforderungen des experimentellen Design und Fragen von Interesse Nach der Berechnung.
- Using der CE - Steuerungssoftware, schreiben Sie die Probe laufenden Sequenz (dh den Arbeitsvorrat, um jede Probe zu trennen , um eine Liste Datei , um die Reihenfolge , in der detailliert die Proben analysiert werden, und das Verfahren verwendet werden) unter Verwendung der "Sequenz" Arbeitsblatt - Schnittstelle. Jede Zeile in der Tabelle wird zu einem Probelauf entsprechen und eine einzelne Datendatei erzeugen.
Ergebnisse
Dieses Protokoll wurde erfolgreich die Auswirkungen der Saatgutbehandlung auf dem SCCA-Gehalt von grünen Kaffeesamen zu messen verwendet. In diesem Experiment wurden die sechs Behandlungen: eine gesättigte Keimsuspension von Leuconostoc - Stamm GCP674 in ihrem Wachstumsmedium pseudomesenteroides (1), eine wässrige Suspension von GCP674 Mikroben in Wasser (2), eine wässrige Lösung von Essigsäure und Milchsäure (0,15 und 0,4 mg / ml) (3), ein M1 - Wachstumsmedium B...
Diskussion
Wie bei jeder analytischen Technik gibt es mehrere kritische Faktoren, die die Qualität und die Zuverlässigkeit der erzeugten Daten erheblich auswirken können. Erstens ist es wichtig Proben effizient zu verarbeiten, mit einem Minimum von Gefrier- / Tau-Zyklen. Wiederholtes Einfrieren und Auftauen können die chemische Zusammensetzung der Probe vor der Verarbeitung oder Analyse beeinträchtigen. Zweitens ist es wichtig, die Schritte des Protokolls für alle Proben konstant und gleichmäßig aufzubringen. Technische Fe...
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
The authors would like to acknowledge the financial support of this project by The J.M. Smucker company.
Materialien
| Name | Company | Catalog Number | Comments |
| Ceramic Moarter and Pestle | Coorstek | 60310 | |
| Beckman Coulter P/ACE MDQ CE system | Beckman Coulter | Various | |
| Glass sample vials | Fisher Inc. | 033917D | |
| 1.5 ml microcentrifuge tubes | Fisher Inc. | 02-681-5 | |
| LC/MS grade water | Fisher Inc. | W6-1 | Milli-Q water (18.2 MΩ.cm) is also acceptable |
| 15 ml glass tube/ Teflon lined cap | Fisher Inc. | 14-93331A | |
| Parafilm M | Fisher Inc. | 13-374-12 | |
| CElixirOA detection Kit pH 5.4 | MicroSolv | 06100-5.4 | |
| BD Safety-Lok syringes | Fisher Inc. | 14-829-32 | |
| 17 mm Target Syringe filter, PTFE | Fisher Inc. | 3377154 | |
| 32 Karat, V. 8.0 control software | Beckman Coulter | 285512 | |
| capillary electrophoresis (CE) sample vials | Beckman Coulter | 144980 | |
| caps for CE vials | Beckman Coulter | 144648 | |
| Liquid Nitrogen | N/A | N/A | Liquid nitrogen is available from most facilities services |
Referenzen
- Araújo, W. L., Nunes-Nesi, A., Nikoloski, Z., Sweetlove, L. J., Fernie, A. R. Metabolic Control and Regulation of the Tricarboxylic Acid Cycle in Photosynthetic and Heterotrophic Plant Tissues: TCA Control and Regulation in Plant Tissues. Plant Cell Environ. 35 (1), 1-21 (2012).
- Finkemeier, I., Konig, A. C., et al. Transcriptomic Analysis of the Role of Carboxylic Acids in Metabolite Signaling in Arabidopsis Leaves. Plant Physiol. 162 (1), 239-253 (2013).
- Doyle, M. P., Buchanan, R. . Food Microbiology: Fundamentals and Frontiers. , (2013).
- Tůma, P., Samcová, E., Štulìk, K. Determination of the Spectrum of Low Molecular Mass Organic Acids in Urine by Capillary Electrophoresis with Contactless Conductivity and Ultraviolet Photometric Detection-An Efficient Tool for Monitoring of Inborn Metabolic Disorders. Anal Chim Acta. 685 (1), 84-90 (2011).
- López-Bucio, J., Nieto-Jacobo, M. F., Ramı́rez-Rodrı́guez, V., Herrera-Estrella, L. Organic Acid Metabolism in Plants: From Adaptive Physiology to Transgenic Varieties for Cultivation in Extreme Soils. Plant Sci. 160 (1), 1-13 (2000).
- Cebolla-Cornejo, J., Valcárcel, M., Herrero-Martìnez, J. M., Rosellò, S., Nuez, F. High Efficiency Joint CZE Determination of Sugars and Acids in Vegetables and Fruits: CE and CEC. Electrophoresis. 33 (15), 2416-2423 (2012).
- Rosello, S., Galiana-Balaguer, L., Herrero-Martinez, J. M., Maquieira, A., Nuez, F. Simultaneous Quantification of the Main Organic Acids and Carbohydrates Involved in Tomato Flavour Using Capillary Zone Electrophoresis. J Sci Food Agr. 82 (10), 1101-1106 (2002).
- Wasielewska, M., Banel, A., Zygmunt, B. Capillary Electrophoresis in Determination of Low Molecular Mass Organic Acids. Int J Environ Sci Dev. 5 (4), 417-425 (2014).
- Galli, V., Garcìa, A., Saavedra, L., Barbas, C. Capillary Electrophoresis for Short-Chain Organic Acids and Inorganic Anions in Different Samples. Electrophoresis. 24 (1213), 1951-1981 (2003).
- Klampfl, C. W. Determination of Organic Acids by CE and CEC Methods. Electrophoresis. 28 (19), 3362-3378 (2007).
- Kenney, B. F. Determination of Organic Acids in Food Samples by Capillary Electrophoresis. J Chromatogr A. 546, 423-430 (1991).
- Galli, V., Barbas, C. Capillary Electrophoresis for the Analysis of Short-Chain Organic Acids in Coffee. J Chromatogr A. 1032 (1-2), 299-304 (2004).
- Schmitt-Kopplin, P. Capillary Electrophoresis: Methods and Protocols. Methods in Molecular Biology. , 384 (2008).
- Nollet, L. . Chromatographic analysis of the environment 3rd ed. , (2006).
- . . ElixerOA Organic Acids/Anions Operating and Instruction Manual, MicroSolv Technology Corperation. , (2001).
- Dahlen, J., Hagberg, J., Karlsson, S. Analysis of low molecular weight organic acids in water with capillary zone electrophoresis employing indirect photometric detection. Fresenius J. Anal. Chem. 366 (5), 488-493 (2000).
- Ibanez, A. B., Bauer, S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectroscopy. Biotech. For Biofuels. 7 (145), (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten