A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
באמצעות אלקטרופורזה נימים לכמת חומצות אורגניות מרקמות צמח: מקרה מבחן בחינה
In This Article
Summary
מאמר זה מציג שיטה איתור וכימות של חומצות אורגניות מחומר הצמח באמצעות אלקטרופורזה נימי אזורי חינם. דוגמא של יישום הפוטנציאל של שיטה זו, הקובע את ההשפעות של תסיסה משנית על רמות חומצה אורגניות זרעי קפה, מסופקת.
Abstract
חומצות קרבוקסיליות הן חומצות אורגניות המכילות carboxyl מסוף אחד או יותר (COOH) קבוצות פונקציונליות. קצר שרשרת חומצות קרבוקסיליות (SCCAs; חומצות קרבוקסיליות המכילות שלושה עד שישה פחמנים), כגון malate ציטראט, הן קריטיות לתפקוד התקין של מערכות ביולוגיות רבות, שבו הם מתפקדים נשימה תאית והוא יכול לשמש אינדיקטורים של בריאות תא. במזונות, תכולת חומצות אורגניות יכולה להיות השפעה משמעותית על טעם, עם רמות SCCA מוגברת וכתוצאה מכך טעם חמוץ או "חומצה". בגלל זה, שיטות לניתוח מהיר של רמות חומצה אורגנית הם בעלי עניין מיוחד לתעשיות המזון והמשקאות. למרבה הצער, עם זאת, רוב שיטות כימות SCCA תלויות פרוטוקולי זמן רבים המחייבים את derivatization של דגימות עם ריאגנטים מסוכנים, ואחריו chromatographic היקר ו / או ספקטרומטריה מנתח. שיטה זו מפרט שיטה חלופית עבור איתור וכימות של orgחומצות anic מחומר צמח דגימות מזון באמצעות אלקטרופורזה נימי אזורים חינם (CZE), לפעמים פשוט המכונות אלקטרופורזה נימים (CE). CZE מספק שיטה חסכונית למדידת SCCAs עם הגבלה נמוכה של גילוי (0.005 מ"ג / מ"ל). מאמר זה מפרט את המיצוי וכימות SCCAs ממדגמים צמח. בעוד השיטה ספקה מתמקדת מדידת SCCAs מפולי קפה, השיטה הניתנת ניתן ליישם חומרי מזון על בסיס צמחי מרובים.
Introduction
Carboxylic acids are organic compounds containing one or more terminal carboxyl functional groups, each attached to an R-group containing one or more carbons (R-C[O]OH). Short chain, low molecular weight carboxylic acids (short chain carboxylic acids, SCCAs) containing between one and six carbons, are essential components of cellular respiration, and function in several biochemical pathways necessary for cell growth and development. SCCAs play critical roles in cellular metabolism1, cell signaling2, and organismal responses to the environment (such as antibiosis3). Because of this, SCCAs can serve as useful indicators of disruptions to cellular metabolism, plant stress responses4,5, and fruit quality6,7. To date, SCCAs have been quantified primarily through chromatographic techniques such as high performance liquid chromatography (HPLC) or gas chromatography-mass spectroscopy (GC-MS). While these methods, are capable of achieving very low limits of detection, they can be expensive, require the derivatization of target SCCAs using caustic and/or toxic reagents, and include lengthy separation runs on the GC or HPLC. Because of this, interest in the use of free zonal capillary electrophoresis (CZE), which does not require sample derivatization, to quantify organic acids has steadily increased8.
Free zonal capillary electrophoresis (CZE) is a chromatographic separation methodology that, due to its high number of theoretical plates, speed, and relative ease-of-use, is increasingly replacing both GC-MS and high-pressure liquid chromatography as an analytical method for the quantification (particularly for quality control purposes) of anions, cations, amino acids, carbohydrates, and short chain carboxylic acids (SCCAs)8,9,10. CZE-based separation of small molecules, including SCCAs, is based two primary principles: the electrophoretic movement of charged ions in an electrical field established across the buffer filling the capillary; and the electro-osmotic movement of the entire buffer system from one end of the capillary to the other, generally towards the negative electrode. In this system, small molecules move towards the negative electrode at varying speeds, with the speed of each molecule determined by the ratio of the net charge of the molecule to the molecular mass. As the movement of each individual molecule in this system is dependent on the charge state of the molecule and the overall rate of electro-osmotic flow (which is itself based on the ion content of the buffer used to fill the capillary), the buffer pH and ionic composition heavily impact the degree to which molecules can be efficiently separated using CZE. Because of this, SCCAs, with their relatively high charge-to-mass ratios, are ideal targets for CZE-based separation. Metabolites separated using CZE can be detected using a variety of methods, including UV absorbance, spectral absorbance (which is generally performed using a photo-diode array [PDA]), and/or mass spectroscopy (CE-MS or CE-MS/MS)8. The diversity of separation and detection methods provided by CZE makes it an extremely flexible and adaptable technique. Because of this, CZE has been increasingly applied as a standard method of analysis in the areas of food safety and quality11,12, pharmaceutical research13, and environmental monitoring13,14.
Capillary electrophoresis has been used to detect and quantify short chain carboxylic acids for nearly two decades13. The resolving power (particularly for small, charged molecules), short run time, and low per sample cost of CZE analyses make CZE an ideal technique for the separation and quantification of SCCAs13. This method presents a protocol to utilize CZE to measure the concentration of organic acids from plant tissues. Example data was generated through the successful implementation of this protocol to measure the change in organic acid levels in coffee seeds following a secondary fermentation treatment. The protocol details the critical steps and common errors of CZE-based separation of SCCAs, and discusses the means by which this protocol can be successfully applied to quantify SCCAs in additional plant tissues.
Protocol
לדוגמא הכנה 1.
- להרכיב דגימות עבור חומצה קרבוקסילית שרשרת קצרה (SCCA) החילוץ. כן 1.0 גרם של זרעי קפה בכל פעם, כדי להבטיח מדגם זה מספיק יישאר לאחר עיבוד.
- אם דגימות הוקפאו לפני תהליך הטחינה, לשמור על הרקמה הקפואה בכל עיבוד כדי למנוע נזק ההקפאה / הפשרה וחמצון המדגם. הסר את המדגם מתוך האחסון במקפיא או מתחת לאפס רק לפי צורך לטחינה.
- פלאש להקפיא דגימות טריות בחנקן נוזל ערב לטעום טחינה. כדי למזער טיפול מדגם, דגימות להקפיא פלאש ידי הצבתם במכתש מראש מלאים בחנקן נוזלי.
- ניתוח דגימות נוזל מיד לאחר הדור, או להקפיא פלאש בחנקן נוזלי ולאחסן ב -20 ºC או -80 ºC עד הניתוח. לפני הניתוח, להסיר דגימות קפואות מהאחסון ולאפשר להפשיר. לקבלת דוגמיות נוזלת המשך לשלב (3.5) לעיבוד.
- תלבש approציוד מגן אישי priate (כולל משקפי מגן, כפפות וחלוק מעבדה) לפני עבודה עם חנקן נוזלי.
- דגימות רקמה Triple-לטחון לאבקה דקה באופן אחיד (כלומר, של גודל החלקיקים אחיד) בחנקן נוזלי באמצעות ובמכתש קרמיקה.
הערה: השגת גודל חלקיקים אחיד חיונית למקסום יעיל מיצוי SCCA.- טרום לצנן את ובמכתש עם חנקן נוזלי לפני התוספת של המדגם. שמור על המרגמה מלאת נפח קטן של חנקן נוזלי כמו המדגם הוא הוסיף.
- בעזרת מצקת, להוסיף חנקן נוזלי מספיק כדי המדוכה כדי להטביע את המדגם לחלוטין.
- להוסיף דגימות קרקע בקלות, כגון עלים או קפה קלוי, אל החנקן הנוזלי ולרסק בתנועות ליטוש מעגליות. בגין לטחון דגימות כאשר רמת החנקן הנוזלת ירד עד לנקודה שבה זה רק בקושי מכסה את הדגימות.
- הוסף קשה לטחון דגימות, כזהזה זרעי קפה גולמיים, חנקן נוזלי ולאפשר להם להקפיא למשך 10-30 שניות (או עד החנקן הנוזלי מפסיק הרותחים במרץ) לפני הטחינה. לשבור את הרקמה לרסיסים קטנים בתנועות ריסוק אנכיות, ולאחר מכן רקמה שלמה שחיקה בתנועות ליטוש מעגליות.
- חזור על שלבים 1.3.2-1.3.4 עוד פעמיים, כך דגימות הקרקע בסך הכל שלוש פעמים. בדרך כלל, שלושה סיבובים רצופים של שחיקה יפחיתו דגימות לאבקה עם עקביויות קמח דמוי.
- אם עקביויות קמח דמוי אינה מושגות, חזור על שלבי 1.3.2-1.3.4 עד דגימות מופחתות לאבקה של גודל חלקיקים קטן באופן אחיד (יעילות מיצוי עומדת ביחס הפוך לגודל חלקיקים).
- העבר אבקת צלוחיות זכוכית או 1.5 מ"ל צינורות microcentrifuge. ליזום עיבוד במורד זרם מייד לאחר שחיקה (מומלץ), או דגימות חנות ב -80 ºC עד דגימות מוכנות חילוץ.
- אם דגימות חייבות להיות מאוחסנות לפניניתוח, לפצל את המדגם לתוך 500 aliquots מ"ג (או 500 aliquots μl עבור דגימות נוזלות) ולפצל בין צינורות מרובים לאחסון. אל תחשפו את דגימות מחזורים להקפיא / להפשיר שוב, כמו אלה עשויים לשנות רכב מדגם ולהשפיע לרעה על מדידות מדגם בעתיד.
2. הכנת התקן חומצה אורגנית
- להרכיב סטנדרטים אותנטיים עבור SCCAs עניין. אלה ישמשו כדי ליצור פתרונות סטנדרטיים חיצוניים ופנימיים לשימוש בקביעת ריכוזי SCCA. לקבלת דוגמיות קפה כוללות לימון, מאלית, חומצה אצטית, וחומצה לקטית כמו חומצות עניין וחומצת adipic כתקן הפנימי.
- ודא בטוח כי התקן הפנימי רצוי לא יאותר טבעי במדגם, וכי התקן אינו לשתף elute עם פסגות אחרות בפרופיל המדגם.
- הפעל עקומות סטנדרטיות לכל SCCA של עניין, ולקבוע טווח התגובה ליניארי לכל SCCA (ראה סעיף 4 להפעלת Instמהומה גדולה). הקפד להפעיל עקומות סטנדרטיות לכל SCCA להימדד המדגם.
הערה: עקומות סטנדרטיות ניתן לרוץ או חיץ או ברקע של המדגם להיות assayed. במקרה השני ( "בנוסף תקן"), ערכים עבור אזור השיא של כל נקודה עקומה סטנדרט ייקבעו על ידי הפחתה משם ברקע של המדגם. - טרום תווית כל צינורות זכוכית צורך עם שם SCCA החומצה, ריכוז, ואת התאריך של assay.
- הכינו פתרונות המניות עבור כל תקן בריכוז ידוע (10 מ"ג / מ"ל) באמצעות בקבוק מדידה כדי להבטיח דיוק במהלך הכנת תקן.
- ממיסים סטנדרטים SCCA מוצק (חומצת לימון וחומצה מאלית) במים ultrapure (18.2 MΩ) כדי להשיג את הריכוז הרצוי עבור פתרון המניות.
- צור פתרון המניה 10 מ"ג / מ"ל על ידי הוספת 100 מ"ג לסטנדרטים בבקבוק נפח 10 מ"ל. מלאו את הבקבוק volumetric לקו 10 מ"ל עם מים ultrapure דissolve החומצה.
- צור ריכוז נמוך יותר לסטנדרטים חומצה או בעדינות לחמם את צלוחיות לנהוג קשות לפזר סטנדרטים SCCA, כמו חומצה adipic, אל הפתרון.
- לדלל סטנדרטי חומצת שלב נוזלי (חומצה אצטית וחומצה לקטית) במי ultrapure כדי להשיג את הריכוז הרצוי.
- טרום למלא בקבוק מדידה עם 5 מ"ל מים ultrapure. הוסף מספיק חומצה להכין פתרון 10 מ"ג / מ"ל (מחושב לפי צפיפות חומצה הניתנים על ידי הספק) אל הבקבוק, ולאחר מכן להוסיף מספיק מים כדי להביא את הנפח הסופי של הפתרון 10 מ"ל.
- ממיסים סטנדרטים SCCA מוצק (חומצת לימון וחומצה מאלית) במים ultrapure (18.2 MΩ) כדי להשיג את הריכוז הרצוי עבור פתרון המניות.
- העברת כל מניות פתרון לצינור זכוכית נקי 15 מ"ל, עם polytetrafluoroethylene (PTFE) מצופה כובע, ואת החותם עם הסרט פרפין פלסטיק. ניתן לאחסן פתרונות מניות צינורות אטומים 4 ºC עבור 1 בשבוע.
- ודא כי הסטנדרטים SCCA לא זירז מתוך פתרון לפני השימוש אם פתרונות המניות כבר בקירור לאחר preparation. כונן משקעים בחזרה פתרון באמצעות חימום עדין.
- הכן את פתרון חילוץ SCCA. כלול את תקן פנימי בריכוז מספיק לגילוי בדגימות (0.05 מ"ג / מ"ל). כן פתרון מספיק כדי לחלץ את כל הדגימות.
- הכן 50 מ"ל של תמיסת מיצוי SCCA על ידי דילול פתרון המניות תקן פנימי 0.05 מ"ג / מ"ל מים ultrapure. הוסף 250 μl של פתרון המניות תקן פנימי (10 מ"ג / מ"ל) ל 49.75 מ"ל מים.
- אם לחלץ צריך להיות מדולל, להתאים את ריכוז התקן הפנימי בפתרון החילוץ כך את הריכוז הסופי ייפול בגבולות כימות (נותן לזיהוי, אבל לא יותר מדי רווי, שיא, ראה 5.2.2 להלן) של מערכת CE לאחר דילול (0.05 מ"ג / מ"ל).
- כן פתרון חילוץ טרי עבור כל סדרה של עקירות (כלומר, עבור כל סדרה ניסיון).
- הכן דגימות עקומות סטנדרט(סדרה של דילולים מתאימים) עבור SCCAs של עניין, באמצעות מינימום של 5 נקודות לפחות. הריכוזים העקומים הסטנדרט המועסק יצטרכו להיות בטווח בתגובה ליניארית עבור SCCA נתון, היקף ריכוזי SCCA הצפוי בדגימות.
- כלול את התקן הפנימי נבחרי הפתרונים העקומים הסטנדרט לאפשר כימות של התקן הפנימי בדגימות. ההתקן הפנימי ישמש כדי לסייע בזיהוי שיא ויעילות חילוץ חישוב (סעיף 6).
- לדלל כל SCCA הריכוזים נקבעו לעיל (0.01, 0.02, 0.04, 0.06, 0.08 מ"ג / מיליליטר; ראה לעיל, 2.4.2) צינורות microcentrifuge חדשות (אחת עבור כל נקודה עקומה ריכוז / רגילה) באמצעות מי ultrapure. כן 1 מיליליטר של תמיסה לכל נקודת ריכוז עקום סטנדרט. ודא שכל נקודת ריכוז מכילה את כל ארבעת תקני חומצה ואת התקן הפנימי בריכוז הנכון.
- כן נקודות עקומות סטנדרט חדשים עבור כל קבוצהדגימות שיופעלו על מערכת אלקטרופורזה נימים. החזק את דגימות התקן העקום SCCA ב 4 ºC עד לניתוח, אשר תתרחש בעקבות החילוץ של SCCAs מרקמות היעד (סעיף 3).
3. הפקת חומצה אורגנית
- דוגמיות טרום תווית, הכנת צינור אחד לפחות עבור כל דגימה להיעקר.
- הסר דגימות להיות מופקות אחסון ומניח אותם על קרח תוך שקיל את חומר עבור חילוץ.
- תשקול 100 מ"ג של מדגם להפקת SCCA.
- לאחר שקילת כל דגימה, העברת רקמות צינור 1.5 מ"ל microcentrifuge נקי. מדוד את כמות של מדגם קרובה ככל למסת היעד ככל האפשר כדי להפחית השתנות.
- עקוב אחר של המסה של כל דגימה הנמדדת, לפי סכומי SCCAs זוהה יהיו מנורמלים באמצעות מסת המדגם (ראה 6.5.2, להלן).
- לאחר שקילת כל הדגימות, להוסיף 1 מ"ל של תמיסת מיצוי (להלן water + תערובת תקן פנימי משלב 2.4) לכל אחד מן דוגמיות. שמור את היחס של פתרון חילוץ מסת רקמה הזהה בכל העקירות (במקרה זה 1 מיליליטר 100 ± 5 רקמות מ"ג). מערבבים היטב על ידי מערבולת עבור 10 שניות.
- אפשר דגימות לשבת בטמפרטורת החדר למשך שעה 1. במהלך שעה זו, לערבב כל צינור כל 15 דקות כמו בשלב 3.4.
- אחרי שעה 1 של מיצוי, לערבב את דגימות בפעם האחרונה ולהעביר דוגמיות על microcentrifuge. צנטריפוגה דגימות ב 4 ° C, XG 10,000 במשך 10 דקות כדי לזרז חומר מוצק (קירות תא, חומר חלקיקים, וכו ').
- כאשר עיבוד דגימות נוזלי, מוסיפים את הריכוז המתאים של תקן פנימי, לערבב בקצרה צנטריפוגות. לאחר צנטריפוגה, לטפל דגימות נוזל זהה לחלץ מן הדגימות מוצקות.
- בדוק את ה- pH של דגימות כדי לוודא שהם עולים בקנה אחד עם טווח ה- pH של למאגר פועל בערכה זיהוי (שלב 4.6) או חיץ מערכת להיות EMPloyed. כמו הכרכים של מדגם הם בדרך כלל די קטנים, pH ניתן לנטר באמצעות נייר pH.
- היכון לסנן דגימות באמצעות מסנני דיסק רכוב מזרק (3.8).
הערה: מנע אובדן מדגם ידי הבטחה שכל מסנן מחובר כהלכה מזרק לפני העברת supernatant. הכין מזרק אחד המצוידת במסנן דיסק עבור כל דגימה להיות מנותחת (כולל דגימות עקומות סטנדרט). - לאחר צנטריפוגה של דגימות והכנת מסננים מזרק, להעביר את supernatant מכל מדגם מזרק 3 מ"ל המצוידת במסנן מזרק 0.2 מיקרומטר. שימוש במסנן מזרק חדש עבור כל דגימה. לסנן את כל הדגימות, כולל דגימות עקומות סטנדרט ובקרות חיץ, לפני פועל על מערכת CE.
- סנן את המדגם ישירות לתוך צינור microcentrifuge נקי. לאחר סינון, לסגור את התסנין המכיל צינור וזורקי מנגנון המזרק / פילטר.
- מיד למקום דגימות מסונניםלמערכת CE לגילוי SCCA; או דגימות חנות ב 4 מעלות צלזיוס למשך הלילה. אם דגימות הן להיות מאוחסן לילה, לאטום את הצינורות עם סרט פרפין פלסטיק כדי למנוע חילופי גזים ואידוי מדגם.
- אם דגימות חייבות להיות מאוחסנות כבר מיממה לאחר סינון, תמציות להקפיא פלאש בחנקן או הקפאת נוזלי ב -20 ºC. לאחר ההפשרה, לעומת זאת, להבטיח כי כל דגימה נבחנת להיווצרות המשקע ולסנן במידת הצורך (כמו בשלב 3.6).
4. הגדרת הפעלת איתור SCCA
- התייעץ במדריך למשתמש CE לפרטי programming- ובקרו תוכנות ספציפיות.
- כן אלקטרופורזה נימים (CE) בקבוקונים מדגמים לגילוי SCCA. ודא בקבוקונים מסומנים כראוי, נקי, ללא פגמים.
- לשטוף ולייבש את הכמוסות של בקבוקוני CE לפני השימוש.
- לשטוף כמוסות על ידי השריית אותם במים ultrapure ומאפשר להם להשרות לילה. לאחר השריית כובעים, לבטל את להשרותing פתרון ולשטוף את הפקקים עוד פעמים עם מי ultrapure.
- העברת שטופי כמוסות משטח ייבוש נקי בשורה עם רקמת מוך ללא ולאפשר להם אוויר יבש. ודאו כמוסות יבשות לחלוטין לפני השימוש כדי למנוע כשלי לחץ.
- העבר 1 מ"ל של המדגם לכל בקבוקון CE, להיות זהיר, כדי למנוע מתיז המדגם בטעות לתוך הצוואר של הבקבוקון. לאחר ההעברה, למקם כובע CE על כל בקבוקון.
- אם דילול נדרש, לדלל את דגימות זרע קפה 1:10 או 1: 100 ישירות בבקבוקון CE באמצעות מי ultrapure. עבור דילולים גדולים מ -1: 100, ליצור דילול ביניים כדי למנוע שגיאות pipetting.
- הכן בקבוקון אחד עבור כל נקודה עקומה סטנדרט ידי העברת פתרונות עקומים סטנדרט (1.0 מיליליטר) משלב 2.5 כדי בקבוקוני CE. כיסוי או כל צינור לאחר ההעברה.
- כן 0.1 M פתרון של נתרן הידרוקסידי (NaOH) על ידי הוספת 0.04 גרם של NaOH כדי כוס המכילה 90 מיליליטר מי ultrapure ולאפשר t הכדורo לפזר. מעבירים את הפתרון M NaOH 0.1 בבקבוק נפח 100 מ"ל ולהביא את הנפח הכולל עד 100 מ"ל.
- הוסף 1 מ"ל של 0.1 פתרון M NaOH בקבוקון וכובע CE נקי.
- הכין בקבוקוני חיץ CE עבור כל אצווה של דגימות שיופעל על מערכת CE. ערכות הפרדה זמינות או 13 יכול לשמש מאגרים מותאמים אישית.
- הכן 1 בקבוקון עם 1 מ"ל של החל פתרון חיץ וכובע.
- הכן שלוש צלוחיות עם 1 מ"ל כל אחד פועל פתרון חיץ וכובע. חלף למאגר פועל לפני כל אצווה של דגימות ונקודות עקומות סטנדרטיות, או לאחר 35 דגימות, מוקדמים מבין שתיים.
- מלאו שלוש צלוחיות נוספות עם 1 מיליליטר מי ultrapure וכובע בקבוקון אחד.
- כן 1 בקבוקון ריק "פסולת" עם כובע.
- לאחר הכנת הצלוחיות כמתוארות בשלב 4.8, לטעון את הבקבוקונים המכילים מאגרי מים, כמו גם את הצלוחיות הפסולות (בצעדיו 4.8.2-5) למגש החיץ של sys אלקטרופורזה הנימיםTEM, לפי הוראות יצרן 15. בזהירות לציין את המיקום של כל בקבוקון עבור תכנות אוטומטי סמפלר.
- טען את הבקבוקונים המכילים את הנקודות עקומות סטנדרט ואת הבקבוקונים המכילים דגימות להיות assayed למגש מדגם הכניסה, כמתואר הוראות היצרן. הערה המיקום של כל בקבוקון עבור תכנות אוטומטי סמפלר (ראה צעדים 4.11.1 להלן).
- הכין מיזוג ושיטות הפרדה מדגמות (תוכניות אלה ניתנות בלוחות 1 ו -2, בהתאמה), ולכתוב קובץ רצף מדגם לפי הוראות הפעלה מכשירות. השתמש בשיטת ההפרדה המפורטת בטבלה 2: לשטוף את העמודה עם יוזם (20 psi) עבור 0.2 דקות; לשטוף עם מאיץ (20 psi) עבור 0.5 דקות, להזריק דגימות (0.5 psi) על הטור עבור 0.09 דקות, דגימות נפרדות 20 קילו וולט עבור 12 דקות, לשטוף עם NaOH (20 psi) עבור 0.5 דקות, ולבסוף לשטוף עם מים ( 20 psi) עבור 0.5 דקות.
- Using תוכנות שליטה CE, לכתוב את רצף פועל מדגם (כלומר, worklist; קובץ רשימה המפרטת את הסדר שבו הדגימות תיבדקנה, והשיטה לשמש כדי להפריד כל דגימה) באמצעות ממשק גיליון "רצף". כל שורה בגיליון האלקטרוני תתאים ריצה מדגם והפקת קובץ נתונים יחיד.
- ודא כי בעת כתיבת קובץ הרצף, דגימות מזוהות באמצעות המיקום הנכון במגש הדגימה. ודא כי כל קובץ נתונים יש שם ייחודי כדי למנוע מהתוכנה להחליף קבצים קודמים. תוכנית CE ריצות מיזוג נימי כרצף נפרד לפני בטווח רצף המכיל את שיטת ההפרדה המדגם.
- בגין רצף המדגם לרוץ עם הפתרונים העקומים סטנדרט, ואחריו דגימות SCCA, ולסיים עם סיבוב שני של הפתרונים העקומים סטנדרט. זה יאפשר חישוב של מידת אובדן אות המתרחשים במהלך מדגם המנתח.

טבלה 1: בתכנית שיטת מיזוג המשמשת להכנת הנימים להפרדת חומצה קצרה שרשרת קרבוקסיליות דרך נימי אלקטרופורזה א.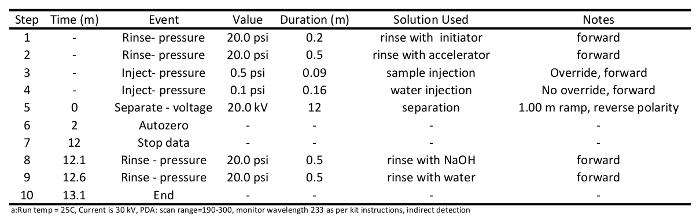
טבלה 2: תכנית שיטת הפרדה נהגה מנתח חומצות קרבוקסיליות שרשרת קצרה דרך נימי אלקטרופורזה א.5. ביצוע SCCA איתור הפעלה ואיסוף נתונים
- ליזום ריצות מיזוג נימים. צפו להתנות את נימי פעמיים או שלוש לפני הטור מוכן ההפרדה המדגם. מיזוג טור צריך להתבצע כפי שמתואר בטבלה 1. בקצרה, לשטוף טור עם 0.1 M NaOH (20 psi) 1 דקות, לשטוף עם מים (20 psi) עבור1 דקות, לשטוף עם יוזם (20 psi) עבור 0.5 דקות, לשטוף עם מאיץ (20 psi) עבור 0.5 דקות, מאיץ נפרד ליום 30 קילו וולט עבור 10 דקות, לשטוף טור עם 0.1 M NaOH (20 psi) עבור 0.5 דקות, ולבסוף לשטוף את העמודה עם מים (20 psi) עבור 0.5 דקות.
- להתנות את הנימים לפני כל ריצה ברצף מדגם. להשיג מיזוג ראוי על ידי שמירה על מתח ההפרדה הוא קבוע לאורך כל הריצה ולשמור על בסיס שטוח על עקבות photodiode המערך.
- לאחר מיזוג, ליזום הפרדה מדגם ידי פתיחת התפריט "שליטה" התוכנה ובחירה (כלומר, לחיצה על) "רצף לרוץ." צג photodiode המערך (PDA) עקבות כדי להבטיח הפרדה נאותה.
- שים את העקבות הראשונות ולהבטיח כי יש לו בסיס שטוח נפתר בצורה נקיה (רזולוצית בסיס), פסגות חומצת פרט. יתר טעון דגימות יראה זנבות שיא ארוך, או עוקב השיא, ויהיה צריך להיות דליל (איור 1).

איור 1:. מהשוואת PDA עקבות הדגשת מדגם עמוס כפי שעולה ריכוז אנליטי, גיאומטרית שיא אישה יכולה להתחיל להיות סימטרי. ב (א) 0.05 מ"ג / מ"ל, חומצה אצטית מציגה שיא מוגדרים היטב, בילטרלי סימטרי. ככל ריכוז של עליות חומצה אצטית (ב) 0.07 מ"ג / מ"ל ו (ג) 0.10 מ"ג / מ"ל, צורות זנב השיא (חיצים). עוקב שיא זה מהווה אינדיקציה טובה כי המדגם עמוס. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.- בסיום ריצת הרצף, לפתוח את קבצי נתונים אחד בכל פעם בתוכנת ניתוח CE ולשלב את הפסגות.
- שלב פסגות מדגמות.
- פתח את הקובץ הראשוןולהגדיר את צעדי אינטגרציה האוטומטיים להוציא את דקות 3 הראשונות של הריצה (שבו המתח, ולכן כיוון זרימת טור, הוא הפוך כמתוארים בטבלה 1). באותה תפריטים, להגדיר קריטריונים לבחירת שיא לרוחב שיא מינימום של 50 יחידות ו אזור שיא של 100 יחידות (או את הגדרות ברירת המחדל של היצרן) כדי לספק רמה גבוהה יחסית של סלקטיביות, הפרדת פסגות חומצה מרעש רקע העקבות.
- ידני לבדוק גבולות שיא ערכי בסיס לכל שמץ PDA כדי להבטיח אינטגרצית שיא נכונה. פסגות משולבות אינו נאות (כלומר, לשיא SSCA סימטרי מעט כי כבר משולב כמו שני שיאים נפרדים על ידי התוכנות האוטומטיות) יהיה צורך מחדש משולבות באופן ידני.
- שלב פסגות מדגמות.
- לאחר אינטגרציה, להציג את דוח אזור אחוזים, ואז לסמן ולהעתיק את דו"ח אזור האחוזים ולהדביק אותו לתוך גיליון אלקטרוני נפרד. חזור על הפעולה עבור כל דגימה כדי לבנות את repor השיא מלא בטווחt עם כל שורה המייצגת שיא יחיד (כלומר., שיא כל צריך מכיל תרכובת אחת אם ההפרדה עובדת היטב).
6. ניתוח נתונים
- הכן את הנתונים לניתוח באמצעות הגיליון האלקטרוני שנבנה (5.4). בגין ניתוח על ידי תיוג בסטנדרטי החומצה עבור כל אחת מן הנקודות העקומות הסטנדרטיות, כולל התקן הפנימי.
- חישוב מדד בשייר שיא כל על ידי חלוקת זמן שמירה על שיא כל במדגם ידי זמן השמירה של התקן הפנימי במדגם זה. מיין את הנתונים שקבעו מדד השמירה וכתוצאה מכך לזהות פסגות עניין מדגם זה.
- לאחר זיהוי השיא עבור כל חומצת עניין, לבנות עקומות סטנדרטיות עבור כל חומצה באמצעות נקודות עקומות סטנדרט החיצוניות.
- צור עקומת סטנדרט (ריכוז) עבור כל תקן SCCA ידי קביעת אזור השיא עבור כל ריכוז של סטנדרטים SCCA, והתוויית ריכוז על XAxis לעומת אזור השיא על ציר ה- y. עלילת רגרסיה ליניארית לכל עקומת SCCA רגילה והגדר את משוואת המדרון (y = mx + b).
- ודא שערכי R 2 של רגרסיה לינארית הם 0.90 ומעלה כמו quantifications מבוצעות בצורה המדויקת ביותר בטווח הליניארי של עקומת הסטנדרט.
- חשב את ריכוז החומצה עבור SCCA נתון מדגם באמצעות אזור השיא ומשוואת מדרון עבור קו רגרסיה ליניארית של עקומת סטנדרט (המחושב 6.3.2 לעיל). בקצרה, לחלק את אזור השיא הנצפה עבור חומצה שנתן שיפוע קו הרגרסיה עבור עקומת סטנדרט של כי חומצה.
- תקן את ערכי ריכוז הגלם מחושבים בשלב 6.4 עבור אובדן מדגם במהלך העיבוד באמצעות התקן הפנימי (שלב 6.5).
- חשבתי את גורם התיקון עבור כל דגימה באמצעות התקן הפנימי.
- מחלק את ריכוז בפועל של התקן הפנימי (כלומר, known כמות הוסיפה בתחילת הניסוי) על ידי הערך הנצפה של התקן הפנימי במדגם (כלומר, הסכום המחושב באמצעות משוואת השיפוע העקום הסטנדרטי עבור התקן הפנימי). הכפל את ערכי ריכוז הגלם של כל SCCA במדגם ידי גורם התיקון הזה.
- מחלק את התקן הפנימי תקן ריכוז SCCA על ידי המסה של המדגם המשמש להפקה לתקן כל וריאציה במסת מדגם. חישוב זה מניב כמות אנליטי לכל המוני של המדגם (מ"ג SCCA לכל מ"ג קפה טחון בדוגמה זו), אשר לאחר מכן ניתן להמיר ליחידות המתאימות לחקר נתון (מ"ג / מ"ג, מ"ג / g, g / g, וכו ' ).
- לאחר חישוב ריכוזי SCCA (מנורמל או המסה [עבור דגימות מוצקות או נוזלים] או הנפח [עבור דגימות נוזל]), להשתמש בערכים אלה לניתוח סטטיסטי על פי הדרישות של תכנון הניסוי ושאלות של עניין.
- Using תוכנות שליטה CE, לכתוב את רצף פועל מדגם (כלומר, worklist; קובץ רשימה המפרטת את הסדר שבו הדגימות תיבדקנה, והשיטה לשמש כדי להפריד כל דגימה) באמצעות ממשק גיליון "רצף". כל שורה בגיליון האלקטרוני תתאים ריצה מדגם והפקת קובץ נתונים יחיד.
תוצאות
פרוטוקול זה נוצל בהצלחה למדוד את ההשפעות של טיפולים זרע על תוכן SCCA של זרעי קפה ירוקים. בניסוי זה, ששת הטיפולים היו: השעית חיידקים רוויה של Leuconostoc pseudomesenteroides GCP674 זן במדיום הגידול שלה (1), השעיה מימית של GCP674 חיידקים במים (2), בתמיסה מימית של אצטית וחומ?...
Discussion
כמו בכל שיטה אנליטית, ישנם מספר גורמים קריטיים שיכולים להשפיע על איכות ואמינות משמעותית של נתונים שנוצר. ראשית, חשוב לעבד דגימות ביעילות, עם מינימום של מחזורי הקפאה / פשרה. חוזרות הקפאה להפשרה יכולים לסכן את ההרכב הכימי של המדגם לפני עיבוד או ניתוח. שנית, חשוב ליישם את ...
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The authors would like to acknowledge the financial support of this project by The J.M. Smucker company.
Materials
| Name | Company | Catalog Number | Comments |
| Ceramic Moarter and Pestle | Coorstek | 60310 | |
| Beckman Coulter P/ACE MDQ CE system | Beckman Coulter | Various | |
| Glass sample vials | Fisher Inc. | 033917D | |
| 1.5 ml microcentrifuge tubes | Fisher Inc. | 02-681-5 | |
| LC/MS grade water | Fisher Inc. | W6-1 | Milli-Q water (18.2 MΩ.cm) is also acceptable |
| 15 ml glass tube/ Teflon lined cap | Fisher Inc. | 14-93331A | |
| Parafilm M | Fisher Inc. | 13-374-12 | |
| CElixirOA detection Kit pH 5.4 | MicroSolv | 06100-5.4 | |
| BD Safety-Lok syringes | Fisher Inc. | 14-829-32 | |
| 17 mm Target Syringe filter, PTFE | Fisher Inc. | 3377154 | |
| 32 Karat, V. 8.0 control software | Beckman Coulter | 285512 | |
| capillary electrophoresis (CE) sample vials | Beckman Coulter | 144980 | |
| caps for CE vials | Beckman Coulter | 144648 | |
| Liquid Nitrogen | N/A | N/A | Liquid nitrogen is available from most facilities services |
References
- Araújo, W. L., Nunes-Nesi, A., Nikoloski, Z., Sweetlove, L. J., Fernie, A. R. Metabolic Control and Regulation of the Tricarboxylic Acid Cycle in Photosynthetic and Heterotrophic Plant Tissues: TCA Control and Regulation in Plant Tissues. Plant Cell Environ. 35 (1), 1-21 (2012).
- Finkemeier, I., Konig, A. C., et al. Transcriptomic Analysis of the Role of Carboxylic Acids in Metabolite Signaling in Arabidopsis Leaves. Plant Physiol. 162 (1), 239-253 (2013).
- Doyle, M. P., Buchanan, R. . Food Microbiology: Fundamentals and Frontiers. , (2013).
- Tůma, P., Samcová, E., Štulìk, K. Determination of the Spectrum of Low Molecular Mass Organic Acids in Urine by Capillary Electrophoresis with Contactless Conductivity and Ultraviolet Photometric Detection-An Efficient Tool for Monitoring of Inborn Metabolic Disorders. Anal Chim Acta. 685 (1), 84-90 (2011).
- López-Bucio, J., Nieto-Jacobo, M. F., Ramı́rez-Rodrı́guez, V., Herrera-Estrella, L. Organic Acid Metabolism in Plants: From Adaptive Physiology to Transgenic Varieties for Cultivation in Extreme Soils. Plant Sci. 160 (1), 1-13 (2000).
- Cebolla-Cornejo, J., Valcárcel, M., Herrero-Martìnez, J. M., Rosellò, S., Nuez, F. High Efficiency Joint CZE Determination of Sugars and Acids in Vegetables and Fruits: CE and CEC. Electrophoresis. 33 (15), 2416-2423 (2012).
- Rosello, S., Galiana-Balaguer, L., Herrero-Martinez, J. M., Maquieira, A., Nuez, F. Simultaneous Quantification of the Main Organic Acids and Carbohydrates Involved in Tomato Flavour Using Capillary Zone Electrophoresis. J Sci Food Agr. 82 (10), 1101-1106 (2002).
- Wasielewska, M., Banel, A., Zygmunt, B. Capillary Electrophoresis in Determination of Low Molecular Mass Organic Acids. Int J Environ Sci Dev. 5 (4), 417-425 (2014).
- Galli, V., Garcìa, A., Saavedra, L., Barbas, C. Capillary Electrophoresis for Short-Chain Organic Acids and Inorganic Anions in Different Samples. Electrophoresis. 24 (1213), 1951-1981 (2003).
- Klampfl, C. W. Determination of Organic Acids by CE and CEC Methods. Electrophoresis. 28 (19), 3362-3378 (2007).
- Kenney, B. F. Determination of Organic Acids in Food Samples by Capillary Electrophoresis. J Chromatogr A. 546, 423-430 (1991).
- Galli, V., Barbas, C. Capillary Electrophoresis for the Analysis of Short-Chain Organic Acids in Coffee. J Chromatogr A. 1032 (1-2), 299-304 (2004).
- Schmitt-Kopplin, P. Capillary Electrophoresis: Methods and Protocols. Methods in Molecular Biology. , 384 (2008).
- Nollet, L. . Chromatographic analysis of the environment 3rd ed. , (2006).
- . . ElixerOA Organic Acids/Anions Operating and Instruction Manual, MicroSolv Technology Corperation. , (2001).
- Dahlen, J., Hagberg, J., Karlsson, S. Analysis of low molecular weight organic acids in water with capillary zone electrophoresis employing indirect photometric detection. Fresenius J. Anal. Chem. 366 (5), 488-493 (2000).
- Ibanez, A. B., Bauer, S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectroscopy. Biotech. For Biofuels. 7 (145), (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved