需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
利用毛细管电泳从植物组织量化有机酸:一个测试用例检查
摘要
本文介绍了检测和使用免费的纬向毛细管电泳从植物材料有机酸定量的方法。该方法的潜在应用中,确定在咖啡种子有机酸水平二次发酵的效果的一个例子中,提供了。
摘要
羧酸是含有一个或多个末端羧基(COOH)官能团的有机酸。短链羧酸(SCCAs;含有三至六个碳原子的羧酸),如苹果酸和柠檬酸,对许多生物系统,在那里它们在细胞呼吸功能,可以作为细胞的健康指标的适当运作的关键。在食品中,有机酸含量会对味道显著影响,导致酸或"酸"味增加SCCA水平。正因为如此,对于有机酸水平的快速分析方法特别适用于食品和饮料工业。然而不幸的是,用于SCCA量化大多数方法都依赖于需要具有危险的试剂样品的衍生费时协议,其次是昂贵的色谱和/或质谱分析。此方法详细介绍了组织的检测和定量替代方法从植物材料和使用自由纬向毛细管电泳(CZE)食物样本齐尼奇酸,有时简称为毛细管电泳(CE)。 CZE提供一种用于测量SCCAs与检测的下限(0.005毫克/毫升)的成本效益的方法。本文将详细介绍SCCAs从植物样品提取和量化。虽然所提供的方法主要针对从咖啡豆SCCAs的测定中,所提供的方法可应用于多个植物为基础的食品原料。
引言
Carboxylic acids are organic compounds containing one or more terminal carboxyl functional groups, each attached to an R-group containing one or more carbons (R-C[O]OH). Short chain, low molecular weight carboxylic acids (short chain carboxylic acids, SCCAs) containing between one and six carbons, are essential components of cellular respiration, and function in several biochemical pathways necessary for cell growth and development. SCCAs play critical roles in cellular metabolism1, cell signaling2, and organismal responses to the environment (such as antibiosis3). Because of this, SCCAs can serve as useful indicators of disruptions to cellular metabolism, plant stress responses4,5, and fruit quality6,7. To date, SCCAs have been quantified primarily through chromatographic techniques such as high performance liquid chromatography (HPLC) or gas chromatography-mass spectroscopy (GC-MS). While these methods, are capable of achieving very low limits of detection, they can be expensive, require the derivatization of target SCCAs using caustic and/or toxic reagents, and include lengthy separation runs on the GC or HPLC. Because of this, interest in the use of free zonal capillary electrophoresis (CZE), which does not require sample derivatization, to quantify organic acids has steadily increased8.
Free zonal capillary electrophoresis (CZE) is a chromatographic separation methodology that, due to its high number of theoretical plates, speed, and relative ease-of-use, is increasingly replacing both GC-MS and high-pressure liquid chromatography as an analytical method for the quantification (particularly for quality control purposes) of anions, cations, amino acids, carbohydrates, and short chain carboxylic acids (SCCAs)8,9,10. CZE-based separation of small molecules, including SCCAs, is based two primary principles: the electrophoretic movement of charged ions in an electrical field established across the buffer filling the capillary; and the electro-osmotic movement of the entire buffer system from one end of the capillary to the other, generally towards the negative electrode. In this system, small molecules move towards the negative electrode at varying speeds, with the speed of each molecule determined by the ratio of the net charge of the molecule to the molecular mass. As the movement of each individual molecule in this system is dependent on the charge state of the molecule and the overall rate of electro-osmotic flow (which is itself based on the ion content of the buffer used to fill the capillary), the buffer pH and ionic composition heavily impact the degree to which molecules can be efficiently separated using CZE. Because of this, SCCAs, with their relatively high charge-to-mass ratios, are ideal targets for CZE-based separation. Metabolites separated using CZE can be detected using a variety of methods, including UV absorbance, spectral absorbance (which is generally performed using a photo-diode array [PDA]), and/or mass spectroscopy (CE-MS or CE-MS/MS)8. The diversity of separation and detection methods provided by CZE makes it an extremely flexible and adaptable technique. Because of this, CZE has been increasingly applied as a standard method of analysis in the areas of food safety and quality11,12, pharmaceutical research13, and environmental monitoring13,14.
Capillary electrophoresis has been used to detect and quantify short chain carboxylic acids for nearly two decades13. The resolving power (particularly for small, charged molecules), short run time, and low per sample cost of CZE analyses make CZE an ideal technique for the separation and quantification of SCCAs13. This method presents a protocol to utilize CZE to measure the concentration of organic acids from plant tissues. Example data was generated through the successful implementation of this protocol to measure the change in organic acid levels in coffee seeds following a secondary fermentation treatment. The protocol details the critical steps and common errors of CZE-based separation of SCCAs, and discusses the means by which this protocol can be successfully applied to quantify SCCAs in additional plant tissues.
研究方案
1.样品制备
- 组装为短链羧酸(SCCA)提取样品。在一个时间准备1.0克咖啡种子,以确保有足够的样本将保持处理之后。
- 如果样品的研磨前冷冻,保持整个处理冻结,以防止冻结/解冻损伤和氧化样组织。移除仅在需要用于研磨从冷冻室或零度存储的样本。
- 在液氮冷冻的Flash新鲜的样本,以试样磨前夕。以通过将它们在研钵中预先填充有液氮减少样品处理,闪光灯冷冻样品。
- 分析立即在液氮中并存储生成,或闪存冷冻在-20 C或-80ºC直至分析如下液体样品。在分析之前,从存储删除冷冻样本,并允许解冻。对液体样品进行到步骤(3.5)进行处理。
- Appro公司磨损priate个人防护设备(包括安全眼镜,手套和白大褂)用液氮工作之前。
- 使用陶瓷研钵和杵三重研磨组织样品到一个均匀细粉末( 即,均匀的粒径)在液氮中。
注:实现有均匀的颗粒尺寸为最大化SCCA提取效率是至关重要的。- 预冷却的研钵和与前加入样品液氮杵。保持填充有作为被加入样品液体氮的小体积的砂浆。
- 用勺子,补充足够的液体氮砂浆完全淹没样品。
- 加容易地样本,如叶或烘焙咖啡,以液氮,并使用圆磨运动粉碎。开始研磨样品时,液氮级别已经降低到它只是勉强覆盖采样点。
- 加硬研磨样品,这样的š生咖啡种子,以液态氮,并允许他们在研磨之前冻结10-30秒(或直到液氮停止剧烈沸腾)。打破使用垂直破碎运动组织成更小的片段,并使用圆磨运动然后完整组织研磨。
- 重复步骤1.3.2-1.3.4两次以上,使样品被研磨,共三次。通常情况下,研磨三个连续两轮将样本缩小与面粉般的一致性粉末。
- 如果没有实现一个面粉状的稠度,重复步骤1.3.2-1.3.4直到样品被还原成均匀的小粒径的粉末(提取效率成反比粒径)。
- 转移粉的玻璃小瓶或1.5 ml离心管中。启动下游加工研磨后立即(推荐),或储存样品在-80ºC至样品准备提取。
- 如果样品必须在存储分析,分裂样品放入500毫克等分试样(或液体样品500μl的等分试样)和多管用于存储之间拆分。避免使样品反复冷冻/解冻循环,因为这些可能会改变样品的组成和负面地影响未来的采样测量。
2.有机酸标准溶液配制
- 组装为感兴趣的SCCAs可信标准。这些将被用于在确定SCCA浓度来创建使用外部和内部标准溶液。对于咖啡样品包括柠檬酸,苹果酸,乙酸和乳酸为感兴趣和己二酸为内标酸。
- 确保确保所选择的内标不与样品中天然发现的,该标准没有共同洗脱与样品轮廓其他峰。
- 运行的标准曲线为每个感兴趣的SCCA,并确定线性响应范围为每个SCCA(见第4节运行研究所ructions)。确保每个SCCA运行标准曲线样品中进行测量。
注意:标准曲线可以在缓冲液或待测定样品的背景中运行。在第二种情况下("标准加入"),对于每一个标准曲线点的峰面积值将减去离开样品的背景来确定。 - 预标签与SCCA酸名,浓度和测定的日期所需要的所有管和玻璃器皿。
- 在使用一个容量瓶,确保标准制备过程中精确度的已知浓度(10毫克/毫升)的每个标准制备储备溶液。
- 溶解在超纯水(18.2MΩ)固体SCCA标准(柠檬酸和苹果酸)以获得所需的储备溶液的浓度。
- 创建加入100毫克的标准为10毫升容量瓶中有10毫克/毫升储液。补液至10毫升线用超纯水到Dissolve酸。
- 创建酸标准的较低浓度或轻轻加热烧瓶以驱动难以溶解SCCA标准,如己二酸,成溶液。
- 在超纯水稀释液相酸标准(醋酸和乳酸),以达到所需的浓度。
- 预填充容量瓶用5ml超纯水。添加足够的酸,以制备10mg / ml的溶液到烧瓶中(使用由供应商提供的酸密度计),然后加入足够的水使溶液的最终体积至10ml。
- 溶解在超纯水(18.2MΩ)固体SCCA标准(柠檬酸和苹果酸)以获得所需的储备溶液的浓度。
- 传输各储备溶液到干净15毫升玻璃管,用聚四氟乙烯(PTFE)衬里帽,并用塑料石蜡膜密封。储备溶液可以在4ºC被储存在密封的管中1周。
- 确保SCCA标准没有在使用前溶液中沉淀出来,如果库存解决方案已经prepar之后被冷藏通货膨胀。驱动沉淀放回通过温和加热解决方案。
- 准备SCCA提取液。包括在浓度足以用于检测的样品中(0.05毫克/毫升)内标。准备足够的解决方案来提取所有样本。
- 通过稀释在超纯水中内标储备溶液到0.05毫克/毫升制备50毫升的SCCA的提取液。添加250微升内标储备溶液(10毫克/毫升),以49.75毫升水中。
- 如果提取物需要稀释,调整在萃取溶液中的内标浓度,以使最终浓度将落在量化的限度内(给予可检测的,但不是过度饱和,峰值,参见下文5.2.2节)的稀释后CE系统(0.05毫克/毫升)。
- 准备每个系列提取新鲜的提取液( 即,每个实验系列)。
- 制备标准曲线样品对于感兴趣SCCAs(一系列适当稀释),使用至少5个点的最低限度。所使用的标准曲线的浓度将需要在一个给定的SCCA的线性响应范围内,并且跨越预期样品中的SCCA的浓度。
- 包括在标准曲线溶液选定内标,以允许样品中的内标定量。内标将被用于在峰值识别和计算提取效率(第6节),以帮助。
- 稀释各SCCA上述确定的浓度(0.01,0.02,0.04,0.06,0.08毫克/毫升;见上文2.4.2)在新的离心管(每个浓度/标准曲线点),使用超纯水。制备1毫升溶液每个标准曲线的集中点。确保每个浓度点包含所有四个酸标准并在正确的浓度的内标。
- 准备新的标准曲线的点为每套样品被毛细管电泳系统上运行。保持在4ºC标准曲线SCCA样品直至分析,这将发生SCCAs从靶组织(第3节)提取以下。
3.有机酸提取
- 预标签样品管,准备至少一个管的每个样本被提取。
- 删除要从存储中提取样本,将它们放在冰上,而称出材料的提取。
- 称出100毫克的样品进行提取SCCA。
- 称量每个样品后,组织转移到一个干净的1.5 ml离心管。量出的样品作为接近目标质量尽可能减少可变性的量。
- 跟踪测定各样品的质量的,作为检测SCCAs的量将使用样品质量被标准化(参见6.5.2,下文)。
- 权衡所有的样品后,加入1毫升提取液(在水:R +从步骤2.4内标混合物)向每个样品管中。保持的提取液,以组织块在所有提取相同的比率(在该壳体1毫升100±5毫克组织)。通过涡旋10秒拌匀。
- 允许样品在室温下静置1小时。在这个时候,混合每根管子每15分钟如步骤3.4。
- 提取1小时后,混合样品一个最终的时间和样品管转移到一个小离心。在4℃下离心样品10000×g离心10分钟以沉淀固体物质(细胞壁,颗粒物等 )。
- 当处理液体样品,添加内部标准适当浓度,混合短暂离心。离心后,相同地对待液体样品从固体样品的提取物。
- 检查样品的pH值,以确认它们与pH范围在检测试剂盒中的运行缓冲液相容(步骤4.6)或缓冲液系统被EMPloyed。作为样品的体积通常是相当小的,pH值可以使用pH试纸进行监测。
- 准备用注射器式盘式过滤器(3.8)来过滤样品。
注:确保每个过滤器正确连接到注射器转移上清之前,防止样品损失。制备装备有盘式过滤对于要分析的每个样品(包括标准曲线样品)一个针筒。 - 样品的离心分离和制备的注射器过滤器后,从每个样品转移上清液至配备0.2微米针筒过滤器3毫升注射器。使用每个样品新的过滤器和注射器。筛选所有样品,包括标准曲线样品和缓冲控制,CE系统上运行之前。
- 直接过滤样品到一个干净的离心管中。过滤后,关闭滤液含管和丢弃的注射器/过滤装置。
- 立即将样品过滤入CE系统对SCCA检测;或在4℃存储样品过夜。如果样品将被保存在一夜之间,密封管道用塑料石蜡膜,防止气体交换和样品的蒸发。
- 如果样品必须比过滤后的第二天被保存更长的时间,在-20ºC液氮冷冻或冻结闪光提取。解冻后,但是,需要确保在必要的每个样本被检查的沉淀的形成和过滤器(如在步骤3.6)。
4.设置了SCCA检测运行
- 请咨询编程 - 和控制软件的特定细节CE用户手册。
- 准备SCCA检测毛细管电泳(CE)样品瓶。确保小瓶有适当的标签,清洁,无缺陷。
- 洗净并在使用前干燥CE小瓶的瓶盖。
- 通过在超纯水中浸没他们并允许它们浸泡过夜洗帽。浸泡帽后,丢弃浸泡ING溶液并用超纯水冲洗帽两倍以上。
- 传输冲洗帽带无绒内衬组织清洁干燥的表面,并让他们风干。确保帽使用前完全干透,避免压故障。
- 转移1ml样品到每个CE小瓶,小心翼翼地避免意外样品溅入瓶的颈部。转让完成后,将在每个小瓶CE帽。
- 使用超纯水直接100中的CE小瓶:如果需要稀释,稀释咖啡种子样品1:10或1。为稀释大于1:100,创建中间稀释,以避免移液误差。
- 通过从步骤2.5转印标准曲线溶液(1.0毫升)的CE小瓶准备为每个标准曲线点一个小瓶。转让后盖上各管。
- 通过添加0.04重量克NaOH的含90毫升超纯水的烧杯中,并允许粒料吨准备0.1M的溶液氢氧化钠(NaOH)的Ø溶解。转移的0.1M NaOH溶液到100ml容量瓶中,使总体积至100ml。
- 将1ml的0.1M NaOH溶液添加到一个干净的CE小瓶和帽。
- 制备的CE缓冲器小瓶每批样品被CE系统上运行。分离试剂盒可或定制的缓冲区可以使用13。
- 制备1小瓶用1ml起始缓冲液溶液和帽。
- 每运行缓冲液和帽1毫升准备三小瓶中。更换样品和标准曲线的点每批前的运行缓冲液,或35后的样品,以先到为准。
- 填三个附加小瓶用1ml超纯水和帽每个小瓶。
- 准备1空"浪费"帽小瓶。
- 制备步骤4.8中所述的小瓶后,装入含缓冲液和水的小瓶,以及废液瓶(从步骤4.8.2-5)到毛细管电泳SYS的缓冲盘透射电镜,按照制造商的说明15。仔细记下每小瓶自动进样器编程的位置。
- 装载含有标准曲线点小瓶和含有样品的小瓶待测定到入口样品盘,如在制造商的说明。注意每个小瓶的自动进样器程序的位置(请参阅以下步骤4.11.1)。
- 制备调理和样品分离的方法(在表1和2中 ,分别提供了用于这些程序),并写一个样本序列文件按照仪器操作的指令。使用表2中详述的分离方法:用清水冲洗剂(20磅)0.2分列;与加速器(20 psi)的0.5分钟冲洗,在20kV注入样品(0.5磅)到柱上为0.09分钟,单独的样品12分钟,用NaOH(20 psi)的0.5分钟冲洗,最后用水冲洗( 20 psi)的0.5分钟。
- USI纳克在CE控制软件,写样品运行序列( 即,工作列表;列表文件详述在其中的样品进行分析的顺序,并且该方法也可以用来将每个样品中分离)使用"序列"电子表格界面。在电子表格上的每一行都会对应一个样品运行并产生一个数据文件。
- 确保写入顺序文件时,样品使用在采样托盘的正确位置标识。确保每个数据文件具有防止软件覆盖以前的文件的唯一名称。程序的CE毛细管空调运行如之前含有样品的分离方法的顺序运行的单独序列。
- 开始与标准曲线溶液运行采样序列,然后SCCA的样品,并与标准曲线溶液的第二次运行结束。这将允许发生期间样品分析任何信号损失的程度的计算。

表 1: 用于通过毛细制备用于短链羧酸的分离毛细管调理方法的程序电泳 。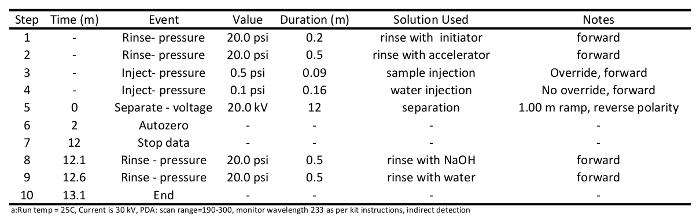
表 2:用于通过毛细管电泳一个以分析短链羧酸的分离方法程序。5. SCCA检测运行执行和数据收集
- 启动毛细管空调运行。期望以调节毛细管两次或三次前列准备样品分离。柱调理应当如表1中所述来进行。简言之,将冲洗柱用0.1M的NaOH(20 psi)的1分钟,用水(20磅),用于冲洗1分钟,用引发剂(20 psi)的0.5分钟,用加速器(20 psi)的0.5分钟,独立加速器漂洗在30千伏10分钟冲洗,用0.1M NaOH水溶液(20 psi)的0.5分钟冲洗柱,最后0.5分钟用清水冲洗干净(20磅)的列。
- 条件之前,每个样品序列运行毛细管。通过保持分离电压达到适当的调节是在整个运行恒定并观察在光电二极管阵列跟踪的平坦的基线。
- 调理后,在软件中打开"控制"菜单,然后选择( 即点击)启动样本分离"的运行顺序。"监控光电二极管阵列(PDA)跟踪,以确保适当的分离。
- 观察第一跟踪,并确保它有一个平坦的基线和完全溶解(基线分辨率),个别酸峰。超载样本显示长高峰的尾巴,或拖尾,并且将需要稀释( 图1)。

图1:PDA的比较突出的痕迹重载样本作为分析物浓度的增加,个别高峰几何可能开始变得不对称。在( 一 )0.05毫克/毫升,乙酸呈现良好定义的,左右对称的峰。作为乙酸增加到浓度(B)的0.07毫克/毫升和(c)0.10毫克/毫升,峰值尾形式(箭头)。这拖尾是一个很好的迹象表明,样品超载。 请点击此处查看该图的放大版本。- 在序列运行的结论,打开数据文件的一个在所述的CE分析软件的时间和整合的峰值。
- 整合样品峰。
- 打开第一个文件并设置自动集成步骤排除运行(其中的电压,并且因此柱的流动方向,如在表1中描述的反相)的前3分钟。在同一个菜单中,将峰的选择标准,以50个单位的最小峰宽和100单位(或制造商的默认设置)的峰面积,以提供选择性的适度高的水平,从背景噪声中的微量分离酸的峰。
- 手动检查峰边界和基线每个PDA跟踪,以确保正确的峰积分。不当集成峰( 即,已被集成为通过自动化软件两个分开的峰稍微不对称SSCA峰值)将需要手动重新结合。
- 整合样品峰。
- 整合后,查看%的面积报告,然后突出显示并复制面积百分比报告,并将其粘贴到一个单独的电子表格。重复每个样本构建完整的运行峰值不到原始吨,表示单峰的每行( 即 ,每个峰应该包含单个化合物如果分离工作良好)。
6.数据分析
- 使用在(5.4)构成的电子表格分析准备数据。通过标记的酸标准,为每个标准曲线的点,其中包括内标开始分析。
- 通过将保留时间供该样品中的内标物的保留时间与样品中每个峰计算每个峰的保留指数。排序的数据通过所得保留指数设定为确定的每个样品中感兴趣的峰。
- 识别的峰值为每个感兴趣的酸后,构造为使用外部标准曲线点每种酸的标准曲线。
- 通过确定峰面积的SCCA标准各浓度,并标绘浓度对XA产生每个SCCA标准标准(浓度)的曲线XIS与在y轴峰面积。绘制每个SCCA标准曲线的线性回归和定义的斜率公式(表达式y = mx + B)。
- 确保线性回归的R 2的值是0.90或更高的quantifications在标准曲线的线性范围最准确地进行。
- 计算使用峰面积与标准曲线(在上面6.3.2计)的线性回归线的斜率方程样品中对于给定的SCCA的酸浓度。简要地说,划分观测峰面积用于通过回归线对于酸的标准曲线的斜率的给定酸。
- 使用内部标准(步骤6.5),在加工过程中改正步骤6.4样品损失计算的原始浓度值。
- 计算使用内标各样品的校正因子。
- 划分内标物的实际浓度(即 KNO由样品中的内标(的观测值在实验开始时加入)WN量即使用内标标准曲线的斜率方程计算出的量)。乘以该修正系数的样本中的每个SCCA的原始浓度值。
- 除以用于萃取以校正在样品质量的任何变化的样品的质量校正SCCA浓度的内标。这种计算得到每个样品的质量(毫克SCCA每毫克在本实施例研磨咖啡),然后可将其转化为针对给定的研究适当的单位(毫克/毫克,毫克/克,克/克, 等分析物的量)。
- 计算SCCA浓度后(归一化至任一质量[固体或液体样品]或体积[液体样品]),使用这些值进行统计分析按实验设计和感兴趣的问题的需求。
- USI纳克在CE控制软件,写样品运行序列( 即,工作列表;列表文件详述在其中的样品进行分析的顺序,并且该方法也可以用来将每个样品中分离)使用"序列"电子表格界面。在电子表格上的每一行都会对应一个样品运行并产生一个数据文件。
结果
该协议已成功用于测量的绿色咖啡种子的SCCA含量种子处理的影响。在这个实验中,6个处理为: 明串珠菌属的饱和微生物悬浮液在其生长培养基pseudomesenteroides应变GCP674(1),在水中GCP674微生物的含水悬浮液(2),乙酸和乳酸(0.15和0.4的水溶液毫克分别/ ml)的(3),一个废M1生长培养基处理(4),卫生署2 O水(5),和未治疗的对照(没有加入到种子...
讨论
正如任何分析技术,存在可以显著影响生成的数据的质量和可靠性的几个关键因素。首先,为了有效地处理样品,用最少的冷冻/解冻循环是很重要的。反复冻融可以处理或分析之前破坏样品的化学组成。其次,它是至关重要的这个协议的步骤一致并均匀地施加到所有样品。从不一致的样品制备和处理产生的技术错误可以显著影响所产生的数据的质量,并导致在SCCA测量增加的"噪音"。例如,样品后...
披露声明
The authors declare that they have no competing financial interests.
致谢
The authors would like to acknowledge the financial support of this project by The J.M. Smucker company.
材料
| Name | Company | Catalog Number | Comments |
| Ceramic Moarter and Pestle | Coorstek | 60310 | |
| Beckman Coulter P/ACE MDQ CE system | Beckman Coulter | Various | |
| Glass sample vials | Fisher Inc. | 033917D | |
| 1.5 ml microcentrifuge tubes | Fisher Inc. | 02-681-5 | |
| LC/MS grade water | Fisher Inc. | W6-1 | Milli-Q water (18.2 MΩ.cm) is also acceptable |
| 15 ml glass tube/ Teflon lined cap | Fisher Inc. | 14-93331A | |
| Parafilm M | Fisher Inc. | 13-374-12 | |
| CElixirOA detection Kit pH 5.4 | MicroSolv | 06100-5.4 | |
| BD Safety-Lok syringes | Fisher Inc. | 14-829-32 | |
| 17 mm Target Syringe filter, PTFE | Fisher Inc. | 3377154 | |
| 32 Karat, V. 8.0 control software | Beckman Coulter | 285512 | |
| capillary electrophoresis (CE) sample vials | Beckman Coulter | 144980 | |
| caps for CE vials | Beckman Coulter | 144648 | |
| Liquid Nitrogen | N/A | N/A | Liquid nitrogen is available from most facilities services |
参考文献
- Araújo, W. L., Nunes-Nesi, A., Nikoloski, Z., Sweetlove, L. J., Fernie, A. R. Metabolic Control and Regulation of the Tricarboxylic Acid Cycle in Photosynthetic and Heterotrophic Plant Tissues: TCA Control and Regulation in Plant Tissues. Plant Cell Environ. 35 (1), 1-21 (2012).
- Finkemeier, I., Konig, A. C., et al. Transcriptomic Analysis of the Role of Carboxylic Acids in Metabolite Signaling in Arabidopsis Leaves. Plant Physiol. 162 (1), 239-253 (2013).
- Doyle, M. P., Buchanan, R. . Food Microbiology: Fundamentals and Frontiers. , (2013).
- Tůma, P., Samcová, E., Štulìk, K. Determination of the Spectrum of Low Molecular Mass Organic Acids in Urine by Capillary Electrophoresis with Contactless Conductivity and Ultraviolet Photometric Detection-An Efficient Tool for Monitoring of Inborn Metabolic Disorders. Anal Chim Acta. 685 (1), 84-90 (2011).
- López-Bucio, J., Nieto-Jacobo, M. F., Ramı́rez-Rodrı́guez, V., Herrera-Estrella, L. Organic Acid Metabolism in Plants: From Adaptive Physiology to Transgenic Varieties for Cultivation in Extreme Soils. Plant Sci. 160 (1), 1-13 (2000).
- Cebolla-Cornejo, J., Valcárcel, M., Herrero-Martìnez, J. M., Rosellò, S., Nuez, F. High Efficiency Joint CZE Determination of Sugars and Acids in Vegetables and Fruits: CE and CEC. Electrophoresis. 33 (15), 2416-2423 (2012).
- Rosello, S., Galiana-Balaguer, L., Herrero-Martinez, J. M., Maquieira, A., Nuez, F. Simultaneous Quantification of the Main Organic Acids and Carbohydrates Involved in Tomato Flavour Using Capillary Zone Electrophoresis. J Sci Food Agr. 82 (10), 1101-1106 (2002).
- Wasielewska, M., Banel, A., Zygmunt, B. Capillary Electrophoresis in Determination of Low Molecular Mass Organic Acids. Int J Environ Sci Dev. 5 (4), 417-425 (2014).
- Galli, V., Garcìa, A., Saavedra, L., Barbas, C. Capillary Electrophoresis for Short-Chain Organic Acids and Inorganic Anions in Different Samples. Electrophoresis. 24 (1213), 1951-1981 (2003).
- Klampfl, C. W. Determination of Organic Acids by CE and CEC Methods. Electrophoresis. 28 (19), 3362-3378 (2007).
- Kenney, B. F. Determination of Organic Acids in Food Samples by Capillary Electrophoresis. J Chromatogr A. 546, 423-430 (1991).
- Galli, V., Barbas, C. Capillary Electrophoresis for the Analysis of Short-Chain Organic Acids in Coffee. J Chromatogr A. 1032 (1-2), 299-304 (2004).
- Schmitt-Kopplin, P. Capillary Electrophoresis: Methods and Protocols. Methods in Molecular Biology. , 384 (2008).
- Nollet, L. . Chromatographic analysis of the environment 3rd ed. , (2006).
- . . ElixerOA Organic Acids/Anions Operating and Instruction Manual, MicroSolv Technology Corperation. , (2001).
- Dahlen, J., Hagberg, J., Karlsson, S. Analysis of low molecular weight organic acids in water with capillary zone electrophoresis employing indirect photometric detection. Fresenius J. Anal. Chem. 366 (5), 488-493 (2000).
- Ibanez, A. B., Bauer, S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectroscopy. Biotech. For Biofuels. 7 (145), (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。