É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Usando Eletroforese Capilar para quantificar ácidos orgânicos a partir de tecido da planta: um caso de teste de exame
Neste Artigo
Resumo
Este artigo apresenta um método para a detecção e quantificação de ácidos orgânicos a partir de material vegetal, utilizando electroforese capilar de zona livre. Um exemplo do potencial aplicação do presente método, a determinação dos efeitos de uma fermentação secundária em níveis de ácidos orgânicos em sementes de café, é fornecida.
Resumo
Os ácidos carboxílicos são ácidos orgânicos que contêm um ou mais carboxilo terminal (COOH) grupos funcionais. ácidos carboxílicos de cadeia curta (SCCAs; ácidos carboxílicos contendo de três a seis átomos de carbono), tais como malato e citrato, são críticas para o funcionamento de muitos sistemas biológicos, onde eles funcionam na respiração celular e podem ser utilizados como indicadores de saúde da célula. Nos alimentos, teor de ácido orgânico pode ter um impacto significativo no sabor, com o aumento dos níveis de SCCA, resultando em um sabor "ácido" azedo ou. Devido a isso, a métodos para a análise rápida dos níveis de ácidos orgânicos são de interesse particular para as indústrias alimentares e de bebidas. Infelizmente, no entanto, a maioria dos métodos utilizados para a quantificação SCCA são dependentes de protocolos demorado que requer a derivação de amostras com reagentes perigosos, seguido de cromatograf ica dispendiosa e / ou de espectrometria de massa. Este método detalha um método alternativo para a detecção e quantificação de Orgácidos Anic de material vegetal e amostras de alimentos que utilizam eletroforese capilar zonal livre (CZE), às vezes chamado simplesmente de eletroforese capilar (CE). CZE fornece um método de custo-eficácia para a medição SCCAs com um baixo limite de detecção (0,005 mg / ml). Este artigo detalha a extração e quantificação de SCCAs a partir de amostras de plantas. Enquanto o método fornecido centra-se na medição de SCCAs de grãos de café, o método fornecido pode ser aplicado a várias substâncias alimentares à base de plantas.
Introdução
Carboxylic acids are organic compounds containing one or more terminal carboxyl functional groups, each attached to an R-group containing one or more carbons (R-C[O]OH). Short chain, low molecular weight carboxylic acids (short chain carboxylic acids, SCCAs) containing between one and six carbons, are essential components of cellular respiration, and function in several biochemical pathways necessary for cell growth and development. SCCAs play critical roles in cellular metabolism1, cell signaling2, and organismal responses to the environment (such as antibiosis3). Because of this, SCCAs can serve as useful indicators of disruptions to cellular metabolism, plant stress responses4,5, and fruit quality6,7. To date, SCCAs have been quantified primarily through chromatographic techniques such as high performance liquid chromatography (HPLC) or gas chromatography-mass spectroscopy (GC-MS). While these methods, are capable of achieving very low limits of detection, they can be expensive, require the derivatization of target SCCAs using caustic and/or toxic reagents, and include lengthy separation runs on the GC or HPLC. Because of this, interest in the use of free zonal capillary electrophoresis (CZE), which does not require sample derivatization, to quantify organic acids has steadily increased8.
Free zonal capillary electrophoresis (CZE) is a chromatographic separation methodology that, due to its high number of theoretical plates, speed, and relative ease-of-use, is increasingly replacing both GC-MS and high-pressure liquid chromatography as an analytical method for the quantification (particularly for quality control purposes) of anions, cations, amino acids, carbohydrates, and short chain carboxylic acids (SCCAs)8,9,10. CZE-based separation of small molecules, including SCCAs, is based two primary principles: the electrophoretic movement of charged ions in an electrical field established across the buffer filling the capillary; and the electro-osmotic movement of the entire buffer system from one end of the capillary to the other, generally towards the negative electrode. In this system, small molecules move towards the negative electrode at varying speeds, with the speed of each molecule determined by the ratio of the net charge of the molecule to the molecular mass. As the movement of each individual molecule in this system is dependent on the charge state of the molecule and the overall rate of electro-osmotic flow (which is itself based on the ion content of the buffer used to fill the capillary), the buffer pH and ionic composition heavily impact the degree to which molecules can be efficiently separated using CZE. Because of this, SCCAs, with their relatively high charge-to-mass ratios, are ideal targets for CZE-based separation. Metabolites separated using CZE can be detected using a variety of methods, including UV absorbance, spectral absorbance (which is generally performed using a photo-diode array [PDA]), and/or mass spectroscopy (CE-MS or CE-MS/MS)8. The diversity of separation and detection methods provided by CZE makes it an extremely flexible and adaptable technique. Because of this, CZE has been increasingly applied as a standard method of analysis in the areas of food safety and quality11,12, pharmaceutical research13, and environmental monitoring13,14.
Capillary electrophoresis has been used to detect and quantify short chain carboxylic acids for nearly two decades13. The resolving power (particularly for small, charged molecules), short run time, and low per sample cost of CZE analyses make CZE an ideal technique for the separation and quantification of SCCAs13. This method presents a protocol to utilize CZE to measure the concentration of organic acids from plant tissues. Example data was generated through the successful implementation of this protocol to measure the change in organic acid levels in coffee seeds following a secondary fermentation treatment. The protocol details the critical steps and common errors of CZE-based separation of SCCAs, and discusses the means by which this protocol can be successfully applied to quantify SCCAs in additional plant tissues.
Protocolo
Preparação 1. Amostra
- Montar amostras para extração de ácido carboxílico de cadeia curta (SCCA). Prepare 1,0 g de sementes de café de cada vez para garantir que a amostra suficiente permanecerá após o processamento.
- Se as amostras foram congeladas antes do processo de moagem, manter o tecido congelado em todo o processamento para evitar danos causados por congelamento / descongelamento e oxidação da amostra. Retirar a amostra do armazenamento do congelador ou sub-zero apenas quando necessário para a moagem.
- congelamento de flash amostras frescas em azoto líquido imediatamente antes da amostra de moagem. Para minimizar o manuseamento das amostras, as amostras congeladas de flash, colocando-os num almofariz pré-carregada com azoto líquido.
- Analisar amostras líquidas imediatamente após geração, ou congelamento de flash em nitrogênio líquido e armazenar a -20 ºC ou -80 ºC até análise. Antes da análise, as amostras congeladas de remover de armazenamento e deixa-se descongelar. Para amostras líquidas vá para a etapa (3.5) para processamento.
- desgaste approequipamentos de protecção individual disso (incluindo óculos de segurança, luvas e bata de laboratório) antes de trabalhar com nitrogênio líquido.
- Amostras de tecido Triplo-moer a forma de um pó fino uniforme (isto é, de tamanho de partícula uniforme) em azoto líquido usando um almofariz e um pilão cerâmico.
NOTA: Atingir um tamanho de partícula uniforme é essencial para maximizar SCCA eficiência de extração.- Pré-resfriar o almofariz e pilão com nitrogênio líquido antes da adição da amostra. Manter a argamassa enchido com um pequeno volume de azoto líquido como a amostra é adicionada.
- Usando uma concha, adiciona nitrogênio líquido suficiente para a argamassa para submergir completamente a amostra.
- Adicione exemplos facilmente moídos, tais como folhas ou café torrado, com o azoto líquido e esmagar com um movimento de moagem circular. Começam a moer amostras quando o nível de nitrogênio líquido diminuiu para o ponto onde ele apenas mal cobre as amostras.
- Adicionar duro para moer amostras, como ums sementes de café cru, ao nitrogênio líquido e permitir-lhes congelar por 10-30 seg (ou até que o nitrogênio líquido pára vigorosamente a ferver) antes da moagem. Quebrar o tecido em fragmentos menores usando um movimento de esmagamento vertical, e tecido, em seguida, completa moagem usando um movimento de moagem circular.
- Repetir passos 1.3.2-1.3.4 duas vezes mais, de modo que as amostras são moídos num total de três vezes. Tipicamente, três rondas sucessivas de moagem irá reduzir as amostras a um pó com uma consistência de farinha semelhante.
- Se uma consistência de farinha como não é alcançada, repetir os passos 1.3.2-1.3.4 até que as amostras são reduzidas a um pó de tamanho de partícula uniforme pequena (a eficiência da extracção é inversamente proporcional ao tamanho de partícula).
- Transferir pó para frascos de vidro ou tubos de microcentrífuga de 1,5 ml. Iniciar o processamento downstream imediatamente após a moagem (recomendado), ou amostras de armazenar a -80 ºC até amostras estão prontas para a extração.
- Se as amostras devem ser armazenadas antesanálise, dividir a amostra em alíquotas de 500 mg (ou 500 mL alíquotas de amostras de líquidos) e dividida entre vários tubos para armazenamento. Evite submeter amostras a ciclos de congelamento / descongelamento repetidos, pois estes podem alterar a composição da amostra e impactar negativamente medições de amostras futuras.
2. Preparação Padrão de ácidos orgânicos
- Montar padrões autênticos para os SCCAs de interesse. Estas serão usadas para criar soluções-padrão externa e interna para utilização na determinação das concentrações de SCCA. Para amostras de café incluem cítrico, málico, acético, e ácido láctico como ácidos de interesse e ácido adípico como padrão interno.
- Assegurar-se que o padrão interno seleccionado não é encontrado naturalmente na amostra, e que o padrão não co-eluem com os outros picos no perfil da amostra.
- Executar curvas padrão para cada SCCA de interesse e determinar a faixa de resposta linear para cada SCCA (ver secção 4 para a execução de instructions). Certifique-se de executar curvas padrão para cada SCCA a ser medido na amostra.
NOTA: As curvas padrão pode ser executado em qualquer tampão ou o fundo da amostra a ser ensaiada. No segundo caso ( "padrão de adição"), os valores para a área do pico de cada ponto da curva padrão vai ser determinada subtraindo distância do fundo da amostra. - Pré-label todos os tubos e copos necessários com o nome SCCA ácido, concentração e a data do ensaio.
- Preparar soluções de reserva para cada padrão com uma concentração conhecida (10 mg / mL) utilizando um balão volumétrico para garantir a precisão durante a preparação do padrão.
- Dissolve-se padrões SCCA sólidos (ácido cítrico e ácido málico) em água ultrapura (18,2 mohms) para atingir a concentração desejada para a solução estoque.
- Criar uma solução / estoque ml 10 mg por adição de 100 mg de padrão a um 10 ml balão volumétrico. Encher o balão volumétrico para a linha de 10 ml com água ultrapura para dissolve o ácido.
- Criar uma concentração mais baixa do padrão de ácido ou aquecer suavemente os frascos de conduzir difíceis de dissolver padrões SCCA, como ácido adípico, em solução.
- Dilui-se padrões de ácido fase líquida (ácido acético e ácido láctico) em água ultra pura para atingir a concentração desejada.
- Pré-encher um frasco volumétrico com 5 ml de água ultrapura. Adiciona-se ácido suficiente para preparar uma solução 10 mg / ml (calculado utilizando a densidade do ácido fornecido pelo fornecedor) ao balão e, em seguida adicionar água suficiente para levar o volume final da solução para 10 mL.
- Dissolve-se padrões SCCA sólidos (ácido cítrico e ácido málico) em água ultrapura (18,2 mohms) para atingir a concentração desejada para a solução estoque.
- Transfira cada solução estoque para um tubo de vidro de 15 ml limpo, com um politetrafluoretileno (PTFE) cap alinhado, e selar com película de parafina plástico. As soluções de reserva pode ser armazenado em tubos selados a 4 ºC durante 1 semana.
- Garantir que as normas SCCA não ter precipitado para fora da solução antes de usar se soluções estoque foram refrigerado após a preparção. Unidade precipita de volta para solução através de aquecimento suave.
- Preparar a solução de extracção SCCA. Incluir o padrão interno a uma concentração suficiente para a detecção em amostras (0,05 mg / ml). Preparar a solução suficiente para extrair todas as amostras.
- Preparar 50 ml de solução de extracção SCCA por diluição da solução de estoque padrão interno de 0,05 mg / ml em água ultrapura. Adicionar 250 ul da solução-mãe padrão interno (10 mg / ml) a 49,75 mL de água.
- Se o extracto tem de ser diluída, ajustar a concentração do padrão interno na solução de extracção de modo a que a concentração final vai cair dentro dos limites de quantificação (dando uma detectável, mas não sobre-saturada, pico, ver 5.2.2 abaixo) do sistema CE após diluição (0,05 mg / ml).
- Preparar a solução de extracção fresco para cada série de extracções (ou seja, para cada uma das séries experimentais).
- Preparar as amostras da curva padrão(Uma série de diluições apropriadas) para SCCAs de interesse, usando um mínimo de pelo menos 5 pontos. As concentrações da curva padrão empregues terão de estar na gama de resposta linear para um dado SCCA, e abrangem as concentrações SCCA esperados nas amostras.
- Incluir o padrão interno seleccionado nas soluções da curva padrão para permitir a quantificação do padrão interno em amostras. O padrão interno será usado para ajudar na identificação de picos e calcular a eficiência de extracção (a secção 6).
- Diluir cada SCCA para as concentrações determinadas acima (0,01, 0,02, 0,04, 0,06, 0,08 mg / ml; ver acima, 2.4.2) em tubos de microcentrífuga novos (um para cada concentração / ponto da curva padrão) usando água ultrapura. Prepare 1 ml de solução para cada ponto de concentração curva padrão. Assegure-se que cada ponto de concentração contém todos os padrões de ácidos quatro e o padrão interno na concentração correcta.
- Prepare novos pontos da curva padrão para cada conjuntode amostras a ser executado no sistema de eletroforese capilar. Mantenha as amostras padrão curva SCCA a 4 ºC até a análise, o que irá ocorrer após a extração de SCCAs de tecidos-alvo (secção 3).
3. Extracção de ácidos orgânicos
- tubos de amostra pré-label, que se preparam, pelo menos, um tubo para cada amostra a ser extraída.
- Retirar amostras a ser extraído a partir do armazenamento e colocá-los em gelo durante a pesagem para fora o material para a extracção.
- Pesar 100 mg de amostra para extração de SCCA.
- Após a pesagem de cada amostra, transferir o tecido a um 1,5 ml tubo de microcentrífuga limpo. Medir uma quantidade de amostra, tal como perto do alvo de massa quanto possível para reduzir a variabilidade.
- Mantenha o controle da massa de cada amostra medida, como as quantidades de SCCAs detectadas serão normalizados utilizando a massa da amostra (ver 6.5.2, abaixo).
- Depois de pesar todas as amostras, adicionar 1 ml de solução de extracção (o water + mistura padrão interno a partir do passo 2.4) a cada um dos tubos de amostra. Manter o rácio da solução de extracção para a massa de tecido do mesmo em todas as extracções (neste caso, 1 ml para 100 ± 5 mg de tecido). Misture bem por vórtice durante 10 seg.
- Permitir amostras para sentar-se à temperatura ambiente durante 1 hora. Durante esta hora, misture cada tubo a cada 15 minutos como no passo 3.4.
- Após 1 h de extracção, misturar as amostras de um tempo final e transferir os tubos de amostra para uma microcentrifugadora. Centrifugar as amostras a 4 ° C, 10000 g durante 10 min para precipitar material sólido (paredes celulares, partículas, etc.).
- Ao processar amostras líquidas, adicione a concentração adequada de padrão interno, misture rapidamente e centrifugar. Após centrifugação, o tratamento de amostras de líquidos de forma idêntica à do extracto a partir de amostras sólidas.
- Verificar o pH das amostras para confirmar que eles são compatíveis com o alcance do tampão de corrida com o kit de detecção de pH (passo 4.6) ou sistema tampão ser EMPloyed. À medida que os volumes de amostra são geralmente bastante pequenos, o pH pode ser monitorizado utilizando papel de pH.
- Prepare-se para filtrar amostras usando filtros de disco montado na seringa (3.8).
NOTA: Evite a perda de amostra, garantindo que cada filtro está correctamente ligado a uma seringa antes de transferir o sobrenadante. Prepare uma seringa equipada com um filtro de disco para cada amostra a ser analisada (incluindo amostras da curva padrão). - Após centrifugação das amostras e preparação dos filtros de seringa, transferir o sobrenadante de cada amostra para uma seringa de 3 ml equipada com um filtro de seringa de 0,2 um. Usar um novo filtro de seringa e para cada amostra. Filtro de todas as amostras, incluindo amostras da curva padrão e controlos de tampão, antes da execução no sistema CE.
- Filtra-se a amostra directamente para um tubo de microcentrífuga limpo. Após filtração, o filtrado fechar tubo contendo e descartar o aparelho de seringa / filtro.
- Colocar imediatamente amostras filtradaspara o sistema CE para detecção SCCA; ou amostras de armazenar a 4 ° C durante a noite. Se as amostras deverão ser armazenadas durante a noite, fechar os tubos com película de parafina plástico para evitar a troca de gases e evaporação da amostra.
- Se as amostras devem ser armazenadas mais de um dia após a filtragem, extratos de flash congelamento em nitrogênio líquido ou congelar a -20 ºC. Após descongelação, no entanto, assegurar que cada amostra é examinada para a formação de precipitado e filtra-se se necessário (como no passo 3.6).
4. Configurar a Detecção Run SCCA
- Consulte o manual do usuário do CE para detalhes Programação- e de controlo específicas do software.
- Prepare eletroforese (CE) frascos de amostra capilar para detecção de SCCA. Garantir frascos estão devidamente rotulados, limpo e livre de defeitos.
- Lave e seque as tampas dos frascos CE antes do uso.
- Lave as tampas, submergindo-os em água ultrapura e permitindo-as de molho durante a noite. Após a imersão as tampas, descartar a mergulharing solução e lave as tampas mais duas vezes com água ultrapura.
- Transferência enxaguado tampas para uma superfície de secagem limpo forrado com tecido que não solte fiapos e permitir-lhes a secar ao ar. Garantir tampas estão completamente secos antes do uso para evitar falhas de pressão.
- Transferir 1 ml da amostra a cada frasco CE, tomando cuidado para evitar que acidentalmente espirra a amostra no pescoço do frasco. Após a transferência, coloque um tampão CE em cada frasco.
- Se uma diluição é necessária, diluir as amostras de sementes de café 1:10 ou 1: 100 diretamente no frasco CE usando água ultrapura. Para diluições maiores do que 1: 100, criar uma diluição intermédia para evitar erros de pipetagem.
- Preparar um frasco para cada ponto da curva padrão através da transferência de soluções da curva padrão (1,0 ml) a partir do passo 2.5 para frascos de CE. Cap cada tubo após a transferência.
- Prepara-se uma solução de hidróxido de sódio (NaOH) a 0,1 M por adição de 0,04 g de NaOH para um copo contendo 90 ml de água ultrapura e permitindo que os peletes tO dissolver. Transferir a solução 0,1 M de NaOH para um balão volumétrico de 100 ml e levar o volume total a 100 ml.
- Adicionar 1 ml de solução de NaOH 0,1 M para um frasco limpo CE e tampão.
- Prepare frascos tampão CE para cada lote de amostras a serem executados no sistema CE. Kits de separação estão disponíveis ou padrões personalizados podem ser usados 13.
- Prepare 1 frasco com 1 ml de solução tampão de partida e tampão.
- Prepare três frascos com 1 ml cada de correr solução tampão e tampão. Substituir o tampão de corrida antes de cada lote de amostras e os pontos da curva padrão, ou depois de 35 amostras, o que ocorrer primeiro.
- Encha três frascos adicionais com 1 ml de água ultrapura e tampe cada frasco.
- Prepare um vazio vial "resíduos" com o tampão.
- Depois de preparar os tubos de ensaio descritas na etapa 4.8, carregar os tubos de ensaio que contêm os tampões e a água, bem como os frascos de resíduo (dos passos 4.8.2-5) na bandeja de tampão de electroforese capilar system, de acordo com as instruções do fabricante 15. Cuidadosamente, note a posição de cada frasco para a programação de auto-amostrador.
- Carregar os frascos contendo os pontos da curva padrão e os frascos contendo as amostras a serem ensaiadas em tabuleiro de amostras de entrada, tal como descrito nas instruções do fabricante. Observe a posição de cada frasco para a programação de auto-amostrador (veja as etapas 4.11.1 abaixo).
- Prepare-condicionado e métodos de separação de amostras (programas para estes são fornecidos nas Tabelas 1 e 2, respectivamente), e escrever um arquivo sequência de amostras de acordo com instruções de operação do instrumento. Usar o método de separação descrito na Tabela 2: lavar a coluna com iniciador (20 psi) durante 0,2 min; enxaguar com acelerador (20 psi) durante 0,5 min, injetar amostras (0,5 psi) na coluna de 0,09 min, amostras separadas a 20 kV para 12 min, lavar com NaOH (20 psi) durante 0,5 min, e, finalmente, lavar com água ( 20 psi) durante 0,5 min.
- Using do software de controlo CE, escrever a sequência de amostras de funcionamento (ou seja, a lista de trabalho; um ficheiro de lista detalhando a ordem pela qual serão analisadas as amostras, e o método para ser utilizado para separar cada amostra), utilizando a interface de folha de cálculo "sequência". Cada linha na planilha corresponderá a uma amostra corrida e produzir um único arquivo de dados.
- Certifique-se que ao escrever o arquivo de seqüência, as amostras são identificadas usando a posição correcta na bandeja de amostragem. Certifique-se de que cada arquivo de dados tem um nome exclusivo para impedir que o software de sobrescrever arquivos anteriores. Programa CE capilar condicionado é executado como uma sequência separada antes do prazo sequência contendo o método de separação da amostra.
- Comece a sequência de amostras de correr com as soluções da curva padrão, seguido de amostras SCCA, e terminam com uma segunda execução das soluções da curva padrão. Isto irá permitir um cálculo do grau de qualquer perda de sinal que ocorre durante a análise de amostras.

Quadro 1: Condicionado programa método utilizado para preparar o capilar para a cadeia curta separação ácido carboxílico via eletroforese capilar a.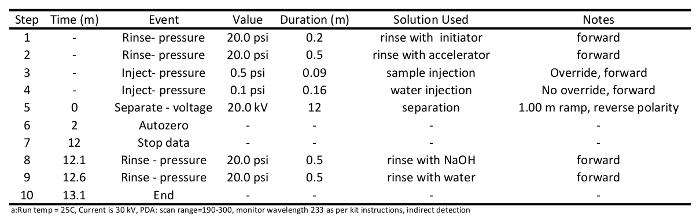
Tabela 2: Programa Método de separação utilizado para análises de ácidos carboxílicos de cadeia curta, via eletroforese capilar a.5. SCCA Detecção Run Execução e Recolha de Dados
- Iniciar condicionamento funcionamentos capilares. Esperar para condicionar o capilar de duas ou três vezes antes da coluna está pronta para a separação da amostra. Coluna condicionado deve ser efectuada tal como descrito na Tabela 1. Resumidamente, lavar coluna com NaOH 0,1 M (20 psi) durante 1 min, lavar com água (20 psi) durante1 min, lavar com iniciador (20 psi) durante 0,5 minutos, lavou-se com acelerador (20 psi) durante 0,5 min, acelerador separada a 30 kV durante 10 minutos, enxaguar coluna com NaOH 0,1 M (20 psi) durante 0,5 min, e finalmente lavar a coluna com água (20 psi) durante 0,5 min.
- Condicionar o capilar antes de cada corrida sequência amostra. Alcançar condicionamento adequado, mantendo a tensão de separação é constante durante toda a corrida e observando uma linha de base plana no traçado de arranjo de diodos.
- Após o condicionamento, iniciar a separação da amostra, abrindo o menu "controle" no software e selecionando (ou seja, clicando em) "sequência de correr." Monitorar o rastreamento de arranjo de fotodiodos (PDA) para garantir a separação adequada.
- Observe o primeiro traço e garantir que ele tem uma base plana e limpa resolvido (resolução de linha de base), picos de ácidos individuais. Over-carregado amostras irá mostrar as caudas longas de pico, ou distorção de picos, e terá de ser diluído (Figura 1).

Figura 1:. Uma comparação entre PDA traços destacando uma amostra sobrecarregado como concentração aumenta analitos, indivíduo geometria pico pode começar a tornar-se assimétrica. Em (a) 0,05 mg / ml, ácido acético apresenta, um pico simétrico bilateralmente bem definida. À medida que a concentração aumenta de ácido acético para (b) 0,07 mg / ml e (c) 0,10 mg / ml, forma-se uma cauda de pico (setas). Este tailing pico é uma boa indicação de que a amostra está sobrecarregado. Por favor clique aqui para ver uma versão maior desta figura.- Na conclusão da sequência de execução, abra os arquivos de dados um de cada vez no software de análise CE e integrar os picos.
- Integrar picos de amostra.
- Abra o primeiro arquivoe definir as etapas de integração automática para excluir o primeiro 3 min da corrida (em que a tensão, e, por conseguinte, a direcção de fluxo da coluna, é invertido, como descrito na Tabela 1). No mesmo menu, definir critérios de selecção de pico para uma largura de pico mínimo de 50 unidades e a área do pico de 100 unidades (ou configurações padrão do fabricante) para fornecer um moderadamente alto nível de selectividade, separando picos do ácido do ruído de fundo no rastreio.
- Verificar manualmente limites de pico e linhas de base para cada traço PDA para assegurar a integração do pico adequado. Indevidamente picos integrados (isto é, um pico SSCA ligeiramente assimétrico que foi integrado como dois picos separados por o software automatizado) terá de ser re-integrado manualmente.
- Integrar picos de amostra.
- Após a integração, ver o relatório da área por cento, em seguida, destacar e copiar o relatório da área por cento e colá-lo em uma planilha separada. Repita o procedimento para cada amostra para construir o pleno funcionamento de pico report com cada linha representa um único pico (ie., cada pico deve conter um único composto, se a separação está a funcionar bem).
Análise 6. Os dados
- Preparar os dados para análise utilizando a planilha construída em (5.4). Comece a análise por marcação dos padrões de ácido para cada um dos pontos da curva padrão, incluindo o padrão interno.
- Calcular um índice de retenção de cada pico dividindo-se o tempo de retenção para cada pico na amostra pelo tempo de retenção do padrão interno, em que a amostra. Classificar os dados definidos pelo índice de retenção resultante para identificar os picos de interesse em cada amostra.
- Após a identificação do pico para cada ácido de interesse, construir curvas padrão para cada ácido utilizando os pontos de curva padrão externo.
- Gerar uma curva padrão (concentração) para cada padrão SCCA por determinação da área do pico para cada concentração dos padrões SCCA, e traçando a concentração do XAXIS versus área de pico no eixo dos y. Traça-se a regressão linear para cada curva padrão e SCCA definir a equação inclinação (y = mx + b).
- Assegure-se que os valores de R 2 das regressões lineares são 0,90 ou superior, tal como as quantificações são executados com maior precisão na gama linear da curva padrão.
- Calcula-se a concentração de ácido para um dado SCCA numa amostra usando a área do pico e da inclinação para a equação da linha de regressão linear da curva padrão (calculada em 6.3.2, supra). Resumidamente, dividir a área de pico observado para um dado ácido pelo declive da linha de regressão para a curva padrão de ácido.
- Corrigir os valores de concentração calculados em bruto no passo 6.4 para a perda de amostra durante o processamento utilizando o padrão interno (passo 6.5).
- Calcular o factor de correcção para cada amostra utilizando o padrão interno.
- Dividir a concentração real do padrão interno (ou seja, o KNOWN quantidade adicionada no início da experiência) por o valor observado do padrão interno na amostra (isto é, a quantidade calculada usando a equação de inclinação da curva padrão para o padrão interno). Multiplicar os valores da concentração de matérias cada SCCA na amostra por este factor de correcção.
- Dividir o padrão interno de concentração corrigida SCCA pela massa da amostra utilizada para a extracção para corrigir para qualquer variação da massa da amostra. Este cálculo produz quantidade de analito por massa de amostra (mg por mg SCCA café moído, neste exemplo), que pode então ser convertido em unidades adequadas para o estudo dado (mg / mg, mg / g, g / G, etc. ).
- Depois de calcular as concentrações de SCCA (normalizado, quer a massa [para amostras sólidas ou líquidas] ou volume [de amostras líquidas]), usar esses valores para análise estatística de acordo com as exigências do desenho experimental e questões de interesse.
- Using do software de controlo CE, escrever a sequência de amostras de funcionamento (ou seja, a lista de trabalho; um ficheiro de lista detalhando a ordem pela qual serão analisadas as amostras, e o método para ser utilizado para separar cada amostra), utilizando a interface de folha de cálculo "sequência". Cada linha na planilha corresponderá a uma amostra corrida e produzir um único arquivo de dados.
Resultados
Este protocolo tem sido utilizada com sucesso para medir os efeitos de tratamentos de sementes sobre o conteúdo SCCA de sementes de café verdes. Nesta experiência, os seis tratamentos foram os seguintes: uma suspensão microbiana saturada de Leuconostoc pseudomesenteroides estirpe GCP674 no seu meio de crescimento (um), de uma suspensão aquosa de GCP674 micróbios em água (2), uma solução aquosa de ácido acético e ácido láctico (0,15 e 0,4 mg / ml, respectivamente) (3...
Discussão
Como acontece com qualquer técnica analítica, existem vários fatores críticos que podem afetar significativamente a qualidade e confiabilidade dos dados gerados. Em primeiro lugar, é importante para processar amostras de forma eficiente, com um mínimo de ciclos de congelamento / descongelamento. ciclos repetidos de congelamento e descongelamento pode comprometer a composição química da amostra antes do processamento ou análise. Em segundo lugar, é crítico para aplicar os passos deste protocolo para todas as ...
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The authors would like to acknowledge the financial support of this project by The J.M. Smucker company.
Materiais
| Name | Company | Catalog Number | Comments |
| Ceramic Moarter and Pestle | Coorstek | 60310 | |
| Beckman Coulter P/ACE MDQ CE system | Beckman Coulter | Various | |
| Glass sample vials | Fisher Inc. | 033917D | |
| 1.5 ml microcentrifuge tubes | Fisher Inc. | 02-681-5 | |
| LC/MS grade water | Fisher Inc. | W6-1 | Milli-Q water (18.2 MΩ.cm) is also acceptable |
| 15 ml glass tube/ Teflon lined cap | Fisher Inc. | 14-93331A | |
| Parafilm M | Fisher Inc. | 13-374-12 | |
| CElixirOA detection Kit pH 5.4 | MicroSolv | 06100-5.4 | |
| BD Safety-Lok syringes | Fisher Inc. | 14-829-32 | |
| 17 mm Target Syringe filter, PTFE | Fisher Inc. | 3377154 | |
| 32 Karat, V. 8.0 control software | Beckman Coulter | 285512 | |
| capillary electrophoresis (CE) sample vials | Beckman Coulter | 144980 | |
| caps for CE vials | Beckman Coulter | 144648 | |
| Liquid Nitrogen | N/A | N/A | Liquid nitrogen is available from most facilities services |
Referências
- Araújo, W. L., Nunes-Nesi, A., Nikoloski, Z., Sweetlove, L. J., Fernie, A. R. Metabolic Control and Regulation of the Tricarboxylic Acid Cycle in Photosynthetic and Heterotrophic Plant Tissues: TCA Control and Regulation in Plant Tissues. Plant Cell Environ. 35 (1), 1-21 (2012).
- Finkemeier, I., Konig, A. C., et al. Transcriptomic Analysis of the Role of Carboxylic Acids in Metabolite Signaling in Arabidopsis Leaves. Plant Physiol. 162 (1), 239-253 (2013).
- Doyle, M. P., Buchanan, R. . Food Microbiology: Fundamentals and Frontiers. , (2013).
- Tůma, P., Samcová, E., Štulìk, K. Determination of the Spectrum of Low Molecular Mass Organic Acids in Urine by Capillary Electrophoresis with Contactless Conductivity and Ultraviolet Photometric Detection-An Efficient Tool for Monitoring of Inborn Metabolic Disorders. Anal Chim Acta. 685 (1), 84-90 (2011).
- López-Bucio, J., Nieto-Jacobo, M. F., Ramı́rez-Rodrı́guez, V., Herrera-Estrella, L. Organic Acid Metabolism in Plants: From Adaptive Physiology to Transgenic Varieties for Cultivation in Extreme Soils. Plant Sci. 160 (1), 1-13 (2000).
- Cebolla-Cornejo, J., Valcárcel, M., Herrero-Martìnez, J. M., Rosellò, S., Nuez, F. High Efficiency Joint CZE Determination of Sugars and Acids in Vegetables and Fruits: CE and CEC. Electrophoresis. 33 (15), 2416-2423 (2012).
- Rosello, S., Galiana-Balaguer, L., Herrero-Martinez, J. M., Maquieira, A., Nuez, F. Simultaneous Quantification of the Main Organic Acids and Carbohydrates Involved in Tomato Flavour Using Capillary Zone Electrophoresis. J Sci Food Agr. 82 (10), 1101-1106 (2002).
- Wasielewska, M., Banel, A., Zygmunt, B. Capillary Electrophoresis in Determination of Low Molecular Mass Organic Acids. Int J Environ Sci Dev. 5 (4), 417-425 (2014).
- Galli, V., Garcìa, A., Saavedra, L., Barbas, C. Capillary Electrophoresis for Short-Chain Organic Acids and Inorganic Anions in Different Samples. Electrophoresis. 24 (1213), 1951-1981 (2003).
- Klampfl, C. W. Determination of Organic Acids by CE and CEC Methods. Electrophoresis. 28 (19), 3362-3378 (2007).
- Kenney, B. F. Determination of Organic Acids in Food Samples by Capillary Electrophoresis. J Chromatogr A. 546, 423-430 (1991).
- Galli, V., Barbas, C. Capillary Electrophoresis for the Analysis of Short-Chain Organic Acids in Coffee. J Chromatogr A. 1032 (1-2), 299-304 (2004).
- Schmitt-Kopplin, P. Capillary Electrophoresis: Methods and Protocols. Methods in Molecular Biology. , 384 (2008).
- Nollet, L. . Chromatographic analysis of the environment 3rd ed. , (2006).
- . . ElixerOA Organic Acids/Anions Operating and Instruction Manual, MicroSolv Technology Corperation. , (2001).
- Dahlen, J., Hagberg, J., Karlsson, S. Analysis of low molecular weight organic acids in water with capillary zone electrophoresis employing indirect photometric detection. Fresenius J. Anal. Chem. 366 (5), 488-493 (2000).
- Ibanez, A. B., Bauer, S. Analytical method for the determination of organic acids in dilute acid pretreated biomass hydrolysate by liquid chromatography-time-of-flight mass spectroscopy. Biotech. For Biofuels. 7 (145), (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados