Method Article
عالية الدقة الكمية متشابك بروتيوم من التنميط ماوس مناطق الدماغ بعد السمعية التمييز التعلم
In This Article
Summary
The identification of molecules and pathways controlling synaptic plasticity and memory is still a major challenge in neuroscience. Here, a workflow is described addressing the relative quantification of synaptic proteins supposedly involved in the molecular reorganization of synapses during learning and memory consolidation in an auditory learning paradigm.
Abstract
The molecular synaptic mechanisms underlying auditory learning and memory remain largely unknown. Here, the workflow of a proteomic study on auditory discrimination learning in mice is described. In this learning paradigm, mice are trained in a shuttle box Go/NoGo-task to discriminate between rising and falling frequency-modulated tones in order to avoid a mild electric foot-shock. The protocol involves the enrichment of synaptosomes from four brain areas, namely the auditory cortex, frontal cortex, hippocampus, and striatum, at different stages of training. Synaptic protein expression patterns obtained from trained mice are compared to naïve controls using a proteomic approach. To achieve sufficient analytical depth, samples are fractionated in three different ways prior to mass spectrometry, namely 1D SDS-PAGE/in-gel digestion, in-solution digestion and phospho-peptide enrichment.
High-resolution proteomic analysis on a mass spectrometer and label-free quantification are used to examine synaptic protein profiles in phospho-peptide-depleted and phospho-peptide-enriched fractions of synaptosomal protein samples. A commercial software package is utilized to reveal proteins and phospho-peptides with significantly regulated relative synaptic abundance levels (trained/naïve controls). Common and differential regulation modes for the synaptic proteome in the investigated brain regions of mice after training were observed. Subsequently, meta-analyses utilizing several databases are employed to identify underlying cellular functions and biological pathways.
Introduction
ويستند التعلم على تشكيل آثار الذاكرة وصيانتها. ومن المسلم به على نطاق واسع أن الآلية الكامنة وراء ما قد يمثل تشكيل تعتمد على النشاط من إعادة ترتيب جديد و / أو الاتصالات متشابك الموجودة بين الخلايا العصبية. على المستوى الجزيئي، وقد وصفت مختلف التعديلات البروتين، relocalizations دوين الخلوي والتغيرات في دوران من البروتينات متشابك 1-4 (LAMPRECHT 2004 رقم 8). ومع ذلك، فإن معظم الدراسات التي تركز حتى الآن على بروتينات محددة بدلا من التركيز على تكوين بروتيوم متشابك العالمي ولكنها معقدة. النهج الحالي يسمح للفحص غير متحيز لإجراء تغييرات بروتيوم متشابك في مناطق مخ الفأر بعد تجربة التعلم. انها مناسبة لتقديم الوقت نقطة لقطات الجزيئية تعتمد عملية إعادة التنظيم التي يسببها تعلم الهندسة المعمارية متشابك. سير العمل صفها يتطلب العمل الجماعي معين من الاختصاصيين من مختلف الاختصاصات في سلوك الحيوان، الكيمياء الحيوية من البروتين، مطياف الكتلة وbioinformatics.
نموذج التعلم المختارة، أي التضمين تردد نغمة التمييز (FMTD)، مهمة التمييز السمعي جيدا اتسم في القوارض 5. التعلم وتكوين الذاكرة على المدى الطويل في مربع المكوك هذه العودة / لا-الذهاب المهام تتضمن آليات اعتمادا على زيادة إشارات الدوبامين القشرية وتخليق البروتين. وفقا لذلك، وكشفت الدراسات البروتين الأخيرة على الجربوع والفئران dopamine- والناجم عن التعلم إعادة ترتيب البلاستيك مكونات متشابك في القشرية، ولكن أيضا في مناطق الدماغ أكثر القاعدية التي من المفترض أن تتفاعل خلال التعلم والذاكرة FMTD 6-8. وهذا يوضح أن تكوين الذاكرة ينطوي على تفاعل معقد بين مناطق الدماغ المختلفة، وبالتالي، يمكن أن ينظم بشكل مختلف في هذه المناطق على مستوى بروتيوم. لذلك، يتم تضمين تشريح مناطق مخ الفأر القشرية وتحت القشرية المحدد في سير العمل.
علاوة على ذلك، يمكن الاعتماد عليها characterizatiعلى حتى التغيرات ضعيفة في تكوين بروتين متشابك يتطلب تخصيب المقصورات قبل وبعد المشبكي بدلا من تحليل الخليط أو كسور غشاء الخام 9. بروتوكولات لذلك، وإعداد synaptosomes استخدام أنشأت قبل تحليل البروتين يوصف من أجل زيادة مستوى الكشف والنطاق الديناميكي للالبروتينات المشبك محددة 10،11.
شرط أساسي لاستخدام التسمية خالية عالية الدقة الطيفي لأغراض الكمية هو على درجة عالية من التشابه من عينات البروتين. حيث من المتوقع أن تحدث بعد والتعلم، ونهج التسمية خالية سيكون مناسبا لمقارنة عينات البروتين الحصول عليها من الفئران المدربة وساذجة المقابلة تغييرات طفيفة إلى حد ما في تكوين بروتين متشابك. بدلا من ذلك، استراتيجيات تسمية حالة معينة من البروتينات / الببتيدات باستخدام النظائر المستقرة (على سبيل المثال TMT، iTRAQ، ICPL وSILAC)، وكذلك تسمية استنادا MS2 غنى عنه مجاناntification (رقعة) هي مفيدة، لكنها أكثر تكلفة من نهج التسمية خالية اختيار أو حاجة خاصة الأجهزة الطيفي الشامل.
منذ عروض البروتين غالبا ما تسفر عن مجموعات البيانات المعقدة، فمن المستحسن معالجة بيوينفورمتيك لتفسير البيانات المناسبة. قد تدعم تحليلات الفوقية إضافية إلى فهم أفضل للآليات الجزيئية الكامنة وراء التغيرات المرتبطة النموذج وتحديد العمليات الخلوية الأساسية المعنية ومسارات إشارات. وكما وصفت المنهجيات المناسبة أدناه.
Protocol
تم تنفيذ جميع الإجراءات بما في ذلك المواد الحيوانية وفقا لأحكام قانون الاتحادي الألماني، ولوائح الاتحاد الأوروبي منها، والمبادئ التوجيهية المعاهد الوطنية للصحة، حيث تم اعتمادها من قبل لجنة أخلاقيات Landesverwaltungsamt سكسونيا / أنهالت (42502-2-1102 IFN).
1. التعلم السمعي
- تعلم التمييز السمعي في مربع المكوك (FMTD نموذج) ملاحظة: دائما ارتداء قفازات أثناء التعامل مع الفئران.
- الفئران منزل C57Bl6 / J في مجموعات من ثلاثة أو أربعة مع حرية الوصول إلى الغذاء الكريات وماء الصنبور في أقفاص البولي واضحة. الحفاظ على ضوء 12 ساعة: دورة الظلام في منشأة الحيوان. إذا وردت الحيوانات من مختبر آخر أو من شركة تسمح أسبوع واحد على الأقل من التأقلم والاستقرار فيها.
- أداء دورة تدريبية مربع المكوك واحدة يوميا.
- اتخاذ الماوس من قفص وطنه في منشأة الحيوان ووضعه في صندوق مكوك الإضاءة الخافتة داخل غرفة عزل الصوت.
- استخدام الجدول الزمني تعلم تماما الكمبيوتر التي تسيطر عليها لتعلم التمييز السمعي. بادئ ذي بدء فترة التعود من 3 دقائق من الصمت، ثم بدء الدورة التدريبية.
- استخدام سلاسل من ارتفاع نبرة (4-8 كيلو هرتز، CS +) كما في العودة التحفيز أثناء العودة، المحاكمات: إن الحيوان لديه لعبور عقبة في غضون 6 ثانية العرض لهجة (الإجابة الصحيحة، ضرب). معاقبة يغيب عن طريق القدم صدمة خفيفة من 50-300 أمبير، تسليمها عن طريق الكلمة شبكة من مربع المكوك.
- استخدام تسلسل لهجة هبوط (8-4 كيلو هرتز، CS-) كما لا يمكن أن تذهب التحفيز خلال بلا الذهاب المحاكمات: الحيوان يجب أن يبقى في المقصورة الحالية للمربع المكوك خلال 6 ثانية العرض لهجة. معاقبة انذار كاذب عن طريق القدم صدمة خفيفة من 50-300 أمبير، تسليمها عن طريق الكلمة شبكة من مربع المكوك.
- استخدام فترات intertrial من 20 5 ثانية.
- أداء 30 العودة-محاكمات و 30 لا GO-محاكمات في كل دورة في ترتيب العشوائية الزائفة، حتى أن واحدا ذاتهايتكون ssion من 60 محاكمات وتستغرق حوالي 25 دقيقة.
- وضع الحيوان تدريب مرة أخرى في قفص وطنه في منشأة الحيوان.
- تشريح الدماغ
- الموت ببطء الحيوان في نقطة الوقت المطلوب بعد العدد المطلوب من الدورات التدريبية باستخدام خلع عنق الرحم (على سبيل المثال 24 ساعة بعد الانتهاء من الدورة الأولى). قطع رأس الحيوان.
- تشريح بسرعة الدماغ عن طريق الخطوات التالية: قص أولا الجلد ثم الجمجمة مع المقص مباشرة على طول السهمي درز. تماما إزالة أجزاء من العظام التي تغطي أنسجة المخ باستخدام ملقط قوية. تأخذ بها الدماغ مع spattle.
- للتشريح، ووضع الدماغ على طبق بيتري مليئة الجليد. تشريح القشرة السمعية، والقشرة الأمامية، المخطط والحصين تحت مجهر تشريحي باستخدام مشرط وإبرة.
- توطين القشرة السمعية باستخدام المعالم البصرية على دماغurface مثل الأوعية الدموية وشكل السطح (Bregma -2.06 إلى -3.4، حجم rostrocaudal 2 مم، ظهري بطني 1.3 مم) وتشريح ثنائيا ككتلة النسيج مستطيلة مع سمك القشرة.
- تشريح القشرة الأمامية بمثابة شريحة الدماغ بين Bregma 3.56 و 1.54 باستخدام البصرية للالتصالبة كمعلم وباستثناء الأنسجة من شمية بصلة.
- تشريح الجسم المخطط بمثابة شريحة الدماغ بين Bregma 1.54 و 0.5 وإزالة بعناية الأنسجة القشرية.
- تشريح الحصين عن طريق تحديد الدماغ مع الإبرة من خلال المخيخ وuncoiling القشرة بدءا من الفص القذالي.
- صدمة تجميد تشريح عينات الدماغ في النيتروجين السائل وتخزينه في -80 درجة مئوية.
2. إعداد Synaptosomes أو بدلا من ذلك على كثافة بعد المشبكي (PSD) جزء -enriched
ملاحظة: خلال جميع الإجراءات، والحفاظ على العينات ومخازن في 0-4 درجة مئوية.مخازن تحتوي على المخفف الطازج الكوكتيل مثبط البروتياز من أجل منع تدهور بروتين من البروتينات. إذا درست أيضا الفسفرة البروتين، كوكتيلات الفوسفاتيز المانع يجب أن تضاف. يتم إعطاء كل القيم ز مبينا أنها ز (المتوسط) في جميع أنحاء بروتوكول كله.
- إعداد جزء غشاء الخام (الشكل 3A)
- نقل تشريح أنسجة المخ في وعاء التجانس التي تحتوي على 1 مل الجليد الباردة العازلة ألف (5 ملي HEPES، 320 ملي السكروز، ودرجة الحموضة 7.4) والتجانس الأنسجة في 900 دورة في الدقيقة مع 12 السكتات الدماغية.
- عينات الطرد المركزي في 1000 x ج لمدة 10 دقيقة. الحفاظ على supernatants.
- إعادة التجانس الكريات في نفس الظروف في نفس الحجم من العازلة التجانس كما كان من قبل وعينات الطرد المركزي مرة أخرى في 1000 x ج لمدة 10 دقيقة. الجمع بين supernatants المقابلة. تجاهل P1 الكريات، والتي تحتوي أساسا النوى والحطام الخلية.
- تدور supernatants جنبا إلى جنب لمدة 20 دقيقة في 12000 ز س. superna تخلصيtants أو استخدام لمزيد من التجزئة 11.
- الكريات Resuspend في نفس الحجم من العازلة التجانس كما كان من قبل باستخدام الخالط مع 6 السكتات الدماغية في 900 دورة في الدقيقة وتدور في 12000 x ج لمدة 20 دقيقة. supernatants تجاهل. الكريات P2 تمثل الكسور غشاء الخام.
- تنقية synaptosomes من كسور غشاء الدماغ الخام (الشكل 3A)
ملاحظة: يمكن فصل أجزاء غشاء الدماغ الخام إلى المايلين، الأغشية الخفيفة، synaptosomes والميتوكوندريا باستخدام السكروز كثافة خطوة التدرج تنبيذ فائق. لهذا الرقم الهيدروجيني 5 ملي تريس / حمض الهيدروكلوريك مطلوبة 8.1 المخازن التي تحتوي على السكروز في أي 0.32 م، 1.0 م أو 1.2 M التركيز.- أثناء تنفيذ الطرد المركزي لإنتاج الكسور P2، وإعداد التدرجات خطوة السكروز في أنابيب نابذة فائقة السرعة. بدء مع 2.5 مل 1.0 M عازلة السكروز والطبقة الفرعية مع 1.5 مل 1.2 M عازلة السكروز باستخدام الماصة الزجاج باستور.
- إعادة التجانس كسور P2في 0.5 مل من العازلة 0.32 M السكروز يدويا مع 6 السكتات الدماغية والحمل على الجزء العلوي من التدرج.
- تدور في 85000 x ج لمدة 2 ساعة في نابذة فائقة السرعة باستخدام الدوار الدلو المتأرجح.
- تجاهل أعلى 0.32 M طبقة السكروز بما في ذلك المواد في واجهة إلى المخزن المؤقت السكروز 1.0 M (المايلين، الأغشية الخفيفة). جمع synaptosomes في واجهة عازلة السكروز 1.0 / 1.2 م. بيليه في الجزء السفلي من أنبوب يحتوي على الميتوكوندريا.
- إضافة العازلة 0.32 M السكروز إلى جزء synaptosomal في نسبة 1: 1، مزيج بعناية وتدور في 150000 x ج لمدة 1 ساعة. Synaptosomes هي في بيليه ويمكن الآن معلق في المخزن المؤقت المطلوب لمزيد من المعالجة.
- إعداد جزء التخصيب PSD (الشكل 3B)
- التجانس كل منطقة محددة في الدماغ من حيوان واحد في 100 استخراج العازلة ميكرولتر (5 ملي تريس / حمض الهيدروكلوريك درجة الحموضة 8.1، و 0.5٪ تريتون X-100) في أنبوب نابذة ميكرولتر 200 مع (بوليتيترافلوريثيليني) مدقة PTFEفي 2000 دورة في الدقيقة مع 12 السكتات الدماغية.
- إضافة 100 ميكرولتر استخراج العازلة، ومزيج احتضان لمدة 1 ساعة على 4 درجات مئوية. تدور باستمرار في 100000 x ج لمدة 1 ساعة وجمع طاف S1 بعناية مع الماصة 200 ميكرولتر.
- إعادة التجانس بيليه P1 في نفس أنبوب مع 100 استخراج العازلة ميكرولتر مرة أخرى مع مدقة PTFE في 2000 دورة في الدقيقة مع 12 السكتات الدماغية.
- إضافة 100 استخراج العازلة ميكرولتر وتخلط جيدا مع ماصة وتدور في 100000 x ج لمدة 1 ساعة.
- الجمع بين S2 طاف مع S1 إلى جزء من البروتين القابلة للذوبان. هذا جزء يحتوي على البروتينات عصاري خلوي، و 0.5٪ تريتون X-100 بروتينات الغشاء القابلة للذوبان وجزيئات المصفوفة خارج الخلية.
- Resuspend وبيليه المتبقية في 50 ميكرولتر 5 ملي تريس / حمض الهيدروكلوريك درجة الحموضة 8.1. هذا جزء يحتوي على عناصر أمنية خاصة، أغشية مقاومة للمنظفات، عناصر هيكل الخلية غير قابلة للذوبان، الميتوكوندريا والحطام الخلية بما نوى. غير المخصب في شعبة القطاع الخاص والتي تشكل جوهر الهياكل بعد المشبكي ولكن أيضا أجزاء مهمة من قبل المشبكيcytomatrix في منطقة نشطة. عامل لتخصيب اليورانيوم من عناصر أمنية حوالي 4 وثبت في إثراء مكونات مديرية الأمن العام سابقا. 12
3. إعداد نموذج لقياس الطيف الكتلي
- تحلل وتطبيع عينة
ملاحظة: التطبيع نموذج بشأن تركيز البروتين هو خطوة حاسمة جدا لتحقيق أخيرا البيانات الكمية يمكن الاعتماد عليها حتى لضعف التغييرات التعبير بروتين متشابك.- حل synaptosomes أو مستحضرات المخصب مديرية الأمن العام من كل منطقة في الدماغ حيوان في 20 - 50 ميكرولتر (تعتمد على الكمية الكلية للمواد: لالقشرة السمعية مع 5 - استخدام الأنسجة 15 ملغ 20 ميكرولتر) من 8 M اليوريا واحتضان على الجليد لمدة 1 ساعة في حمام بالموجات فوق الصوتية.
- للهضم في جل، حل synaptosomes مباشرة في المنطقة العازلة SDS عينة. بعناية حساب كمية تحميل لتجنب الحمل الزائد من هلام. نظر أنه في هذه الحالة، وارتفاع وفرة protei سقالةسيتم فقدان نانوثانية خلال الكهربائي للهلام وفي جل هضم.
- تمييع مع 1٪ من المنظفات القابلة للإزالة لضمان تركيز النهائي من 2 M اليوريا. تجنب أي درجة حرارة أعلى من 30 درجة مئوية إلى منع كربملة البروتين.
- أداء SDS-PAGE مع قسامة (على سبيل المثال 10 ميكرولتر) من العينة وفقا للاجراءات المتبعة 13،14.
- وصمة عار الجل مع Coomassie الأزرق وفقا لبروتوكول الشركة المصنعة. الإجراء يجمع بين خطوة تحديد وتلطيخ مع الميثانول وحمض الخليك.
- تحديد كثافة ضوئية من كل عينة لحارة كله مع ماسح ضوئي هلام معايرة في اسطة نقل وحساب كمية البروتين النسبي.
- تطبيع العينات وفقا لهذه الحسابات.
- تقسيم كل عينة إلى قسمين مختلفين. استخدام ثلث للهضم في جل وثلثي لفي-حل هضم.
- حل synaptosomes أو مستحضرات المخصب مديرية الأمن العام من كل منطقة في الدماغ حيوان في 20 - 50 ميكرولتر (تعتمد على الكمية الكلية للمواد: لالقشرة السمعية مع 5 - استخدام الأنسجة 15 ملغ 20 ميكرولتر) من 8 M اليوريا واحتضان على الجليد لمدة 1 ساعة في حمام بالموجات فوق الصوتية.
- في جل الهضم
- فصل جل
- إجراء الثانية SDS-PAGE باستخدام عينات تعديل التركيز. وصمة عار وتحديد المواد الهلامية للمرة الثانية للتحقق من جودة التطبيع.
- قطع كل حارة من عينة داخل هلام في مجالات مختلفة (8 / حارة) ولكن استبعاد نطاق الوزن الجزيئي فوق 170 كيلو دالتون. ونقل القطع هلام في أنابيب منفصلة.
- قطع المناطق في قطع صغيرة (حوالي 1 × 1 مم) مع مشرط حاد لتسهيل في جل الهضم فعالية.
- ملخص 15
- غسل القطع هلام عدة مرات (اعتمادا على شدة تلطيخ) لمدة 10 دقيقة مع 50-150 ميكرولتر من منطقة عازلة مكونة من 50٪ الأسيتونتريل (إيه سي) و 50 ملي بيكربونات الأمونيوم (NH 4 HCO 3).
- إزالة supernatants. تغطية القطع هلام مع إيه سي واحتضان عند 20 درجة مئوية حتى تصبح القطع هلام البيض ويتقلص.
- إزالة ACN وترطيب القطع هلام لمدة 5دقيقة مع 50 ميكرولتر من 0.1 M NH 4 HCO 3. إضافة نفس الحجم من ACN واحتضان لمزيد من 15 دقيقة عند 37 درجة مئوية.
- إزالة والتخلص السائل تماما. تجفيف القطع هلام في جهاز للطرد المركزي فراغ.
- ترطيب القطع هلام في 50 ميكرولتر من NH 4 HCO 3 تحتوي على 10 ملي dithiothreitol (DTT) وعينات الحرارة لمدة 45 دقيقة عند 56 درجة مئوية للحد من بقايا السيستين.
- إزالة supernatants وإضافة 50 ميكرولتر NH 4 HCO 3 تحتوي على 55 ملي iodoacetamide (IAA) لمدة 30 دقيقة في الظلام لcarbamidomethylate خفض cysteines.
- إزالة وتجاهل كل السائل فوق قطع جل وغسلها مرتين مع 50 ميكرولتر NH 4 HCO 3 وإيه سي (1: 1) لمدة 10 دقيقة لإزالة أي IAA المتبقية. العينات الجافة في جهاز للطرد المركزي فراغ.
- لهضم محدود من البروتينات إضافة 25 ملي NH 4 HCO 3 تحتوي على 12.5 نانوغرام / ميكرولتر من التربسين. الحجم المطلوب يعتمد على حجم وكمية من هلام صieces. احتضان لمدة بضع دقائق ومعرفة ما اذا كان يتم امتصاص العازلة. إضافة المزيد من عازلة إذا لزم الأمر، وقطع هلام يجب أن تكون مغطاة بالكامل. احتضان عند 37 درجة مئوية بين عشية وضحاها (دقيقة 12 ساعة).
- استخراج الببتيد
- قطع هلام تراكب مع 10-20 ميكرولتر من 25 ملي NH 4 HCO 3 وتضيف نفس الحجم من إيه سي. احتضان لمدة 10 دقيقة على الجليد باستخدام حمام بالموجات فوق الصوتية. بعد ذلك إزالة وجمع supernatants والتي تحتوي على أكثر من الببتيدات التي تم إنشاؤها.
- إضافة 100 ميكرولتر من استخراج العازلة التي تحتوي على 30٪ ACN حمض trifluoroacetic / 0.1٪ (TFA) إلى قطع هلام. كرر حضانة في حمام بالموجات فوق الصوتية، وجمع بعناية هذا طاف.
- كرر الخطوات استخراج الماضية عن طريق زيادة تركيز ACN إلى 50٪. بعد 10 دقيقة من حمام بالموجات فوق الصوتية تدور باستمرار، وجمع supernatants.
- الجمع بين جميع supernatants المقابلة ثلاثة من خطوات استخراج وتجفيفها في جهاز للطرد المركزي فراغ. لاحظ أننتيجة الفصل هلام يتم الجمع بين 8 مناطق في حارة / عينة لعينة واحدة مرة أخرى في هذه الخطوة.
- فصل جل
- في-حل الهضم
- هضم
- استخدام المبلغ المحسوب (على سبيل المثال 100 ميكرولتر من المحللة 150 ميكرولتر، ويعتمد على كمية المواد والحجم المطلوب لإعادة تعليق لعينة من منطقة محددة في الدماغ) من عينات طبيعية للحصول على مواد انطلاق كافية لا يقل عن ثلاث مكررات التقنية ل أداء قياس الطيف الكتلي خالية من التسمية.
- إضافة 2 ملي DTT في 25 ملي NH 4 HCO 3 ودوامة بلطف العينة. الحد من العينات لمدة 45 دقيقة عند 20 درجة مئوية.
- إضافة 10 ملي IAA إلى carbamidomethylate بقايا السيستين. خلط واحتضان لمدة 30 دقيقة في الظلام عند 20 درجة مئوية.
- أخيرا، إضافة 1 ميكرولتر من محلول المخزون التربسين (1 ميكروغرام / التربسين ميكرولتر في 25 ملي حمض الخليك)، واحتضان عند 20 درجة مئوية لمدة 12 ساعة.
- استخراج المرحلة الصلبة (SPE) -Purification
- لإزالة حمض المنظفات شطورة، وضبط العينات إلى تركيز النهائي من 1٪ TFA واحتضان لمدة 1 ساعة على 20 درجة مئوية.
- عينات الطرد المركزي في 16000 x ج لمدة 10 دقيقة وبعناية جمع supernatants.
- ضع عمود SPE في رفوف وتتوازن المصفوفة مع 2 مل الميثانول. غسل مرتين مع 2 مل من 0.1٪ TFA في الماء (B العازلة).
- إضافة 2 مل من B العازلة وتحميل عينة. يغسل ثلاث مرات أخرى.
- أزل الببتيدات بإضافة 200 ميكرولتر 70٪ ACN / 0.1٪ TFA. كرر هذه الخطوة.
- تجمع كلا eluates وتجفيفها عليها في جهاز للطرد المركزي فراغ.
- هضم
- الفوسفات الببتيد اليورانيوم من قبل تيو 2 اللوني 16
- حل الببتيدات التي تنتجها في جل أو في حل الهضم في 150 ميكرولتر من 80٪ ACN / 2.5٪ TFA (عازلة C) وتتوازن ~ 2 ملغ من الخرز تيو 2 في 50ميكرولتر من العازلة C.
- إضافة حبات العينة واحتضان في جهاز الدوران لمدة 1 ساعة عند 20 درجة مئوية. بعد ذلك، وتدور الخرز أسفل (16000 x ج، 1 دقيقة)، وجمع supernatants.
- تغسل حبات ثلاث مرات مع 100 ميكرولتر من العازلة C عن طريق خلط بلطف والغزل منصبه بعد 5 دقائق. جمع supernatants. كرر هذه الخطوة ثلاث مرات مع 100 ميكرولتر من 80٪ ACN / 0.1٪ TFA تليها ثلاث غسلات مع 100 ميكرولتر من 0.1٪ TFA (بدون ACN)، على التوالي.
- الجمع بين جميع supernatants عشرة، وتجفيفها في جهاز للطرد المركزي فراغ والتعامل معها باعتبارها جزء المنضب الفوسفات الببتيد لمزيد من تنقية وفقا خطوة 3.5.
- أزل ملزمة الفوسفات-الببتيدات مع 20 ميكرولتر من 400 ملي NH 4 OH / 30٪ ACN من الخرز. كرر هذه الخطوة ثلاث مرات، وجمع كل supernatants بعد الغزل أسفل الخرز.
- الجمع بين eluates للهضم في جل والحل في الهضم من عينة والتعامل معها باعتبارها الفوسفات فجزء-eptide المخصب. تجفيفها في جهاز للطرد المركزي فراغ إلى الحجم النهائي من 4-8 ميكرولتر.
- التركيز وإزالة الأملاح من كسور المنضب الفوسفات الببتيد من قبل الصغرى SPE
- حل الببتيدات المجففة في 20 ميكرولتر من TFA 0.1٪.
- تتوازن الثابتة C 18 -matrix عن طريق رسم 20 ميكرولتر ACN إلى الحافة. غسل المصفوفة عن طريق رسم TFA 0.1٪ في الماء إلى الحافة. كرر هذه العملية ثلاث مرات.
- ببطء تحميل عينة المحمض في تلميح (كرر هذه الخطوة ثلاث مرات).
- غسل C 18 -matrix ثلاث مرات مع 20 ميكرولتر 0.1٪ TFA في الماء وتجاهل حل الغسيل.
- أزل الببتيدات من طرف ماصة من قبل مرارا وتكرارا (3 مرات) رسم 20 ميكرولتر من 70٪ ACN / 0.1٪ TFA وجمع هذا الحل شطف في أنبوب منفصل.
- الجمع بين eluates لعينة وتجفيفها في جهاز للطرد المركزي فراغ.
4. تحليل بروتيوم
<يتم تنفيذ بروتيوم التحليل على الهجين المزدوج الضغط الخطية ايون فخ / orbitrap مطياف الكتلة مجهزة HPLC جدا: p> ملحوظة. يتكون HPLC من الاوتوماتيكى تبريدها باستخدام حقن حلقة 20 ميكرولتر، مضخة الثنائية تحميل (المدى تدفق ميكرولتر)، وثنائي تدفق نانو مضخة الانفصال، سخان عمود مع اثنين الصغيرة تبديل الصمامات والغاز الراحل. يتعرضون عينات أولا إلى عمود محاصرة (على سبيل المثال 100 ميكرون × 2 سم) بمعدل تدفق من 7 ميكرولتر / دقيقة يليه فصل على عمود (على سبيل المثال 75 ميكرون × 25 سم) في 250 نيكولا لانغ / دقيقة. ويقترن منفذ عمود الفصل مباشرة إلى المغلفة بيكو طرف باعث وضعه في واجهة نانو رذاذ على مصدر مطياف التأين الشامل.- نانو السائل اللوني والكتلة جنبا إلى جنب الطيف
- حل عينات الببتيد في 12 ميكرولتر 2٪ ACN / 0.1٪ TFA لمدة 30 دقيقة على الأقل. تدور باستمرار لمدة 15 ثانية، ونقل 11 ميكرولتر طاف لالاوتوماتيكى قارورة (مخروطي الشكل، وانخفاض diameteص).
- إعداد نظام آلي لتطبيق نموذج، الفصل الكروماتوغرافي وجنبا إلى جنب مطياف الكتلة في السيطرة على برنامج (على سبيل المثال، Xcalibur) على النحو التالي.
- استخدام التالية لدرجة الحرارة: الاوتوماتيكى: 5 درجة مئوية. فرن العمود: 45 ° C.
- استخدام التالية للحقن: حجم: 10 ميكرولتر. معدل التدفق: 7 ميكرولتر / دقيقة (2٪ ACN، 0.1٪ TFA)؛ الوقت: 8 دقائق. وضع صمام: عمود فخ - النفايات؛ الشامل اكتساب المواصفات: إيقاف.
- استخدام التالية للفصل: معدل التدفق: 250 NL / دقيقة صمام الإعداد: فخ العمود عمود الفصل. اكتساب المواصفات الشامل: على.
0 دقيقة - 100 دقيقة: 2٪ ACN، 0.1٪ حمض الفورميك - 40٪ ACN، 0.1٪ حمض الفورميك
100 دقيقة - 105 دقيقة: 40٪ ACN، 0.1٪ حمض الفورميك - 95٪ ACN، 0.1٪ حمض الفورميك
105 دقيقة - 109 دقيقة: 95٪ إيه سي وحمض الفورميك بنسبة 0.1٪
109 دقيقة - 120 دقيقة: 2٪ إيه سي وحمض الفورميك بنسبة 0.1٪ - استخدام التالية لإعدادات مطياف الكتلة: MS كاملة: في Ftms. قرار 60،000. م / ض نطاق 400 - 2000؛ الآنسة/MS: خطي Iontrap. حد أدنى إشارة 500. عرض العزلة 2 دا. دينامية استبعاد تحديد الوقت 30 ثانية؛ يتم استبعاد أيونات مشحونة منفردة-من الاختيار؛ يتم تعيين طاقة الاصطدام تطبيع إلى 35٪، ووقت التنشيط إلى 10 ميللي ثانية.
ملاحظة: يتم اتباع مسح MS الكامل بنسبة تصل إلى 15 LTQ MS / MS يدير باستخدام الاصطدام التي يسببها تفكك (CID) من أيونات الببتيد الأكثر الكشف عن بوفرة.
- تشغيل ثلاث مكررات التقنية لجميع العينات.
- تحديد البروتين والتسمية الكمي مجانا
- معالجة البيانات الخام الطيفي الشامل نحو تحديد البروتين وتقدير التسمية خالية الاستفادة مجموعة التجاري البرمجيات (على سبيل المثال، ذروات ستوديو). وعلى النقيض من معظم حزم البرمجيات بروتيوم أخرى يستخدم هذا البرنامج بشكل خاص على دي نوفو -sequencing خوارزمية قبل التحالفات قاعدة بيانات البروتين. ومع ذلك، هذه الخطوة يمكن أن تكون بديلا بسهولة من قبل غيرها من حزم البرامج شعبية.
- استخدام وفاق سطيفإعدادات ential المدرجة في الجدول 2.
- الفوسفات-البروتينات
ملاحظة: يتطلب اقتناء الفوسفات الببتيد كفاءة وموثوق بها بضعة تغييرات أساسية في الإعداد سير العمل البروتين.- بعد تخصيب الفوسفات الببتيد، وعينات أبدا جافة تماما. دائما الاحتفاظ بعينات المنحل.
ملاحظة: السندات الفوسفات استر من threonines فسفرته أو serines هش جدا. خلال تجزئة الناجم عن الاصطدام داخل فخ ايون هذا يؤدي إلى خسارة محايدة من الفوسفات. هذا يمنع أي تجزئة مزيد من الببتيد، والذي بدوره هو مطلوب لتحديد الهوية. يسمح النطاق العريض التنشيط في الإعداد قياس الطيف الكتلي يسمح تفتيت الفوسفات-الببتيدات حتى بعد خسارة محايدة من مجموعة فوسفات. فإنه يؤدي إلى توفير الوقت "شبه MS 3". تقرير الموقع الفوسفات في البيانات MS / MS يتطلب التحقق وتقييم معين، ويمكن أن يقوم بها الليومينيوفورات 3.0.
- بعد تخصيب الفوسفات الببتيد، وعينات أبدا جافة تماما. دائما الاحتفاظ بعينات المنحل.
5. المعلوماتية الحيوية - التحليل التلوي
ملاحظة: قبل تنفيذ الشرح الوظيفي وتحليل الشبكة، وقوائم البروتين يجب أن تكون preprocessed. أولا دمج القوائم من البروتينات تنظم والفوسفات-الببتيدات لكل منطقة في الدماغ بشكل منفصل. قم بإزالة كافة تكرار يونيبروت معرفات لكل جزء لمنع سوء الفهم.
- تحليل تخصيب المفرد مع GeneCodis 17
- فتح أداة على شبكة الإنترنت من GeneCodis (http://genecodis.cnb.csic.es)
- حدد "العضلة المصحف" كما كائن و"GO عملية بيولوجية"، كما شرح.
- لصق قائمة يونيبروت معرفات من جزء معين. إرسال والانتظار حتى يتم تنفيذ تحليل. انقر على "تحليل إثراء المفرد من عملية GO البيولوجية" وعرض النتائج.
- كرر الخطوة 5.1.3 لكسور الثلاثة الأخرى.
- لمعرفة أي الازدواجية والتقاطعات بين القوائم نتيجةاستخدام لغة البرمجة مثل بيرل أو بيثون لتصفية البيانات اللازمة. أدوات مماثلة لتحليل تخصيب المفرد هي DAVID (https://david.ncifcrf.gov/) وCytoscape (http://www.cytoscape.org/) مع الإضافات البنغو (http://apps.cytoscape.org/ التطبيقات / بنغو) وClueGO (http://apps.cytoscape.org/apps/cluego).
- توليد الرسم البياني على أساس قوة من البيانات GeneCodis مع Gephi (https://gephi.org/)
ملاحظة: البيانات عن الرسوم البيانية لابد من المقدمة من قبل المستخدم، إما في شكل رسم بياني (.gexf، .graphml، .DOT، .gv، .gml) أو إدخالها يدويا.- توليد العقد الرسم البياني
- باليد: توسيع Gephi وانقر على "مختبر البيانات". إنشاء العقد. انقر على "العقد" على اليسار للتبديل إلى الطاولة "العقد". انقر على "أضف العقدة". أدخل اسم الأجل. انقر على زر "موافق" / الصحافة أدخل.
- البديل: حفظ GeneCodis يؤدي إلى جهاز الكمبيوتر. فتح. TXT مع برنامج جداول البيانات. حذف كافة الصفوف exceحزب العمال من (أسماء المدى) "Item_Details". تغيير رأس "Item_Details" إلى "تسمية". حفظ جدول باسم "بتنسيق csv". الآن في Gephi، انقر على "استيراد جدول بيانات". اختيار جدول من ملف المتصفح من Gephi. انقر على زر "التالي". انقر على "إنهاء".
- ربط العقد عبر الحواف.
- انقر على "الحواف" على اليسار للتبديل إلى الطاولة "الحواف". لكل عقدة (المدى): بحث عن أسماء الجينات في شروط أخرى. إذا مشترك واحد أو أكثر من الجينات -> إنشاء الحافة.
- انقر على "أضف الحافة". حدد "غير موجهة". حدد مصدر والعقدة الهدف من القوائم المنسدلة. انقر على زر "موافق" / الصحافة أدخل. وإذا تم نشر أكثر من جين واحد، أدخل وفرة في "الوزن" (الجدول).
- القوة القائمة على تخطيط بياني.
- فتح ملف بيانات الرسم البياني، تعيين نوع الرسم البياني إلى "صليات" أو استخدام البيانات كما دخلت من جهة، انقر على "نظرة عامة" في حالة عدم اختيارهم بالفعلد.
- تغيير حجم العقد اعتمادا على وفرة من الترابط. انقر على الإحصاء، تشغيل إما "متوسط درجة" (حواف غير المرجحة) أو "متوسط درجة الموزونة" (حواف المرجح) تحت عنوان "نظرة عامة الشبكة". في "المظهر"، انقر على "العقد"، ثم على زر الحجم، بجانب اختيار "سمات" وتعيين سمات المعلمة إلى "متوسط درجة الموزونة" أو "متوسط درجة". انقر فوق تطبيق.
- وأخيرا: حدد "قوة الأطلس" في "تخطيط" وتشغيل. تغيير "قوة تنافر" إذا العقد وتصطدم.
- تصدير إلى الصورة.
- ميزة قطة: انقر على "نظرة عامة"، والتخطيط الرسم البياني التغيير، سمك الحافة، وحجم التسمية والتوسع مع القائمة في الجزء السفلي من نافذة "الرسم البياني". انقر على زر الكاميرا اليسار، وحفظ الصورة.
- ميزة تصدير "معاينة": انقر على "معاينة". تغيير إعدادات مسبقة ل"الافتراضي على التوالي". تغيير الإعداداتالصورة وفقا لتفضيلات اختيار وانقر على "SVG / PDF / PNG" للتصدير.
- توليد العقد الرسم البياني
النتائج
ويلخص الشكل 1 سير العمل كاملة من الكمية التنميط بروتيوم متشابك من مناطق مخ الفأر بعد تعلم التمييز السمعي. ويبدأ مع تدريب الحيوانات في مربع المكوك. في المثال هو موضح في الشكل 2، بدأت الفئران لإظهار كبيرا تمييز لهجة وزير الخارجية في الدورة التدريبية ال 4، مشيرا إلى التعلم الفعال. التضحية الحيوانات في نقاط زمنية محددة لتشريح منطقة الدماغ. إثراء المطلوب من نقاط الاشتباك العصبي ويمكن أن يتحقق ذلك إما إعداد synaptosomes أو بدلا من ذلك عن طريق إعداد جزء التخصيب مديرية الأمن العام، على حد سواء وصفت بالتفصيل في الشكل 3. وقد تم تطوير طريقة PSD لتخصيب لكميات الأنسجة منخفضة، وعلى سبيل المثال 1 - 2 شرائح الحصين من دماغ الفئران 12 و 18. ويتطلب ذلك أنابيب صغيرة، المدقات PTFE المناسب لهذه الأنابيب، ومختبر الحفر حملة لتوفير الطاقة للمدقة.
ويرجع ذلك إلى تكوين بروتين معين من synaptosomes، فمن نوصي بشدة لأداء إعداد العينات بطريقتين مختلفتين ولكنهما متكاملان. السقالات من عناصر أمنية خاصة غالبا ما تكون مرتفعة جدا البروتينات ذات الوزن الجزيئي التي تحدث في رياضيات الكيمياء عالية. في-حل هضم هو أفضل وسيلة لاستخراجها بكفاءة ولكن قد يؤدي إلى الإفراط في خليط الببتيد الذي تم إنشاؤه. وفي جل هضم يؤديها من نفس العينة بالتوازي يمكن استبعاد تلك البروتينات عالية الوزن الجزيئي ويفضل تحليل البروتينات مع المتوسطة وانخفاض الوزن الجزيئي. إجراء تحليل شامل ينصح كلا النوعين من هضم البروتينات.
تتطلب كميات مختلفة من الأنسجة من مناطق الدماغ التحقيق تعديلا للمادة بطلب للحصول على أفضل مقارنة. ضمن مناطق الدماغ أربعة التحقيق في القشرة السمعية بشكل عام حقيقة الحدأو. المواد من جميع مناطق الدماغ الأخرى يجب بعناية تعديلها لكمية من القشرة السمعية بعد إعداد synaptosomes أو الكسور المخصب مديرية الأمن العام (انظر 3.1.1). الأوزان نموذجية من مناطق الدماغ الطازجة من الفئران هي على النحو التالي: القشرة السمعية (AC): ~ 50 ملغ. الحصين (HIP): ~ 90 ملغ. المخطط (STR): ~ 120 ملغ و القشرة الأمامية (FC): ~ 100 ملغ.
طريقة PSD-التخصيب هو موضح في القسم 2.3 يسمح تحديد ما يقرب من 1500 البروتينات المختلفة وحوالي 250 مختلفة الفوسفات-الببتيدات في منطقة الدماغ على مستوى حيوان واحد (الجدول 1). وكشف تحليل البروتين 24 ساعة بعد انتهاء الدورة التدريبية الأولى التي 7.3٪ من البروتينات التي تم تحديدها و 5.8٪ من الفوسفات-الببتيدات أظهرت معنوي (p <0.05) التغيرات الكمية في التعبير عنها متشابك مقارنة مع الضوابط ساذجة (الجدول 1). وهناك اتجاه واضح لالعاديه أسفل نشوئها السقالات متشابك قد يشير إلى إعادة ترتيب واضح للبنية متشابك خلال المراحل الأولى من التعلم FMTD. تم تغيير الغالبية العظمى من البروتينات تنظم في الدماغ بطريقة منطقة معينة، في حين وجدت فقط 22٪ إلى أن ينظم في اثنين أو أكثر من مناطق الدماغ. وأظهرت ستة أمثلة مختارة في الشكل (4).
التلوي تحليل النتائج المعقدة التي IPA دليلا لمشاركة معينة / التلاعب في مسارات الكنسي التالية: "بوساطة بالكلاذرين الإلتقام اشارة"، "محور عصبي توجيه اشارة"، "اشارة الكالسيوم"، "RhoA اشارة"، "الشق اشارة "،" إعادة عرض من طلائي الملتصقة المفارق "،" مستقبلات الغلوتامات اشارة "،" GABA مستقبلات اشارة "،" مستقبلات الدوبامين اشارة "و" متشابك طويل الأجل التقوية ".
في الصفحة = "1"> كشف تحليل تخصيب احد العمليات الحيوية الزائدة التمثيل كبيرة في القشرة الأمامية المتعلقة بالنقل البروتين، والتصاق الخلايا، الفسفرة، الإلتقام والنقل بوساطة حويصلة، وتطوير الدماغ الأمامي وaxonogenesis (الشكل 5). في العمليات البيولوجية القشرة السمعية بما في ذلك النقل أيون، والترجمة والنقل مرنا، كان نقل البروتين والتعلم ملحوظ. تحليل نسبة البروتين في قرن آمون يكشف إلى حد كبير عمليات التخصيب المتعلقة بالنقل أيون، دورة الخلية، والترجمة، الفسفرة وتطوير النظام العصبي. في المخطط، تمثيل زائد تم العثور على العمليات البيولوجية بما في ذلك النقل مرنا والنقل بوساطة حويصلة، axonogenesis، التحلل البروتيني، نقل البروتين والإلتقام.
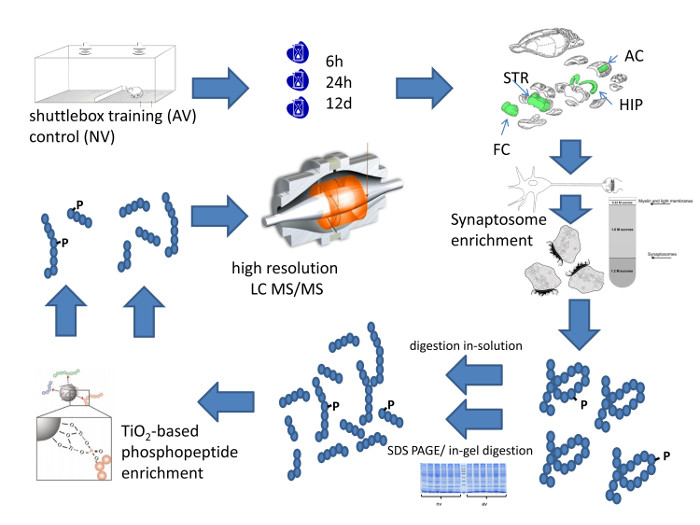
الشكل 1: منهجي Workfloث من المقاربة المنهجية. هذا الرقم يلخص الخطوط العريضة لسير العمل عالية الدقة التنميط الكمي لمنطقة محددة في الدماغ تكوين بروتين متشابك. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: مثال لأداء الفئران في لهجة FM التمييز المهام. تظهر الحيوانات تزايد معدل ضربات (المنحنى الأزرق) ومعدل تناقص الانذارات الكاذبة (المنحنى الأسود) في دورة من الدورات التدريبية. يحدث تمييزا كبيرا من الدورة الرابعة. يتم توفير أشرطة الخطأ كما SEM. الرجاء انقر هنا لعرض لارنسخة الالماني من هذا الرقم.

الشكل (3): إعداد جسيم مشبكي والكسر المخصب PSD. ج: إعداد جسيم مشبكي. باء: التخصيب PSD إعداد الكسر. كلا الرقمين توضح سير العمل المفصل من إعداد synaptosomes أو الكسور بدلا من ذلك PSD مخصب من أنسجة المخ. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
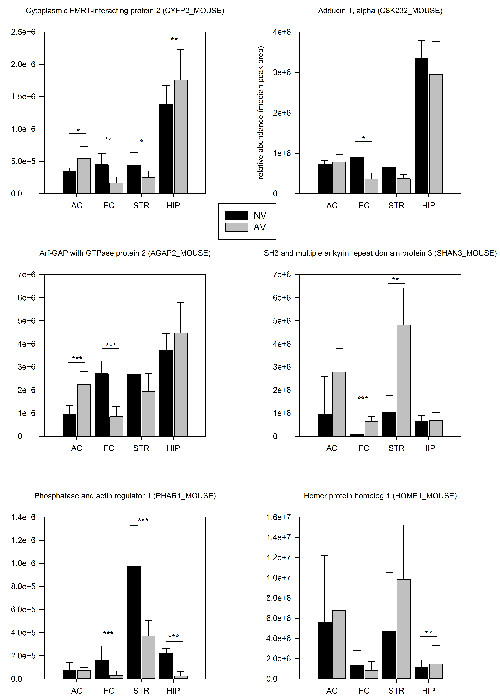
الشكل 4: تحديد نتائج الكمي [بروتيوميك. تتم مقارنة وفرة متشابك النسبية للبروتينات اختيار بين هيئة تنظيم الاتصالات الفئرانINED على المهمة FMTD (AV، ن = 6) والسيطرة على الفئران ساذجة (NV، ن = 6) 24 ساعة بعد الدورة التدريبية الأولى. تم حساب القيم وفرة كما المتوسط للمناطق ذروة الببتيدات ثلاثة أشد من البروتين. يتم وضع علامة داخل المؤامرات، البروتينات مع تغييرات كبيرة وفرة اختبار (ت AV / NV): * ف <0.05، ** ف <0.01 ***، ف <0.005. يتم توفير أشرطة الخطأ كما SD. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 5: تصور البيولوجية ممرات للالقشرة الأمامية التي كتبها GeneCodis / Gephi. فقط حيث كبيرة من الجينات علم الوجود (GO) قاعدة البيانات (http://geneontology.org) المرتبطة ب "عملية بيولوجية" مع الحد الأدنى من عدد من البروتين من ثلاثة وتظهر هنا. العقد تمثل الشروط GO، وحجم العقدة، عرض الخط وعدد من الاتصالات من عقدة معينة تصور عدد من البروتينات، التي تشترك هذه GO الأمد مع العقد الأخرى. ونظرا لطريقة "قوة الأطلس" من Gephi، عقد ذات الصلة وتجمع معا بشكل وثيق. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| منطقة في الدماغ | AC | FC | ورك او نتوء | 000 "وجها =" Calibri "حجم =" 3 "> STR | Σ |
| البروتينات التي تم تحديدها | 1435 | 1758 | 1572 | 1507 | 6272 |
| البروتينات المنظمة (ع <0.05) | 59 | 130 | 162 | 108 | وجه = "Calibri" حجم = "3"> 459 |
| ↑ AV / NV | 8 | 4 | 76 | 35 | 123 |
| ↓ AV / NV | 51 | 126 | 86 | 73 | 336 |
| phosphomoti التي تم تحديدها خ | 197 | 361 | 273 | 278 | 1109 |
| phosphomotifs التنظيم (ع <0.05) | 8 | 22 | 21 | 14 | 65 |
| ↑ AV / NV | 4 | 00000 "وجها =" Calibri "حجم =" 3 "> 17 | 5 | 9 | 35 |
| ↓ AV / NV | 4 | 5 | 16 | 5 | 30 |
الجدول 1: ملخص لنتائج البروتيومية. يلخص هذا الجدول تجربة البروتين تمثيلية من الفئران المدربة (AV، ن = 6) 24 ساعة بعد الدورة التدريبية الأولى مقارنة بالمجموعة الضابطة البسطاء (NV، ن = 6). المبلغ 459 البروتينات تنظم يشمل أنظمة متداخلة. تم تحديد 283 اللوائح المختلفة وخاصة الدماغ. في التفاصيل، ويتم تنظيم 57 البروتينات في مناطق الدماغ اثنين، تم الكشف عن 18 وائح البروتين في ثلاث مناطق الدماغ وتنظم البروتينات فقط 2 في كل مناطق الدماغ أربعة التحقيق.
| التحمل خطأ | |
| السلائف كتلة (تحويل فورييه الطيفي) | 10 جزء في المليون |
| كتلة جزء أيون (الخطي فخ أيون) | 0.6 دا |
| الانشقاقات غاب القصوى في الببتيد | 3 |
| تعديلات الثابتة | |
| لفي وهضمها هلام عينات | Carbamidomethylation من سيستين |
| للعينات في حل هضم | Methylthiolatioن من سيستين |
| التعديلات متغير | أكسدة الميثيونين |
| Deamidations من أسباراجين و / أو الجلوتامين | |
| قاعدة البيانات | يونيبروت / Sprot |
| التصنيف | فأر |
| إعدادات تحديد الهوية قبول الإحصائية | |
| دي نوفو معدل الثقة المحلية (ALC) | > 50٪ |
| الببتيد كاذبة معدل اكتشاف (فرانكلين روزفلت، استنادا إلى تقديرات شرك الانصهار) | <1٪ |
| أهمية البروتين (-10logP، استنادا إلى تعديل T-اختبار) | > 20 |
| الببتيدات فريدة / البروتين | ≥ 1 |
| إعدادات الكمي: | |
| الببتيدات المستخدمة لتقدير إذا: | |
| أهمية الببتيد (-10logP) | > 30 |
| تحديد الببتيد في | ≥ 50٪ من عينات |
| الببتيد جودة الإشارة | > 1 |
| متوسط مساحة الببتيد | > 1E5 |
| الببتيد التسامح الوقت الاحتفاظ | <5 دقيقة |
| تطبيع | على مجموع أيون الحالية (TIC) |
الجدول 2: إعدادات لتحديد البروتين (الخطوة 4.2.2).
Discussion
تقدم دراسة سير العمل المنهجي الأمثل لالتنميط الكمي الدقيق للتغيرات التعبير بروتين متشابك خلال التعلم وتعزيز الذاكرة في الدماغ مناطق مختلفة من الفئران. يوفر الإعداد الفرصة لدراسة تعبير البروتين على مستوى حيوان واحد على الرغم من التطبيق المطلوب لا يقل عن ثلاثة مكررات التقنية لكل عينة للتحليل الطيفي الشامل.
تأخذ المنهجية في الحسبان تكوين بروتين معين من قبل وpostsynapse تتكون من البروتينات الوزن سقالة جزيئية عالية ولكن أيضا من البروتينات الوسيط الهامة ذات الأوزان المتوسطة أو أقل الجزيئية. النبذ في حل من الاستعدادات synaptosomal تؤدي إلى جيل فعال، وبالتالي، والإفراط في تمثيل الببتيدات المستمدة من سقالة. وهذا، بدوره، قد قمع تحليل البروتينات وفيرة أصغر أو أقل. إعداد اقترح الكسور SDS-PAGE منقسامة من كل عينة جنبا إلى جنب مع إجراء عملية الهضم في جل بالتوازي تسهل تحليل البروتينات وفرة المتوسطة والمنخفضة وتمثل وسيلة مكملة للغاية وأوصت. بعد منفصل تطبيق الطيفي الشامل لجميع أجزاء المستمدة من عينة (على سبيل المثال في حل الهضم، في جل الهضم، جنبا إلى جنب كسور التخصيب الفوسفات) مجموعات البيانات MS / MS المقابلة ويمكن الجمع بين وزيادة يحسب لتحديد البروتين وتقدير من قبل ذروات البرنامج أو بديلة من حزم البرامج الشائعة.
بدلا من ذلك، طلب فردي من كسور في جل المستمدة الهضم من عينة (معالجتها بشكل منفصل جل مناطق حارة العينة) والكسور الناتجة من العينة هضمها في حل (مثلا عن طريق التبادل الأيوني اللوني) لقياس الطيف الكتلي يمكن أن تزيد عمق تحليلي. ومع ذلك، فإن هذا العمل الموسعة يزيد بشكل كبير من الوقت اللازم لLS-MS الحصول على البيانات / MS. لgeneratioمطلوب ن من سلسلة الجزيئي مفصل لإعادة ترتيب بروتين متشابك خلال التعلم وتكوين الذاكرة دورة زمنية محددة من التنميط البروتين. قد تبدأ هذه الدورة الوقت على الفور بعد أو حتى أثناء الدورة التدريبية الأولى ويغطي فترة زمنية مزجها عن قرب حتى وصلت أداء الحيوانات مستوى مقارب للمنحنى التعلم بعد تقريبا. 8-10 أيام من التدريب (انظر الشكل 2 لمزيد من التفاصيل).
يتطلب تحليل التغيرات الفسفرة من البروتينات متشابك التركيز بشكل خاص على الأطر الزمنية المحددة أثناء التعلم FMTD. من ناحية يشير شلالات الشروع في إعادة ترتيب بروتين متشابك المعروف أن سببها phosphorylations البروتين وdephosphorylations من المتوقع في المراحل المبكرة جدا من تدريب الحيوان. من ناحية أخرى، هناك تعديلات طويلة الأمد متعددة البروتينات متشابك فسفرته المعروفة التي تنظم الربط والتجميع داخل الصورةالعمارة ynaptic 19 و 20. ومن المتوقع تلك التعديلات posttranslational حتى في نقاط زمنية لاحقة للذكريات.
مجموعات البيانات المعقدة الناتجة عن هذا العمل البروتين تتطلب معالجة بيوينفورمتيك لتحديد المسارات الجزيئية والجزيئات الرئيسية المشاركة. ويظهر التحليل التلوي مسارات الزائدة التمثيل كبيرة، والتي تلعب دورا في عمليات التعلم والذاكرة.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We wish to thank Yvonne Ducho and Kathrin Pohlmann for excellent technical assistance. This work was supported by the Deutsche Forschungsgemeinschaft (SFB 779) and by the State Saxony-Anhalt / European Regional Development Fund (ERDF) via the Center for Behavioral Brain Sciences (CBBS).
Materials
| Name | Company | Catalog Number | Comments |
| 3 M Empore Solid Phase Extraction- Filter | 3M Bioanalytical Technologies | 4245SD | 7 mm/3 ml |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164564 | 100 µm x 2 cm, C18 |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164569 | 75 µm x 25 cm, C18 |
| Acetic acid | Carl Roth GmbH | 3738.1 | |
| Acetonitrile (ACN) | Carl Roth GmbH | AE70.2 | |
| Acrylamide (30%) | AppliChem | A0951 | |
| Ammonium hydrogen carbonate | Fluka | 9830 | |
| Ammonium hydroxide | Fluka | 44273 | |
| Ammonium persulfate (APS) | AppliChem | A2941 | |
| Biofuge pico | Heraeus GmbH | 75003280 | |
| Blue R-250 | SERVA Electrophoresis GmbH | 17525 | |
| Bromophenol Blue | Pharmacia Biotech | 17132901 | |
| C57BL/6J mice | Charles River | ||
| Cantharidin | Carl Roth GmbH | 3322.1 | |
| Centrifuge tubes for MLS-50 | Beckman Coulter | 344057 | |
| Centrifuge tubes for TLA 100.1 rotor | Beckman Coulter | 343776 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| Eppendorf 5417R centrifuge | VWR | 22636138 | |
| Eppendorf A-8-11 rotor | VWR | 5407000317 | |
| Formic acid | Fluka | 14265 | |
| GeneCodis | http://genecodis.cnb.csic.es/ | ||
| Gephi | https://gephi.org/ | ||
| Glycerol | AppliChem | A1123 | |
| Glycine | AppliChem | A1067 | |
| HALT Phosphatase Inhibitor Cocktail | Pierce /Thermo Scientific | 78420 | |
| HEPES Buffer solution | PAA Laboratories GmbH | S11-001 | |
| Homogenization vessel 2 ml | Sartorius AG | 854 2252 | |
| Hydrochloric acid | Sigma-Aldrich | H1758 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide (IAA) | Sigma-Aldrich | I1149 | |
| Laboratory drilling drive K-ControlTLC 4957 | Kaltenbach & Vogt GmbH | 182997 | |
| LTQ Tune Plus 2.7.0.1112 SP2 | Thermo Scientific | ||
| LTQ Orbitrap Velos Pro | Thermo Scientific | ||
| Macs-mix tube rotator | Miltenyi Biotech | 130-090-753 | |
| Magic Scan 4.71 | UMAX | ||
| Methanol | Carl Roth GmbH | AE71.2 | |
| MLS-50 rotor | Beckman Coulter | 367280 | |
| Optima MAX Ultracentrifuge | Beckman Coulter | 364300 | |
| PageRuler Prestained Protein Ladder | Thermo Scientific | 26616 | |
| PEAKS 7.5 | Bioinformatic Solutions | ||
| Phosphatase Inhibitor Cocktail 3 | Sigma-Aldrich | P0044 | |
| PhosphoRS 3.1 | IMP/IMBA/GMI | ||
| PhosSTOP | Roche | 4906845001 | |
| Plunger/pestle made of PTFE | Sartorius AG | 854 2651 | |
| PotterS homogenizer | Sartorius AG | 853 3024 | |
| Protease Inhibitor complete mini | Roche | 4693159001 | |
| Quantity One 4.5.1 | BioRad | ||
| RapiGest | Waters | 186002122 | |
| Shuttle box | Coulbourne Instruments | ||
| Sodium dodecylsulfate (SDS) | AppliChem | A1112 | |
| Sodium molybdate | Carl Roth GmbH | 274.2 | |
| Sodium tartrate dihydrate | Sigma-Aldrich | 228729 | |
| SONOREX RK 156 Ultrasonic Bath | BANDELIN electronic GmbH & Co. KG | 305 | |
| Soundproof chamber | Industrial Acoustics Company | ||
| Sucrose | Carl Roth GmbH | 4621.2 | |
| Tetramethyl ethylene -1,2-diamine (TEMED) | Sigma-Aldrich | T9281 | |
| Thermomixer basic | CallMedia | 111000 | |
| Titansphere TiO 5µm | GL Sciences Inc. Japan | 502075000 | |
| TLA 100.1 rotor | Beckman Coulter | 343840 | |
| Trifluoro acetic acid (TFA) | Sigma-Aldrich | T6508 | |
| Tris ( hydroxymethyl) aminomethane (TRIS) | AppliChem | A1086 | |
| Triton X-100 | Sigma-Aldrich | T8532 | |
| Trypsin Gold | Promega | V5280 | |
| Ultimate 3000 Ultra HPLC | Dionex/Thermo Scientific | ||
| Ultracentrifuge tube | Beckman Coulter | 343776 | |
| Unijet II Refrigerated Aspirator | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| UNIVAPO 100 H Concentrator Centrifuge | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| Urea | AppliChem | A1049 | |
| Water (high quality purifed) | Resistivity: > 18.2 MΩ*cm at 25 °C Pyrogens: < 0.02 EU/ml TOC: < 10 ppb | ||
| Xcalibur 3.0.63 | Thermo Scientific | ||
| ZipTipC18 Pipette Tips | MILLIPORE | ZTC18S960 |
References
- Lamprecht, R., LeDoux, J. Structural plasticity and memory. Nat Rev Neurosci. 5 (1), 45-54 (2004).
- Bingol, B., Schuman, E. M. Synaptic protein degradation by the ubiquitin proteasome system. Curr Opin Neurobiol. 15 (5), 536-541 (2005).
- Richter, J. D., Klann, E. Making synaptic plasticity and memory last: mechanisms of translational regulation. Genes Dev. 23 (1), 1-11 (2009).
- Rosenberg, T., et al. The roles of protein expression in synaptic plasticity and memory consolidation. Front Mol Neurosci. 7, 86 (2014).
- Scheich, H., et al. Behavioral semantics of learning and crossmodal processing in auditory cortex: the semantic processor concept. Hear Res. 271 (1-2), 3-15 (2011).
- Kähne, T., et al. Synaptic proteome changes in mouse brain regions upon auditory discrimination learning. Proteomics. 12 (15-16), 2433-2444 (2012).
- Reichenbach, N., et al. Differential effects of dopamine signalling on long-term memory formation and consolidation in rodent brain. Proteome Sci. 13, 13 (2015).
- Kähne, T., et al. Proteome rearrangements after auditory learning: high-resolution profiling of synapse-enriched protein fractions from mouse brain. J Neurochem. , (2016).
- Li, K., et al. Organelle proteomics of rat synaptic proteins: correlation-profiling by isotope-coded affinity tagging in conjunction with liquid chromatography-tandem mass spectrometry to reveal post-synaptic density specific proteins. J Proteome Res. 4 (3), 725-733 (2005).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. J Cell Biol. 86 (3), 831-845 (1980).
- Smalla, K. H., Klemmer, P., Wyneken, U., Dermietzel, R. . The Cytoskeleton - Imaging, Isolation, and Interaction. , 265-282 (2012).
- Smalla, K. H., et al. The synaptic glycoprotein neuroplastin is involved in long-term potentiation at hippocampal CA1 synapses. Proc Natl Acad Sci U S A. 97 (8), 4327-4332 (2000).
- Shapiro, A. L., Vinuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem. 68 (5), 850-858 (1996).
- Thingholm, T. E., Larsen, M. R., Ingrell, C. R., Kassem, M., Jensen, O. N. TiO(2)-based phosphoproteomic analysis of the plasma membrane and the effects of phosphatase inhibitor treatment. J Proteome Res. 7 (8), 3304-3313 (2008).
- Carmona-Saez, P., Chagoyen, M., Tirado, F., Carazo, J. M., Pascual-Montano, A. GENECODIS: a web-based tool for finding significant concurrent annotations in gene lists. Genome Biol. 8 (1), 3 (2007).
- Bonn, S., Seeburg, P. H., Schwarz, M. K. Combinatorial expression of alpha- and gamma-protocadherins alters their presenilin-dependent processing. Mol Cell Biol. 27 (11), 4121-4132 (2007).
- Tweedie-Cullen, R. Y., Reck, J. M., Mansuy, I. M. Comprehensive mapping of post-translational modifications on synaptic, nuclear, and histone proteins in the adult mouse brain. J Proteome Res. 8 (11), 4966-4982 (2009).
- Li, L., et al. The differential hippocampal phosphoproteome of Apodemus sylvaticus paralleling spatial memory retrieval in the Barnes maze. Behav Brain Res. 264, 126-134 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved