Method Article
גבוהה פרופיל Proteome Synaptic החלטה כמותי של אזורים במוח העכבר לאחר למידה אפליה שמיעתית
In This Article
Summary
The identification of molecules and pathways controlling synaptic plasticity and memory is still a major challenge in neuroscience. Here, a workflow is described addressing the relative quantification of synaptic proteins supposedly involved in the molecular reorganization of synapses during learning and memory consolidation in an auditory learning paradigm.
Abstract
The molecular synaptic mechanisms underlying auditory learning and memory remain largely unknown. Here, the workflow of a proteomic study on auditory discrimination learning in mice is described. In this learning paradigm, mice are trained in a shuttle box Go/NoGo-task to discriminate between rising and falling frequency-modulated tones in order to avoid a mild electric foot-shock. The protocol involves the enrichment of synaptosomes from four brain areas, namely the auditory cortex, frontal cortex, hippocampus, and striatum, at different stages of training. Synaptic protein expression patterns obtained from trained mice are compared to naïve controls using a proteomic approach. To achieve sufficient analytical depth, samples are fractionated in three different ways prior to mass spectrometry, namely 1D SDS-PAGE/in-gel digestion, in-solution digestion and phospho-peptide enrichment.
High-resolution proteomic analysis on a mass spectrometer and label-free quantification are used to examine synaptic protein profiles in phospho-peptide-depleted and phospho-peptide-enriched fractions of synaptosomal protein samples. A commercial software package is utilized to reveal proteins and phospho-peptides with significantly regulated relative synaptic abundance levels (trained/naïve controls). Common and differential regulation modes for the synaptic proteome in the investigated brain regions of mice after training were observed. Subsequently, meta-analyses utilizing several databases are employed to identify underlying cellular functions and biological pathways.
Introduction
למידה מבוססת על ההיווצרות של עקבות זיכרון והתחזוקה שלהם. מקובל כי מנגנון אחד הבסיסי שלו עשוי לייצג היווצרות פעילות התלויה של חדש ו / או סידור מחדש של קשרים סינפטיים קיימים בין נוירונים. ברמה המולקולרית, שינויים חלבון שונים, relocalizations subcellular ושינויים במחזור של חלבונים סינפטיים תוארו 1-4 (Lamprecht 2004 # 8). עם זאת, רוב המחקרים עד כה התמקדו חלבונים נבחרים ולא על רכב proteome הסינפטי העולמי אך מורכב. הגישה הנוכחית מאפשרת סינון משוחד לשינויי proteome סינפטי באזורי מוח עכבר לאחר ניסוי למידה. היא מתאימה כדי להבהיר תמונות מולקולריות תלוי זמן נקודות של הארגון מחדש הנגרמת למידה של האדריכלות הסינפטי. זרימת העבודה המתוארת דורש עבודת צוות מסוים של מומחים שונים בהתנהגות בעלי חיים, ביוכימיה חלבון, ספקטרומטריית מסה bioinformatics.
הפרדיגמה למידה הנבחרת, כלומר אפלית טון תדר מאופנן (FMTD), היא משימת אפלית שמיעה היטב מאופיינת במכרסמים 5. למידה היווצרות הזיכרון לטווח ארוך ב תיבת המעבורת הזאת Go / No-Go-משימה כרוך מנגנוני תלוי איתות דופאמין בקליפת המוח גדל סינתזת החלבון. בהתאם לכך, מחקרים proteomic האחרונות על גרבילים ועכברים חשף dopamine- ו rearrangements פלסטיק הנגרמת למידה של רכיבים סינפטיים קליפת המוח, אלא גם באזורי מוח הבזליים יותר כי אינטראקציה כביכול במהלך הלמידה FMTD וזיכרון 6-8. זה ממחיש כי היווצרות זיכרון כרוך גומלין מורכב של אזורי מוח שונים ובכך, אולי להיות מוסדרת באופן דיפרנציאלי באזורים אלה במישור proteome. לכן, דיסקציה של אזורים במוח עכבר קליפת מוח קורטיקליים שנבחרו כלול העבודה.
יתר על כן, characterizati האמיןאפילו על שינויים חלשים בהרכב חלבון הסינפטי דורשת העשרת תאים טרום postsynaptic ולא בניתוח homogenates או שברי קרום גולמיים 9. לכן, הכנת synaptosomes ניצול הוקמה פרוטוקולים לפני ניתוח proteomic מתואר על מנת להגביר את רמת הגילוי ואת טווח דינמי עבור חלבונים ספציפיים סינפסה 10,11.
תנאים הכרחיים להשתמש ספקטרומטריית מסה ברזולוציה גבוהה ללא תווית למטרות כמותית הוא מידה רבה של דמיון של דגימות חלבון. כפי למדי שינויים קלים בהרכב חלבון הסינפטי צפויים להתרחש לאחר שנודע, גישה ללא תווית תהיה מתאימה להשוות מקביל דגימות חלבון שהתקבלו בעכברים מאומנים ונאיביים. לחלופין, אסטרטגיות תווית ספציפית מצב של חלבונים / פפטידים באמצעות איזוטופים יציבים (למשל TMT, iTRAQ, ICPL ו SILAC) וכן MS2 מבוסס תווית קואה חינםntification (רצועה) שימושי, אבל הם יקרים יותר מאשר הגישה ללא תווית נבחרה או זקוקים חומרת ספקטרומטריה מיוחדת.
מאז הקרנות proteomic לעתים קרובות להניב קבוצות נתונים מורכבות, עיבוד bioinformatic מומלץ לפרשנות נתונים מתאימה. מטא-אנליזה נוספת עשויה לתמוך הבנה טובה יותר של מנגנונים מולקולריים שבבסיס פוטנציאל שינויים הקשורים הפרדיגמה ועל זיהוי של תהליכים תאיים מפתח מעורבים במעברי אותות. מתודולוגיות מתאימה גם מתוארת להלן.
Protocol
כל הנהלים לרבות בנושאים בעלי חיים בוצעו בהתאם לתקנות של החוק הפדרלי הגרמני, תקנות האיחוד האירופי בהתאמה והנחיות NIH, אושרו על ידי ועדת האתיקה של Anhalt Landesverwaltungsamt Sachsen / (42502-2-1102 IFN).
1. למידה שמיעתית
- למידת אפלית שמיעה בתיבת ההסעות (פרדיגמה FMTD) הערה: תמיד ללבוש כפפות בעת טיפול העכברים.
- עכברים בית C57BL6 / J בקבוצות של שלושה או ארבעה עם גישה חופשית כדורי מזון ומים מהברז בכלובים פוליקרבונט ברור. שמור על אור 12 שעות: מחזור כהה במתקן החיה. אם בעלי החיים מתקבלים ממעבדה אחרת או מחברה לאפשר לפחות שבוע של הסתגלות ומייצבת.
- בצע אימון תיבת הסעות אחד ליום.
- קח את העכבר מהכלוב הביתה שלה במתקן החיה ומניח אותו בתוך קופסא הסעות אפלולית בתוך תא קול, ראיה.
- השתמש בלוח זמנים ללמידה מול מחשב-בשליטה מלאה ללמידת אפלית שמיעה. שמתחיל בנקודת הרגלה של 3 דקות של שתיקה, ולאחר מכן להתחיל את האימון.
- רצפי שימוש הטון העולה (4 - 8 kHz, CS +) כמו גירוי Go במהלך ניסויים יעברו: החיה יש לחצות את המשוכה בתוך 6 שניות של מצגת טון (תשובה נכונה, פגעה). להעניש החטאה ידי זעזוע רגל קלה של 50 - 300 מיקרו-אמפר, שיועבר דרך רצפת רשת של תיבת הסעות.
- השתמש רצפים של הטון נופל (8 - 4 קילוהרץ, CS-) כמו גירוי-No-Go-Go במהלך וניסויי No: יש החיה להישאר בתא הנוכחי של תיבת הסעות במהלך 6 שניות של מצגת הטון. להעניש אזעקת שווא ידי זעזוע רגל קלה של 50 - 300 מיקרו-אמפר, שיועבר דרך רצפת רשת של תיבת הסעות.
- השתמש במרווחי intertrial של 20 5 שניות.
- בצעו 30 Go-ניסויים ו -30 לא- Go-ניסויים בכל הפעלה בסדר פסאודו אקראי, כך שאף אחד session מורכב 60 ניסויים ונמשך כ -25 דקות.
- שים את החיה המאומנת חזרה לכלוב בבית שלה במתקן החיה.
- לנתיחת המוח
- להרדימו בנקודת הזמן הרצוי לאחר המספר הרצוי של אימונים באמצעות נקע בצוואר הרחם (למשל 24 שעות לאחר השלמת בפגישה הראשונה). לערוף את החיה.
- במהירות לנתח את המוח באמצעות השלבים הבאים: חותכים ראשונים עור ולאחר מכן את הגולגולת עם מספריים ישר לאורך sagittalis Sutura. להסיר לחלוטין את חלקי העצם אשר מכסה את רקמת המוח באמצעות מלקחיים חזקים. להוציא את המוח עם spattle.
- לנתיחה, למקם מוח על צלחת פטרי מלאות קרח. לנתח את קליפת המוח השמיעתית, האונה הקדמית, בסטריאטום ואת ההיפוקמפוס תחת סטראו באמצעות אזמל ומחט.
- למקם את קליפת המוח השמיעתית באמצעות ציוני דרך חזותיים על המוח שלurface כגון כלי הדם ואת הצורה של השטח (גבחת -2.06 ל -3.4, מ"מ 2 גודל rostrocaudal, dorsoventral 1.3 מ"מ) לנתח בילטרלי כבלוק רקמות מלבני עם עובי של קליפת המוח.
- לנתח את קליפת המוח הקדמית כמו פרוסת המוח בין גבחת 3.56 ו 1.54 באמצעות opticum chiasma כציון דרך ולמעט רקמה olfactorius bulbus.
- לנתח את הסטריאטום כמו פרוסת המוח בין גבחת 1.54 ו 0.5 ובזהירות להסיר רקמת קליפת המוח.
- לנתח את ההיפוקמפוס ידי תיקון המוח עם המחט דרך המוח הקטן ומתעקל בקליפה החל מ באונה העורפית.
- הלם הקפאת גזור דגימות מוח בחנקן נוזל חנות ב -80 ° C.
2. הכנת Synaptosomes או לחלופין בעל צפיפות Postsynaptic (PSD) שבר -enriched
הערה: במהלך כל ההליכים, לשמור דגימות או מאגר של 0 - 4 מעלות צלזיוס.חוצצים טריים מכילים בדילול קוקטיילי פרוטאז מעכב כדי למנוע שפלה פרוטאוליטים של חלבונים. אם זרחון החלבון נלמד גם, קוקטיילים מעכבים phosphatase צריכים להוסיף. כל g-הערכים המצוינים ניתן g (ממוצע) ברחבי הפרוטוקול כולו.
- הכנת שבריר קרום גולמי (איור 3 א)
- העברת גזור רקמת המוח לתוך כלי המגון המכילה 1 מ"ל קרח קר הצפת (5 HEPES מ"מ, 320 מ"מ סוכרוז, pH 7.4) ו homogenize הרקמה ב 900 סל"ד עם 12 חבטות.
- צנטריפוגה דגימות XG ב 1000 למשך 10 דקות. שמור את supernatants.
- Re-homogenize כדורי נייר באותם תנאים באותו נפח של חיץ המגון כמקודם ודוגמאות צנטריפוגות שוב XG ב 1000 למשך 10 דקות. שלב supernatants המקביל. מחק את P1 הכדורי, אשר מכיל בעיקר גרעינים ופסולים תא.
- ספין supernatants בשילוב במשך 20 דקות ב 12,000 x ז. superna מחקtants או שימוש עבור חלוקה נוספת 11.
- כדורי Resuspend באותו נפח של חיץ המגון כמקודם באמצעות homogenizer עם 6 משיכות ב 900 סל"ד ו ספין על XG 12,000 במשך 20 דקות. supernatants מחק. כדורי P2 לייצג שברי הקרום הגולמי.
- טיהור synaptosomes מתוך שברי קרום מוח הגולמי (איור 3 א)
הערה: שברים קרום המוח גולמי ניתן לחלק המיאלין, ממברנות אור, synaptosomes ואת המיטוכונדריה באמצעות ultracentrifugation שיפוע צעד צפיפות סוכרוז. עבור זה 5 מ"מ טריס / HCl pH 8.1 מאגרים המכילים סוכרוז משני 0.32 M, 1.0 M או 1.2 M ריכוז נדרשים.- בעת ביצוע צנטריפוגה לייצר את שברי P2, להכין הדרגתיים צעד סוכרוז צינורות ultracentrifuge. התחל עם 2.5 מ"ל 1.0 M סוכרוז חיץ שכבת משנה עם 1.5 מ"ל 1.2 M חיץ סוכרוז באמצעות pipet פסטר זכוכית.
- Re-homogenize שברי P2ב 0.5 מ"ל של חיץ 0.32 M סוכרוז ידני עם 6 משיכות והעומס על גבי שיפוע.
- ספין על 85,000 XG במשך שעה 2. בתוך ultracentrifuge באמצעות הרוטור דלי מתנדנד.
- מחק את שכבת סוכרוז 0.32 M העליון כולל את החומר במהירות ממשק למאגר סוכרוז 1.0 M (המיאלין, ממברנות אור). אסוף synaptosomes בממשק חיץ סוכרוז 1.0 / 1.2 M. גלולה בחלק התחתון של הצינור מכיל מיטוכונדריה.
- להוסיף 0.32 M סוכרוז חיץ לשבר synaptosomal ב 1: 1 יחס, לערבב היטב ספין על 150,000 XG במשך שעה 1. Synaptosomes נמצאים גלולה כעת ניתן resuspended במאגר הנדרש לעיבוד נוסף.
- הכנת שבריר PSD מועשר (איור 3)
- Homogenize בכל אזור מסוים במוח מבעל חיים אחד חיץ החילוץ 100 μl (5 מ"מ טריס / HCl pH 8.1, 0.5% Triton X-100) בצינור ultracentrifuge 200 μl עם העלי PTFE (polytetrafluorethylene)ב 2000 סל"ד עם 12 חבטות.
- הוספת 100 חיץ החילוץ μL, לערבב דגירה במשך שעה 1 ב 4 ° C.. ספין למטה ב 100.000 XG במשך שעה 1 ולאסוף את supernatant S1 בזהירות עם pipet 200 μl.
- Re-homogenize P1 גלול באותו צינור עם 100 חיץ חילוץ μl שוב עם עלי PTFE ב -2,000 סל"ד עם 12 חבטות.
- הוספת 100 חיץ החילוץ μl ומערבבים היטב עם טפטפת ו ספין על 100,000 XG במשך שעה 1.
- מערבבים את S2 supernatant עם S1 לשבר חלבון מסיס. חלק זה מכיל חלבוני cytosolic, 0.5% Triton X-100 חלבונים בממברנה מסיס ומולקולות תא מטריקס.
- Resuspend גלולה שנותרו 50 μl 5 מ"מ טריס / HCl pH 8.1. חלק זה מכיל PSDs, ממברנות עמידות חומר ניקוי, אלמנטי cytoskeletal מסיסים, המיטוכונדריה ופסולת תאיים כולל גרעינים. הוא מועשר ב PSDs המהווים את הליבה של מבנים postsynaptic אלא גם חלקים חשובים של presynapticcytomatrix על האזור הפעיל. הגורם להעשרת PSDs הוא סביב 4 ואת העשרת רכיבים PSD הודגמה בעבר. 12
3. הכנת דוגמאות עבור ספקטרומטריית מסה
- תמוגה ונורמליזציה מדגם
הערה: נורמליזציה לדוגמא בדבר ריכוז החלבון היא צעד חיוני מאוד להשיג בסופו של נתונים כמותיים אמינים אפילו לשינויי ביטוי חלבון חלשים הסינפטי.- ממיסים synaptosomes או תכשירים מועשר PSD של כל אזור במוח של חיה 20 - 50 μl (תלוי בסכום כולל של החומר: עבור קליפת המוח השמיעתית עם 5 - שימוש רקמות 15 מ"ג 20 μl) של 8 אוריאה ז ו דגירה על קרח למשך 1 hr באמבטיה קולית.
- עבור ג'ל לעכל, לפזר synaptosomes ישירות למאגר SDS-המדגם. בזהירות לחשב את הכמות הטעונה כדי למנוע עומס יתר של הג'ל. אחשוב על זה במקרה זה, protei הפיגום בשפע הגבוהns יאבדו במהלך ג'ל אלקטרופורזה וב-ג'ל לעכל.
- לדלל עם 1% של חומר ניקוי נשלף כדי להבטיח ריכוז סופי של 2 M אוריאה. הימנע גבוה בכל טמפרטורה מ -30 ° C כדי למנוע carbamylation חלבון.
- בצע SDS-PAGE עם aliquot (למשל 10 μl) של המדגם על פי נהלים קבועים 13,14.
- כתם ג'ל עם Coomassie הכחול על פי הפרוטוקול של היצרן. ההליך משלב לשלב תיקון ו מכתים עם מתנול וחומצה אצטית.
- לקבוע את הצפיפות האופטית של כל דגימה עבור השביל כולו עם סורק ג'ל מכויל במצב שידור ולחשב את כמות החלבון יחסית.
- לנרמל את הדגימות על פי חישובים אלה.
- פיצול כל מדגם לשני חלקים שונים. השתמש שליש עבור ג'ל לעכל ושני שלישים עבור לעכל-פתרון.
- ממיסים synaptosomes או תכשירים מועשר PSD של כל אזור במוח של חיה 20 - 50 μl (תלוי בסכום כולל של החומר: עבור קליפת המוח השמיעתית עם 5 - שימוש רקמות 15 מ"ג 20 μl) של 8 אוריאה ז ו דגירה על קרח למשך 1 hr באמבטיה קולית.
- ב-ג'ל לעכל
- הפרדת ג'ל
- בצע SDS-PAGE שני ניצול הדגימות-מותאם הריכוז. כתם ולכמת את הג'לים בפעם שנייה כדי לבדוק את איכות הנורמליזציה.
- לגזור כל השביל של מדגם בתוך הג'ל בתחומים שונים (8 / נתיב) אך אינם כוללים את טווח המשקל המולקולרי מעל 170 kDa. מעבירים את חתיכות ג'ל לתוך צינורות נפרדים.
- חותכים את תחומי לחתיכות קטנות (כ. 1 x 1 מ"מ) עם אזמל חד להקל יעילות עיכול ג'ל.
- תקציר 15
- שטפו את החלקים ג'ל מספר פעמים (תלוי בעוצמה מכתים) במשך 10 דקות עם 50 - 150 μl של חיץ המורכב אצטוניטריל 50% (ACN) ו קרבונט מימן אמוניום 50 מ"מ (NH 4 HCO 3).
- הסר supernatants. מכסים את החלקים ג'ל עם ACN לדגור על 20 מעלות צלזיוס עד חתיכות ג'ל להפוך לבן ולהתכווץ.
- הסר את ACN ו רעננותם חתיכות ג'ל 5דקות עם 50 μl של 0.1 M NH 4 HCO 3. מוסיפים את אותו נפח של ACN דגירה במשך 15 דקות נוספות על 37 מעלות צלזיוס.
- סר וזורק נוזל לחלוטין. יבש את החלקים ג'ל בצנטריפוגה ואקום.
- רעננותם חתיכות ג'ל 50 μl של NH 4 HCO 3 המכיל 10 מ"מ dithiothreitol (DTT) דגימות חום למשך 45 דקות ב 56 מעלות צלזיוס כדי להפחית שאריות ציסטאין.
- הסר supernatants ולהוסיף 50 μl NH 4 HCO 3 המכיל 55 מ"מ iodoacetamide (רש"ת) במשך 30 דקות בחושך כדי carbamidomethylate cysteines מופחת.
- הסר וזורקים את כל נוזל מעל חתיכות ג'ל ולשטוף אותם פעמיים עם 50 μl NH 4 HCO 3 ו ACN (1: 1) במשך 10 דקות כדי להסיר כל רשות העתיקות שיורית. דגימות יבשות בצנטריפוגה ואקום.
- לעיכול מוגבל של חלבוני להוסיף 25 מ"מ NH 4 HCO 3 המכיל 12.5 ng / μl של טריפסין. הנפח נדרש תלוי בגודל וסכום של p ג'לieces. דגירה במשך כמה דקות ולבדוק אם למאגר נספג. הוסף עוד חיץ במידת צורך, חתיכות ג'ל צריכות להיות מכוסות לחלוטין. לדגור על 37 מעלות צלזיוס למשך הלילה (מינימום. 12 שעות).
- מיצוי פפטיד
- חתיכות ג'ל שכבת עם 10 - 20 μl של 25 מ"מ NH 4 HCO 3 ולהוסיף אותו נפח ACN. דגירה במשך 10 דקות על קרח באמצעות באמבטיה קולית. לאחר מכן להסיר ולאסוף supernatants אשר מכיל את רוב פפטידים שנוצרו.
- הוספת 100 μl של חיץ חילוץ המכילים 30% ACN / 0.1% חומצת trifluoroacetic (TFA) אל החלקים ג'ל. חזור דגירה באמבטיה קולית ובזהירות לאסוף supernatant זה.
- חזור על שלבי החילוץ האחרונים על ידי הגדלת ריכוז ACN 50%. לאחר 10 דקות של באמבטיה קולה ספין למטה ולאסוף supernatants.
- מערבבים את כל שלושת supernatants המקביל הצעדים החילוץ ומייבשים אותם בצנטריפוגה ואקום. ציין זאתכתוצאה של הפרדה ג'ל 8 אזורים לכל ליין / מדגם משולבים מדגם אחד שוב בשלב זה.
- הפרדת ג'ל
- ב-פתרון לעכל
- לְעַכֵּל
- השתמש הסכום המחושב (למשל 100 μl של lysate 150 μl, תלוי בכמות חומר ואת הנפח הנדרש עבור resuspension של מדגם אזור מסוים במוח) של דגימות מנורמלות להשיג חומר המוצא מספיק לשלושה משכפל טכני לפחות לבצע ספקטרומטריית מסה ללא תווית.
- להוסיף 2 מ"מ DTT ב 25 מ"מ NH 4 HCO 3 בעדינות מערבולת המדגם. מנמיכים את הדגימות למשך 45 דקות ב 20 מעלות צלזיוס.
- הוסף 10 מ"מ רשות העתיקות כדי carbamidomethylate שאריות ציסטאין. מערבבים דגירה במשך 30 דקות בחושך על 20 מעלות צלזיוס.
- לבסוף, להוסיף 1 μl של פתרון המניות טריפסין (1 מיקרוגרם / טריפסין μl ב 25 מ"מ חומצה אצטית) ו לדגור על 20 מעלות צלזיוס למשך 12 שעות.
- מיצוי מוצק שלב (SPE) -Purification
- כדי להסיר את נוזל הכלים cleavable חומצה, להתאים דגימות לריכוז סופי של 1% TFA ו דגירה במשך שעה 1 ב 20 מעלות צלזיוס.
- דגימות צנטריפוגה ב XG 16,000 במשך 10 דקות ובזהירות לאסוף supernatants.
- מניחים את הטור SPE במעמד לאזן המטריצה עם 2 מ"ל מתנול. לשטוף פעמיים עם 2 מ"ל של 0.1% TFA במים (חיץ B).
- הוסף 2 מ"ל של חיץ B ו- לטעון את המדגם. לשטוף עוד שלוש פעמים.
- Elute פפטידים על ידי הוספת 200 μl 70% ACN / 0.1% TFA. חזור על שלב זה.
- הפינה היא eluates ולייבש אותם בצנטריפוגה ואקום.
- לְעַכֵּל
- Phospho-פפטיד-העשרה על ידי Tio 2 כרומטוגרפיה 16
- ממיסים פפטידים המיוצר על ידי ג'ל או פתרון לעכל 150 μl של 80% ACN / 2.5% TFA (חיץ C) לאזן ~ 2 מ"ג של חרוזים 2 Tio ב 50μl של חיץ ג
- להוסיף חרוזי מדגם דגירת מכשיר מסתובב עבור שעה 1 ב 20 מעלות צלזיוס. לאחר מכן, ספין חרוזים למטה (16,000 XG, 1 דקות) ולאסוף supernatants.
- שטפו את החרוזים שלוש פעמים עם 100 μl של חיץ C על ידי ערבוב שצנח בעדינות אחרי 5 דקות. אסוף supernatants. חזור על פעולה זו שלוש פעמים עם 100 μl של 80% ACN / 0.1% TFA ואחריו שלושה שוטף עם 100 μl של 0.1% TFA (ללא ACN), בהתאמה.
- מערבבים את כל עשר supernatants, לייבש אותם בצנטריפוגה ואקום לטפל בהם כמו השבר phospho מדולדל-פפטיד לטיהור נוסף על פי שלב 3.5.
- Elute את phospho-פפטידים המאוגדים עם 20 μl של 400 מ"מ NH 4 OH / 30% ACN מן החרוזים. חזור על פעולה זו שלוש פעמים לאסוף את כל supernatants לאחר שצנח החרוזים.
- מערבבים את eluates של ג'ל לעכל של לעכל פתרון של מדגם ולטפל בהן כמו-p phosphoeptide מועשר חלק. לייבש אותם בצנטריפוגה ואקום לנפח סופי של 4 - 8 μl.
- ריכוז desalting של שברים מדולדל phospho-פפטיד על ידי מיקרו-SPE
- ממיסים את פפטידים מיובש 20 μl של 0.1% TFA.
- לאזן את -matrix C 18 הקבוע על ידי ציור 20 μl ACN לתוך הקצה. שטוף את מטריקס על ידי ציור 0.1% TFA במים לתוך הקצה. חזור על התהליך שלוש פעמים.
- לאט לטעון מדגם acidified לתוך הקצה (לחזור על פעולה זו שלוש פעמים).
- שטוף את זמני 18 -matrix שלוש C עם 20 μl 0.1% TFA במים וזורקי פתרון הכביסה.
- Elute פפטידים מן קצה פיפטה ידי שוב ושוב (3 פעמים) ציור 20 μl של 70% ACN / 0.1% TFA ולאסוף פתרון elution זה בצינור נפרד.
- מערבבים את eluates של מדגם ומייבשים אותם בצנטריפוגה ואקום.
4. ניתוח Proteome
הערה: ניתוח Proteome מבוצע על מלכודת יונים ליניארי היברידית כפול לחץ / ספקטרומטר מסה orbitrap מצויד HPLC אולטרה. HPLC מורכב autosampler מקורר עם לולאה הזרקת 20 μl, משאבה טעינת בינארי (טווח תזרים μl), משאבת ההפרדה זרימת ננו בינארי, מחמם טור עם שני מיקרו מיתוג שסתומים ו מסלק גזים. דוגמאות חשופים ראשית לעמודה השמנה (למשל 100 מיקרומטר X 2 ס"מ) בקצב זרימה של 7 μl / min ואחריו ההפרדה על עמודה (למשל 75 מיקרומטר x 25 ס"מ) ב 250 NL / min. שקע טור הפרדה מצמידים ישירות טיפ פולט מצופה פיקו ממוקם בממשק ננו-ספריי במקור יינון ספקטרומטר מסה.
- ספקטרומטריית ננו-נוזלת כרומטוגרפיה ומסת טנדם
- ממיסים דגימות פפטיד 12 μl 2% ACN / 0.1% TFA עבור לפחות 30 דקות. ספין למטה במשך 15 שניות ולהעביר 11 μl supernatant אל autosampler בקבוקונים (diamete חרוטים, מופחתr).
- הגדרת משטר אוטומטי יישום לדוגמה, הפרדת chromatographic ו ספקטרומטריית טנדם מונית תוכנת שליטה (למשל, Xcalibur) כדלקמן.
- השתמש בהבא עבור טמפרטורה: autosampler: 5 מעלות צלזיוס; תנור טור: 45 ° C.
- השתמש בהבא עבור הזרקה: הנפח: 10 μl; ספיקה: 7 μl / min (2% ACN, 0.1% TFA); זמן: 8 דקות; הגדרת Valve: טור מלכודת - פסולת; רכישת spec מונית: off.
- השתמש בהבא עבור הפרדה: קצב זרימה: 250 NL / min Valve הגדרה: מלכודת טור טור-הפרדה; רכישת spec מונית: על.
0 דק '- 100 דק': 2% ACN, 0.1% חומצה פורמית - 40% ACN, 0.1% חומצה פורמית
100 דק '- 105 דק': 40% ACN, 0.1% חומצה פורמית - 95% ACN, 0.1% חומצה פורמית
105 דק '- 109 דק': 95% ACN, 0.1% חומצה פורמית
109 דק '- 120 דקות: 2% ACN, 0.1% חומצה פורמית - השתמש בהבא עבור הגדרות ספקטרומטריית מסה: מלאה MS: FTMS; רזולוציה 60,000; מ '/ z טווח 400 - 2,000; גברת/MS: בשכבות Iontrap; סף אות מינימום 500; רוחב בידוד 2 Da; זמן הדרה דינמי הגדרת 30 שניות; יונים טעונים ביחידים מודרים מהבחירה; אנרגית התנגשות מנורמלת מוגדרת 35%, והפעלת זמן 10 msec.
הערה: סריקת MS מלאה ואחריו עד 15 LTQ MS / MS פועל באמצעות התנגשות מושרה-דיסוציאציה (CID) של יוני פפטיד זוהה רוב בשפע.
- הפעל שלושה משכפל טכני עבור כל הדגימות.
- זיהוי חלבון וכימות תווית חינם
- תהליך המוני נתונים גולמיים spectrometric לקראת זיהוי חלבונים וכימות ללא תווית ניצול חבילת תוכנה מסחרית (למשל, פסגות סטודיו). בניגוד לרוב חבילות תוכנת proteome אחרות בתוכנה המסוימת הזה משתמשת דה נובו -sequencing אלגוריתם לפני מערכי מסד נתוני חלבון. עם זאת, בשלב זה ניתן להחליף בקלות על ידי חבילות תוכנה פופולריות אחרות.
- ESS שימושהגדרות ential המפורטים בטבלה 2.
- Phospho-פרוטאומיקה
הערה: יעיל ואמין רכישת פפטיד-phospho דורשת כמה שינויים מהותיים של התקנת עבודת proteomic.- אחרי העשרה-פפטיד phospho, דגימות יבשות לא לגמרי. תמיד לשמור דגימות מומסות.
הערה: קשר phospho-אסתר של threonines פוספורילציה או serines הוא מאוד שביר. במהלך פיצול מושרה התנגשות בתוך המלכודת היונים זה תוצאות לאובדן ניטראלי של פוספט. זה מונע כל פיצול נוסף של הפפטיד, אשר בתורו נדרש לצורך זיהוי. Wideband הפעלה מותרים ההתקנה ספקטרומטריית מסה מאפשר את הפיצול של פפטידים phospho גם אחרי הפסד נייטרלי של קבוצת פוספט. היא מבצעת זמן חיסכון "פסאודו-MS 3". נחישות phospho-אתר בנתוני MS / MS דורשת אימות מסוימת והערכה וניתן לבצעו על ידי phosphors 3.0.
- אחרי העשרה-פפטיד phospho, דגימות יבשות לא לגמרי. תמיד לשמור דגימות מומסות.
ביואינפורמטיקה 5. - Meta-Analysis
הערה: לפני ביצוע ביאור תפקודי וניתוח רשתות, רשימות החלבון צריכות להיות מעובד. ראשית למזג את הרשימות של חלבונים מוסדרים-פפטידים phospho לכל איזור במוח בנפרד. ואז להסיר את כל לשכפל UniProt-ID עבור כל חלק כדי למנוע פרשנות שגויה.
- ניתוח העשרה Singular עם GeneCodis 17
- פתח את כלי מבוסס אינטרנט של GeneCodis (http://genecodis.cnb.csic.es)
- בחר "Mus musculus" כמו אורגניזם ו "GO תהליכים ביולוגים" כפי ביאור.
- הדבק רשימה של מזהי UniProt של שבריר מסוים. שלח ולחכות עד הניתוח מבוצע. לחץ על "ניתוח העשרה Singular של תהליכי ביולוגי GO" ולהציג תוצאות.
- חזור על שלב 5.1.3 עבור שלושה שברים אחרים.
- כדי לראות את כל כפילויות בצמתים בין רשימות התוצאהלהשתמש בשפת תכנות כמו Perl או Python כדי לסנן את הנתונים הדרושים. כלי דומה לניתוח העשרה יחיד הם DAVID (https://david.ncifcrf.gov/) ו cytoscape (http://www.cytoscape.org/) עם תוספים בינגו (http://apps.cytoscape.org/ apps / בינגו) ו ClueGO (http://apps.cytoscape.org/apps/cluego).
- יצירת גרף מבוסס כוח מתוך נתונים GeneCodis עם Gephi (https://gephi.org/)
יש נתונים עבור גרפים להינתן על ידי המשתמש, בין אם במתכונת גרף (.gexf, .graphml, .dot, .gv, .gml) או נכנס ביד: הערה.- יצירת צומת הגרף
- ביד: Open Gephi ולחץ על "מעבדת המידע". צור צמתים. לחץ על "צומת" מצד שמאל כדי לעבור לשולחן "צומת". לחץ על "הוסף צומת". הזן את השם של המונח. לחץ על "אישור" / לחץ על Enter.
- אלטרנטיבי: GeneCodis שמור לגרום למחשב. פתח את .txt באמצעות תוכנת גיליונות אלקטרוניים. מחק את כל exce השורותpt מ "Item_Details" (שמות ארוכים). כותרת שינוי "Item_Details" ל "לייבל". שמור גיליון אלקטרוני כמו ".csv". עכשיו ב Gephi, לחץ על "ייבוא גיליון". בחר גיליון אלקטרוני מדפדפן הקובץ של Gephi. לחץ על "הבא". לחץ על "סיום".
- חיבור בלוטות באמצעות קצוות.
- לחץ על "קצוות" מצד שמאל כדי לעבור לשולחן "קצוות". עבור כל צומת (Term): לחפש את שמות גני תנאים אחרים. אם אחד או יותר גנים משותפים -> ליצור יתרון.
- לחץ על "הוסף Edge". בחר "undirected". מקור בחר צומת היעד מתוך רשימות נפתחות. לחץ על "אישור" / לחץ על Enter. אם יותר מ גן אחד משותף, זן בשפע "משקל" (טבלה).
- חיל מבוסס פריסה גרפית.
- נתונים גרף להרחיב קובץ, לקבוע את סוג הגרף "מכוון" או להשתמש בנתונים כפי שהוזן על ידי יד, לחץ על "סקירה" אם לא כבר שנבחר 'ד.
- שינוי גודל בלוטות תלויים השפע של קשרים הדדיים. לחץ על סטטיסטיקות, לרוץ או "תואר ממוצע" (קצוות משוקללים) או "ממוצע. תואר משוקלל" (קצוות משוקללים) תחת "סקירת רשת". ב 'מראה', לחץ על "צומת", ואז על לחצן הגודל, הבא לבחור "מאפיינים" ולהגדיר את פרמטר תכונות כדי "ממוצע. תואר משוקלל" או "תואר ממוצע". לחץ על החל.
- לבסוף: בחר "חיל אטלס" ב "פריסה" ולהפעיל; לשנות "כוח דחייה" אם בלוטות מתנגשות.
- ייצוא לתמונה.
- תכונת תמונת מסך: לחץ על "סקירה", פריסת גרף שינוי, עובי קצה, גודל תווית ומדרוג עם התפריט בתחתית חלון "גרף". לחץ על הלחצן השמאלי המצלמה, ולשמור תמונה.
- תכונת יצוא של "תצוגה מקדימה": לחץ על "תצוגה מקדימה". שנת תחנות כדי "מחדל ישר". שינוי הגדרהים על פי ההעדפות שנבחרו ולחץ על "SVG / PDF / PNG" לייצא.
- יצירת צומת הגרף
תוצאות
איור 1 מסכם את העבודה המלאה של פרופיל proteome כמותית הסינפטי של אזורים במוח העכבר לאחר למידת אפלית שמיעה. זה מתחיל עם אימון חיה בתוך קופסא הסעות. בדוגמא המוצגת באיור 2, עכברים החלו להראות אפלית FM טון משמעותית אימון 4 th, המציין למידה יעילה. בעלי חיים מוקרבים בנקודות הזמן שנבחר לנתיחה באזור המוח. ההעשרה הנדרשת של סינפסות יכולה להיות מושגת על ידי הכנת synaptosomes או לחלופין על ידי הכנת שבריר PSD המועשר, הן תארו בפירוט באיור 3. השיטה PSD-העשרה פותח עבור כמויות רקמות נמוכות, למשל 1 - 2 פרוסות בהיפוקמפוס מן החולדה המוח 12, 18. זה דורש צינוריות, PTFE העליים הולמים צינורות אלה, ובמרחק קידוח מעבדה להפעלת העלי.
בשל הרכב חלבון המסוים של synaptosomes, הוא ממליץ בחום לבצע את הכנת המדגם בשתי דרכים שונות אך משלימות. פיגומים של PSDs הם בדרך כלל חלבונים בעלי משקל מולקולרי גבוה מאוד המתרחשים והרכב גבוהה. ב-פתרון לעכל היא הדרך הטובה ביותר לחלץ אותן ביעילות אך הוא עשוי להוביל oversampling של תערובת הפפטיד שנוצר. ב-ג'ל לעכל ביצע של מדגם זהה במקביל יכול לכלול אותם חלבונים בעלי משקל מולקולרי גבוה ולהקל על ניתוח של חלבונים עם המדיום ועל משקל מולקולרי נמוך. לקבלת ניתוח מקיף שני סוגי מעכל פרוטאוליטים מומלצים.
הסכומים השונים של רקמות של אזורי המוח הנחקרים דורשים התאמה של חומר מועמדותן השוואה טובה יותר. בתוך ארבעת האזורים במוח חקרו את קליפת המוח השמיעתית היא בדרך כלל עובדת ההגבלהאוֹ. החומר של כל אזורי המוח האחרים צריך להיות מותאם בקפידה לסכום של קליפת המוח השמיעתית לאחר ההכנה של synaptosomes או שברי PSD מועשרים (ראה 3.1.1.). משקולות אופייניות של אזורי מוח מוכנים טרי מעכברים הן כדלקמן: קליפת מוח שמיעתית (AC): ~ 50 מ"ג; ההיפוקמפוס (מותן): ~ 90 מ"ג; הסטריאטום (STR): ~ 120 מ"ג ו בקליפת המוח הקדמית (FC): ~ 100 מ"ג.
שיטת PSD-העשרה שמתוארת בסעיף 2.3 אפשרה זיהוי של 1500 חלבונים שונים וכ -250 phospho-פפטידים שונים לכל אזור במוח על רמת חיה אחת (טבלה 1). ניתוח proteomic 24 שעות לאחר האימון הראשון גילה כי 7.3% מכלל החלבונים שזוהו ו -5.8% של-פפטידים phospho הראו משמעותי (p <0.05) שינויים הכמותיים הביטוי הסינפטי שלהם בהשוואה לקבוצת ביקורת נאיבית (טבלה 1). נטייה בולטת regula למטה tion של פיגומים הסינפטי עשוי להצביע על התארגנות מבוטאת של האדריכלות הסינפטי במהלך בשלבים הראשונים של למידת FMTD. הרוב המכריע של החלבונים המוסדרים שונה באופן ספציפי לאזור מוח, ואילו רק 22% נמצאו שיוסדרו שניים או יותר אזורים במוח. שש דוגמאות נבחרות מוצגות באיור 4.
מטה-אנליזה של תוצאות מורכבות על ידי IPA מספק ראיות עבור השתתפות / מניפולציה מסוימת של המסלולים הקנונית הבאים: "בתיווך Clathrin איתות אנדוציטוזה", "איתות הדרכה axonal", "איתות סידן", "איתות RhoA", "Notch איתות "," שיפוץ של אפיתל Adherens צומת "," איתות קולטן גלוטמט "," איתות קולטן GABA "," איתות קולטן דופמין "ו" Synaptic לטווח ארוך הגברה ".
ב-page = "1"> ניתוח העשרה יחיד גילה תהליכים ביולוגיים ייצוג יתר משמעותי בקליפת המוח הקדמית בדבר תחבורה חלבון, הידבקות התא, זרחון, אנדוציטוזה, תחבורה בתיווך שלפוחית, פיתוח המוח הקדמי ו axonogenesis (איור 5). בשנת התהליכים הביולוגיים שמיעת הקליפה כולל הובלת יון, תרגום, תחבורת mRNA, תחבורת חלבון ולמידה היו מורגשות. הניתוח של שבר החלבון של ההיפוקמפוס מזהה תהליכים מועשרים משמעותי הקשורים לתחבורת יון, מחזור תא, תרגום, זירחון ופיתוח מערכת עצבים. בסטריאטום, ייצוג יתר התהליכים הביולוגיים כולל הובלה mRNA, תחבורה בתיווך שלפוחית, axonogenesis, proteolysis, תחבורה חלבון אנדוציטוזה נמצאו.
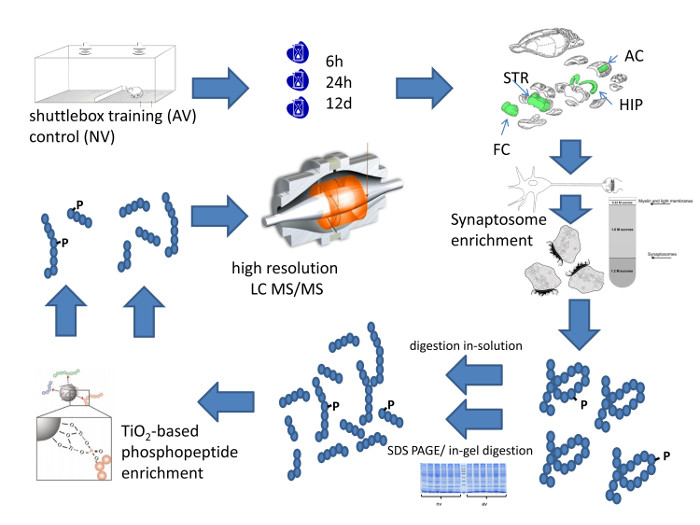
איור 1: Workflo השיטתיתw הגישה המתודולוגית. נתון זה סכמטי מסכם את העבודה של פרופיל כמוני ברזולוציה הגבוהה של רכב חלבון הסינפטי ספציפי באזור המוח. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2: דוגמה של ביצועים של עכברים בטון FM אפליה המשימות. בעלי חיים מראים בקצב הולך וגובר של להיטים (עקומה כחולה) ושיעור קטן והולך של אזעקות שווא (עקומה שחור) במהלך אימונים. אפליה משמעותית מתרחשת מההפעלה הרביעית. ברי שגיאה ניתנים SEM. אנא לחץ כאן כדי להציג את העדפתהגרסת ger של נתון זה.

איור 3: הכנת Synaptosome ואת השבר PSD המועשר. ת: הכנת Synaptosome. B: הכנת שבריר מועשר PSD. שני הדמויות להסביר את העבודה המפורטת של הכנת synaptosomes או לחילופין שברי PSD מועשרים מרקמות המוח. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
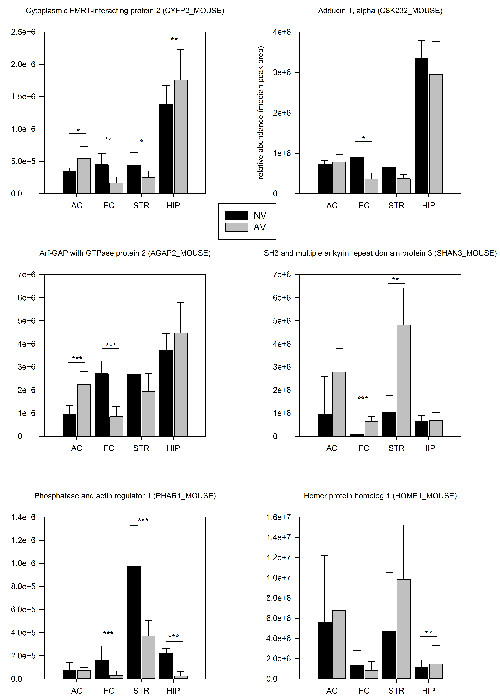
איור 4: מבחר תוצאות proteomic כמותי. השכיחויות הסינפטי היחסיות של חלבונים שנבחרו מושוות בין tra העכבריםשאינו עומד במשימת FMTD (AV, n = 6) ועכברים מלאים נאיביים (NV, n = 6) 24 שעות לאחר האימון הראשון. ערכי השפע חושבו החציוני של אזורי השיא של שלושת פפטידים העזים ביותר של חלבון. חלבונים עם שינויי שפע משמעותיים (AV / NV; מבחן t) מסומנים בתוך ההחלקות: * p <0.05, ** p <0.01, *** p <0.005. ברי שגיאה ניתנים SD. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5: ויזואליזציה של מסלולים ביולוגיים עבור Cortex פרונטאלית ידי GeneCodis / Gephi. רק שהתנאים המהותיים של מסד הנתונים ג'ין אונטולוגיה (GO) (http://geneontology.org) הקשורים "תהליך ביולוגי" עם מספר חלבון מינימום של שלושה מוצגים כאן. צמתים מייצגות מונחי GO, בגודל של הצומת, רוחב הקו ואת מספר החיבורים של צומת מסוימת מתאר את מספר החלבונים, אשר חולקים לטווח GO זה עם צומת אחרים. בשל שיטת "חיל אטלס" של Gephi, בלוטות הקשורות מקבצים אותם יחד באופן הדוק. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| אזור במוח | AC | FC | ירך | 000 "face =" Calibri "size =" 3 "> STR | Σ |
| חלבונים המזוהים | 1435 | 1758 | 1572 | 1507 | 6272 |
| חלבונים מוסדרים (p <0.05) | 59 | 130 | 162 | 108 | face = "Calibri" size = "3"> 459 |
| ↑ AV / NV | 8 | 4 | 76 | 35 | 123 |
| ↓ AV / NV | 51 | 126 | 86 | 73 | 336 |
| זיהיתי phosphomoti FS | 197 | 361 | 273 | 278 | 1109 |
| phosphomotifs מוסדר (p <0.05) | 8 | 22 | 21 | 14 | 65 |
| ↑ AV / NV | 4 | 00000 "face =" Calibri "size =" 3 "> 17 | 5 | 9 | 35 |
| ↓ AV / NV | 4 | 5 | 16 | 5 | 30 |
טבלה 1: סיכום של תוצאות proteomic. טבלה זו מסכמת ניסוי proteomic נציג של עכברים מאומנים (AV, n = 6) 24 שעות לאחר האימון הראשון בהשוואה לקבוצת הביקורת הנאיבית שלהם (NV, n = 6). הסכום של 459 חלבונים מוסדרים כולל תקנות חופפות. 283 תקנות שונות נקבעו ספציפי במוח. בפירוט, 57 חלבונים מוסדרים בשני אזורים במוח, 18 תקנות חלבון התגלו בשלושה אזורים במוח ורק 2 חלבונים מוסדרים בכל אזורי המוח הארבעה נחקר.
| טולרנסים שגיאה | |
| מבשר מסה (מסת טרנספורמציה פורה ספקטרומטריית) | 10 עמודים לדקה |
| מסת יון שבר (מלכודת יונים ליניארי) | 0.6 Da |
| שסעים החמיצו לכל היותר פפטיד | 3 |
| שינויים קבועים | |
| עבור ב-מתעכל-ג'ל דגימות | Carbamidomethylation של ציסטאין |
| מחפש פתרון מתעכל דגימות | Methylthiolation של ציסטאין |
| שינויים משתנים | חמצון של מתיונין |
| Deamidations של אספרגין ו / או גלוטמין | |
| מאגר מידע | Uniprot / Sprot |
| טקסונומיה | עכבר |
| הגדרות זיהוי קבלה סטטיסטיות | |
| דה נובו ביטחון מקומי ממוצע (ALC) | > 50% |
| פפטיד-שווא שיעור הגילוי (FDR, מבוסס על est. דמה-פיוז'ן) | <1% |
| משמעות חלבון (-10logP, המבוסס על T-מבחן שונה) | > 20 |
| פפטידים ייחודיים / חלבון | ≥ 1 |
| הגדרות כימות: | |
| פפטידים המשמש כימות אם: | |
| משמעות פפטיד (-10logP) | > 30 |
| זיהוי פפטיד | ≥ 50% של דגימות |
| איכות האות פפטיד | > 1 |
| שטח ממוצע פפטיד | > 1E5 |
| סובלנות זמן שמירת פפטיד | <5 דק ' |
| נוֹרמָלִיזָצִיָה | על ידי נוכחי יון כולל (עוית) |
טבלה 2: הגדרות לזיהוי חלבונים (שלב 4.2.2).
Discussion
המחקר מציג תהליך עבודה מתודולוגית אופטימיזציה עבור פרופיל כמותי מדויק של השינויים ביטוי חלבון הסינפטי במהלך לימוד וגיבוש זיכרון באזורים שונים במוח של עכברים. ההתקנה מספקת ההזדמנות ללמוד את ביטוי החלבון ברמה של חיה אחת למרות הבקשה הנדרשת לפחות שלושה משכפל טכני לדגימה לניתוח ספקטרומטריה.
המתודולוגיה לוקח בחשבון את הרכב חלבון המסוים של טרום postsynapse מורכב חלבוני פיגום משקל מולקולריים גבוהים אלא גם של חלבונים מתווכים חשובים נושאות משקל מולקולרי בינוני או נמוך. מעכל ב-פתרון של הכנות synaptosomal לגרום דור יעיל, ומכאן, ייצוג יתר של פפטידים שמקורם פיגום. זה, בתורו, עשוי לדכא את הניתוח של חלבונים בשפע קטנים או נמוכים. הכנת הציע של שברי SDS-PAGE מתוךaliquot של כל דגימה בשילוב עם הליך עיכול ג'ל במקביל מקלה על הניתוח של חלבוני שפע בינוניים ונמוכים מייצג שיטת משלימה מומלצת מאוד. לאחר יישום spectrometric נפרד מסת כל שברים נגזר מדגם (למשל פתרון לעכל, ב-ג'ל לעכל, שברים בשילוב מועשר phospho) ערכות נתונים MS המתאים / MS ניתן לשלב ומחושב נוספת לזיהוי חלבונים וכימות בפסגות תוכנה או חבילות תוכנה פופולריות חלופיות.
לחלופין, הבקשה הפרטנית של שברים ב-ג'ל הנגזרות עיכול של מדגם (מעובד בנפרד-תחומי ג'ל של נתיב מדגם) ושברים שנוצרה המדגם ב-פתרון המתעכל (למשל על ידי כרומטוגרפיה חילוף יונים) כדי ספקטרומטריית מסה יכולה להגדיל עומק אנליטי. עם זאת, העבודה המורחבת זה מגדיל באופן דרמטי את הזמן הנדרש עבור LS-MS / MS רכישת נתונים. לקבלת generation של רצף מולקולרי מפורט של rearrangements חלבון הסינפטי במהלך לימוד היווצרות הזיכרון קורס זמן מוגדר של פרופיל proteomic נדרש. כמובן הפעם יכול להתחיל מייד אחרי או אפילו במהלך האימון הראשון ומכסת מסגרת קרובה-מרושת זמן עד הביצועים של החיות הגיעו לרמה אסימפטוטי של העקומה למידה לאחר כ. 8 - 10 ימים של אימונים (ראה איור 2 לפרטים נוספים).
ניתוח השינויים זרחון של חלבונים סינפטיים דורש תשומת לב מיוחדת לנושא מסגרות הזמן שנבחרו במהלך למידת FMTD. על מפלי איתות יד אחת ייזום rearrangements חלבון הסינפטי ידוע להיות מופעל על ידי phosphorylations ו dephosphorylations חלבון צפוי בשלבים מוקדמים מאוד של אימונים חיים. מצד השני, ישנם שינויים לאורך זמן של חלבונים סינפטיים פוספורילציה המרובים הידועים המסדירים את הקישוריות והרכבה בתוך היםאדריכלות ynaptic 19, 20. אלה שינויים posttranslational צפויים גם בנקודות זמן מאוחר יותר של גיבוש הזיכרון.
בבסיסי הנתונים המורכבים שנוצרו על ידי עבודת proteomic זה דורשים עיבוד bioinformatic לזהות משתתפי מסלולים מולקולריים ומולקולות מפתח. מטה-אנליזה עולה מסלולי ייצוג יתר משמעותיים, אשר ממלאים תפקיד בתהליכי למידה וזיכרון.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We wish to thank Yvonne Ducho and Kathrin Pohlmann for excellent technical assistance. This work was supported by the Deutsche Forschungsgemeinschaft (SFB 779) and by the State Saxony-Anhalt / European Regional Development Fund (ERDF) via the Center for Behavioral Brain Sciences (CBBS).
Materials
| Name | Company | Catalog Number | Comments |
| 3 M Empore Solid Phase Extraction- Filter | 3M Bioanalytical Technologies | 4245SD | 7 mm/3 ml |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164564 | 100 µm x 2 cm, C18 |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164569 | 75 µm x 25 cm, C18 |
| Acetic acid | Carl Roth GmbH | 3738.1 | |
| Acetonitrile (ACN) | Carl Roth GmbH | AE70.2 | |
| Acrylamide (30%) | AppliChem | A0951 | |
| Ammonium hydrogen carbonate | Fluka | 9830 | |
| Ammonium hydroxide | Fluka | 44273 | |
| Ammonium persulfate (APS) | AppliChem | A2941 | |
| Biofuge pico | Heraeus GmbH | 75003280 | |
| Blue R-250 | SERVA Electrophoresis GmbH | 17525 | |
| Bromophenol Blue | Pharmacia Biotech | 17132901 | |
| C57BL/6J mice | Charles River | ||
| Cantharidin | Carl Roth GmbH | 3322.1 | |
| Centrifuge tubes for MLS-50 | Beckman Coulter | 344057 | |
| Centrifuge tubes for TLA 100.1 rotor | Beckman Coulter | 343776 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| Eppendorf 5417R centrifuge | VWR | 22636138 | |
| Eppendorf A-8-11 rotor | VWR | 5407000317 | |
| Formic acid | Fluka | 14265 | |
| GeneCodis | http://genecodis.cnb.csic.es/ | ||
| Gephi | https://gephi.org/ | ||
| Glycerol | AppliChem | A1123 | |
| Glycine | AppliChem | A1067 | |
| HALT Phosphatase Inhibitor Cocktail | Pierce /Thermo Scientific | 78420 | |
| HEPES Buffer solution | PAA Laboratories GmbH | S11-001 | |
| Homogenization vessel 2 ml | Sartorius AG | 854 2252 | |
| Hydrochloric acid | Sigma-Aldrich | H1758 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide (IAA) | Sigma-Aldrich | I1149 | |
| Laboratory drilling drive K-ControlTLC 4957 | Kaltenbach & Vogt GmbH | 182997 | |
| LTQ Tune Plus 2.7.0.1112 SP2 | Thermo Scientific | ||
| LTQ Orbitrap Velos Pro | Thermo Scientific | ||
| Macs-mix tube rotator | Miltenyi Biotech | 130-090-753 | |
| Magic Scan 4.71 | UMAX | ||
| Methanol | Carl Roth GmbH | AE71.2 | |
| MLS-50 rotor | Beckman Coulter | 367280 | |
| Optima MAX Ultracentrifuge | Beckman Coulter | 364300 | |
| PageRuler Prestained Protein Ladder | Thermo Scientific | 26616 | |
| PEAKS 7.5 | Bioinformatic Solutions | ||
| Phosphatase Inhibitor Cocktail 3 | Sigma-Aldrich | P0044 | |
| PhosphoRS 3.1 | IMP/IMBA/GMI | ||
| PhosSTOP | Roche | 4906845001 | |
| Plunger/pestle made of PTFE | Sartorius AG | 854 2651 | |
| PotterS homogenizer | Sartorius AG | 853 3024 | |
| Protease Inhibitor complete mini | Roche | 4693159001 | |
| Quantity One 4.5.1 | BioRad | ||
| RapiGest | Waters | 186002122 | |
| Shuttle box | Coulbourne Instruments | ||
| Sodium dodecylsulfate (SDS) | AppliChem | A1112 | |
| Sodium molybdate | Carl Roth GmbH | 274.2 | |
| Sodium tartrate dihydrate | Sigma-Aldrich | 228729 | |
| SONOREX RK 156 Ultrasonic Bath | BANDELIN electronic GmbH & Co. KG | 305 | |
| Soundproof chamber | Industrial Acoustics Company | ||
| Sucrose | Carl Roth GmbH | 4621.2 | |
| Tetramethyl ethylene -1,2-diamine (TEMED) | Sigma-Aldrich | T9281 | |
| Thermomixer basic | CallMedia | 111000 | |
| Titansphere TiO 5µm | GL Sciences Inc. Japan | 502075000 | |
| TLA 100.1 rotor | Beckman Coulter | 343840 | |
| Trifluoro acetic acid (TFA) | Sigma-Aldrich | T6508 | |
| Tris ( hydroxymethyl) aminomethane (TRIS) | AppliChem | A1086 | |
| Triton X-100 | Sigma-Aldrich | T8532 | |
| Trypsin Gold | Promega | V5280 | |
| Ultimate 3000 Ultra HPLC | Dionex/Thermo Scientific | ||
| Ultracentrifuge tube | Beckman Coulter | 343776 | |
| Unijet II Refrigerated Aspirator | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| UNIVAPO 100 H Concentrator Centrifuge | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| Urea | AppliChem | A1049 | |
| Water (high quality purifed) | Resistivity: > 18.2 MΩ*cm at 25 °C Pyrogens: < 0.02 EU/ml TOC: < 10 ppb | ||
| Xcalibur 3.0.63 | Thermo Scientific | ||
| ZipTipC18 Pipette Tips | MILLIPORE | ZTC18S960 |
References
- Lamprecht, R., LeDoux, J. Structural plasticity and memory. Nat Rev Neurosci. 5 (1), 45-54 (2004).
- Bingol, B., Schuman, E. M. Synaptic protein degradation by the ubiquitin proteasome system. Curr Opin Neurobiol. 15 (5), 536-541 (2005).
- Richter, J. D., Klann, E. Making synaptic plasticity and memory last: mechanisms of translational regulation. Genes Dev. 23 (1), 1-11 (2009).
- Rosenberg, T., et al. The roles of protein expression in synaptic plasticity and memory consolidation. Front Mol Neurosci. 7, 86(2014).
- Scheich, H., et al. Behavioral semantics of learning and crossmodal processing in auditory cortex: the semantic processor concept. Hear Res. 271 (1-2), 3-15 (2011).
- Kähne, T., et al. Synaptic proteome changes in mouse brain regions upon auditory discrimination learning. Proteomics. 12 (15-16), 2433-2444 (2012).
- Reichenbach, N., et al. Differential effects of dopamine signalling on long-term memory formation and consolidation in rodent brain. Proteome Sci. 13, 13(2015).
- Kähne, T., et al. Proteome rearrangements after auditory learning: high-resolution profiling of synapse-enriched protein fractions from mouse brain. J Neurochem. , (2016).
- Li, K., et al. Organelle proteomics of rat synaptic proteins: correlation-profiling by isotope-coded affinity tagging in conjunction with liquid chromatography-tandem mass spectrometry to reveal post-synaptic density specific proteins. J Proteome Res. 4 (3), 725-733 (2005).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. J Cell Biol. 86 (3), 831-845 (1980).
- Smalla, K. H., Klemmer, P., Wyneken, U. The Cytoskeleton - Imaging, Isolation, and Interaction. Dermietzel, R. , Humana Press. 265-282 (2012).
- Smalla, K. H., et al. The synaptic glycoprotein neuroplastin is involved in long-term potentiation at hippocampal CA1 synapses. Proc Natl Acad Sci U S A. 97 (8), 4327-4332 (2000).
- Shapiro, A. L., Vinuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem. 68 (5), 850-858 (1996).
- Thingholm, T. E., Larsen, M. R., Ingrell, C. R., Kassem, M., Jensen, O. N. TiO(2)-based phosphoproteomic analysis of the plasma membrane and the effects of phosphatase inhibitor treatment. J Proteome Res. 7 (8), 3304-3313 (2008).
- Carmona-Saez, P., Chagoyen, M., Tirado, F., Carazo, J. M., Pascual-Montano, A. GENECODIS: a web-based tool for finding significant concurrent annotations in gene lists. Genome Biol. 8 (1), 3(2007).
- Bonn, S., Seeburg, P. H., Schwarz, M. K. Combinatorial expression of alpha- and gamma-protocadherins alters their presenilin-dependent processing. Mol Cell Biol. 27 (11), 4121-4132 (2007).
- Tweedie-Cullen, R. Y., Reck, J. M., Mansuy, I. M. Comprehensive mapping of post-translational modifications on synaptic, nuclear, and histone proteins in the adult mouse brain. J Proteome Res. 8 (11), 4966-4982 (2009).
- Li, L., et al. The differential hippocampal phosphoproteome of Apodemus sylvaticus paralleling spatial memory retrieval in the Barnes maze. Behav Brain Res. 264, 126-134 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved