Method Article
Alta Resolución cuantitativa Synaptic proteoma perfiles de cerebro de ratón Regiones Después de discriminación auditiva de aprendizaje
En este artículo
Resumen
The identification of molecules and pathways controlling synaptic plasticity and memory is still a major challenge in neuroscience. Here, a workflow is described addressing the relative quantification of synaptic proteins supposedly involved in the molecular reorganization of synapses during learning and memory consolidation in an auditory learning paradigm.
Resumen
The molecular synaptic mechanisms underlying auditory learning and memory remain largely unknown. Here, the workflow of a proteomic study on auditory discrimination learning in mice is described. In this learning paradigm, mice are trained in a shuttle box Go/NoGo-task to discriminate between rising and falling frequency-modulated tones in order to avoid a mild electric foot-shock. The protocol involves the enrichment of synaptosomes from four brain areas, namely the auditory cortex, frontal cortex, hippocampus, and striatum, at different stages of training. Synaptic protein expression patterns obtained from trained mice are compared to naïve controls using a proteomic approach. To achieve sufficient analytical depth, samples are fractionated in three different ways prior to mass spectrometry, namely 1D SDS-PAGE/in-gel digestion, in-solution digestion and phospho-peptide enrichment.
High-resolution proteomic analysis on a mass spectrometer and label-free quantification are used to examine synaptic protein profiles in phospho-peptide-depleted and phospho-peptide-enriched fractions of synaptosomal protein samples. A commercial software package is utilized to reveal proteins and phospho-peptides with significantly regulated relative synaptic abundance levels (trained/naïve controls). Common and differential regulation modes for the synaptic proteome in the investigated brain regions of mice after training were observed. Subsequently, meta-analyses utilizing several databases are employed to identify underlying cellular functions and biological pathways.
Introducción
El aprendizaje se basa en la formación de huellas de la memoria y su mantenimiento. Es ampliamente aceptado que un mecanismo subyacente puede representar una formación dependiente de la actividad de nuevos y / o reordenamiento de los contactos sinápticos existentes entre las neuronas. A nivel molecular, diversas modificaciones de las proteínas, relocalizaciones subcelulares y los cambios en el volumen de negocios de proteínas sinápticas se han descrito 1-4 (Lamprecht, 2004 Nº 8). Sin embargo, la mayoría de los estudios hasta ahora se centraron en proteínas seleccionadas en lugar de en la composición proteoma sináptica global, pero compleja. El presente enfoque permite un examen imparcial de cambios proteoma sinápticas en las regiones del cerebro del ratón después de un experimento de aprendizaje. Es adecuado para hacer instantáneas moleculares dependientes punto de tiempo de la reorganización inducida por aprendizaje de la arquitectura sináptica. El flujo de trabajo descrito requiere un trabajo en equipo particular de diferentes especialistas en el comportamiento animal, la bioquímica de proteínas, espectrometría de masas y bioinformatics.
El paradigma de aprendizaje elegido, es decir, la discriminación tono de frecuencia modulada (FMTD), es una tarea de discriminación auditiva bien caracterizado en roedores 5. El aprendizaje y la formación de la memoria a largo plazo en esta caja de transporte Go / No-Go-tarea implica mecanismos en función de una mayor señalización de la dopamina cortical y la síntesis de proteínas. En consecuencia, los últimos estudios proteómicos en jerbos y ratones revelaron dopamina y reordenamientos de plástico inducida de aprendizaje de los componentes sinápticas en cortical, sino también en regiones del cerebro más basales que supuestamente interactúan durante el aprendizaje y la memoria FMTD 6-8. Esto ilustra que la formación de memoria implica una compleja interacción de diversas regiones del cerebro y por lo tanto, podría ser regulada diferencialmente dentro de estas regiones en el nivel proteoma. Por lo tanto, la disección de las regiones del cerebro del ratón corticales y subcorticales seleccionados se incluye en el flujo de trabajo.
Además, la characterizati fiableincluso en los cambios débiles en la composición de la proteína sináptica requiere un enriquecimiento de los compartimentos pre y post-sinápticas más que el análisis de los homogeneizados o fracciones de membrana cruda 9. Protocolos Por lo tanto, la preparación de sinaptosomas Utilizando establecido antes del análisis proteómico se describe con el fin de aumentar el nivel de detección y el rango dinámico de las proteínas-sinapsis específica 10,11.
Un requisito fundamental para el uso libre de etiquetas espectrometría de masas de alta resolución para fines cuantitativos es un alto grado de similitud de las muestras de proteínas. Como se espera que los cambios en lugar de menor importancia en la composición de la proteína sináptica que se produzca después de saber, un enfoque libre de etiquetas será apropiado comparar muestras de proteínas obtenidas de ratones no tratados previamente formados y que corresponde. Por otra parte, las estrategias de etiquetas condición específica de proteínas / péptidos usando isótopos estables (por ejemplo, TMT, iTRAQ, ICPL y SILAC), así como etiquetas basado en MS2 qua librentification (SWATH) son útiles, pero son más caros que el enfoque libre de etiquetas elegido o necesita hardware especial de espectrometría de masas.
Desde proyecciones proteómicos rinden a menudo complejos conjuntos de datos, se recomienda el procesamiento bioinformáticas para la interpretación de datos adecuado. Además, los meta-análisis pueden apoyar una mejor comprensión de los mecanismos moleculares que subyacen a los posibles cambios relacionados con paradigmas y la identificación de los principales procesos celulares involucrados y vías de señalización. Las metodologías adecuadas también se describen a continuación.
Protocolo
Todos los procedimientos, incluidos los sujetos con animales se realizaron de acuerdo con las regulaciones de la Ley Federal de Alemania, los reglamentos respectivos de la UE y las directrices de los NIH, y han sido aprobados por el comité de ética de la Landesverwaltungsamt Sachsen / Anhalt (42502-2-1102 IFN).
1. Aprendizaje Auditivo
- Discriminación auditiva de aprendizaje en la caja de transporte (FMTD paradigma) Nota: Usar siempre guantes durante la manipulación de los ratones.
- Casa ratones C57Bl6 / J en grupos de tres o cuatro con libre acceso a bolitas de comida y agua del grifo en jaulas de policarbonato transparente. Mantener un 12 hr luz: oscuridad ciclo en el animalario. Si los animales se reciben de otro laboratorio o de una compañía deje al menos una semana de aclimatación y de establecerse en.
- Lleve a cabo una sesión de entrenamiento de la caja de transporte por día.
- Tome el ratón de su jaula de alojamiento en las instalaciones de animales y colocarlo en una caja de transporte con poca luz dentro de una cámara a prueba de sonido.
- Utilice un programa de aprendizaje totalmente controlado por ordenador para el aprendizaje de discriminación auditiva. Comience con un período de habituación de 3 minutos de silencio, y luego comenzar la sesión de entrenamiento.
- Use secuencias del tono ascendente (4 - 8 kHz, CS +) como el Go-Go-estímulo durante los ensayos: el animal tiene que cruzar el obstáculo dentro de 6 segundos de la presentación de tono (la respuesta correcta, golpeado). Castigar a un fallo por una leve pies de choque de 50 - 300 mu, entregado a través del suelo de rejilla de la caja de transporte.
- Utilizar secuencias de la caída de tono (8 - 4 kHz, CS) como el n-Go-estímulo durante la no-go-ensayos: El animal tiene que permanecer en el compartimiento de corriente de la caja de transporte durante los 6 segundos de tono de la presentación. Castigar a una falsa alarma por un leve pies de choque de 50 - 300 mu, entregado a través del suelo de rejilla de la caja de transporte.
- Utilice intervalos entre ensayos de 20 5 seg.
- Realizar 30 Go-ensayos y 30 no-go-ensayos por sesión en un orden pseudo-aleatorios, de modo que uno sesión consiste en 60 ensayos y dura unos 25 minutos.
- Poner el animal entrenado de nuevo en su jaula de alojamiento en las instalaciones de animales.
- La disección del cerebro
- La eutanasia a los animales en el punto de tiempo deseado después de un número deseado de las sesiones de entrenamiento utilizando dislocación cervical (por ejemplo, 24 horas después de la terminación de la primera sesión). Decapitar al animal.
- Diseccionar rápidamente el cerebro a través de los siguientes pasos: Primero corte la piel y luego el cráneo con unas tijeras rectas a lo largo de los sagittalis sutura. Eliminar completamente las partes del hueso que cubren el tejido cerebral utilizando pinzas fuertes. Sacar el cerebro con una spattle.
- Para la disección, coloque cerebro en una placa de Petri llena de hielo. Diseccionar la corteza auditiva, la corteza frontal, el cuerpo estriado y el hipocampo en un estereomicroscopio utilizando un escalpelo y una aguja.
- Localizar la corteza auditiva utilizando puntos de referencia visuales en el cerebro surface tales como los vasos sanguíneos y la forma de la superficie (Bregma -2,06--3,4, tamaño rostrocaudal 2 mm, dorsoventral 1,3 mm) y bilateralmente diseccionar como un bloque de tejido rectangular con el grosor de la corteza.
- Diseccionar la corteza frontal como un corte de cerebro entre bregma 3,56 y 1,54 utilizando opticum chiasma como un punto de referencia y con exclusión de los tejidos de olfactorius bulbo.
- Diseccionar el cuerpo estriado como un corte de cerebro entre bregma 1,54 y 0,5 y retirar con cuidado el tejido cortical.
- Diseccionar el hipocampo mediante la fijación del cerebro con la aguja a través del cerebelo y la corteza desenrollar a partir de el lóbulo occipital.
- Choque-congelación de muestras de cerebro diseccionado en nitrógeno líquido y se almacena a -80 ° C.
2. Preparación de sinaptosomas o alternativamente un Postsináptica densidad (PSD) Fracción enriquecida
NOTA: Durante todos los procedimientos, mantener las muestras y tampones con un 0 - 4ºC.Los tampones contienen recién diluido cócteles inhibidores de la proteasa con el fin de evitar la degradación proteolítica de las proteínas. Si la fosforilación de proteínas también se estudia, cócteles de inhibidores de fosfatasa se tienen que añadir. Todos los valores de g indicados se dan como g (promedio) durante todo el protocolo.
- Preparación de una fracción de membrana en bruto (Figura 3A)
- Transferencia diseccionado tejido cerebral en un recipiente de homogeneización que contiene 1 ml de hielo frío tampón A (HEPES 5 mM, sacarosa 320 mM, pH 7,4) y homogeneizar el tejido en 900 rpm con 12 golpes.
- Centrifugar las muestras a 1.000 xg durante 10 min. Mantenga los sobrenadantes.
- Re-homogeneizar gránulos a las mismas condiciones en el mismo volumen de tampón de homogeneización como antes y las muestras de centrífuga de nuevo a 1000 xg durante 10 min. Combinar sobrenadantes correspondientes. Desechar el gránulos P1, que contienen principalmente los núcleos y restos celulares.
- Girar los sobrenadantes combinados durante 20 min a 12.000 x g. superna descartetantes o el uso de un fraccionamiento adicional 11.
- pellets de resuspender en el mismo volumen de tampón de homogeneización como antes de usar el homogeneizador con 6 golpes en 900 rpm y centrifugado a 12.000 xg durante 20 min. sobrenadantes de descarte. Los pellets P2 representan las fracciones de membrana cruda.
- Purificación de sinaptosomas a partir de fracciones de membrana de cerebro bruta (Figura 3A)
NOTA: fracciones de membrana bruta de cerebro se pueden separar en la mielina, las membranas de luz, sinaptosomas y mitocondrias usando ultracentrifugación en gradiente de densidad de sacarosa paso. Para este pH mM Tris 5 / HCl se requieren 8.1 tampones que contienen sacarosa, ya sea en 0,32 M, la concentración de 1,0 M o 1,2 M.- Mientras se realiza la centrifugación para producir las fracciones P2, preparar gradientes por etapas de sacarosa en los tubos de ultracentrífuga. Comience con 2,5 ml de 1,0 M tampón de sacarosa y la subcapa con 1,5 ml de 1,2 M tampón de sacarosa usando una pipeta Pasteur de vidrio.
- Vuelva a homogeneizar las fracciones P2en 0,5 ml de tampón sacarosa 0,32 M de forma manual con 6 accidentes cerebrovasculares y la carga en la parte superior de la pendiente.
- Girar a 85.000 xg durante 2 horas en una ultracentrífuga usando un rotor de cubeta oscilante.
- Desechar la capa superior 0,32 M de sacarosa incluyendo el material en la interfaz en el búfer de 1.0 M de sacarosa (mielina, las membranas de la luz). Recoger sinaptosomas en la interfaz de tampón de sacarosa 1,0 / 1,2 M. El sedimento en la parte inferior del tubo contiene mitocondrias.
- Añadir tampón de 0,32 M de sacarosa a la fracción sinaptosomal en proporción de 1: 1, se mezcla cuidadosamente y centrifugado a 150.000 xg durante 1 hr. Sinaptosomas están en el sedimento y ahora pueden resuspenderse en un tampón requerido para su posterior procesamiento.
- Preparación de una fracción enriquecida PSD (Figura 3B)
- Homogeneizar cada área específica del cerebro de un solo animal en 100 l de tampón de extracción (5 mM Tris / HCl pH 8,1, 0,5% Triton X-100) en un tubo de ultracentrífuga l 200 con una mano de mortero de PTFE (politetrafluoretileno)a 2000 rpm con 12 golpes.
- Añadir 100 l de tampón de extracción, se mezcla y se incuba durante 1 hora a 4 ° C. Centrifugar a 100.000 xg durante 1 hr y se recoge el sobrenadante S1 cuidadosamente con una pipeta de 200 l.
- Re-homogeneizar pellet P1 en el mismo tubo con 100 l de tampón de extracción de nuevo con una mano de mortero de PTFE a 2000 rpm con 12 golpes.
- Añadir 100 l de tampón de extracción y mezclar bien con una pipeta y centrifugado a 100.000 xg durante 1 hr.
- Combinar el sobrenadante con S2 S1 a la fracción de proteína soluble. Esta fracción contiene proteínas citosólicas, 0,5% Triton X-100 proteínas de membrana soluble y moléculas de la matriz extracelular.
- Resuspender el sedimento restante en 50 l 5 mM Tris / HCl pH 8,1. Esta fracción contiene los PSD, detergente resistentes membranas, elementos del citoesqueleto insolubles, las mitocondrias y los restos de células incluyendo núcleos. Está enriquecido en los PSD que forman el núcleo de las estructuras postsinápticas, sino también partes importantes de la presinápticacytomatrix en la zona activa. El factor de enriquecimiento de los PSD es de alrededor de 4 y el enriquecimiento de componentes PSD se ha demostrado previamente. 12
3. Preparación de muestras para espectrometría de masas
- La lisis y la normalización de la muestra
NOTA: la normalización de la muestra en relación con la concentración de proteínas es un paso muy importante para lograr, finalmente, los datos cuantitativos fiables, incluso para los débiles cambios en la expresión de proteínas sinápticas.- Disolver sinaptosomas o preparaciones enriquecidas-PSD de cada área del cerebro de un animal en 20 - 50 l (dependiendo de la cantidad total de material: para corteza auditiva con 5-15 mg uso tejido 20 l) de 8 M urea y se incuba en hielo durante 1 h en un baño de ultrasonidos.
- Para digerir en gel, se disuelven sinaptosomas directamente en el tampón de muestra de SDS. calcular cuidadosamente la cantidad cargada para evitar la sobrecarga del gel. Tengamos en cuenta que en este caso, la alta abundancia protei andamions se perderán durante la electroforesis en gel y en gel de digerir.
- Diluir con 1% de un detergente extraíble para asegurar una concentración final de urea 2 M. Evitar cualquier temperatura superior a 30 ° C para evitar carbamilación proteína.
- Realizar SDS-PAGE con una alícuota (por ejemplo 10 l) de la muestra de acuerdo con procedimientos estándar 13,14.
- Tinción del gel con azul de Coomassie de acuerdo con el protocolo del fabricante. El procedimiento combina la etapa de fijación y tinción con metanol y ácido acético.
- Determinar la densidad óptica de cada muestra para todo el carril con un escáner de gel calibrado en modo de transmisión y calcular la cantidad de proteína relativa.
- Normalizar las muestras de acuerdo con estos cálculos.
- Dividir cada muestra en dos partes diferentes. Utilice un tercio de la de-gel de digerir y dos tercios para la solución de digestión.
- Disolver sinaptosomas o preparaciones enriquecidas-PSD de cada área del cerebro de un animal en 20 - 50 l (dependiendo de la cantidad total de material: para corteza auditiva con 5-15 mg uso tejido 20 l) de 8 M urea y se incuba en hielo durante 1 h en un baño de ultrasonidos.
- En-gel de digerir
- separación del gel
- Realizar una segunda SDS-PAGE utilizando las muestras de concentración ajustados. Manchar y cuantificar los geles por segunda vez para comprobar la calidad de la normalización.
- Cortar cada carril de una muestra dentro del gel en diferentes áreas (8 / carril) pero excluir el intervalo de peso molecular superior a 170 kDa. Transferir las piezas de gel en tubos separados.
- Cortar las áreas en piezas más pequeñas (aprox. 1 x 1 mm) con un escalpelo afilado para facilitar la eficacia digestión en gel.
- Digesto 15
- Lavar las piezas de gel varias veces (dependiendo de la intensidad de la tinción) durante 10 minutos con 50 - 150 l de un tampón que consiste en 50% de acetonitrilo (ACN) y 50 mM de hidrógeno carbonato de amonio (NH 4 HCO 3).
- Retirar los sobrenadantes. Cubrir las piezas de gel con ACN y se incuba a 20 ° C hasta que se convierten en piezas de gel blanco y se encogen.
- Retire la ACN y rehidratar las piezas de gel de 5min con 50 l de 0,1 M de NH 4 HCO 3. Añadir el mismo volumen de ACN y se incuba durante 15 min a 37 ° C.
- Retire y deseche el líquido por completo. Secar las piezas de gel en una centrífuga de vacío.
- Rehidratar piezas de gel en 50 l de NH 4 HCO 3 que contiene 10 mM de ditiotreitol (DTT) y las muestras de calor durante 45 minutos a 56 ° C para reducir los residuos de cisteína.
- Eliminar los sobrenadantes y se añaden 50 l NH 4 HCO 3 que contiene 55 mM de yodoacetamida (IAA) durante 30 min en la oscuridad para carbamidomethylate cisteínas reducidas.
- Retire y deseche todo el líquido por encima de las piezas de gel y lavar dos veces con 50 l NH 4 HCO 3 y ACN (1: 1) durante 10 minutos para eliminar cualquier residuo de IAA. Las muestras secas en una centrífuga de vacío.
- Para la digestión limitada de las proteínas agregar 25 mM NH 4 HCO 3 que contiene 12,5 ng / l de tripsina. El volumen requerido depende del tamaño y cantidad del gel de pieces. Incubar durante unos minutos y comprobar si se absorbe la memoria intermedia. Añadir más memoria intermedia si, gel de piezas necesarias deben estar completamente cubiertos. Incubar a 37 ° C durante la noche (min. 12 h).
- la extracción de péptidos
- Piezas de gel de solapamiento de 10 - 20 l de 25 mM NH 4 HCO 3 y añaden el mismo volumen de ACN. Incubar durante 10 minutos en hielo utilizando baño de ultrasonidos. Después de quitar y recoger los sobrenadantes que contienen la mayoría de los péptidos generados.
- Añadir 100 ml de tampón de extracción que contienen ácido 30% de ACN / 0,1% trifluoroacético (TFA) a las piezas de gel. Repita la incubación en un baño de ultrasonidos y recoger cuidadosamente este sobrenadante.
- Repita los últimos pasos de extracción mediante el aumento de la concentración de ACN al 50%. Después de 10 minutos de baño de ultrasonidos de girar y recoger los sobrenadantes.
- Combinar los tres sobrenadantes correspondientes de las etapas de extracción y secarlas en una centrífuga de vacío. Tenga en cuenta quecomo resultado de la separación en gel de los 8 áreas por carril / muestra se combinan para una muestra de nuevo en este paso.
- separación del gel
- En solución de digerir
- Digerir
- Usar la cantidad calculada (por ejemplo, 100 l de un lisado de 150 l, depende de la cantidad de material y el volumen requerido para la resuspensión de una muestra de un área específica del cerebro) de las muestras normalizadas para obtener material de partida suficiente para al menos tres repeticiones técnica a realizar etiqueta libre de espectrometría de masas.
- Añadir DTT 2 mM en 25 mM NH 4 HCO 3 y agitar suavemente la muestra. Reducir las muestras durante 45 minutos a 20 ° C.
- Añadir IAA 10 mM a carbamidomethylate los residuos de cisteína. Mezclar e incubar durante 30 minutos en la oscuridad a 20 ° C.
- Por último, añadir 1 l de una solución de tripsina de valores (1 mg / l de tripsina en 25 mM de ácido acético) y se incuba a 20 ° C durante 12 horas.
- Extracción en fase sólida (SPE) -Purification
- Para eliminar el detergente escindible ácido, ajustar las muestras a una concentración final de 1% de TFA y se incuba durante 1 hora a 20 ° C.
- Centrifugar las muestras a 16.000 xg durante 10 minutos y se recogen los sobrenadantes cuidadosamente.
- Colocar la columna de SPE en un bastidor y equilibrar la matriz con 2 ml de metanol. Lavar dos veces con 2 ml de 0,1% de TFA en agua (tampón B).
- Añadir 2 ml de tampón B y la carga de la muestra. Lavar otras tres veces.
- La elución de los péptidos mediante la adición de 200 l 70% de ACN / 0,1% de TFA. Repita este paso.
- Aunar ambas eluidos y secarlas en una centrífuga de vacío.
- Digerir
- Fosfo-péptido-enriquecimiento mediante cromatografía de TiO2 16
- Disolver péptidos producidos por en gel o en solución de digerir en 150 l de 80% de ACN / TFA al 2,5% (tampón C) y equilibrar ~ 2 mg de las perlas de TiO2 en el 50l de tampón C.
- Añadir perlas a la muestra y se incuba en un dispositivo de rotación durante 1 hora a 20 ° C. Posteriormente, los granos de giro hacia abajo (16.000 xg, 1 min) y recoger los sobrenadantes.
- Se lavan las perlas tres veces con 100 l de tampón C mezclando y girando hacia abajo después de 5 min suavemente. Recoger los sobrenadantes. Repita este paso tres veces con 100 l de 80% de ACN / TFA al 0,1%, seguido de tres lavados con 100 l de TFA al 0,1% (sin ACN), respectivamente.
- Combinar todos los diez sobrenadantes, secarlas en una centrífuga de vacío y manejarlos como la fracción empobrecida en fosfo-péptido para la purificación adicional según la etapa 3.5.
- La elución de los fosfo-péptidos unidos con 20 l de 400 mM NH4OH / 30% de ACN de las perlas. Repita este paso tres veces y recoger todos los sobrenadantes después de centrifugar las perlas.
- Combinar los eluatos de la en-gel de digerir y de la solución en-Recopilación de una muestra y manejarlos como la fosfo-pfracción eptide enriquecida. Secar en una centrífuga de vacío a un volumen final de 4 - 8 l.
- Para concentrarse y desalado de fracciones peptídicas-fosfo-empobrecido por micro-SPE
- Disolver los péptidos secos en 20 l de 0,1% de TFA.
- Equilibrar la fija C18 -matrix dibujando 20 l ACN hacia la punta. Lavar la matriz mediante la elaboración de 0,1% de TFA en agua en la punta. Repetir el proceso tres veces.
- Poco a poco la carga de la muestra acidificada en la punta (repetir este paso tres veces).
- Lavar los C 18 -matrix tres veces con 20 l 0,1% de TFA en agua y desechar la solución de lavado.
- Eluir péptidos a partir de la punta de la pipeta por repetidamente (3 veces) dibujo 20 l de 70% de ACN / 0,1% de TFA y recoger esta solución de elución en un tubo separado.
- Combinar los eluidos de una muestra y secarlas en una centrífuga de vacío.
4. Análisis del proteoma
NOTA: Proteoma análisis se realiza en una trampa de iones lineal de doble presión híbrido / espectrómetro de masas Orbitrap equipado con un HPLC Ultra. La HPLC se compone de un automuestreador refrigerado con un bucle de inyección de 20 l, una bomba binaria de carga (rango de caudal l), una bomba de separación de flujo nano binario, un calentador de columna con dos micro válvulas de conmutación y un desgasificador. Las muestras se someten en primer lugar a una columna de captura (por ejemplo, 100 micras x 2 cm) a una velocidad de flujo de 7 l / min, seguido de separación en una columna (por ejemplo, 75 m x 25 cm) a 250 nl / min. La salida de la columna de separación se acopla directamente a una punta recubierta emisor Pico posicionado en una interfaz de nano-aerosol en la fuente de ionización del espectrómetro de masas.
- Nano-cromatografía líquida y espectrometría de masas en tándem
- Disolver muestras de péptidos en 12 l 2% ACN / TFA al 0,1% durante al menos 30 min. Centrifugar durante 15 segundos y transferir 11 l sobrenadante a viales muestreador automático (cónica, reducida diameter).
- Establecer un régimen automático de aplicación de ejemplo, separación por cromatografía y espectrometría de masas en tándem en el software de control (por ejemplo, Xcalibur) de la siguiente manera.
- Utilice lo siguiente para las temperaturas del inyector automático: 5 ° C; horno de columna: 45 ° C.
- Utiliza el siguiente para Inyección: Volumen: 10 l; velocidad de flujo: 7 l / min (2% ACN, 0,1% de TFA); Tiempo: 8 min; ajuste de la válvula: columna trampa - los residuos; adquisición de espectro de masa: off.
- Utilice la siguiente para la Separación: Caudal: 250 nl / min ajuste de la válvula: columna de la columna de separación de la trampa; adquisición de espectro de masa: en.
0 min - 100 min: 2% ACN, 0,1% de ácido fórmico - 40% de ACN, ácido fórmico 0,1%
100 min - 105 min: 40% de ACN, 0,1% de ácido fórmico - 95% de ACN, ácido fórmico 0,1%
105 min - 109 min: 95% de ACN, ácido fórmico 0,1%
109 min - 120 min: 2% ACN, ácido fórmico 0,1% - Utilice los siguientes ajustes para la espectrometría de masas: Completo MS: FTMS; Resolución 60.000; m / z gama de 400 - 2.000; SRA/MS: Lineal Iontrap; umbral mínimo de señal 500; Ancho de aislamiento 2 Da; Tiempo de exclusión dinámica de ajuste de 30 segundos; Los iones cargados individualmente están excluidos de la selección; energía de colisión normalizada se establece en 35%, y la activación de tiempo de 10 mseg.
NOTA: Un análisis completo de MS es seguido por hasta 15 LTQ MS / MS ejecuta utilizando inducida por colisión-disociación (CID) de los iones peptídicos más detectados en abundancia.
- Correr tres repeticiones técnica para todas las muestras.
- Identificación de proteínas y la etiqueta de la cuantificación libre
- Proceso de masas de espectrometría de datos en bruto hacia la identificación de proteínas y libre de etiquetas cuantificación utilizando una suite de software comercial (por ejemplo, los picos de Estudio). En contraste con la mayoría de otros paquetes de software proteoma este software en particular utiliza un algoritmo de novo -sequencing antes de alineaciones de bases de datos de proteínas. Sin embargo, este paso puede ser fácilmente sustituido por otros paquetes de software populares.
- uso essciales ajustes enumerados en la Tabla 2.
- Fosfo-proteómica
NOTA: la adquisición eficiente y fiable fosfopéptido requiere algunos cambios esenciales de la configuración del flujo de trabajo proteómico.- Después del enriquecimiento fosfo-peptídico, las muestras nunca se seque por completo. Siempre mantenga muestras disueltas.
NOTA: El enlace fosfo-éster de treoninas fosforiladas o serinas es muy frágil. Durante la fragmentación inducida por colisión dentro de la trampa de iones esto resulta en una pérdida neutra de fosfato. Esto evita que cualquier fragmentación de péptido, que a su vez es necesario para la identificación. Permitido de banda ancha-activación en la configuración de espectrometría de masas permite la fragmentación de fosfo-péptidos, incluso después de una pérdida neutral del grupo fosfato. Se lleva a cabo un ahorro de "pseudo-MS 3" tiempo. determinación fosfo-sitio en los datos de MS / MS requiere una verificación y evaluación en particular y puede ser realizada por fósforos 3.0.
- Después del enriquecimiento fosfo-peptídico, las muestras nunca se seque por completo. Siempre mantenga muestras disueltas.
5. Bioinformática - Meta-Análisis
NOTA: Antes de realizar la anotación funcional y análisis de redes, las listas de proteínas tienen que ser pre-procesado. En primer lugar unificar las listas de proteínas reguladas y fosfo-péptidos para cada región del cerebro por separado. A continuación, retire todo el duplicado UniProt-ID para cada fracción para evitar malas interpretaciones.
- Análisis de enriquecimiento singular con GENECODIS 17
- Abra la herramienta basada en la web de GENECODIS (http://genecodis.cnb.csic.es)
- Seleccione "Mus musculus", como organismo y "GO procesos biológicos", como anotación.
- Pegar una lista de identificadores UniProt-de una cierta fracción. Enviar y esperar hasta que se realiza el análisis. Haga clic en "Análisis de enriquecimiento Singular de GO proceso biológico" y ver los resultados.
- Repita el paso 5.1.3 para las otras tres fracciones.
- Para ver las duplicaciones y las intersecciones entre las listas de resultadosutilizar un lenguaje de programación como Perl o Python para filtrar los datos necesarios. herramientas similares para un análisis de enriquecimiento singular son DAVID (https://david.ncifcrf.gov/) y Cytoscape (http://www.cytoscape.org/) con los plugins de bingo (http://apps.cytoscape.org/ aplicaciones / bingo) y ClueGO (http://apps.cytoscape.org/apps/cluego).
- Generar un gráfico basado vigor a partir de datos GENECODIS con Gephi (https://gephi.org/)
NOTA: Los datos de los gráficos tiene que ser proporcionada por el usuario, ya sea en un formato gráfico (.gexf, .graphml, .dot, .gv, .gml) o introducido manualmente.- La generación de los nodos del grafo
- A mano: Abrir Gephi y hacer clic en "Laboratorio de Datos". Crear nodos. Haga clic en "nodos" de la izquierda para cambiar a la mesa de "nodos". Haga clic en "Agregar estación". Introduzca el nombre del término. Haga clic en "Aceptar" / Pulse Intro.
- Alternativa: Save GENECODIS resultado al PC. Abra la .txt con un programa de hoja de cálculo. Eliminar todas las filas except de "Item_Details" (nombres de plazo). Modificación de la cabecera "Item_Details" a "Etiqueta". Guarde la hoja de cálculo como ".csv". Ahora en Gephi, haga clic en "Importar hoja de cálculo". Elija hoja de cálculo desde el explorador de archivos de Gephi. Haga clic en Siguiente". Haga clic en "Finalizar".
- Conexión de los nodos a través de los bordes.
- Haga clic en "bordes" de la izquierda para cambiar a la mesa "bordes". Por cada nodo (Plazo): buscar nombres de genes en otros términos. Si uno o más genes son compartidos -> crear borde.
- Haga clic en "Añadir Edge". Seleccione "sin dirección". Seleccione la fuente y el nodo de destino de las listas desplegables. Haga clic en "Aceptar" / Pulse Intro. Si más de un gen es compartida, introduzca la abundancia de "peso" (tabla).
- Fuerza basa el diseño gráfico.
- Abrir archivo de datos de la gráfica, establecer el tipo de gráfico que "no dirigida" o utilizar los datos como se ha introducido manualmente, haga clic en "Información general" si no está ya SELECTEre.
- Cambiar el tamaño de los nodos en función de la abundancia de interconexiones. Haga clic sobre la estadística, ya sea correr "grado medio" (bordes no ponderados) o "Promedio. Grado ponderado" (bordes ponderados) bajo "Descripción de la red". En "Apariencia", haga clic en "nodos", y luego en el botón de tamaño, junto seleccione "Atributos" y establecer el parámetro atributos de precio. "Grado ponderado" o "grado medio". Haga clic en Aplicar.
- Por último: Seleccionar "Fuerza Atlas" en "Diseño" y correr; cambiar "la fuerza de repulsión" si los nodos están chocando.
- Exportación de imagen.
- función Captura: Haga clic en "Información general", diseño gráfico cambio, espesor del borde, tamaño de la etiqueta y la ampliación con el menú en la parte inferior de "Gráfico" ventana. Haga clic en el botón de la izquierda de la cámara, y guardar la imagen.
- función de exportación de "Vista previa": Haga clic en "Vista previa". Cambiar los valores predefinidos en "default recta". Cambio de configuracions según las preferencias elegidas y hacer clic en "SVG / PDF / PNG" para exportar.
- La generación de los nodos del grafo
Resultados
La Figura 1 resume el flujo de trabajo completo de perfiles proteoma cuantitativa sináptica de las regiones del cerebro del ratón después de conocer la discriminación auditiva. Se inicia con la formación de los animales en una caja de transporte. En el ejemplo mostrado en la Figura 2, los ratones comenzaron a mostrar significativa discriminación tono de FM en la sesión de entrenamiento 4 TH, lo que indica aprendizaje eficiente. Los animales se sacrifican en puntos de tiempo seleccionados para la disección área del cerebro. El enriquecimiento requerido de sinapsis o bien se puede logra mediante la preparación de sinaptosomas o, alternativamente, por la preparación de una fracción enriquecida PSD, ambos descritos en detalle en la figura 3. El método de enriquecimiento de PSD se ha desarrollado para cantidades de tejido bajas, por ejemplo 1 - 2 rebanadas de hipocampo de cerebro de rata 12, 18. Requiere pequeños tubos, manos de mortero de PTFE montaje de estos tubos, y una unidad de perforación de laboratorio para la alimentación de la mano del mortero.
Debido a la composición de la proteína particular de sinaptosomas, se recomienda encarecidamente para realizar la preparación de la muestra de dos maneras diferentes pero complementarios. Los andamios de los PSD son a menudo proteínas de muy alto peso molecular que se producen en alta estequiometría. Dentro de la solución de digestión es la mejor manera de extraer de manera eficiente, pero puede conducir a un sobremuestreo de la mezcla de péptidos generados. El gel-en digerir realiza de la misma muestra en paralelo puede excluir aquellas proteínas de alto peso molecular y favorecer el análisis de proteínas con medio y bajo peso molecular. Para un análisis exhaustivo se recomiendan dos tipos de digestiones proteolíticas.
Las diferentes cantidades de tejidos de las áreas del cerebro investigados requieren un ajuste del material aplicado para una mejor comparación. Dentro de las cuatro áreas del cerebro investigado la corteza auditiva es generalmente el hecho de limitaro. El material de todas las demás áreas del cerebro cuidadosamente debe ajustarse a la cantidad de la corteza auditiva después de la preparación de sinaptosomas o fracciones enriquecidas-PSD (véase 3.1.1.). Los pesos típicos de las áreas del cerebro de ratones recién preparados son los siguientes: corteza auditiva (CA): ~ 50 mg; hipocampo (HIP): ~ 90 mg; estriado (STR): ~ 120 mg y la corteza frontal (FC): ~ 100 mg.
El método de enriquecimiento de PSD se describe en la sección 2.3 permitió la identificación de aproximadamente 1500 diferentes proteínas y aproximadamente 250 diferentes fosfo-péptidos por región del cerebro en el nivel de un solo animal (Tabla 1). El análisis proteómico 24 h después de la primera sesión de entrenamiento reveló que el 7,3% de las proteínas identificadas y el 5,8% de los fosfo-péptidos mostraron significativa (p <0,05) los cambios cuantitativos en su expresión sináptica en comparación con los controles no tratados previamente (Tabla 1). Una tendencia notable por abajo Regulación de andamios sinápticas puede apuntar a un reordenamiento pronunciada de la arquitectura sináptica durante las primeras etapas del aprendizaje FMTD. La gran mayoría de las proteínas reguladas se alteró de manera específica para la región del cerebro, mientras que se encontraron sólo el 22% ser regulada en dos o más áreas del cerebro. Seis ejemplos seleccionados se muestran en la Figura 4.
El metanálisis de los complejos resultados por IPA proporciona evidencia de lo particular la participación / manipulación de las siguientes vías canónicas: "La endocitosis de señalización mediada por clatrina", "la señalización de calcio" "axonal orientación Señalización", "RhoA señalización", "la señalización de Notch "," Remodelación de las uniones adherentes epitelial "," El glutamato receptor de señalización "," GABA receptor de señalización "," La dopamina receptor de señalización "y" Synaptic potenciación a largo plazo ".
Análisis individual de enriquecimiento reveló procesos biológicos excesivamente significativas en la corteza frontal en relación con el transporte de proteínas, la adhesión celular, la fosforilación, la endocitosis, el transporte de vesículas mediada, el desarrollo del cerebro anterior y axonogenesis (Figura 5). En los procesos biológicos corteza auditiva, incluyendo el transporte de iones, la traducción, el transporte del ARNm, el transporte de proteínas y el aprendizaje fueron notables. El análisis de la fracción de proteína del hipocampo detecta significativamente los procesos enriquecidos relacionados con el transporte de iones, el ciclo celular, la traducción, la fosforilación y desarrollo del sistema nervioso. En el cuerpo estriado, sobrerrepresentados se encontraron procesos biológicos, incluyendo el transporte del ARNm, el transporte de vesículas mediada, axonogenesis, proteolisis, el transporte de proteínas y la endocitosis.
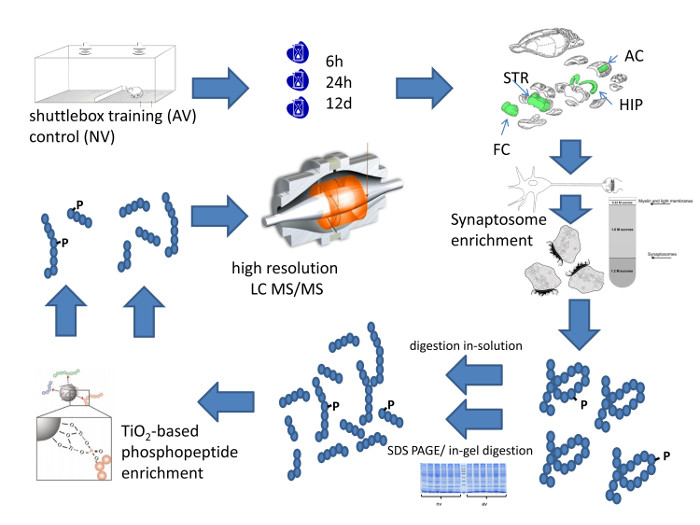
Figura 1: Sistemática Workflow del enfoque metodológico. Esta figura resume esquemáticamente el flujo de trabajo de alta resolución de perfiles cuantitativa de la composición de la proteína sináptica específica área del cerebro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplo del comportamiento de la rata en el tono de FM Discriminación de tareas. Animales muestran una tasa creciente de accesos (curva azul) y una tasa de disminución de falsas alarmas (curva negro) en el curso de las sesiones de entrenamiento. la discriminación significativa se produce a partir de la cuarta sesión. Las barras de error se proporcionan como SEM. Haga clic aquí para ver una larger versión de esta figura.

Figura 3: Preparación de la sinaptosomas y la fracción enriquecida en PSD. A: preparación de sinaptosomas. B: Preparación de la fracción enriquecida PSD. Ambas figuras explican el flujo de trabajo detallado de preparación de sinaptosomas o fracciones enriquecidas alternativamente-PSD de los tejidos del cerebro. Haga clic aquí para ver una versión más grande de esta figura.
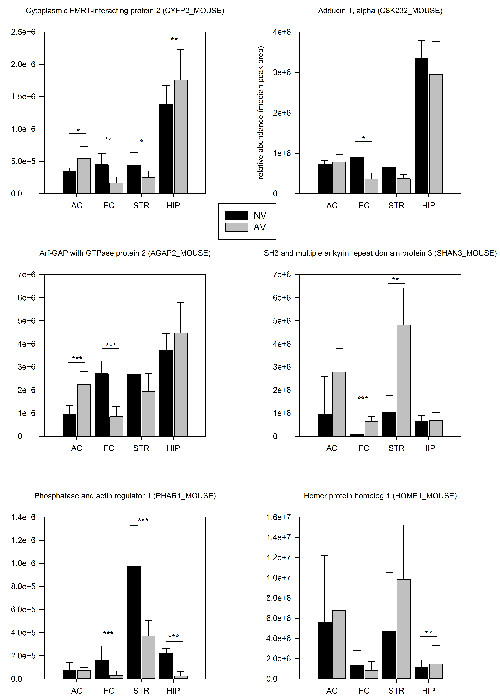
Figura 4: Selección cuantitativa proteómicos resultados. Las abundancias relativas de sinápticas proteínas seleccionadas se comparan entre ratones trained en la tarea FMTD (AV, n = 6) y los ratones de control no tratados previamente (NV, n = 6) 24 horas después de la primera sesión de entrenamiento. Los valores de abundancia se calcularon como la mediana de las áreas de los picos de los tres péptidos más intensos de una proteína. Las proteínas con cambios significativos de abundancia (AV / NV; t-test) se marcan dentro de las parcelas: * p <0,05, ** p <0,01, *** p <0,005. Las barras de error se proporcionan como SD. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: La visualización de las vías biológicas para la corteza frontal por GENECODIS / Gephi. Solamente los términos significativos de la base de datos de ontología de genes (GO) (http://geneontology.org) relacionados con "proceso biológico" con un número mínimo de proteínas de tres se muestran aquí. Los nodos representan los términos de GO, el tamaño del nodo, el ancho de línea y el número de conexiones de un cierto nodo representan el número de proteínas, que comparten este término GO con otros nodos. Debido al método de "Fuerza Atlas" de Gephi, los nodos relacionados está aglomerando estrechamente. Haga clic aquí para ver una versión más grande de esta figura.
| región del cerebro | C.A. | FC | CADERA | 000 "face =" "size =" Calibri 3 "> STR | Σ |
| proteínas identificadas | 1435 | 1758 | 1572 | 1507 | 6272 |
| proteínas reguladas (p <0,05) | 59 | 130 | 162 | 108 | face = "Calibri" size = "3"> 459 |
| ↑ AV / NV | 8 | 4 | 76 | 35 | 123 |
| ↓ AV / NV | 51 | 126 | 86 | 73 | 336 |
| phosphomoti identificado fs | 197 | 361 | 273 | 278 | 1109 |
| phosphomotifs regulados (p <0,05) | 8 | 22 | 21 | 14 | sesenta y cinco |
| ↑ AV / NV | 4 | 00000 "face =" "size =" Calibri 3 "> 17 | 5 | 9 | 35 |
| ↓ AV / NV | 4 | 5 | dieciséis | 5 | 30 |
Tabla 1: Resumen del resultado de Proteómica. Esta tabla resume un experimento proteómico representante de ratones entrenados (AV, n = 6) 24 horas después de la primera sesión de entrenamiento en comparación con sus controles no tratados previamente (NV, n = 6). lossuma de 459 proteínas reguladas incluye regulaciones superpuestas. 283 regulaciones diferentes se determinaron como específicas del cerebro. En detalle, las 57 proteínas están reguladas en dos regiones del cerebro, se detectaron 18 reglamentos de proteínas en tres regiones del cerebro y sólo 2 proteínas están reguladas en las cuatro áreas del cerebro investigadas.
| tolerancias de error | |
| masa precursora (Fourier masa espectrometría de transformación) | 10 ppm |
| de masas de iones fragmento (trampa de iones lineal) | 0.6 Da |
| Divisiones máximas perdidas por péptido | 3 |
| modificaciones fijos | |
| en-gel digerido muestras | Carbamidomethylation de cisteína |
| para las muestras en solución digerido | Methylthiolation de la cisteína |
| variable modificaciones | La oxidación de la metionina |
| Desamidaciones de asparagina y / o glutamina | |
| Base de datos | Uniprot / Sprot |
| taxonomía | ratón |
| Ajustes estadísticos de identificación de aceptación | |
| de novo promedio de la confianza local (ALC) | > 50% |
| Péptido-falsa tasa de descubrimiento (FDR, basado en est. Decoy-fusión) | <1% |
| Proteína significación (-10logP, basado en T-test modificado) | > 20 |
| péptidos únicos / proteínas | ≥ 1 |
| Ajustes de cuantificación: | |
| Los péptidos utilizados para la cuantificación si: | |
| Péptido significación (-10logP) | > 30 |
| la identificación de péptidos en | ≥ 50% de las muestras |
| calidad de la señal de péptidos | > 1 |
| superficie media de péptidos | > 1E5 |
| Péptido tolerancia tiempo de retención | <5 min |
| Normalización | por la corriente de iones total (TIC) |
Tabla 2: Ajustes para la identificación de proteínas (paso 4.2.2).
Discusión
El estudio presenta un flujo de trabajo optimizado metodológica para un perfilado cuantitativa precisa de los cambios de expresión de proteínas sinápticas durante el aprendizaje y la consolidación de la memoria en diferentes zonas del cerebro de los ratones. La configuración proporciona la oportunidad de estudiar la expresión de la proteína en el nivel de un solo animal a pesar de la aplicación requerida de al menos tres repeticiones técnica por muestra para el análisis de espectrometría de masas.
La metodología tiene en cuenta la composición de la proteína particular de la pre- y postsynapse que consiste en proteínas de peso molecular elevado de andamio, sino también de las proteínas mediador importante teniendo pesos moleculares medio o inferior. Los digeridos en solución de sinaptosomas preparados dan como resultado una generación eficiente y, por lo tanto, un exceso de representación de los péptidos derivados de andamios. Esto, a su vez, puede suprimir el análisis de proteínas abundantes más pequeños o más bajas. La preparación de las fracciones sugerido SDS-PAGE de unaalícuota de cada muestra se combina con un procedimiento de digestión en gel en paralelo facilita el análisis de las proteínas de abundancia media y baja y representa un método complementario muy recomendable. Después de la aplicación de espectrometría de masas independiente de todas las fracciones derivadas de una muestra (por ejemplo, en solución de digerir, en gel de digerir, fracciones fosfo-enriquecido combinados) los conjuntos de datos de MS / MS correspondientes se pueden combinar y calculados para la identificación de proteínas y cuantificación de picos más software o paquetes de software populares alternativos.
Alternativamente, la aplicación individual de las fracciones en-gel-digestión derivados de una muestra (de gel zonas procesadas por separado de un carril de la muestra) y fracciones generado de la muestra digerida en solución (por ejemplo, por cromatografía de intercambio iónico) a espectrometría de masas puede aumentar la profundidad analítica. Sin embargo, este flujo de trabajo prolongado aumenta dramáticamente el tiempo requerido para LS-MS de adquisición de datos / MS. para generatioSe requiere n de una secuencia molecular detallada de los reordenamientos de proteínas sinápticas durante el aprendizaje y la formación de la memoria de un curso de tiempo especificado de la perfiles proteómicos. Este curso de tiempo puede empezar inmediatamente después o incluso durante la primera sesión de entrenamiento y cubre un periodo de tiempo de malla fina hasta que el rendimiento de los animales alcanzó el nivel asintótico de la curva de aprendizaje después de aprox. 8 - 10 días de entrenamiento (véase la Figura 2 para más detalles).
El análisis de los cambios de fosforilación de las proteínas sinápticas requiere un enfoque particular en los marcos de tiempo seleccionados durante el aprendizaje FMTD. En las cascadas de señalización por un lado, que inician reordenamientos de proteínas sinápticas conocidos por estar desencadenada por fosforilaciones de proteínas y desfosforilaciones se espera en etapas muy tempranas de la formación animal. Por otro lado, hay largos modificaciones duraderas de múltiples proteínas sinápticas fosforilados conocidas que regulan la conectividad y el montaje dentro de los sarquitectura ynaptic 19, 20. Se espera que estas modificaciones posteriores a la traducción, incluso en momentos posteriores de consolidación de la memoria.
Los conjuntos de datos complejos generados por este flujo de trabajo proteómico requieren un procesamiento bioinformático para identificar las vías moleculares y moléculas clave que participan. El meta-análisis muestra vías excesivamente importantes, que desempeñan un papel en los procesos de aprendizaje y memoria.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
We wish to thank Yvonne Ducho and Kathrin Pohlmann for excellent technical assistance. This work was supported by the Deutsche Forschungsgemeinschaft (SFB 779) and by the State Saxony-Anhalt / European Regional Development Fund (ERDF) via the Center for Behavioral Brain Sciences (CBBS).
Materiales
| Name | Company | Catalog Number | Comments |
| 3 M Empore Solid Phase Extraction- Filter | 3M Bioanalytical Technologies | 4245SD | 7 mm/3 ml |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164564 | 100 µm x 2 cm, C18 |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164569 | 75 µm x 25 cm, C18 |
| Acetic acid | Carl Roth GmbH | 3738.1 | |
| Acetonitrile (ACN) | Carl Roth GmbH | AE70.2 | |
| Acrylamide (30%) | AppliChem | A0951 | |
| Ammonium hydrogen carbonate | Fluka | 9830 | |
| Ammonium hydroxide | Fluka | 44273 | |
| Ammonium persulfate (APS) | AppliChem | A2941 | |
| Biofuge pico | Heraeus GmbH | 75003280 | |
| Blue R-250 | SERVA Electrophoresis GmbH | 17525 | |
| Bromophenol Blue | Pharmacia Biotech | 17132901 | |
| C57BL/6J mice | Charles River | ||
| Cantharidin | Carl Roth GmbH | 3322.1 | |
| Centrifuge tubes for MLS-50 | Beckman Coulter | 344057 | |
| Centrifuge tubes for TLA 100.1 rotor | Beckman Coulter | 343776 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| Eppendorf 5417R centrifuge | VWR | 22636138 | |
| Eppendorf A-8-11 rotor | VWR | 5407000317 | |
| Formic acid | Fluka | 14265 | |
| GeneCodis | http://genecodis.cnb.csic.es/ | ||
| Gephi | https://gephi.org/ | ||
| Glycerol | AppliChem | A1123 | |
| Glycine | AppliChem | A1067 | |
| HALT Phosphatase Inhibitor Cocktail | Pierce /Thermo Scientific | 78420 | |
| HEPES Buffer solution | PAA Laboratories GmbH | S11-001 | |
| Homogenization vessel 2 ml | Sartorius AG | 854 2252 | |
| Hydrochloric acid | Sigma-Aldrich | H1758 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide (IAA) | Sigma-Aldrich | I1149 | |
| Laboratory drilling drive K-ControlTLC 4957 | Kaltenbach & Vogt GmbH | 182997 | |
| LTQ Tune Plus 2.7.0.1112 SP2 | Thermo Scientific | ||
| LTQ Orbitrap Velos Pro | Thermo Scientific | ||
| Macs-mix tube rotator | Miltenyi Biotech | 130-090-753 | |
| Magic Scan 4.71 | UMAX | ||
| Methanol | Carl Roth GmbH | AE71.2 | |
| MLS-50 rotor | Beckman Coulter | 367280 | |
| Optima MAX Ultracentrifuge | Beckman Coulter | 364300 | |
| PageRuler Prestained Protein Ladder | Thermo Scientific | 26616 | |
| PEAKS 7.5 | Bioinformatic Solutions | ||
| Phosphatase Inhibitor Cocktail 3 | Sigma-Aldrich | P0044 | |
| PhosphoRS 3.1 | IMP/IMBA/GMI | ||
| PhosSTOP | Roche | 4906845001 | |
| Plunger/pestle made of PTFE | Sartorius AG | 854 2651 | |
| PotterS homogenizer | Sartorius AG | 853 3024 | |
| Protease Inhibitor complete mini | Roche | 4693159001 | |
| Quantity One 4.5.1 | BioRad | ||
| RapiGest | Waters | 186002122 | |
| Shuttle box | Coulbourne Instruments | ||
| Sodium dodecylsulfate (SDS) | AppliChem | A1112 | |
| Sodium molybdate | Carl Roth GmbH | 274.2 | |
| Sodium tartrate dihydrate | Sigma-Aldrich | 228729 | |
| SONOREX RK 156 Ultrasonic Bath | BANDELIN electronic GmbH & Co. KG | 305 | |
| Soundproof chamber | Industrial Acoustics Company | ||
| Sucrose | Carl Roth GmbH | 4621.2 | |
| Tetramethyl ethylene -1,2-diamine (TEMED) | Sigma-Aldrich | T9281 | |
| Thermomixer basic | CallMedia | 111000 | |
| Titansphere TiO 5µm | GL Sciences Inc. Japan | 502075000 | |
| TLA 100.1 rotor | Beckman Coulter | 343840 | |
| Trifluoro acetic acid (TFA) | Sigma-Aldrich | T6508 | |
| Tris ( hydroxymethyl) aminomethane (TRIS) | AppliChem | A1086 | |
| Triton X-100 | Sigma-Aldrich | T8532 | |
| Trypsin Gold | Promega | V5280 | |
| Ultimate 3000 Ultra HPLC | Dionex/Thermo Scientific | ||
| Ultracentrifuge tube | Beckman Coulter | 343776 | |
| Unijet II Refrigerated Aspirator | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| UNIVAPO 100 H Concentrator Centrifuge | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| Urea | AppliChem | A1049 | |
| Water (high quality purifed) | Resistivity: > 18.2 MΩ*cm at 25 °C Pyrogens: < 0.02 EU/ml TOC: < 10 ppb | ||
| Xcalibur 3.0.63 | Thermo Scientific | ||
| ZipTipC18 Pipette Tips | MILLIPORE | ZTC18S960 |
Referencias
- Lamprecht, R., LeDoux, J. Structural plasticity and memory. Nat Rev Neurosci. 5 (1), 45-54 (2004).
- Bingol, B., Schuman, E. M. Synaptic protein degradation by the ubiquitin proteasome system. Curr Opin Neurobiol. 15 (5), 536-541 (2005).
- Richter, J. D., Klann, E. Making synaptic plasticity and memory last: mechanisms of translational regulation. Genes Dev. 23 (1), 1-11 (2009).
- Rosenberg, T., et al. The roles of protein expression in synaptic plasticity and memory consolidation. Front Mol Neurosci. 7, 86 (2014).
- Scheich, H., et al. Behavioral semantics of learning and crossmodal processing in auditory cortex: the semantic processor concept. Hear Res. 271 (1-2), 3-15 (2011).
- Kähne, T., et al. Synaptic proteome changes in mouse brain regions upon auditory discrimination learning. Proteomics. 12 (15-16), 2433-2444 (2012).
- Reichenbach, N., et al. Differential effects of dopamine signalling on long-term memory formation and consolidation in rodent brain. Proteome Sci. 13, 13 (2015).
- Kähne, T., et al. Proteome rearrangements after auditory learning: high-resolution profiling of synapse-enriched protein fractions from mouse brain. J Neurochem. , (2016).
- Li, K., et al. Organelle proteomics of rat synaptic proteins: correlation-profiling by isotope-coded affinity tagging in conjunction with liquid chromatography-tandem mass spectrometry to reveal post-synaptic density specific proteins. J Proteome Res. 4 (3), 725-733 (2005).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. J Cell Biol. 86 (3), 831-845 (1980).
- Smalla, K. H., Klemmer, P., Wyneken, U., Dermietzel, R. . The Cytoskeleton - Imaging, Isolation, and Interaction. , 265-282 (2012).
- Smalla, K. H., et al. The synaptic glycoprotein neuroplastin is involved in long-term potentiation at hippocampal CA1 synapses. Proc Natl Acad Sci U S A. 97 (8), 4327-4332 (2000).
- Shapiro, A. L., Vinuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem. 68 (5), 850-858 (1996).
- Thingholm, T. E., Larsen, M. R., Ingrell, C. R., Kassem, M., Jensen, O. N. TiO(2)-based phosphoproteomic analysis of the plasma membrane and the effects of phosphatase inhibitor treatment. J Proteome Res. 7 (8), 3304-3313 (2008).
- Carmona-Saez, P., Chagoyen, M., Tirado, F., Carazo, J. M., Pascual-Montano, A. GENECODIS: a web-based tool for finding significant concurrent annotations in gene lists. Genome Biol. 8 (1), 3 (2007).
- Bonn, S., Seeburg, P. H., Schwarz, M. K. Combinatorial expression of alpha- and gamma-protocadherins alters their presenilin-dependent processing. Mol Cell Biol. 27 (11), 4121-4132 (2007).
- Tweedie-Cullen, R. Y., Reck, J. M., Mansuy, I. M. Comprehensive mapping of post-translational modifications on synaptic, nuclear, and histone proteins in the adult mouse brain. J Proteome Res. 8 (11), 4966-4982 (2009).
- Li, L., et al. The differential hippocampal phosphoproteome of Apodemus sylvaticus paralleling spatial memory retrieval in the Barnes maze. Behav Brain Res. 264, 126-134 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados