Method Article
High Resolution Количественный Synaptic Протеом профилирование мозга мыши регионов После обучения Слуховые дискриминации
В этой статье
Резюме
The identification of molecules and pathways controlling synaptic plasticity and memory is still a major challenge in neuroscience. Here, a workflow is described addressing the relative quantification of synaptic proteins supposedly involved in the molecular reorganization of synapses during learning and memory consolidation in an auditory learning paradigm.
Аннотация
The molecular synaptic mechanisms underlying auditory learning and memory remain largely unknown. Here, the workflow of a proteomic study on auditory discrimination learning in mice is described. In this learning paradigm, mice are trained in a shuttle box Go/NoGo-task to discriminate between rising and falling frequency-modulated tones in order to avoid a mild electric foot-shock. The protocol involves the enrichment of synaptosomes from four brain areas, namely the auditory cortex, frontal cortex, hippocampus, and striatum, at different stages of training. Synaptic protein expression patterns obtained from trained mice are compared to naïve controls using a proteomic approach. To achieve sufficient analytical depth, samples are fractionated in three different ways prior to mass spectrometry, namely 1D SDS-PAGE/in-gel digestion, in-solution digestion and phospho-peptide enrichment.
High-resolution proteomic analysis on a mass spectrometer and label-free quantification are used to examine synaptic protein profiles in phospho-peptide-depleted and phospho-peptide-enriched fractions of synaptosomal protein samples. A commercial software package is utilized to reveal proteins and phospho-peptides with significantly regulated relative synaptic abundance levels (trained/naïve controls). Common and differential regulation modes for the synaptic proteome in the investigated brain regions of mice after training were observed. Subsequently, meta-analyses utilizing several databases are employed to identify underlying cellular functions and biological pathways.
Введение
Обучение основано на формировании следов памяти и их текущий ремонт. Широко распространено мнение, что один основной механизм может представлять зависимым от активности образование новых и / или переустройства существующих синаптических контактов между нейронами. На молекулярном уровне, различные модификации белков, субклеточных relocalizations и изменения в обороте синаптических белков были описаны 1-4 (Лампрехт, 2004 # 8). Тем не менее, большинство исследований до сих пор сосредоточены на отдельных белков, а не на глобальном, но сложной синаптической композиции протеома. Данный подход позволяет непредвзято скрининг на синаптических изменений протеома в регионах мозга мыши после обучающего эксперимента. Он подходит для отображения времени точечные зависимые молекулярные снимки учебно-индуцированной реорганизации синаптической архитектуры. Описанный рабочий процесс требует особого совместную работу различных специалистов в области поведения животных, биохимии белков, масс-спектрометрии и bioinformatics.
Выбранная парадигма обучения, т.е. частотно-модулированный тон дискриминации (FMTD), является хорошо охарактеризованный слуховое дискриминация задача у грызунов 5. Изучение и формирование долговременной памяти в этом окне челночной Go / No-Go-задача включает в себя механизмы в зависимости от увеличения сигнализации корковой дофамина и синтеза белка. Соответственно, недавние исследования протеомические на песчанок и мышей показали допамином и обучения индуцированных пластических перестроек синаптических компонентов в корковых, но и в более базальных отделах головного мозга , которые , предположительно , взаимодействуют во время FMTD обучения и памяти 6-8. Это показывает, что формирование памяти включает в себя сложное взаимодействие различных областей мозга, и, таким образом, может быть по-разному регулируется в этих регионах на уровне протеома. Поэтому рассечение отдельных корковых и подкорковых областях мозга мыши входит в рабочий процесс.
Кроме того, надежный characterizatiна даже слабых изменений в синаптической белковой композиции требует обогащения пре- и постсинаптических отсеков , а не анализ гомогенатах или сырых мембранных фракций 9. Таким образом, подготовка синаптосомах с использованием объявленных установленными протоколами до начала анализа на протеомические описан с целью повышения уровня обнаружения и динамический диапазон для синапс-специфических белков 10,11.
Существенной предпосылкой для использования этикетки свободных масс-спектрометрии высокого разрешения для количественных целей является высокая степень сходства образцов белка. Как весьма незначительные изменения в синаптической белковой композиции, как ожидается, произойдет после обучения, подход этикетки свободных будет уместно сравнить соответствующие образцы белка, полученные из обученных и наивных мышей. В качестве альтернативы, состояние конкретных стратегий этикетке белков / пептидов с использованием стабильных изотопов (например , ТМТ, iTRAQ, ICPL и SILAC), а также на основе MS2 этикеток бесплатно кваntification (SWATH) полезны, но они являются более дорогостоящими, чем выбранный подход этикетки, свободной или нужны специальные аппаратные средства массовой спектрометрического.
Так как протеомические скрининги часто дают сложные наборы данных, биоинформатики обработка рекомендуется для соответствующей интерпретации данных. Дополнительные мета-анализы могут поддерживать лучшее понимание потенциальных молекулярных механизмов, лежащих в основе парадигмы, связанные с изменениями и идентификации вовлеченных ключевых клеточных процессов и сигнальных путей. Соответствующие методики также описаны ниже.
протокол
Все процедуры, в том числе субъектов животных были проведены в соответствии с нормами немецкого Федерального закона, соответствующих нормам ЕС и руководства NIH и были одобрены этическим комитетом Landesverwaltungsamt Sachsen / Ангальт (42502-2-1102 ИНФ).
1. Слуховые обучения
- Слуховые дискриминации обучение в челночной коробке (FMTD парадигма) Примечание: Всегда носите перчатки при обращении мышей.
- Дом C57BL6 / J мышей в группах по три или четыре с свободным доступом к пище гранул и водопроводной воды в прозрачных клетках поликарбоната. Поддержание 12 ч света в: темный цикл в виварии. Если животные получены из другой лаборатории или от компании, позволяют по крайней мере одну неделю акклиматизации и поселение.
- Выполните одно окно шатл тренировки в день.
- Возьмите мышь из своей домашней клетки в виварии и поместить его в слабо освещенном челночной коробки в пробной камере звука.
- Используйте график обучения полностью компьютерным управлением для слухового обучения дискриминации. Начните с привыкания течение 3 мин молчания, а затем начать тренировку.
- Используйте последовательности восходящего тона (4 - 8 кГц, CS +) как Go-раздражителя во время Go-испытаний: Животное должно пересечь барьер в течение 6 секунд тонального презентации (правильный ответ, удар). Наказать промах по мягким ножной шока 50 - 300 мкА, доставленной по сетке пол коробки челнока.
- Используйте последовательности падающего тона (8 - 4 кГц, CS-) как No-Go-раздражителя во время No-Go-испытаний: Животное должно оставаться в текущем отсеке челночной коробке в течение 6 секунд тонального презентации. Наказать ложную тревогу с помощью мягкого пешеходного шока 50 - 300 мкА, доставленной по сетке пол коробки челнока.
- Используйте intertrial интервалы 20 5 сек.
- Выполните 30 Go-испытания и 30 No-Go-испытаний на каждую сессию в псевдо-случайном порядке, так что себеssion состоит из 60 испытаний и длится около 25 мин.
- Поместите обученный животное обратно в дом клетке в виварии.
- Мозг рассечение
- Усыпить животное в желаемый момент времени после желаемого количества тренировок с использованием цервикальной дислокации (например , через 24 часа после завершения первой сессии). Обезглавьте животное.
- Быстро препарировать мозг с помощью следующих шагов: вырезать сначала кожи , а затем череп с прямыми ножницами вдоль sagittalis SUTURA. Полное удаление части кости, которые покрывают ткани мозга с использованием сильных щипцов. Вынуть мозг с шпателем.
- Для рассечения, поместите мозг на чашку Петри, наполненную льдом. Рассеките слуховую кору, лобную кору головного мозга, стриатуме и гиппокампе под стереомикроскопа с помощью скальпеля и иглы.
- Локализуйте слуховую кору с использованием визуальных ориентиров на мозг сurface, таких как кровеносные сосуды и формы поверхности (брегмы -2.06 до -3.4, размер рострокаудального 2 мм, дорсовентральный 1,3 мм) и на двусторонней основе, рассекают в качестве блока прямоугольной ткани с толщиной коры.
- Рассеките лобной коры как срез мозга между брегмы 3.56 и 1.54 с использованием хиазмы Оптикум в качестве ориентира и исключая ткани из Bulbus olfactorius.
- Рассеките стриатума как срез мозга между брегмы 1,54 и 0,5 и осторожно удалить ткани коры.
- Рассеките гиппокамп, фиксируя мозг с иглой через мозжечок и разматывания коры головного мозга, начиная с затылочной доли.
- Ударно-сублимационной рассеченные образцы мозга в жидком азоте и хранят при температуре -80 ° C.
2. Получение Синаптосомы или в качестве альтернативы постсинаптической плотности (PSD) Фракция обогащенного
Примечание: Во время всех процедур, держать образцы и буферы при 0 - 4 ° C.Буферы содержат свеже разбавленный ингибитор протеазы коктейли, чтобы предотвратить протеолитический распад белков. Если белок фосфорилирования также изучен, ингибитор фосфатазы коктейли должны быть добавлены. Все г-значения, указанные приведены в качестве г (в среднем) в течение всего протокола.
- Приготовление сырой мембранной фракции (Фигура 3А)
- Передача рассеченные ткани мозга в гомогенизацией сосуд, содержащий 1 мл охлажденного льдом буфера A (5 мМ HEPES, 320 мМ сахарозы, рН 7,4) и гомогенизируют ткани при 900 оборотах в минуту с 12 ударов.
- Центрифуга образцов при 1000 мкг в течение 10 мин. Держите супернатантов.
- Повторно гомогенизировать окатышей при тех же условиях, в том же объеме буфера дл гомогенизации, как до, так и Центрифуга образцов снова при 1000 х г в течение 10 мин. Объединить соответствующие супернатантов. Откажитесь гранулы P1, которые в основном содержат ядра и клеточных обломков.
- Спин объединенные супернатанты в течение 20 мин при 12000 х г. Отбросить supernaTants или использовать для дальнейшего фракционирования 11.
- Ресуспендируют гранулы в том же объеме буфера дл гомогенизации, как перед использованием гомогенизатора с 6 ударов при 900 оборотах в минуту и спина при 12000 х г в течение 20 мин. Отбросить супернатанты. Гранулы Р2 представляют собой сырой мембранные фракции.
- Очистка синаптосом из сырой мозга мембранных фракций (фиг.3А)
Примечание: мембранные фракции сырой мозга могут быть разделены на миелин, легкие мембраны, синаптосомы и митохондрий с использованием плотности сахарозы ступенчатого градиентного ультрацентрифугирования. Для этого рН 5 мМ Трис / HCl 8,1 буферы, содержащие сахарозу при любом 0,32 М, 1,0 М или 1,2 М концентрации требуются.- При проведении центрифугирования для получения Р2 фракций, готовят сахарозы шаг градиентов в ультрацентрифуге трубок. Начните с 2,5 мл 1,0 М буфера сахарозы и подслоя с 1,5 мл 1,2 М буфера сахарозы с использованием стеклянного Пастера пипетку.
- Re-гомогенизируют P2 фракцийв 0,5 мл буфера 0,32 М раствором сахарозы вручную с помощью 6 ударов и нагрузки на верхней части градиента.
- Спин при 85000 мкг в течение 2 часов в ультрацентрифуге с использованием Бакет ротор.
- Выбросить верхний слой 0,32М сахарозы, включая материал на границе раздела фаз в 1,0 М буфере сахарозы (миелина, легкие мембраны). Сбор Синаптосомы на границе буферной сахарозы 1.0 / 1.2 M. Осадок на дне пробирки содержит митохондрии.
- Добавить буфер 0,32 М сахарозы в синаптосомальной фракции при соотношении 1: 1, тщательно и спинового смешивания при 150000 мкг в течение 1 часа. Синаптосомы находятся в осадке и в настоящее время может быть повторно суспендировали в буфере, необходимого для дальнейшей обработки.
- Приготовление фракции РЧР обогащенного (фигура 3В)
- Однородный каждой конкретной области мозга от одного животного в 100 мкл буфера для экстракции (5 мМ Трис / HCl, рН 8,1, 0,5% Тритон Х-100) в 200 мкл ультрацентрифуге трубки с (фторопласта) пестиком PTFEпри 2000 оборотах в минуту с 12 ударов.
- Добавьте 100 мкл буфера для экстракции, перемешивают и инкубируют в течение 1 ч при температуре 4 ° С. Спин вниз при 100000 х г в течение 1 ч и осторожно собирают надосадочную S1 с 200 мкл пипеткой.
- Повторно гомогенизировать окатышей P1 в той же пробирке 100 мкл буфера для экстракции снова с тефлоновым пестиком со скоростью 2000 оборотов в минуту с 12 ударов.
- Добавьте 100 мкл буфера для экстракции и хорошо перемешать с помощью пипетки и спином при 100000 х г в течение 1 часа.
- Смешайте надосадочную S2 с S1 на фракции растворимого белка. Эта фракция содержит цитозольных белков, 0,5% Тритон Х-100 растворимы мембранных белков и молекул внеклеточного матрикса.
- Ресуспендируют оставшийся осадок в 50 мкл 5 мМ Трис / HCl рН 8,1. Эта фракция содержит РСП, детергентов устойчивые мембраны, нерастворимые элементы цитоскелета, митохондрии и остатков клеток в том числе ядер. Он обогащен в ДПП, которые образуют ядро постсинаптических структур, но и важных частей пресинаптическогоcytomatrix в активной зоне. Фактор для обогащения ДПП составляет около 4 и обогащение PSD компонентов было продемонстрировано ранее. 12
3. Подготовка образцов для масс-спектрометрии
- Лизис и образец нормализации
Примечание: Образец нормализации относительно концентрации белка является очень важным шагом, чтобы наконец достичь надежных количественных данных даже для слабых синаптических изменений экспрессии белка.- Растворите Синаптосомы или PSD-обогащенные препараты каждой области мозга животного в 20 - 50 мкл (в зависимости от общего количества материала: для слуховой коры с 5 - 15 мг использования ткани 20 мкл) 8 М мочевины и инкубировать на льду в течение 1 ч в ультразвуковой ванне.
- Ибо в геле переваривать, растворять Синаптосомы непосредственно в буфере SDS-образца. Тщательно рассчитать заложенную сумму, чтобы избежать перегрузки геля. Учтите, что в этом случае высокая обильные эшафот PROTEIнс будут потеряны во время электрофореза в геле и в геле переварить.
- Разбавляют 1% сменной моющего средства, чтобы обеспечить конечную концентрацию 2 М мочевины. Во избежание любой температуре выше 30 ° C для предотвращения белка карбамилирования.
- Выполнить SDS-PAGE с аликвоты (например , 10 мкл) образца в соответствии со стандартными процедурами 13,14.
- Пятно гель с Кумасси синим в соответствии с протоколом производителя. Процедура сочетает в себе фиксации и маркировки шаг с метанолом и уксусной кислоты.
- Определить оптическую плотность каждого образца для всей полосы движения с помощью калиброванного сканера гель в режиме передачи и вычислить относительное количество белка.
- Осуществить нормировку образцов в соответствии с этими расчетами.
- Разделить каждую выборку на две разные части. Используйте одну треть для в геле переварить и две трети для комплексного решения дайджеста.
- Растворите Синаптосомы или PSD-обогащенные препараты каждой области мозга животного в 20 - 50 мкл (в зависимости от общего количества материала: для слуховой коры с 5 - 15 мг использования ткани 20 мкл) 8 М мочевины и инкубировать на льду в течение 1 ч в ультразвуковой ванне.
- В-гель дайджест
- разделение геля
- Выполните второй SDS-PAGE с использованием концентрационных скорректированные образцов. Пятно и количественно гели во второй раз, чтобы проверить качество нормализации.
- Вырежьте каждую полосу образца в геле в различных областях (8 / переулок), но исключив диапазон молекулярной массой свыше 170 кДа. Перенесите гель частей в отдельные пробирки.
- Сокращение площадей на более мелкие куски (ок. 1 х 1 мм) с острым скальпелем, чтобы облегчить в геле пищеварения эффективность.
- Дайджест 15
- Промыть кусочки геля в несколько раз ( в зависимости от интенсивности окрашивания) в течение 10 мин при 50 - 150 мкл буфера , содержащего 50% ацетонитрила (ACN) и 50 мМ бикарбоната аммония (NH 4 HCO 3).
- Удалить супернатантов. Накройте кусочки геля с ACN и инкубировать при температуре 20 ° С до тех пор, пока кусочки геля становятся белыми и сжиматься.
- Удалите ACN и увлажняет кусочки геля для 5мин с 50 мкл 0,1 М NH 4 HCO 3 Добавьте один и тот же объем ACN и инкубировать в течение еще 15 мин при 37 ° С.
- Удаляют жидкость полностью. Сухие кусочки геля в вакуумной центрифуге.
- Увлажняет кусочки геля в 50 мкл NH 4 HCO 3 , содержащей 10 мМ дитиотреитола (DTT) и образцы высокой температуре в течение 45 мин при 56 ° С , чтобы уменьшить остатки цистеина.
- Удалить супернатантов и добавьте 50 мкл NH 4 HCO 3 , содержащего 55 мМ йодацетамида (IAA) в течение 30 мин в темноте , чтобы carbamidomethylate уменьшенные цистеина.
- Снимите и выбросьте всю жидкость над кусочками геля и мыть их дважды с 50 мкл NH 4 HCO 3 и ACN (1: 1) в течение 10 мин для удаления остатков IAA. Сухие образцы в вакуумной центрифуге.
- Для ограниченного перевариванию белков добавляют 25 мМ NH 4 HCO 3 , содержащего 12,5 нг / мкл трипсина. Необходимый объем зависит от размера и количества геля рieces. Выдержите в течение нескольких минут и проверьте, если буфер поглощается. Добавить больше буфер, если это необходимо, кусочки геля должна быть полностью покрыта. Инкубируют при 37 ° С в течение ночи (мин. 12 ч).
- Пептид экстракция
- Overlay кусочки геля с 10 - 20 мкл 25 мМ NH 4 HCO 3 и добавить один и тот же объем ACN. Инкубировать в течение 10 минут на льду с использованием ультразвуковой ванны. После удаления и сбора супернатантов, которые содержат большую часть генерируемых пептидов.
- Добавьте 100 мкл буфера для экстракции, содержащего 30% ACN / 0,1% трифторуксусной кислоты (ТФУ) на кусочки геля. Повторите инкубации в ультразвуковой ванне и тщательно собирают супернатант.
- Повторите последние шаги экстракции путем увеличения концентрации ACN до 50%. Через 10 мин ультразвуковой ванне со спином вниз и собирают супернатанты.
- Смешайте все три соответствующих супернатантов стадий экстракции и высушить их в вакуумной центрифуге. Обратите внимание, чтов результате разделения геля 8 областей на дорожку / образец объединены в одну выборку снова на этом шаге.
- разделение геля
- В-дайджест решения
- дайджест
- С помощью вычисленного количества (например , 100 мкл 150 мкл лизата, зависит от количества материала и объема , требуемого для взмучивания образца из определенной области мозга) нормированных выборок , чтобы получить достаточное количество исходного материала , по крайней мере , трех технических реплицируются выполнять без наклеек масс-спектрометрии.
- Добавить 2 мМ DTT в 25 мМ NH 4 HCO 3 и мягко вихрь образец. Сокращение образцов в течение 45 мин при температуре 20 ° С.
- Добавляют 10 мМ IAA в carbamidomethylate цистеиновые остатки. Смешать и инкубировать в течение 30 мин в темноте при температуре 20 ° С.
- И, наконец, добавить 1 мкл исходного раствора трипсина (1 мкг / мкл трипсина в 25 мМ уксусной кислоты) и инкубируют при 20 ° C в течение 12 часов.
- Твердофазной экстракции (SPE) -Purification
- Для удаления кислоты расщепляемую моющего средства, регулировать образцы до конечной концентрации 1% TFA и инкубировать в течение 1 часа при температуре 20 ° С.
- Центрифуга образцов при 16000 мкг в течение 10 мин и тщательно собирают супернатанты.
- Поместите колонку SPE в стойку и уравновешивают матрицу с 2 мл метанола. Промыть два раза с 2 мл 0,1% ТФУ в воде (буфер В).
- Добавляют 2 мл буфера В и загрузить образец. Вымойте еще три раза.
- Элюируйте пептиды путем добавления 200 мкл 70% ACN / 0,1% TFA. Повторите этот шаг.
- Бассейн как элюатов и высушить их в вакуумной центрифуге.
- дайджест
- Фосфо-пептид-обогащение TiO 2 хроматографии 16
- Растворите пептиды , произведенные в геле или в растворе-дайджест в 150 мкл 80% ACN / 2,5% ТФК (буфер С) и уравновешивают ~ 2 мг TiO 2 шариков в 50мкл буфера C,
- Добавьте бусинки к образцу и инкубировать во вращающемся устройстве в течение 1 часа при температуре 20 ° С. После этого спина бисер вниз (16 000 XG, 1 мин) и собирают супернатанты.
- Вымойте бисером три раза 100 мкл буфера C, осторожно смешивая и спиннинг вниз через 5 мин. Собирают супернатанты. Повторите этот шаг три раза с помощью 100 мкл 80% ACN / 0,1% TFA с последующим тремя промывками 100 мкл 0,1% TFA (без ACN) соответственно.
- Смешайте все десять супернатантов, высушить их в вакуумной центрифуге и обращаться с ними как фосфо-пептид-обедненной фракции для дальнейшей очистки шаг 3.5 в соответствии.
- Элюируйте связанных фосфо-пептидов с 20 мкл 400 мМ NH 4 OH / 30% ACN из гранул. Повторите этот шаг три раза и собрать все супернатантов после спиннинг вниз бисером.
- Комбинат элюатов из в геле переваривать и раствора в усваиваемые образца и обращаться с ними как фосфо-рeptide фракции , обогащенной. Сушат их в вакуумной центрифуге до конечного объема 4 - 8 мкл.
- Сосредоточение и обессоливания фосфо-пептидных фракций обедненного микро-SPE
- Растворение высушенных пептидов в 20 мкл 0,1% ТФУ.
- Равновесие фиксированный C 18 -матрица, нарисовав 20 мкл ACN в наконечник. Промывают матрицу рисуя 0,1% ТФУ в воде в наконечник. Повторите этот процесс три раза.
- Медленно загрузить подкисленного образца в наконечник (повторить этот шаг в три раза).
- Промыть раз C 18 -матрица три с 20 мкл 0,1% ТФУ в воде и отбрасывать моющий раствор.
- Элюции пептиды из кончика пипетки по несколько раз (3 раза), рисунок 20 мкл 70% ACN / 0,1% TFA, и собирать эту элюции раствора в отдельную пробирку.
- Комбинат элюатов образца и высушить их в вакуумной центрифуге.
4. Анализ Протеом
<р> Примечание: Протеом анализ выполняется на гибридном двойного давления линейного захвата ионов / Orbitrap масс-спектрометр, снабженный ультра ВЭЖХ. ВЭЖХ состоит из охлаждаемого автоматического пробоотборника с петлей впрыска 20 мкл, двоичная загрузочный насос (диапазон мкл потока), бинарный насос наноповерхности потока, нагреватель колонки с двумя микро переключающих клапанов и дегазатора. Образцы предварительно подвергнуты улавливающего колонке (например , 100 мкм х 2 см) при скорости потока 7 мкл / мин с последующим разделением на колонке (например , 75 мкм х 25 см) при 250 Нл / мин. Выпускное отверстие разделительной колонны непосредственно соединен с покрытием Pico эмиттера наконечником, расположенным в интерфейсе нано-спрей на масс-спектрометре источника ионизации.- Нано-жидкостной хроматографии и тандемной масс - спектрометрии
- Разведите образцы пептида в 12 мкл 2% ACN / 0,1% TFA в течение не менее 30 мин. Спин вниз в течение 15 секунд и передать 11 мкл супернатанта в AutoSampler Флаконы (коническую, снижение diameteр).
- Настройка автоматизированный режим для применения образца, хроматографического разделения и тандемной масс - спектрометрии при управлении программным обеспечением (например, Xcalibur) следующим образом .
- Используйте следующие действия для регулировки температуры: AutoSampler: 5 ° C; духовой шкаф Колонка: 45 ° C.
- Используйте следующие для инъекций: объем: 10 мкл; Скорость потока: 7 мкл / мин (2% ACN, 0,1% TFA); Время: 8 мин; Установка клапана: колонка ловушка - отходы; массовое приобретение спецификации: выкл.
- Используйте следующие для разделения: скорость потока: 250 л / мин установка клапана: ловушка столбец колонного разделения; массовое приобретение спецификации: на.
0 мин - 100 мин: 2% ACN, 0,1% муравьиной кислоты - 40% ACN, 0,1% муравьиной кислоты
100 мин - 105 мин: 40% ACN, 0,1% муравьиной кислоты - 95% ACN, 0,1% муравьиной кислоты
105 мин - 109 мин: 95% ACN, 0,1% муравьиной кислоты
109 мин - 120 мин: 2% ACN, 0,1% муравьиной кислоты - Используйте следующие настройки для масс-спектрометрии: Полное МС: FTMS; Разрешение 60 000; м / г диапазон 400 - 2000; МИЗ/МС: Линейная Iontrap; минимальный порог сигнала 500; ширина изоляции 2 Da; динамическая установка 30 сек Время исключения; однократно заряженные ионы, исключаются из отбора; нормализованная энергия удара устанавливается на 35%, а время активации, до 10 мс.
Примечание: Полный MS сканирование с последующим до 15 LTQ MS / MS работает с использованием индуцированные столкновениями диссоциации (CID) наиболее обильно обнаруженных ионов пептидов.
- Выполните три технических повторах для всех образцов.
- Идентификация белка и этикетки бесплатно Количественное
- Процесс масс - спектрометрии необработанных данных по отношению к идентификации белка и этикетки , свободной Количественное с использованием коммерческого набора программного обеспечения (например, козырьков Studio). В отличие от большинства других пакетов программного обеспечения протеом это специфическое программное обеспечение использует De Novo алгоритм до характерны чередования для выравнивания базы данных белков. Тем не менее, этот шаг может быть легко заменен другими популярными программными пакетами.
- Использование ESSренциальное настройки , перечисленные в таблице 2.
- Фосфо-протеомики
Примечание: Эффективный и надежный фосфо-пептид приобретение требует несколько существенных изменений в протеомического настройки рабочего процесса.- После того, как фосфо-пептидной обогащения, никогда не сухие образцы полностью. Всегда держать образцы растворится.
ПРИМЕЧАНИЕ: фосфо-эфирную связь фосфорилированных треонина или серинам очень хрупок. Во время столкновения индуцированной фрагментации в ионной ловушке, это приводит к нейтральной потере фосфата. Это предотвращает дальнейшее дробление пептида, который, в свою очередь, необходимо для идентификации. Разрешенные широкополосная-активация в установке масс - спектрометрии позволяет фрагментация фосфо-пептидов , даже после того, как нейтральной потери фосфатной группы. Он выполняет спасительную "псевдо-MS 3" время. определение фосфо-сайта в данных MS / MS требует специальной проверке и оценке и могут быть выполнены с помощью люминофоров, 3.0.
- После того, как фосфо-пептидной обогащения, никогда не сухие образцы полностью. Всегда держать образцы растворится.
5. Биоинформатика - Мета-анализ
ПРИМЕЧАНИЕ: Перед выполнением функционального аннотацию и анализ сети, списки белка должны быть предварительно обработаны. Во-первых объединить списки регулируемых белков и фосфо-пептидов для каждого участка мозга по отдельности. Затем удалите все дубликаты UniProt-идентификаторы для каждой фракции, чтобы не допустить неправильного толкования.
- Болванка анализ обогащения с GeneCodis 17
- Откройте веб-инструмент GeneCodis (http://genecodis.cnb.csic.es)
- Выберите "Mus Musculus" в организме и «GO биологический процесс", как аннотацию.
- Вставить список UniProt-идентификаторов определенной фракции. Отправить и ждать, пока анализ не выполняется. Нажмите на кнопку "сингулярного обогатительной Анализ GO биологического процесса" и просматривать результаты.
- Повторите шаг 5.1.3 для трех других фракций.
- Чтобы увидеть любые дупликации и перекрестки между списками результатовиспользовать язык сценариев, как Perl или Python для фильтрации данных, необходимых. Подобные инструменты для особого анализа обогащения являются ДЭВИД (https://david.ncifcrf.gov/) и Cytoscape (http://www.cytoscape.org/) с плагинами BINGO (http://apps.cytoscape.org/~~HEAD=pobj приложения / лото) и ClueGO (http://apps.cytoscape.org/apps/cluego).
- Создание графика на основе силы из данных GeneCodis с Gephi (https://gephi.org/)
Примечание: Данные для графиков должен быть предоставлен пользователем, либо в графическом формате (.gexf, .graphml, .dot, .gv, .gml) или вводятся вручную.- Генерация узлов графа
- Под рукой: Open Gephi и нажмите на кнопку "Лабораторные данные". Создание узлов. Нажмите на "Узлов" налево, чтобы перейти к столу "Узлов". Нажмите на кнопку "Добавить узел". Введите имя этого термина. Нажмите кнопку "OK" / Нажмите Enter.
- Альтернативные: Сохранить GeneCodis привести к ПК. Откройте .txt с электронными таблицами. Удалить все строки Exceпт с "Item_Details" (термин имен). Изменить заголовок "Item_Details" до "Этикетка". Сохранить таблицу как ".csv". Сейчас в Gephi, нажмите на кнопку "Импортировать электронную таблицу". Выберите таблицу из файла браузера Gephi. Нажмите "Далее". Нажмите кнопку "Готово".
- Подключение узлов с помощью ребер.
- Нажмите на "Грани" слева, чтобы перейти к столу "кромками". Для каждого узла (Term): поиск имен генов в других терминах. Если один или несколько генов являются общими -> создать края.
- Нажмите на кнопку "Добавить Edge". Выберите "неориентированный". Выберите исходный и целевой узел из выпадающего списка. Нажмите кнопку "OK" / Нажмите Enter. Если более чем один ген общий, введите изобилие в "вес" (таблица).
- Силы на основе графического макета.
- Открыть файл графа данных, установите тип графика на "неориентированный" или использовать данные, введенные вручную, нажмите на кнопку "Обзор", если уже не selected.
- Изменение размеров узлов в зависимости от обилия межсоединений. Нажмите на статистике, либо запустить "средняя степень" (невзвешенные ребра) или "Средн. Взвешенная степень" (взвешенными дугами) в разделе «Обзор сети». В "Внешний вид", нажмите на "Узлов", а затем на кнопке Размер, следующий выберите "Свойства" и установите параметр атрибуты для "Avg. Взвешенная степени" или "средняя степень". Нажмите кнопку Применить.
- И, наконец: Выберите "Force Атлас" в "Layout" и запустить; изменить "силу отталкиванием", если узлы встречными.
- Экспорт в изображения.
- Функция Снимок экрана: Нажмите на кнопку "Обзор", изменение компоновки графика, толщина края, размер этикетки и масштабирования с помощью меню в нижней части окна "График". Нажмите на кнопку камеры слева, и сохранить изображение.
- Экспорт особенность "Предварительный просмотр": Нажмите кнопку "Предварительный просмотр". Изменение предварительных настроек "По умолчанию прямо". Изменить настройкиs в соответствии с выбранными предпочтениями и нажмите на кнопку "SVG / PDF / PNG" для экспорта.
- Генерация узлов графа
Результаты
На рисунке 1 представлены полный рабочий процесс количественного синаптической протеома профилирования областей мозга мыши после слухового обучения дискриминации. Она начинается с подготовки животных в челночной коробке. В примере , показанном на рисунке 2, мыши стали проявлять значительную дискриминацию FM - тон в учебной сессии 4 - го, что указывает на эффективное обучение. Животных умерщвляли в выбранные моменты времени для области мозга рассечение. Требуемое обогащение синапсах может либо быть достигнуто за счет подготовки синаптосомах или , альтернативно , путем получения фракции РЧР обогащенным, как описано подробно на рисунке 3. Метод СДП обогащения был разработан для количеств низких тканей, например , 1 - 2 срезы гиппокампа из мозга крысы 12, 18. Она требует небольших труб, PTFE пестики фитингов для этих труб, и буровой привод лабораторный для питания пестик.
В силу особого белкового состава синаптосомах, настоятельно рекомендуется выполнить подготовку образца в двух разных, но дополняющих друг друга способами. Каркасы из СРЧС часто очень высокомолекулярных белков, происходящие в высокой стехиометрии. В-растворе дайджеста является лучшим способом, чтобы эффективно извлекать их, но может привести к оверсемплингом генерируемой смеси пептидов. В геле дайджеста выполнены из того же образца, параллельно могут исключить эти белки с высоким молекулярным весом и способствуют анализ белков со средней и низкой молекулярной массой. Для всестороннего анализа рекомендуются оба типа протеолитических гидролизатов.
Различные количества тканей областей мозга исследованных требуют корректировки применяемого материала для лучшего сравнения. В четырех исследованных областях мозга слуховой коры головного мозга, как правило, предельный фактили. Материал из всех других областей мозга должны тщательно регулироваться на количество слуховой коры после подготовки синаптосомах или PSD-обогащенных фракций (см 3.1.1.). Типичные веса свежеприготовленных областей мозга мышей, являются следующие: слуховая кора (AC): ~ 50 мг; Гиппокамп (HIP): ~ 90 мг; стриатуме (STR): ~ 120 мг и лобная кора головного мозга (ФК): ~ 100 мг.
Метод PSD-Обогащение описано в разделе 2.3 позволило идентифицировать около 1500 различных белков и около 250 различных фосфо-пептидов в области головного мозга на уровне одного животного (таблица 1). Протеомный анализ через 24 ч после первой тренировки показали , что 7,3% из идентифицированных белков и 5,8% из фосфо-пептидов показал достоверное (р <0,05) количественные изменения в их синаптической выражении по сравнению с контрольной группой (наивных таблица 1). Красноречивым тенденция вниз Регулации синаптических лесов может указывать на выраженной перестройкой синаптических архитектуры на ранних стадиях обучения FMTD. Подавляющее большинство регулируемых белков были изменены в мозговой области-специфическим образом, в то время как только 22% были признаны регулироваться в двух или более областях мозга. Шесть отобранных примеров приведены на рисунке 4.
Мета-анализ результатов комплексного АПИ предоставляет доказательства для конкретного участия / манипуляции следующих канонических путей: "клатрина-эндоцитоза Signaling", "аксонов Наведение Signaling", "Signaling кальция", "RhoA Signaling", "передача сигнала Notch "," Модернизации эпителиального слипчивых соединений "," Глутамат рецептор Signaling "," ГАМК рецептор Signaling "," Допамин рецептор Signaling "и" Synaptic долговременная потенциация ".
Один анализ обогащения выявили значительные сверхпредставленных биологические процессы в лобной коре , касающиеся транспорта белков, клеточную адгезию, фосфорилирование, эндоцитоз, везикул-опосредованной транспорт, развитие переднего и axonogenesis (рисунок 5). В биологических процессах, включая слуховую кору переноса ионов, перевод, мРНК транспорта, транспортирование белка и обучения были заметны. Анализ белковой фракции гиппокампа значительно обнаруживает обогащенные процессы, связанные с переносом ионов, клеточный цикл, перевод, фосфорилирование и развитие нервной системы. В стриатуме, перепредставлены были найдены биологические процессы, в том числе мРНК транспорта, везикул-опосредованной транспорта, axonogenesis, протеолиза, транспорт белков и эндоцитоза.
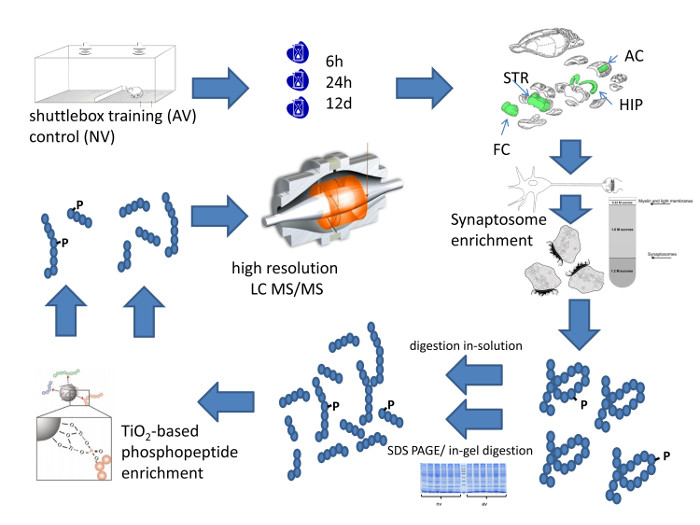
Рисунок 1: Систематический Workfloш методологического подхода. На этом рисунке схематически резюмирует рабочий процесс высокого разрешения количественного профилирования области мозга конкретного синаптической белковой композиции. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: Пример У мышей в тон FM дискриминации задач. Животные показывают возрастающую скорость просмотра (синяя кривая) и уменьшающейся частотой ложных срабатываний (черная кривая) в ходе учебно-тренировочных занятий. Значительная дискриминация происходит от четвертой сессии. Отрезки ошибок предоставляются как SEM. Пожалуйста , нажмите здесь , чтобы просмотреть LARGER версия этой фигуры.

Рисунок 3: Приготовление синаптосома и СДП-обогащенную фракцию. A: синаптосома подготовка. B: PSD-обогащенному фракцию. Обе цифры объясняют детальный рабочий процесс подготовки синаптосомах или в качестве альтернативы PSD-обогащенных фракций из тканей мозга. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
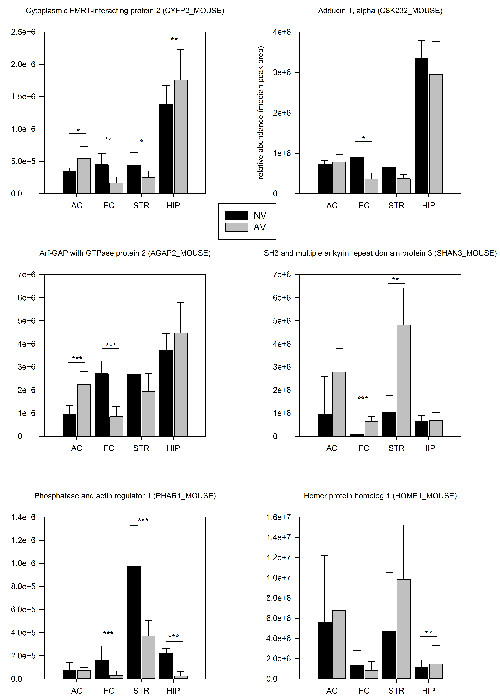
Рисунок 4: Отдельные результаты количественного Протеомные. Относительные синаптические содержаний отдельных белков сравниваются между мышами TRAINed на задаче FMTD (AV, п = 6) и наивные контрольных мышей (NV, N = 6) 24 ч после первой тренировки. Значения численности рассчитывали как медианы площадей пиков трех наиболее интенсивных пептидов белка. Белки с существенными изменениями численности (AV / NV, T-тест) отмечены в пределах участков: * р <0,05, ** р <0,01, *** р <0,005. Отрезки ошибок предоставляются как SD. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5: Визуализация биологических путей для лобной коры по GeneCodis / Gephi. Только существенные условия Джин Онтология (ГО) базы данных (http://geneontology.org), связанной с "биологическим процессом" с минимальным количеством белка из трех показаны здесь. Узлы представляют собой термины GO, размер узла, ширина линии и количество соединений определенного узла изображают количество белков, которые разделяют этот термин GO с другими узлами. Благодаря методу "Force Атлас" из Gephi, родственные узлы тесно кластеризация вместе. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Мозг область | переменный ток | FC | HIP | 000 "лицо =" Calibri "размер =" 3 "> STR | Σ |
| идентифицированные белки | 1435 | 1758 | 1572 | 1507 | 6272 |
| регулируемые белки (р <0,05) | 59 | 130 | 162 | 108 | лицо = "Calibri" размер = "3"> 459 |
| ↑ А.В. / Н.В. | 8 | 4 | 76 | 35 | 123 |
| ↓ А.В. / Н.В. | 51 | 126 | 86 | 73 | 336 |
| определены phosphomoti фс | 197 | 361 | 273 | 278 | 1109 |
| регулируемые phosphomotifs (р <0,05) | 8 | 22 | 21 | 14 | 65 |
| ↑ А.В. / Н.В. | 4 | 00000 "лицо =" Calibri "размер =" 3 "> 17 | 5 | 9 | 35 |
| ↓ А.В. / Н.В. | 4 | 5 | 16 | 5 | 30 |
Таблица 1: Резюме в протеомных результата. В данной таблице представлены представительный эксперимент Протеомические обученных мышей (AV, п = 6) 24 ч после первой тренировки по сравнению с их наивных контроля (NV, п = 6).сумма 459 регулируемых белков включает в себя перекрывающиеся правила. 283 различных правил были определены как специфического мозга. Более подробно, 57 белки регулируются в двух областях мозга, 18 правил белка были обнаружены в трех областях мозга, и только 2 белки регулируются во всех четырех исследованных областях мозга.
| допуски ошибок | |
| масса предшественника (преобразование Фурье масс-спектрометрии) | 10 частей на миллион |
| Фрагмент ионной масс (линейная ионная ловушка) | 0,6 Da |
| Максимум пропущенных расколы на пептид | 3 |
| Фиксированные модификации | |
| для в-гель-переваренной образцов | Carbamidomethylation цистеина |
| для комплексного решения переваривается образцы | Methylthiolatioн цистеина |
| Переменные модификации | Окисление метионин |
| Deamidations из аспарагин и / или глутамина | |
| База данных | UniProt / Sprot |
| систематика | мышь |
| Статистические параметры идентификации-приемки | |
| De Novo средней локальной доверия (ALC) | > 50% |
| Пептид-вероятность ложного обнаружения (FDR, основанный на ЭСТа. Манок-фьюжн) | <1% |
| Протеин значение (-10logP, на основе модифицированных Т-теста) | > 20 |
| уникальные пептиды / белок | ≥ 1 |
| Настройки Количественная: | |
| Пептиды, используемые для количественной оценки, если: | |
| Пептид значение (-10logP) | > 30 |
| Идентификация пептида в | ≥ 50% образцов |
| Качество сигнала Пептид | > 1 |
| Пептид средняя площадь | > 1E5 |
| Пептид толерантность время удерживания | <5 мин |
| нормализация | от полного ионного тока (TIC) |
Таблица 2: Настройки для идентификации белка (этап 4.2.2).
Обсуждение
Исследование представляет собой методологическую рабочий процесс, оптимизированный для точного количественного профилирования синаптических изменений экспрессии белка в процессе обучения и консолидации памяти в различных областях мозга мышей. Установка обеспечивает возможность изучать экспрессию белка на уровне одного животного, несмотря требуемого применения по крайней мере, трех технических повторах на образец для масс-спектрометрического анализа.
Методика учитывает конкретный белковый состав пре- и postsynapse, состоящей из высокомолекулярных белков подмостей, но и важным медиатором белков, несущих средний или низкий молекулярные массы. Сводки в-раствор синаптосомальных препаратов приводит к эффективной генерации и, следовательно, более-представление каркасных производных пептидов. Это, в свою очередь, может подавлять анализ меньших или более низких обильных белков. Предлагаемый препарат SDS-PAGE фракций отАликвоту каждого образца в сочетании с процедурой переваривания в геле параллельно облегчает анализ средних и низкое содержание белков и представляет собой очень рекомендуется дополнительный метод. После раздельной обработки масс - спектрометрических всех фракций , полученных из образца (например , в-растворе переваривают, в-гель переваривать, комбинированные фосфо-обогащенные фракции) соответствующие наборы данных MS / MS могут быть объединены и далее рассчитано для идентификации белков и количественной оценки по пикам программное обеспечение или альтернативные популярные пакеты программного обеспечения.
В качестве альтернативы, индивидуальное применение в геле-сбраживания полученных фракций образца (отдельно обработанных гель-областей образца полосу) и фракции , генерируется из расщепленной пробы в-растворе (например , с помощью ионообменной хроматографии) с масс - спектрометрии может повысить аналитическая глубина. Тем не менее, этот расширенный рабочий процесс значительно увеличивает необходимое время для LS-MS сбора данных / MS. Для Generatioп детальной молекулярной последовательности белка синаптических перестроек в процессе обучения и формирования памяти заданный временной ход протеомического профилирования требуется. На этот раз курс может начаться сразу после или даже во время первой тренировочной сессии и охватывает мелкоячеистая временные рамки, пока производительность животных не достигли асимптотического уровня кривой обучения после прибл. 8 - 10 дней обучения (см рисунок 2 для деталей).
Анализ фосфорилирования изменений синаптических белков требует особого внимания на выбранные временные рамки во время обучения FMTD. С одной стороны сигнальных каскадов, начавших синаптических перестроек белок, известный быть вызвано белка фосфорилирований и dephosphorylations, как ожидается, на самых ранних этапах обучения животных. С другой стороны, существуют длительные модификации нескольких фосфорилированных синаптических белков, известных, которые регулируют возможность соединения и сборки в пределах сynaptic архитектуры 19, 20. Эти посттрансляционные модификации, как ожидается, даже в более поздние моменты времени консолидации памяти.
Сложные наборы данных, генерируемые этим протеомического процесса требуют биоинформационного обработки для идентификации участвующих молекулярных путей и ключевых молекул. Мета-анализ показывает значительные сверхпредставленных пути, которые играют роль в процессе обучения и памяти процессов.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We wish to thank Yvonne Ducho and Kathrin Pohlmann for excellent technical assistance. This work was supported by the Deutsche Forschungsgemeinschaft (SFB 779) and by the State Saxony-Anhalt / European Regional Development Fund (ERDF) via the Center for Behavioral Brain Sciences (CBBS).
Материалы
| Name | Company | Catalog Number | Comments |
| 3 M Empore Solid Phase Extraction- Filter | 3M Bioanalytical Technologies | 4245SD | 7 mm/3 ml |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164564 | 100 µm x 2 cm, C18 |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164569 | 75 µm x 25 cm, C18 |
| Acetic acid | Carl Roth GmbH | 3738.1 | |
| Acetonitrile (ACN) | Carl Roth GmbH | AE70.2 | |
| Acrylamide (30%) | AppliChem | A0951 | |
| Ammonium hydrogen carbonate | Fluka | 9830 | |
| Ammonium hydroxide | Fluka | 44273 | |
| Ammonium persulfate (APS) | AppliChem | A2941 | |
| Biofuge pico | Heraeus GmbH | 75003280 | |
| Blue R-250 | SERVA Electrophoresis GmbH | 17525 | |
| Bromophenol Blue | Pharmacia Biotech | 17132901 | |
| C57BL/6J mice | Charles River | ||
| Cantharidin | Carl Roth GmbH | 3322.1 | |
| Centrifuge tubes for MLS-50 | Beckman Coulter | 344057 | |
| Centrifuge tubes for TLA 100.1 rotor | Beckman Coulter | 343776 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| Eppendorf 5417R centrifuge | VWR | 22636138 | |
| Eppendorf A-8-11 rotor | VWR | 5407000317 | |
| Formic acid | Fluka | 14265 | |
| GeneCodis | http://genecodis.cnb.csic.es/ | ||
| Gephi | https://gephi.org/ | ||
| Glycerol | AppliChem | A1123 | |
| Glycine | AppliChem | A1067 | |
| HALT Phosphatase Inhibitor Cocktail | Pierce /Thermo Scientific | 78420 | |
| HEPES Buffer solution | PAA Laboratories GmbH | S11-001 | |
| Homogenization vessel 2 ml | Sartorius AG | 854 2252 | |
| Hydrochloric acid | Sigma-Aldrich | H1758 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide (IAA) | Sigma-Aldrich | I1149 | |
| Laboratory drilling drive K-ControlTLC 4957 | Kaltenbach & Vogt GmbH | 182997 | |
| LTQ Tune Plus 2.7.0.1112 SP2 | Thermo Scientific | ||
| LTQ Orbitrap Velos Pro | Thermo Scientific | ||
| Macs-mix tube rotator | Miltenyi Biotech | 130-090-753 | |
| Magic Scan 4.71 | UMAX | ||
| Methanol | Carl Roth GmbH | AE71.2 | |
| MLS-50 rotor | Beckman Coulter | 367280 | |
| Optima MAX Ultracentrifuge | Beckman Coulter | 364300 | |
| PageRuler Prestained Protein Ladder | Thermo Scientific | 26616 | |
| PEAKS 7.5 | Bioinformatic Solutions | ||
| Phosphatase Inhibitor Cocktail 3 | Sigma-Aldrich | P0044 | |
| PhosphoRS 3.1 | IMP/IMBA/GMI | ||
| PhosSTOP | Roche | 4906845001 | |
| Plunger/pestle made of PTFE | Sartorius AG | 854 2651 | |
| PotterS homogenizer | Sartorius AG | 853 3024 | |
| Protease Inhibitor complete mini | Roche | 4693159001 | |
| Quantity One 4.5.1 | BioRad | ||
| RapiGest | Waters | 186002122 | |
| Shuttle box | Coulbourne Instruments | ||
| Sodium dodecylsulfate (SDS) | AppliChem | A1112 | |
| Sodium molybdate | Carl Roth GmbH | 274.2 | |
| Sodium tartrate dihydrate | Sigma-Aldrich | 228729 | |
| SONOREX RK 156 Ultrasonic Bath | BANDELIN electronic GmbH & Co. KG | 305 | |
| Soundproof chamber | Industrial Acoustics Company | ||
| Sucrose | Carl Roth GmbH | 4621.2 | |
| Tetramethyl ethylene -1,2-diamine (TEMED) | Sigma-Aldrich | T9281 | |
| Thermomixer basic | CallMedia | 111000 | |
| Titansphere TiO 5µm | GL Sciences Inc. Japan | 502075000 | |
| TLA 100.1 rotor | Beckman Coulter | 343840 | |
| Trifluoro acetic acid (TFA) | Sigma-Aldrich | T6508 | |
| Tris ( hydroxymethyl) aminomethane (TRIS) | AppliChem | A1086 | |
| Triton X-100 | Sigma-Aldrich | T8532 | |
| Trypsin Gold | Promega | V5280 | |
| Ultimate 3000 Ultra HPLC | Dionex/Thermo Scientific | ||
| Ultracentrifuge tube | Beckman Coulter | 343776 | |
| Unijet II Refrigerated Aspirator | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| UNIVAPO 100 H Concentrator Centrifuge | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| Urea | AppliChem | A1049 | |
| Water (high quality purifed) | Resistivity: > 18.2 MΩ*cm at 25 °C Pyrogens: < 0.02 EU/ml TOC: < 10 ppb | ||
| Xcalibur 3.0.63 | Thermo Scientific | ||
| ZipTipC18 Pipette Tips | MILLIPORE | ZTC18S960 |
Ссылки
- Lamprecht, R., LeDoux, J. Structural plasticity and memory. Nat Rev Neurosci. 5 (1), 45-54 (2004).
- Bingol, B., Schuman, E. M. Synaptic protein degradation by the ubiquitin proteasome system. Curr Opin Neurobiol. 15 (5), 536-541 (2005).
- Richter, J. D., Klann, E. Making synaptic plasticity and memory last: mechanisms of translational regulation. Genes Dev. 23 (1), 1-11 (2009).
- Rosenberg, T., et al. The roles of protein expression in synaptic plasticity and memory consolidation. Front Mol Neurosci. 7, 86(2014).
- Scheich, H., et al. Behavioral semantics of learning and crossmodal processing in auditory cortex: the semantic processor concept. Hear Res. 271 (1-2), 3-15 (2011).
- Kähne, T., et al. Synaptic proteome changes in mouse brain regions upon auditory discrimination learning. Proteomics. 12 (15-16), 2433-2444 (2012).
- Reichenbach, N., et al. Differential effects of dopamine signalling on long-term memory formation and consolidation in rodent brain. Proteome Sci. 13, 13(2015).
- Kähne, T., et al. Proteome rearrangements after auditory learning: high-resolution profiling of synapse-enriched protein fractions from mouse brain. J Neurochem. , (2016).
- Li, K., et al. Organelle proteomics of rat synaptic proteins: correlation-profiling by isotope-coded affinity tagging in conjunction with liquid chromatography-tandem mass spectrometry to reveal post-synaptic density specific proteins. J Proteome Res. 4 (3), 725-733 (2005).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. J Cell Biol. 86 (3), 831-845 (1980).
- Smalla, K. H., Klemmer, P., Wyneken, U. The Cytoskeleton - Imaging, Isolation, and Interaction. Dermietzel, R. , Humana Press. 265-282 (2012).
- Smalla, K. H., et al. The synaptic glycoprotein neuroplastin is involved in long-term potentiation at hippocampal CA1 synapses. Proc Natl Acad Sci U S A. 97 (8), 4327-4332 (2000).
- Shapiro, A. L., Vinuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem. 68 (5), 850-858 (1996).
- Thingholm, T. E., Larsen, M. R., Ingrell, C. R., Kassem, M., Jensen, O. N. TiO(2)-based phosphoproteomic analysis of the plasma membrane and the effects of phosphatase inhibitor treatment. J Proteome Res. 7 (8), 3304-3313 (2008).
- Carmona-Saez, P., Chagoyen, M., Tirado, F., Carazo, J. M., Pascual-Montano, A. GENECODIS: a web-based tool for finding significant concurrent annotations in gene lists. Genome Biol. 8 (1), 3(2007).
- Bonn, S., Seeburg, P. H., Schwarz, M. K. Combinatorial expression of alpha- and gamma-protocadherins alters their presenilin-dependent processing. Mol Cell Biol. 27 (11), 4121-4132 (2007).
- Tweedie-Cullen, R. Y., Reck, J. M., Mansuy, I. M. Comprehensive mapping of post-translational modifications on synaptic, nuclear, and histone proteins in the adult mouse brain. J Proteome Res. 8 (11), 4966-4982 (2009).
- Li, L., et al. The differential hippocampal phosphoproteome of Apodemus sylvaticus paralleling spatial memory retrieval in the Barnes maze. Behav Brain Res. 264, 126-134 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены