A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج المبيدات العضوية من البلاستيك الكريات والبلاستيك تحليل نوع
In This Article
Summary
تعمل اللدائن الدقيقة كناقلات للملوثات العضوية السامة المحتملة مع تأثيرات لا يمكن التنبؤ بها. يصف هذا البروتوكول منهجية بديلة لتقييم مستويات المبيدات العضوية الكلورية العضوية كثف على الكريات البلاستيكية وتحديد الهيكل الكيميائي البوليمر. التركيز على استخراج السوائل المضغوط و الموهن الكلي انعكاس تحويل فورييه مطياف الأشعة تحت الحمراء.
Abstract
حبيبات الراتنج البلاستيكية، المصنفة كلدائن بلاستيكية (قطرها 5 مم)، هي حبيبات صغيرة يمكن إطلاقها عن غير قصد على البيئة أثناء التصنيع والنقل. وبسبب استمرارها البيئي، فإنها توزع على نطاق واسع في المحيطات وعلى الشواطئ في جميع أنحاء العالم. ويمكن أن تكون بمثابة ناقل للمركبات العضوية السامة المحتملة ( مثل مركبات ثنائي الفينيل المتعددة الكلور) تؤثر سلبا على الكائنات البحرية. وآثارها المحتملة على طول السلسلة الغذائية ليست مفهومة جيدا بعد. من أجل تقييم المخاطر المرتبطة بحدوث الكريات البلاستيكية في البيئة البحرية، من الضروري وضع منهجيات تسمح بتحديد سريع لمستويات الملوثات العضوية المرتبطة بها. يصف هذا البروتوكول الخطوات المختلفة المطلوبة لأخذ عينات من الكريات الراتنجية، وتحليل مبيدات الآفات الكلورية العضوية الممتصة (أوكبس) وتحديد نوع البلاستيك. التركيز علىواستخراج أوكبس من الكريات البلاستيكية عن طريق مستخرج السوائل المضغوط (ب) وعلى التحليل الكيميائي البوليمر تطبيق التحليل الطيفي فورييه-إنفرارد (فت-إر). وتركز المنهجية المتقدمة على 11 من مركبات أوكب والمركبات ذات الصلة، بما في ذلك ثنائي كلوريد الفينيل ثنائي الفينيل (دت) واثنين من الأيضات الرئيسية والليندين واثنين من ايزومرات الإنتاج، فضلا عن إيزومرات نشطة بيولوجيا من الإندوسلفان التقني. هذا البروتوكول يشكل بديلا بسيط وسريع للمنهجية القائمة لتقييم تركيز الملوثات العضوية كثف على قطع من البلاستيك.
Introduction
يرتفع الإنتاج العالمي من اللدائن بشكل مستمر منذ عام 1950 ليصل إلى 311 مليون طن في عام 2014 مع استخدام حوالي 40٪ في التعبئة والتغليف 1 . وفي موازاة ذلك، تتراكم كميات متزايدة من هذه المواد في البيئة، مما قد يشكل تهديدا خطيرا للنظم الإيكولوجية 2 . وعلى الرغم من الإبلاغ عنها بالفعل في السبعينيات، فإن حدوث الحطام البلاستيكي في البيئة البحرية لم يحظ إلا بقدر أكبر من الاهتمام في العقد الماضي. خاصة اللدائن البلاستيكية، شظايا البلاستيك التي يبلغ قطرها ≤ 5 ملم، هي الآن معترف بها باعتبارها واحدة من القضايا الرئيسية نوعية المياه البحرية 3 .
حبيبات الراتنج البلاستيكية هي حبيبات صغيرة عموما في شكل اسطوانة أو قرص وقطرها بضعة ملم (على سبيل المثال، 2 إلى 5 ملم) 4 ، 5 . وهي تقع في فئة اللدائن الدقيقة. هذه حبيبات البلاستيك هيالمواد الخام الصناعية التي يتم تصنيعها من المنتجات البلاستيكية النهائية من خلال إعادة ذوبان وقولبة في درجة حرارة عالية 6 . ويمكن إطلاقها عن غير قصد في البيئة أثناء التصنيع والنقل. على سبيل المثال، يمكن إدخالها مباشرة إلى المحيط من خلال الانسكابات العرضية أثناء الشحن 4 ، 7 ، 8 . ويمكن نقلها من الأرض إلى المحيطات عن طريق الجريان السطحي، والجداول والأنهار. بسبب استمرارها البيئي، يتم توزيع الكريات البلاستيكية على نطاق واسع في المحيطات وجدت على الشواطئ في جميع أنحاء العالم 4 . ويمكن أن تؤثر سلبا على الكائنات البحرية، ويمكن أن تدخل السلسلة الغذائية، حيث تكون آثارها غير متوقعة 6 ، 7 . وعلاوة على ذلك، كشفت العديد من الدراسات وجود الملوثات البيئية كثف على الكريات البلاستيكية التي تم جمعها في كواستال، التي تعمل كموجة من هذه المواد الكيميائية السامة المحتملة 4 ، 9 ، 10 . في الواقع، هناك أدلة مختبرية تشير إلى أن هذه المواد الكيميائية يمكن أن تتراكم أحيائيا في أنسجة الكائنات الحية بعد إطلاقها من شظايا بلاستيكية مبتللة 11 ، 12 .
من أجل تقييم أفضل للأخطار المرتبطة بحدوث حبيبات بلاستيكية في البيئة البحرية، من الضروري وضع منهجيات يمكن أن تحدد الملوثات العضوية السائلة. وتتمثل إحدى الخطوات الهامة في استخراج المواد الكيميائية من المصفوفات البلاستيكية التي يمكن أن تقدم خصائص كيميائية فيزيائية غير متجانسة تبعا لنوع البوليمر ومرحلة التدهور والمعالجات المسبقة. معظم التحقيقات التي ذكرت في الأدب استخدام تقنيات التهدئة أو سوكسليت 4 ،5 ، 6 ، 9 ، 13 ، 14 ، 15 ، 16 ، 17 ، 18 ، والتي هي المذيبات و / أو تستغرق وقتا طويلا. وفيما يتعلق بالاهتمام المتزايد بهذه المسألة، ينبغي وضع بدائل من أجل إجراء تقييم أسرع للملوثات العضوية الممتزة على القطع البلاستيكية. وبالإضافة إلى ذلك، يوفر التحليل الكيميائي البلاستيك معلومات عن التركيب الكيميائي للاللدائن الدقيقة. ونتيجة لذلك، يمكن تقييم الأنواع السائدة من البوليمرات والبوليمرات المشتركة الموجودة في البيئة. على الرغم من أن شظايا البلاستيك عادة ما تكون مصنوعة من البولي إيثيلين والبولي بروبلين (ب) 5 ، يمكن لبعض مواقع أخذ العينات تقديم ملف تعريف معين حيث يتم تمثيل فئات أخرى بشكل كبير (على سبيل المثال، البوليمرات أسيتات الإيثيلين / فينيل أسيتاتوالبوليستيرين (بس)). فت-إر الطيفي هو تقنية موثوقة وسهلة الاستعمال لتحديد البوليمر تستخدم عادة لتحديد البلاستيك الدقيقة 19 ، 20 .
الهدف الرئيسي من هذا العمل هو تقديم خيار سريع وبسيط لاستخراج أوكبس والمركبات ذات الصلة من الكريات البلاستيكية عن طريق ب. ومع ذلك، فإن تصميم البروتوكول يتضمن جميع الخطوات التي تؤدي إلى تحديد أوكبس سوربيد، من أخذ العينات من الكريات الراتنج لتحليل المركبات. كما يتم وصف طريقة تحديد نوع من البلاستيك. وتركز المنهجية المتقدمة على 11 من مركبات أوكب والمركبات ذات الصلة: 1) دت (2،4'- و 4،4'-ثنائي كلورو ثنائي الفينيل ثلاثي كلور الإيثان) واثنين من الأيض الرئيسي ددي (2،4'- و 4،4'-ثنائي كلورودي فينيلديكلور إيثيلين) و دد (2،4'- و 4،4'-ثنائي كلورودي فينيلديكلور إيثان)؛ 2) سداسي كلورو حلقي الهكسان (أيسومر غاما - سداسي كلور حلقي الهكسان) باعتباره العنصر الرئيسي o(و) لدينان مبيدات الآفات والايزومرات α - هش وسداسي كلورو حلقي الهكسان - هش أثناء إنتاجه 15 ؛ 3) والايزومرات النشطة بيولوجيا إندوسلفان الأول (إندو الأول) والثاني (إندو إي) الموجودة في إندوسلفان التقنية. والمبيدات المدروسة هي مبيدات حشرية واسعة الطيف، مستقرة كيميائيا، مسعور، وتصنف على أنها ملوثات عضوية ثابتة (بوبس) بموجب اتفاقية استكهولم 21 .
Protocol
1. البلاستيك بيليه أخذ العينات
- قبل الذهاب إلى الميدان، ثلاث مرات شطف جميع المواد اللازمة أخذ العينات (على سبيل المثال، ملاقط ورقائق الألومنيوم) مع الأسيتون أو الإيثانول (99٪). في حالة عدم قدرة المادة على شطف المذيبات، قم بتسخينها عند درجة حرارة 450 درجة مئوية في الفرن (على سبيل المثال، الأواني الزجاجية).
ملاحظة: في المناطق السياحية، الحصول على معلومات حول أنشطة تنظيف الشاطئ المحتملة التي من شأنها إزالة معظم القمامة البحرية بما في ذلك اللدائن الدقيقة. إذا كان ذلك ممكنا، قم بتخطيط العينات قبل هذه العملية. إذا أخذت العينات خلال موسم التنظيف، حدد تفاصيل هذا النشاط في نموذج الهوية (على سبيل المثال، التواريخ، طريقة التنظيف المستخدمة، وما إلى ذلك ) - ارتداء القفازات، وجمع الكريات البلاستيكية من الشاطئ مع المذيبات الشطف الفولاذ المقاوم للصدأ ملاقط.
- عينة 50 إلى 100 الكريات لكل موقع، وهو ما يتطابق مع 5 إلى 10 مكررات لكل موقع (10 الكريات لكل تكرار). إذا كان العدد المطلوب من الكريات لا يمكن أن يكون أوبتاإينيد، وجمع الكريات القصوى الممكنة وتحديده في شكل شاطئ الهوية.
- في نهاية أخذ العينات، التفاف الكريات التي تم جمعها في المذيبات-- شطف رقائق الألومنيوم. الزجاجات الزجاجية يمكن استخدامها كبديل أو حتى أكياس الورق.
- ملء نموذج هوية الشاطئ المحدد مع المعلومات المفقودة ( أي موقع الشاطئ، والظروف الجوية، وتفاصيل عن الكريات، وما إلى ذلك ).
- نقل العينات إلى المختبر في علبة الجليد إذا كانت درجة الحرارة المحيطة تتجاوز 25 درجة مئوية. يمكن تخطي هذه الخطوة في حالة الرحلات القصيرة (على سبيل المثال، <1 h).
- مرة واحدة في المختبر، يمسح بلطف قبالة الجسيمات القابلة للإزالة (على سبيل المثال، الرمل) من الكريات. تجفيف العينات إذا لزم الأمر في مجفف قبل التخزين (الظلام، T <25 درجة مئوية). تجنب الغرف التي قد تكون فيها مراكز الرعاية الصحية الخارجية قيد الاستخدام (على سبيل المثال، تخزين الحلول القياسية).
- تخزين الكريات في الثلاجة (4 درجة مئوية) لفترات قصيرة ( أي بضعة أيام) أوفي الفريزر (-18 درجة مئوية) لفترات أطول في رقائق الألومنيوم المغلفة بالمذيبات.
- تجنب تعرض العينات للضوء الاصطناعي أو أشعة الشمس. التعامل مع عينات أقل قدر ممكن قبل التحليل للحد من خطر التلوث.
2. استخراج أوكبس من الكريات البلاستيكية
- للحد من خطر التلوث، العمل في مختبر نظيفة باستخدام الأواني الزجاجية غسلها بعناية على النحو التالي: يشطف 2 مع الأسيتون التحليلية الصف، ثنائي كلورو ميثان و ن الهكسان. تجفيف الأواني الزجاجية تحت تدفق النيتروجين وحماية من الاتصال مع الهواء المحيط (على سبيل المثال، غطاء مع رقائق الألومنيوم تنظيفها). تطبيق هذا الإجراء التنظيف في خطوات أخرى من البروتوكول ( أي الأقسام 3 و 4).
- باستخدام ملاقط شطف المذيبات، فرز الكريات حسب اللون في الفئات التالية: أبيض / شفاف، أبيض / مصفر، أصفر / برتقالي، العنبر / البني، ومصطبغة (على سبيل المثال، الأحمر والأخضر والأزرق، وما إلى ذلك )
- جمع 10 بيليهق من لون مماثل عشوائيا ( أي نوع من البلاستيك لا يعتبر)، والتي سوف تشكل تكرار واحد.
- وزن العينة على التوازن التحليلي وتسجيل الكتلة. في هذه المرحلة، يمكن وضع العينات مرة أخرى في الثلاجة أو الفريزر.
- أن تأخذ في الاعتبار تلوث الخلفية، إجراء عينة فارغة مع كل مجموعة من مكررات (على سبيل المثال، 1 فارغة لمدة 5 مكررات). تحقيقا لهذه الغاية، وتطبيق نفس البروتوكول كما هو موضح أعلاه، ولكن لا تضيف الكريات البلاستيكية في الخلية استخراج. وهذه العينة فارغة تخضع لمزيد من الخطوات من البروتوكول ويتم تحليلها جنبا إلى جنب مع العينات.
- التبديل على ب. تحميل طريقة الاستخراج والاحماء الصك إلى 60 درجة مئوية. وفيما يلي تفاصيل هذه الطريقة:
- ضبط درجة الحرارة إلى 60 درجة مئوية والضغط إلى 100 بار.
- حدد دورة واحدة مع الحرارة حتى وقت 1 دقيقة، وقت الانتظار من 25 دقيقة، ووقت التفريغ من 2 دقيقة.
- تعيين المذيباتوالغاز (N 2 ) مرات تدفق إلى 3 دقائق لكل منهما.
- حدد n- الهكسان كمذيب استخراج.
- في حين أن الجهاز هو الاحماء، وإعداد خلية استخراج كما هو موضح أدناه. إذا لزم الأمر، وتكييف البروتوكول لتعليمات المورد من الصك الخاص بك:
- وضع مرشح أسفل وفريت في الخلية استخراج. إغلاقه وتحويله.
- ملء ما يقرب من نصف الخلية مع تنظيف الرمال الكوارتز باستخدام قمع.
- إضافة عينة وزنها ( أي واحد من تكرار 10 الكريات). وينبغي وضع الكريات البلاستيكية المجمدة في الثلاجة بين عشية وضحاها قبل الاستخراج.
- إضافة رمل الكوارتز تصل إلى 1 سم من الجزء العلوي من الخلية. توخى عناية خاصة لاستخدام رمل الكوارتز النظيف جدا (أو الخرز الزجاجي بدلا من ذلك) نظرا لأنه يتعرض لنفس ظروف الاستخراج مثل العينات. لتنظيف الرمل، على التوالي استخراجه في ب في ثنائي كلورو ميثان التحليلي و n- الهكسان، وتطبيق 2 أوالمزيد من الدورات لكل مذيب (على سبيل المثال، 30 دقيقة عند 100 درجة مئوية تحت 100 بار). بدلا من ذلك، استخدم حمام بالموجات فوق الصوتية و / أو المبخر الدورية. كرر إجراء التنظيف، إذا لزم الأمر.
- إدراج أعلى مرشح في الخلية ووضع الخلية في الصك.
- وضع السفن جمع في الصك وبدء طريقة استخراج (المدى الكلي من حوالي 35 دقيقة).
- عند اكتمال الطريقة، إفراغ خلية الاستخراج في وعاء زجاجي تنظيف (على سبيل المثال، كوب، طبق زجاجي ثقافة الخلية) واسترداد 10 الكريات في الرمال. تخزينها في وعاء حتى مزيد من التحليل لتحديد البلاستيك (على سبيل المثال، كيس البريدي أو قارورة زجاجية).
3. تركيز وتنظيف استخراج
- نقل استخراج الحصول عليها (حوالي 40 مل) من وعاء جمع إلى أنبوب زجاجي وتبخره إلى 1 مل في المكثف الدورية تعيين إلى 35 درجة مئوية لمدة 20 دقيقة. ويمكن استخدام الطرق البديلة سوتش كما التبخر تحت تدفق النيتروجين أو المبخر الدورية. وينبغي تحسين درجة الحرارة والمدة وفقا لذلك.
- في هذه الأثناء، إعداد مستخرج المرحلة الصلبة (سب) عن طريق وضع أنبوب النفايات في الرف وخرطوشة مليئة المنشط سيليكات المغنيسيوم الماصة (1 غرام) على مشعب في موقف صمام وثيق. ويستند التنظيف على طريقة وكالة حماية البيئة 3620C 22 على النحو التالي:
- بدوره على الفراغ على المصدر وإضافة 4 مل من الهكسان في خرطوشة لتنشيط المواد الماصة.
- افتح الصمام واترك المذيب يمر عبر السرير الماص بالكامل. ثم، أغلق صمام والسماح للمادة الماصة لنقع في الهكسان لمدة 5 دقائق.
- افتح الصمام واترك المذيب يمر، ولكن أغلق الصمام قبل تجفيف الماصة.
- عندما تتركز العينة، نقله إلى خرطوشة مع ماصة باستور الزجاج. افتح الصمام بلطف واتركه يمر ببطء. 1-2 قطرات في الثانية الواحدةسرعة مناسبة.
- شطف أنبوب زجاجي يحتوي على استخراج مع 0.5 مل من الهكسان وإضافته إلى خرطوشة عندما مرت المستخلص من خلال.
- عندما يمر المذيب بأكمله، أغلق الصمام وأوقف الفراغ.
- استبدال أنبوب النفايات مع أنبوب جمع واستخدام نظيفة إبرة دليل المذيبات.
- إضافة 9 مل من الأسيتون / الهكسان (10/90، v / v) إلى خرطوشة وتشغيل الفراغ في المصدر. السماح للمادة الماصة لنقع في المذيب لمدة 1 دقيقة.
- فتح صمام وجمع كامل شطافة في أنبوب جمع.
- وضع أنبوب جمع في المكثف وتبخر المذيبات لمدة 9 دقائق في 35 درجة مئوية من أجل الوصول إلى 1 مل من الشطف.
- نقل شطافة المركزة في العنبر قارورة الاوتوماتيكى مع ماصة باستور الزجاج. في هذه المرحلة، يمكن تخزين العينات في الثلاجة قبل التحليل.
4. تحليل تنظيف و كونسنتراتيد استخراج
- تحميل الأسلوب التحليلي على برامج التحكم من أداة غ-ميكرد (كروماتوجراف الغاز مجهزة كاشف التقاط الإلكترون الجزئي). وفيما يلي تفاصيل هذه الطريقة:
- تعيين حاقن لوضع سبليتليس، درجة حرارته إلى 250 درجة مئوية، ووقت تطهير إلى 1 دقيقة.
- تعيين تدفق الغاز الناقل (هو) إلى 1.5 مل دقيقة -1 .
- برنامج الفرن العمود مع التدرج درجة الحرارة التالية: 60 درجة مئوية عقد لمدة 1 دقيقة، منحدر من 30 درجة مئوية دقيقة -1 إلى 200 درجة مئوية، منحدر من 5 درجات مئوية دقيقة -1 إلى 230 درجة مئوية، منحدر من 3 درجات مئوية دقيقة -1 لتصل إلى 250 درجة مئوية، وعقد هذه درجة الحرارة لمدة 5 دقائق.
- تعيين درجة الحرارة للكشف إلى 300 درجة مئوية وتدفق الغاز الاحتياطي (N 2 ) إلى 60 مل دقيقة -1 .
- وضع قارورة تحتوي على عينة (تنظيف وتركز) في رف الاوتوماتيكى وتشغيل الطريقة (وقت تشغيل 23.3 دقيقة). أنا نجكت 2 ميكرولتر من العينة.
- بعد التحليل، وتحديد المركبات المختلفة على اللوني من قبل أوقات الاحتفاظ بهم وتسجيل المناطق الذروة المقابلة.
- مع الأخذ في الاعتبار الاسترداد (R) ومناطق الذروة (A 1 )، وحساب تركيز (C 1 ) لكل أوكب في استخراج باستخدام معادلات منحنيات المعايرة على النحو التالي:
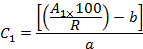
حيث b هو اعتراض في الأصل و هو منحدر معادلة المعايرة،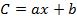
- مع الأخذ بعين الاعتبار كتلة (م) من تكرار ( أي 10 الكريات، انظر القسم 2.4) وحجم (V) من المستخلص النهائي ( أي 1 مل)، وحساب تركيز (C2) من كل أوكب كثف على الكريات البلاستيكية ( أي نانوغرام من أوكب لكل غرام من البلاستيك بيليه):
/ftp_upload/55531/55531eq3.jpg "/>
5. تحديد نوع البلاستيك
- نقل الكريات في طبق بيتري الزجاج ووضعه في كيس من البلاستيك.
- عقد بيليه واحد مع ملاقط وقطع شريحة من بيليه مع مشرط. كيس من البلاستيك يمنع فقدان الكريات أثناء عملية القطع.
- تنظيف الكريستال الانعكاس الكلي الموهوب (أتر) من أداة فت-إر مع الإيثانول.
- تسجيل طيف الخلفية.
- وضع جزء على الكريستال أتر والمسمار صاحب العينة. يجب أن يكون الجانب الداخلي من قطعة في اتصال مع الكريستال.
- مسح العينة وتسجيل الطيف.
- تحديد البوليمر التي تشكل بيليه البلاستيك بمقارنة الطيف التي تم الحصول عليها إلى مكتبة أطياف. على الرغم من أن أكثر استهلاكا للوقت، ويمكن أن يتم تفسير الأطياف التي تم الحصول عليها يدويا أيضا، ولكن على الأرجح دون الوصول إلى درجة الخصوصية التي تحققت مع بحر مكتبةRCH.
النتائج
يتم العثور على الكريات البلاستيكية عادة على طول خطوط المد والجزر العالية والمنخفضة من الشواطئ الرملية ( الشكل 1A ). ويمكنهم أيضا التمسك الأعشاب البحرية التي تقطعت بهم السبل على الشواطئ، بعد عاصفة على سبيل المثال. ويمكن العثور عليها ف?...
Discussion
وقد اعتمدت معظم الدراسات التي تركز على الملوثات العضوية المرتبطة الكريات البلاستيكية على أساليب استخراج الكلاسيكية من المواد الكيميائية كثف. جهاز سوكسليت هو أكثر التقنيات استخداما على نطاق واسع مع فترات استخلاص نموذجية تتراوح من 12 إلى 24 ساعة ومع استهلاك عالي من...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
تم تمويل هذا العمل من قبل برنامج التعاون الأدرياتيكي عبر الحدود 2007-2013، ضمن مشروع ديفيشجير (1 ° ستر / 00010).
Materials
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
References
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved