Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экстракция органохлоридных пестицидов из пластиковых гранул и анализ пластического типа
В этой статье
Резюме
Микропластики действуют как вектор потенциально токсичных органических загрязнителей с непредсказуемыми эффектами. В этом протоколе описывается альтернативная методика оценки уровней хлорорганических пестицидов, адсорбированных на пластиковых гранулах, и определения химической структуры полимера. Основное внимание уделяется извлечению жидкости под давлением и аттенуированной инфракрасной спектроскопии с коэффициентом отражения Фурье.
Аннотация
Пластиковые полимерные гранулы, классифицированные как микропластики (≤5 мм в диаметре), представляют собой небольшие гранулы, которые могут непреднамеренно высвобождаться в окружающую среду при производстве и транспортировке. Из-за их экологической стойкости они широко распространены в океанах и на пляжах по всему миру. Они могут действовать как вектор потенциально токсичных органических соединений ( например, полихлорированных дифенилов) и, следовательно, могут Отрицательно влияют на морские организмы. Их возможные воздействия вдоль пищевой цепи еще недостаточно изучены. Для оценки опасностей, связанных с появлением пластиковых гранул в морской среде, необходимо разработать методологии, которые позволят быстро определить уровни связанных органических загрязнителей. В настоящем протоколе описаны различные этапы, необходимые для отбора проб гранул смолы, анализа адсорбированных хлорорганических пестицидов (ОХП) и идентификации пластического типа. Основное внимание уделяетсяИзвлечение OCP из пластиковых гранул с помощью экстрактора под давлением (PFE) и химического анализа полимера с применением спектроскопии Фурье-преобразования (FT-IR). В разработанной методологии основное внимание уделяется 11 ОТП и родственным соединениям, включая дихлордифенилтрихлорэтан (ДДТ) и его два основных метаболита, линдан и два изомера производства, а также два биологически активных изомера технического эндосульфана. Этот протокол представляет собой простую и быструю альтернативу существующей методологии оценки концентрации органических загрязнителей, адсорбированных на пластмассовых изделиях.
Введение
Мировое производство пластмасс постоянно растет с 1950-х годов до 311 млн тонн в 2014 году, причем около 40% используется в упаковке 1 . Параллельно увеличение количества этих материалов накапливается в окружающей среде, что может представлять серьезную угрозу для экосистем 2 . Хотя уже сообщалось в 1970-х годах, появление пластического мусора в морской среде уделялось больше внимания в последнее десятилетие. Особенно микропластики, пластиковые фрагменты диаметром ≤ 5 мм, теперь признаны одной из основных проблем качества морской воды 3 .
Пластиковые полимерные гранулы представляют собой небольшие гранулы, обычно в виде цилиндра или диска и диаметром от нескольких мм ( например, от 2 до 5 мм) 4 , 5 . Они относятся к категории микропластиков. Эти пластиковые гранулыПромышленное сырье, из которого конечные пластмассовые изделия производятся путем переплавки и формования при высокой температуре 6 . Во время производства и транспортировки они могут быть непреднамеренно выпущены в окружающую среду. Например, они могут быть непосредственно введены в океан через случайные разливы во время отгрузки 4 , 7 , 8 . Они могут перевозиться с суши в океаны поверхностным стоком, ручьями и реками. Из-за их экологической стойкости пластиковые гранулы широко распространены в океанах и встречаются на пляжах по всему миру 4 . Они могут отрицательно влиять на морские организмы и могут проникать в пищевую цепь, где их последствия непредсказуемы 6 , 7 . Кроме того, в нескольких исследованиях было обнаружено наличие загрязняющих веществ окружающей среды, адсорбированных на пластиковых гранулах, собранных в прибрежной зонеL, которые действуют как вектор этих потенциально токсичных химических веществ 4 , 9 , 10 . Фактически, имеются лабораторные данные, свидетельствующие о том, что эти химические вещества могут биоаккумулироваться в тканях организмов после выхода из проглатываемых пластиковых фрагментов 11 , 12 .
Чтобы лучше оценить опасности, связанные с появлением пластиковых гранул в морской среде, необходимо разработать методологии, которые могут определять сорбированные органические загрязнители. Важным шагом является извлечение химических веществ из пластиковых матриц, которые могут представлять гетерогенные физико-химические характеристики в зависимости от типа полимера, стадии его деградации и предварительной обработки. Большинство исследований, описанных в литературе, используют мацерацию или методы Сокслета 4 ,5 , 6 , 9 , 13 , 14 , 15 , 16 , 17 , 18 , которые являются растворителями и / или занимают много времени. Что касается растущего интереса к этой проблеме, следует разработать альтернативы для более быстрой оценки органических загрязнителей, адсорбированных на пластиковых изделиях. Кроме того, пластический химический анализ предоставляет информацию о химической структуре микропластиков. В результате можно оценить преобладающие типы полимеров и сополимеров, присутствующих в окружающей среде. Хотя пластмассовые фрагменты обычно изготовлены из полиэтилена (ПЭ) и полипропилена (ПП) 5 , некоторые места отбора проб могут представлять конкретный профиль, где представлены другие категории ( например, сополимер этилена и винилацетатаИ полистирол (PS)). FT-IR-спектроскопия является надежной и удобной для пользователя методикой идентификации полимера, обычно используемой для идентификации микропластиков 19 , 20 .
Основная цель настоящей работы - предложить быстрый и простой вариант для извлечения OCP и родственных соединений из пластиковых гранул с помощью PFE. Однако конструкция протокола включает все этапы, ведущие к определению сорбированных ОХП, от отбора проб гранул смолы до анализа соединений. Также описан метод идентификации пластического типа. В разработанной методологии основное внимание уделяется 11 OCP и родственным соединениям: i) ДДТ (2,4'- и 4,4'-дихлордифенилтрихлорэтан) и его два основных метаболита DDE (2,4'- и 4,4'-дихлордифенилдихлорэтилен) и DDD (2,4'- и 4,4'-дихлордифенилдихлорэтан); Ii) изомер гамма-гексахлорциклогексан (γ-ГХГ) в качестве основного ингредиента oF - пестицидный линдан и два изомера α-ГХГ и β-ГХЦ, высвобождаемые во время его производства 15 ; Iii) и двух биологически активных изомеров эндосульфана I (Endo I) и II (Endo II), присутствующих в техническом эндосульфане. Изученные пестициды представляют собой инсектициды широкого спектра действия, химически стабильные, гидрофобные и классифицируются как стойкие органические загрязнители (СОЗ) в Стокгольмской конвенции 21 .
протокол
1. Отбор проб пластмассы
- Перед тем, как отправиться на поле, трижды промойте все необходимые пробоотборные материалы ( например, пинцет и алюминиевую фольгу) с ацетоном или этанолом (99%). В случае, если материал не может быть промыт растворителем, нагреть его при 450 ° C в течение ночи в духовке ( например, посуду).
ПРИМЕЧАНИЕ. В туристических зонах получите информацию о возможных мероприятиях по очистке пляжа, которые позволили бы удалить большую часть морского мусора, включая микропластики. Если возможно, планируйте выборку перед этой операцией. Если выборка во время сезона очистки, укажите подробности этого вида деятельности в форме идентификации ( например, даты, метод очистки и т. Д. ), - Носите перчатки, собирайте пластиковые гранулы с пляжа с помощью пинцета из нержавеющей стали с растворителем.
- Образец от 50 до 100 гранул на место, что соответствует от 5 до 10 повторов на место (10 гранул на репликацию). Если требуемое количество гранул не может быть обтаЧтобы собрать максимальные гранулы и указать их в форме пляжа.
- По окончании отбора проб оберните собранные гранулы в алюминиевую фольгу с растворителем. Стеклянные бутылки можно использовать в качестве альтернативных или даже бумажных пакетов.
- Заполните личную форму выбранного пляжа с отсутствующей информацией ( например, местоположение пляжа, погодные условия, данные о гранулах и т . Д. ).
- Транспортируйте образцы в лабораторию в холодильнике, если температура окружающей среды превышает 25 ° C. Этот шаг можно пропустить в случае коротких отключений ( например, <1 час).
- Как только в лаборатории аккуратно вытрите удаляемые частицы ( например, песок) гранул. Высушите образцы, если необходимо, в эксикаторе перед хранением (темнота, T <25 ° C). Избегайте помещений, где могут использоваться OCP ( например, хранение стандартных решений).
- Храните гранулы в холодильнике (4 ° C) в течение коротких периодов ( т. Е. Несколько дней) илиВ морозильной камере (-18 ° C) в течение длительного времени в алюминиевой фольге с растворителем.
- Избегайте воздействия образцов на искусственный свет или солнечный свет. Обращайтесь с образцами как можно меньше перед анализом, чтобы уменьшить риск заражения.
2. Добыча ОХП из пластиковых гранул
- Чтобы уменьшить риск заражения, работайте в чистой лаборатории, используя тщательно промытую посуду следующим образом: 2 полоскания с аналитическим ацетоном, дихлорметаном и н-гексаном. Высушите стеклянную посуду под потоком азота и предохраняйте ее от контакта с окружающим воздухом ( например, крышкой с очищенной алюминиевой фольгой). Примените эту процедуру очистки на последующих этапах протокола ( т. Е. Разделы 3 и 4).
- Используя пинцеты с растворителем, сортируйте гранулы по цвету в следующих категориях: белый / прозрачный, беловатый / желтоватый, желтый / оранжевый, янтарно-коричневый и пигментированный ( например, красный, зеленый, синий и т. Д. ),
- Соберите 10 гранул( Т. Е. Не рассматриваемый пластический тип), который будет представлять собой один репликат.
- Взвесьте образец на аналитическом балансе и запишите массу. На этом этапе образцы можно вернуть обратно в холодильник или морозильник.
- Чтобы учесть фоновое загрязнение, выполните пустой образец с каждым набором реплик ( например, 1 пустая строка для 5 повторов). С этой целью примените тот же протокол, который описан выше, но не добавляйте пластиковые гранулы в экстракционную ячейку. Этот пустой образец будет проходить дальнейшие шаги протокола и анализироваться вместе с образцами.
- Включите PFE. Загрузите метод извлечения и размойте прибор до 60 ° C. Детали метода следующие:
- Установите температуру до 60 ° C и давление до 100 бар.
- Выберите один цикл с временем нагрева 1 мин, временем удержания 25 мин и временем разряда 2 мин.
- Установите растворительИ газа (N 2 ) времени промывки до 3 мин каждый.
- Выберите н-гексан в качестве экстракционного растворителя.
- Пока прибор прогревается, подготовьте экстракционную ячейку, как описано ниже. При необходимости адаптируйте протокол к инструкциям поставщика вашего прибора:
- Поместите нижний фильтр и фритту в экстракционную ячейку. Закройте его и переверните.
- Заполните примерно половину ячейки очищенным кварцевым песком с помощью воронки.
- Добавьте взвешенный образец ( т. Е. Один репликат из 10 гранул). Замороженные пластиковые гранулы следует помещать в холодильник на ночь перед экстракцией.
- Добавьте кварцевый песок до 1 см от верхней части ячейки. Особое внимание следует уделять использованию ультрачистого кварцевого песка (или, альтернативно, стеклянных шариков), поскольку он подвергается тем же условиям экстракции, что и образцы. Для очистки песка последовательно экстрагируйте его в PFE в аналитическом классе дихлорметан и н-гексан, применяя 2 илиБольше циклов на растворитель ( например, 30 мин при 100 ° С менее 100 бар). Альтернативно, используйте ультразвуковую ванну и / или вращающийся испаритель. При необходимости повторите процедуру очистки.
- Вставьте верхний фильтр в ячейку и поместите ячейку в инструмент.
- Поместите сборные сосуды в прибор и начните метод извлечения (общий прогон около 35 минут).
- Когда метод будет завершен, опустошите экстракционную ячейку в очищенном стеклянном сосуде ( например, стакан, блюдо с культурой из стеклянной ячейки) и извлеките 10 гранул в песок. Храните их в контейнере до дальнейшего анализа для идентификации пластика ( например, почтовый пакет или стеклянный флакон).
3. Концентрация и очистка экстракта
- Перенесите полученный экстракт (около 40 мл) из сосуда для сбора в стеклянную трубку и упаривают его до 1 мл во вращающемся концентраторе, установленном до 35 ° С в течение 20 мин. Альтернативные методы можно использовать suЧ как испарение в потоке азота или вращающемся испарителе. Соответственно следует оптимизировать температуру и продолжительность.
- Тем временем подготовьте твердофазный экстрактор (SPE), поместив в стойку трубу для отходов и картридж, заполненный активированным силикатным сорбентом магния (1 г) на коллекторе в положении закрытого клапана. Очистка основана на способе EPA 3620C 22 следующим образом:
- Включите вакуум на источнике и добавьте 4 мл гексана в картридж, чтобы активировать сорбент.
- Откройте клапан и пропустите растворитель через весь слой сорбента. Затем закройте клапан и дайте сорбенту смочить в гексане в течение 5 мин.
- Откройте клапан и пропустите растворитель, но закройте клапан до того, как сорбент высохнет.
- Когда образец концентрируется, перенесите его в картридж со стеклянной пипеткой Пастера. Аккуратно откройте клапан и пропустите его медленно. 1-2 капли в секундуСоответствующую скорость.
- Промойте стеклянную трубку, содержащую экстракт 0,5 мл гексана, и добавьте его в картридж, когда пробирка прошла.
- Когда весь растворитель прошел, закройте клапан и выключите вакуум.
- Замените трубу для отходов сборной трубкой и используйте чистую направляющую иглу для растворителя.
- Добавьте 9 мл ацетона / гексана (10/90, об. / Об.) В картридж и включите вакуум в источнике. Позвольте сорбенту замачивать в растворителе в течение 1 мин.
- Откройте клапан и соберите весь элюат в сборной трубе.
- Поместите сборную трубку в концентратор и испарите растворитель в течение 9 минут при 35 ° C, чтобы достичь 1 мл элюата.
- Перенесите концентрированный элюат в ампульный флакон с пробоотборником со стеклянной пипеткой Пастера. На этом этапе образцы могут храниться в морозильной камере перед анализом.
4. Анализ очищенных и концентрированныхИзвлечение
- Загрузите аналитический метод в программном обеспечении прибора GC-μECD (газовый хроматограф, оснащенный детектором микроэлектронного захвата). Детали метода следующие:
- Установите инжектор в режим без разделения, его температуру до 250 ° C и время продувки до 1 мин.
- Установите поток газа-носителя (He) до 1,5 мл мин -1 .
- Запрограммируйте колонную печь с последующим температурным градиентом: 60 ° C удерживайте в течение 1 минуты, рампой от 30 ° C мин -1 до 200 ° C, рампой от 5 ° C мин -1 до 230 ° C, рампой 3 ° C мин -1, чтобы достичь 250 ° C, удерживайте эту температуру в течение 5 мин.
- Установите температуру детектора на 300 ° C и поток резервного газа (N 2 ) до 60 мл мин -1 .
- Поместите флакон с образцом (очищенным и концентрированным) в стойку автосамплера и запустите метод (время работы 23,3 мин). я Nject 2 мкл образца.
- После анализа идентифицируйте различные соединения на хроматограмме по времени их хранения и запишите соответствующие области пиков.
- Принимая во внимание восстановление (R) и площади пиков (A 1 ), вычислите концентрацию (C 1 ) каждого OCP в выписке, используя уравнения калибровочных кривых следующим образом:
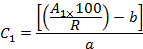
Где b - перехват в начале координат, a - наклон уравнения калибровки,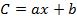
- Принимая во внимание массу (м) репликации ( т. Е. 10 гранул, см. Раздел 2.4) и объем (V) конечного экстракта ( т. Е. 1 мл), рассчитайте концентрацию (C 2 ) каждого OCP, адсорбированного на Пластиковые гранулы ( т. Е. Нг OCP на грамм пластиковой таблетки):
/ftp_upload/55531/55531eq3.jpg "/>
5. Идентификация пластикового типа
- Перенесите гранулы в стеклянную чашку Петри и поместите ее в полиэтиленовый пакет.
- Держите одну таблетку пинцетом и вырежьте кусочек шарика скальпелем. Пластмассовый пакет предотвращает потерю гранул во время процесса резания.
- Очистите кристалл аттенюированного полного отражения (ATR) прибора FT-IR с этанолом.
- Запишите фоновый спектр.
- Поместите фрагмент на кристалл ATR и ввинтите держатель образца. Внутренняя сторона детали должна находиться в контакте с кристаллом.
- Сканирование образца и запись спектра.
- Определите полимер, составляющий пластиковую таблетку, путем сравнения полученного спектра с библиотекой спектров. Хотя и более трудоемкий, интерпретация полученных спектров может быть выполнена и вручную, но, скорее всего, не достигнув степени специфичности, достигнутой в библиотечном мореRCH.
Результаты
Пластиковые гранулы обычно встречаются вдоль линий высокого и низкого приливов песчаных пляжей ( рис. 1А ). Они могут также придерживаться морской травы, недавно застрявшей на пляжах, например, после шторма. Их иногда можно встретить на галечных и камен?...
Обсуждение
Большинство исследований, посвященных органическим загрязняющим веществам, связанным с пластиковыми гранулами, основывались на классических способах экстракции адсорбированных химикатов. Аппарат Soxhlet является наиболее широко используемым методом с типичным временем экстракци?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована Программой приграничного сотрудничества МПА в 2007-2013 годах в рамках проекта DeFishGear (1 ° str / 00010).
Материалы
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
Ссылки
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены