È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Estrazione di pesticidi di organochlorato da pellicole di plastica e analisi di tipo plastico
In questo articolo
Riepilogo
Le microplastiche agiscono come vettori di contaminanti organici potenzialmente tossici con effetti imprevedibili. Questo protocollo descrive una metodologia alternativa per valutare i livelli di pesticidi organocloruri adsorbiti sui pellet di plastica e identificare la struttura chimica del polimero. Il fuoco è sulla estrazione del fluido pressurizzato e la riflessione totale attenuata che Fourier trasforma la spettroscopia a infrarossi.
Abstract
Le pellicole in resina plastica, classificate come microplastiche (≤ 5 mm di diametro), sono piccoli granuli che possono essere liberati involontariamente nell'ambiente durante la produzione e il trasporto. A causa della loro persistenza ambientale, sono ampiamente distribuiti negli oceani e nelle spiagge di tutto il mondo. Possono agire come vettori di composti organici potenzialmente tossici ( ad esempio, bifenili policlorurati) e potrebbero conseguenza Influenzano negativamente gli organismi marini. I loro possibili impatti lungo la catena alimentare non sono ancora ben compresi. Per valutare i rischi associati al verificarsi di pellets di plastica nell'ambiente marino, è necessario sviluppare metodologie che consentano una rapida determinazione dei livelli di contaminanti organici associati. Il presente protocollo descrive le diverse fasi necessarie per il campionamento di pellets di resina, analizzando i pesticidi organoclorurici adsorbiti (OCP) e identificando il tipo di plastica. L'attenzione è attivaL'estrazione di OCP da pellet di plastica mediante un estrattore fluido pressurizzato (PFE) e sull'analisi chimica polimerica applicando spettroscopia Fourier Transform-InfraRed (FT-IR). La metodologia sviluppata si concentra su 11 OCP e composti connessi, tra cui il diclorodifeniltricloroetano (DDT) ei suoi due principali metaboliti, il lindano e due isomeri di produzione, nonché i due isomeri biologicamente attivi di endosulfan tecnico. Questo protocollo costituisce un'alternativa semplice e rapida alla metodologia esistente per la valutazione della concentrazione di contaminanti organici adsorbiti su pezzi di plastica.
Introduzione
La produzione mondiale di materie plastiche è in continuo aumento dal 1950 fino a raggiungere 311 milioni di tonnellate nel 2014 con circa il 40% utilizzato nell'imballaggio 1 . Parallelamente, crescono quantità di questi materiali accumulando nell'ambiente, che potrebbe costituire una grave minaccia per gli ecosistemi 2 . Anche se già riportato negli anni '70, il verificarsi di detriti di plastica nell'ambiente marino ha ricevuto solo una maggiore attenzione negli ultimi dieci anni. Soprattutto le microplastiche, frammenti di plastica con diametro ≤ 5 mm, sono ora riconosciuti come uno dei principali problemi di qualità delle acque marine 3 .
I pellets di resina plastica sono piccoli granuli generalmente a forma di cilindro o disco e con un diametro di pochi millimetri ( ad esempio da 2 a 5 mm) 4 , 5 . Sono nella categoria delle microplastiche. Questi granuli di plastica sonoMaterie prime industriali da cui i prodotti plastici finali sono fabbricati mediante re-fusione e stampaggio ad alta temperatura 6 . Possono essere rilasciati involontariamente nell'ambiente durante la produzione e il trasporto. Ad esempio, possono essere direttamente introdotti nell'oceano attraverso fuoriuscite accidentali durante la spedizione 4 , 7 , 8 . Possono essere trasportati da terre a oceani da corsi d'acqua, ruscelli e fiumi. A causa della loro persistenza ambientale, i pellet di plastica sono ampiamente distribuiti negli oceani e si trovano sulle spiagge di tutto il mondo 4 . Possono influire negativamente sugli organismi marini e possono entrare nella catena alimentare, dove i loro effetti sono imprevedibili 6 , 7 . Inoltre, diversi studi hanno rivelato la presenza di contaminanti ambientali adsorbiti su pellet di plastica raccolti in una coastaL, che agiscono come vettore di queste sostanze potenzialmente tossiche 4 , 9 , 10 . Infatti, ci sono prove di laboratorio che suggeriscono che queste sostanze chimiche possono bioaccumularsi nei tessuti degli organismi dopo essere stati liberati dai frammenti di plastica ingeriti 11 , 12 .
Al fine di valutare meglio i rischi associati al verificarsi di pellets di plastica nell'ambiente marino, è necessario sviluppare metodologie che possano determinare contaminanti organici sorbitati. Un passo importante è l'estrazione delle sostanze chimiche dalle matrici plastiche, che possono presentare eterogenei caratteristiche fisico-chimiche a seconda del tipo di polimero, della sua fase di degradazione e dei pre-trattamenti. La maggior parte delle indagini riportate in letteratura usa la macerazione o le tecniche Soxhlet 4 ,5 , 6 , 9 , 13 , 14 , 15 , 16 , 17 , 18 , che sono solventi e / o che richiedono molto tempo. Per quanto riguarda l'interesse crescente per questo tema, occorre sviluppare alternative per una valutazione più rapida dei contaminanti organici adsorbiti su pezzi in plastica. Inoltre, l'analisi chimica plastica fornisce informazioni sulla struttura chimica delle microplastiche. Di conseguenza, i tipi predominanti di polimeri e copolimeri presenti nell'ambiente possono essere valutati. Sebbene i frammenti di plastica siano solitamente costituiti da polietilene (PE) e polipropilene (PP) 5 , alcune posizioni di campionamento possono presentare un particolare profilo in cui altre categorie sono significativamente rappresentate ( ad esempio, copolimero di etilene / vinilacetatoE polistirene (PS)). La spettroscopia FT-IR è una tecnica affidabile e user-friendly per l'identificazione del polimero comunemente utilizzata per identificare le microplastiche 19 , 20 .
Lo scopo principale del presente lavoro è quello di offrire un'opzione rapida e semplice per estrarre OCP e composti connessi da pellets di plastica per mezzo di un PFE. Tuttavia, la progettazione del protocollo comprende tutti i passaggi che conducono alla determinazione di OCP sorbitati, dal campionamento dei pellet resinati all'analisi dei composti. Viene descritto anche il metodo di identificazione del tipo di plastica. La metodologia sviluppata si concentra su 11 OCP e relativi composti: i) DDT (2,4'- e 4,4'-diclorodifeniltrichloroetano) ei suoi due principali metaboliti DDE (2,4'- e 4,4'-diclorodifenildicloroetilene) e DDD (2,4'- e 4,4'-diclorodifenildicloroetano); Ii) l'isomero gamma-esaclorocicloesano (γ-HCH) come ingrediente principale oIl pesticidi lindano ei due isomeri α-HCH e β-HCH liberati durante la sua produzione 15 ; Iii) ei due isomeri biologicamente attivi endosulfan I (Endo I) e II (Endo II) presenti nell'endosulfan tecnico. I pesticidi studiati sono insetticidi ad ampio spettro, chimicamente stabili, idrofobici e classificati come inquinanti organici persistenti (POP) dalla Convenzione di Stoccolma 21 .
Protocollo
1. Campionamento di pellicole di plastica
- Prima di entrare nel campo, sciacquare triplicamente tutti i materiali di campionamento richiesti ( ad esempio, pinzette e fogli di alluminio) con acetone o etanolo (99%). Nel caso in cui il materiale non possa essere risciacquato con solvente, scaldare a 450 ° C per una notte in un forno ( ad es. Bicchieri).
NOTA: nelle aree turistiche, ottenere informazioni sulle possibili attività di pulizia della spiaggia che eliminerebbero la maggior parte dei letti marini, incluse le microplastiche. Se possibile, pianificare il campionamento prima di questa operazione. Se il campionamento è effettuato durante la stagione di pulizia, specificare i dettagli di questa attività nel modulo di identità ( ad esempio, date, metodo di pulizia utilizzato, ecc. ) - Indossare guanti, raccogliere pellets di plastica dalla spiaggia con pinzette in acciaio inossidabile solvente.
- Campione da 50 a 100 pellet per posizione, che corrisponde a 5 a 10 repliche per località (10 pellets per replicato). Se non è possibile ottenere il numero di pellets richiestoIned, raccogliere i pellets massimi possibili e specificarlo nella forma di spiaggia di identità.
- Al termine del campionamento, avvolgere i pellet raccolti in foglio di alluminio lavato con solvente. Le bottiglie di vetro possono essere utilizzate come sacchetti di carta alternativi o addirittura di carta.
- Compilare la forma d'identità della spiaggia selezionata con le informazioni mancanti ( vale a dire, la posizione della spiaggia, le condizioni meteorologiche, i dettagli sui pallet, ecc .).
- Trasportare i campioni nel laboratorio in un contenitore di ghiaccio se la temperatura ambiente supera i 25 ° C. Questo passo può essere saltato in caso di corse brevi ( ad esempio, <1 h).
- Una volta in laboratorio, pulire delicatamente le particelle rimuovibili ( ad esempio, sabbia) dei pellet. Se necessario, asciugare i campioni in un essiccatore prima di conservare (tenebre, T <25 ° C). Evitare le stanze in cui potrebbero essere in uso OCP ( ad es., Stoccaggio di soluzioni standard).
- Conservare i pellet nel frigorifero (4 ° C) per brevi periodi ( cioè pochi giorni) oNel congelatore (-18 ° C) per lunghi periodi in foglio di alluminio lavato con solvente.
- Evitare l'esposizione dei campioni alla luce artificiale o alla luce del sole. Maneggiare i campioni il più piccolo possibile prima di analizzare per ridurre il rischio di contaminazione.
2. Estrazione di OCP da pellicole di plastica
- Per ridurre il rischio di contaminazione, lavare in un laboratorio pulito con vetrini lavati accuratamente come segue: 2 risciacqui con acetone di grado analitico, diclorometano e n-esano. Asciugare la vetreria sotto flusso di azoto e proteggere dal contatto con l'aria ambiente ( ad esempio, coprire con foglio di alluminio pulito). Applicare questa procedura di pulizia nelle ulteriori fasi del protocollo ( vale a dire le sezioni 3 e 4).
- Utilizzando le pinzette risciacquate con il solvente, ordinate i pellet per colore nelle seguenti categorie: bianco / trasparente, biancastro / giallastro, giallo / arancio, ambra / marrone e pigmentato ( es. Rosso, verde, blu,
- Raccogli 10 pelletS di colore simile a caso ( cioè tipo di plastica non considerato), che costituirà una replica.
- Pesare il campione su un equilibrio analitico e registrare la massa. A questo punto i campioni possono essere riposti in frigorifero o congelatore.
- Per tener conto della contaminazione di sfondo, eseguire un campione vuoto con ciascuna serie di repliche ( ad esempio, 1 blank per 5 repliche). A tal fine, applicare lo stesso protocollo come descritto in precedenza, ma non aggiungere pellets di plastica nella cella di estrazione. Questo campione vuoto subirà ulteriori passi del protocollo e sarà analizzato insieme ai campioni.
- Accendere il PFE. Scaricare il metodo di estrazione e riscaldare lo strumento a 60 ° C. I dettagli del metodo sono i seguenti:
- Impostare la temperatura a 60 ° C e la pressione a 100 bar.
- Selezionare un ciclo con tempo di riscaldamento di 1 minuto, una durata di 25 minuti e un tempo di scarica di 2 min.
- Impostare il solventeE il gas (N 2 ) riducono i tempi a 3 minuti ciascuno.
- Selezionare n-esano come solvente di estrazione.
- Mentre lo strumento si riscalda, preparare la cella di estrazione come descritto di seguito. Se necessario, adattare il protocollo alle istruzioni del fornitore del proprio strumento:
- Posizionare il filtro inferiore e il frit nella cella di estrazione. Chiudere e trasformarlo.
- Riempire circa la metà della cella con la sabbia di quarzo pulita usando un imbuto.
- Aggiungere il campione pesato ( vale a dire, una replica di 10 pellet). I pellets di plastica congelati devono essere collocati nel frigorifero durante la notte prima dell'estrazione.
- Aggiungere una sabbia di quarzo fino a 1 cm dalla cima della cella. Prestare particolare attenzione a utilizzare sabbia di quarzo ultra-pulito (o in alternativa perle di vetro) in quanto è esposto alle stesse condizioni di estrazione dei campioni. Per pulire la sabbia, estrarla successivamente nel PFE in diclorometano e n-esano di grado analitico, applicando 2 oPiù cicli per solvente ( ad esempio, 30 minuti a 100 ° C sotto i 100 bar). In alternativa, utilizzare un bagno ad ultrasuoni e / o un evaporatore rotante. Se necessario, ripetere la procedura di pulizia.
- Inserire il filtro superiore nella cella e posizionare la cella nello strumento.
- Posizionare i recipienti di raccolta nello strumento e avviare il metodo di estrazione (corsa totale di circa 35 minuti).
- Quando il metodo è completato, svuotare la cella di estrazione in un recipiente di vetro pulito ( ad es. , Bicchiere, piatto di coltura di cellule di vetro) e recuperare i 10 pellet nella sabbia. Conservare in un contenitore fino a ulteriori analisi per l'identificazione di plastica ( ad es. Zip o flaconcino di vetro).
3. Concentrazione e pulizia dell'estratto
- Trasferire l'estratto ottenuto (circa 40 mL) dal recipiente di raccolta in un tubo di vetro e evaporarlo a 1 mL in un concentratore rotante impostato a 35 ° C per 20 minuti. Metodi alternativi potrebbero essere usati suCh come evaporazione sotto flusso di azoto o evaporatore rotante. La temperatura e la durata dovrebbero essere ottimizzati in base a ciò.
- Nel frattempo, preparare l'estrattore a fase solida (SPE) mettendo un tubo di scarico nel rack e una cartuccia riempita con sorbente di silicato di magnesio attivato (1 g) sul collettore nella posizione della valvola chiusa. La pulizia è basata sul metodo EPA 3620C 22 come segue:
- Girare il vuoto alla sorgente e aggiungere 4 ml di esano nella cartuccia per attivare il sorbente.
- Aprire la valvola e lasciare passare il solvente attraverso l'intero letto sorbente. Quindi, chiudere la valvola e permettere al sorbente di immergere in esano per 5 minuti.
- Aprire la valvola e lasciare passare il solvente, ma chiudere la valvola prima che il sorbente si asciughi.
- Quando il campione è concentrato, trasferirlo sulla cartuccia con una pipetta di vetro Pasteur. Aprire delicatamente la valvola e lasciar passare lentamente. 1-2 gocce al secondo èUna velocità adeguata.
- Sciacquare il tubo di vetro contenente l'estratto con 0,5 ml di esano e aggiungerlo alla cartuccia quando l'estratto è passato.
- Quando l'intero solvente è passato, chiudere la valvola e spegnere il vuoto.
- Sostituire il tubo di scarico con un tubo di raccolta e utilizzare un ago pulito del solvente.
- Aggiungere 9 ml di acetone / esano (10/90, v / v) alla cartuccia e accendere il vuoto alla fonte. Lasciare che il sorbente si immerga nel solvente per 1 minuto.
- Aprire la valvola e raccogliere l'intero eluato nel tubo di raccolta.
- Mettere il tubo di raccolta nel concentratore e evaporare il solvente per 9 minuti a 35 ° C per raggiungere 1 mL di eluato.
- Trasferire l'eluato concentrato in una fiala di autosampler ambrata con una pipetta di Pasteur di vetro. A questo punto i campioni possono essere conservati nel congelatore prima dell'analisi.
4. Analisi del Pulito e della ConcentraTed Estratto
- Scaricare il metodo analitico sul software di controllo dello strumento GC-μECD (cromatografo a gas dotato di rivelatore di cattura micro elettronica). I dettagli del metodo sono i seguenti:
- Impostare l'iniettore in modalità splitless, la sua temperatura a 250 ° C e il tempo di spurgo a 1 min.
- Impostare il flusso del gas portante (He) a 1,5 mL min -1 .
- Programmare il forno a colonna con il seguente gradiente di temperatura: 60 ° C per 1 min, rampa di 30 ° C min -1 a 200 ° C, rampa di 5 ° C min -1 a 230 ° C, rampa di 3 ° C min -1 per raggiungere 250 ° C, mantenere questa temperatura per 5 min.
- Impostare la temperatura del rivelatore a 300 ° C e il flusso del gas di salvataggio (N 2 ) a 60 ml min -1 .
- Posizionare il flaconcino contenente il campione (pulito e concentrato) nel rack di autocampionatore e eseguire il metodo (tempo di funzionamento di 23,3 min). io Prelevare 2 μL di campione.
- Dopo l'analisi, individuare i diversi composti sul cromatogramma per i tempi di ritenzione e registrare le aree di picco corrispondenti.
- Tenendo conto dei recuperi (R) e delle aree di picco (A 1 ), calcolare la concentrazione (C 1 ) di ogni OCP nell'estratto utilizzando le equazioni delle curve di calibrazione come segue:
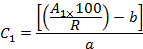
Dove b è l'intercetta all'origine e a è la pendenza dell'equazione di calibrazione,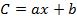
- Tenendo conto della massa (m) del replicato ( cioè 10 pellet, vedi sezione 2.4) e del volume (V) dell'estratto finale ( cioè 1 ml), calcolare la concentrazione (C 2 ) di ogni OCP adsorbita I pellets di plastica ( ossia, ng di OCP per g di pellet di plastica):
/ftp_upload/55531/55531eq3.jpg "/>
5. Identificazione del tipo di plastica
- Trasferite i pellet in un piatto di Petri di vetro e inseriscilo in un sacchetto di plastica.
- Tenere una pellet con le pinzette e tagliare una fetta del pellet con un bisturi. Il sacchetto di plastica impedisce la perdita di pellet durante il processo di taglio.
- Pulire il cristallo di riflessione totale attenuato (ATR) dello strumento FT-IR con etanolo.
- Registrare uno spettro di sfondo.
- Posizionare il frammento sul cristallo ATR e avvitare il portacampione. Il lato interno del pezzo deve essere in contatto con il cristallo.
- Scansionare il campione e registrare lo spettro.
- Identificare il polimero che costituisce il pellet di plastica confrontando lo spettro ottenuto con una libreria di spettri. Anche se più tempo richiede, l'interpretazione degli spettri ottenuti potrebbe essere effettuata manualmente, ma probabilmente senza raggiungere il grado di specificità raggiunto con un mare della bibliotecaRCH.
Risultati
Solitamente si trovano pellets di plastica lungo le linee di alta e bassa marea di spiagge sabbiose ( Figura 1A ). Possono anche attaccarsi ai seagrass appena rannicchiati sulle spiagge, ad esempio dopo una tempesta. Possono essere trovati occasionalmente su spiagge di ciottoli e rocce in aree di accumulo di materiale arrugginito.
I pellets di plastica sono di solito facilmente riconoscibili per l...
Discussione
La maggior parte degli studi incentrati sui contaminanti organici associati ai pellet di plastica si sono basati sui metodi classici di estrazione dei prodotti chimici adsorbiti. L'apparecchiatura Soxhlet è la tecnica più utilizzata con tempi tipici di estrazione che vanno da 12 a 24 h e con alto consumo di solventi organici ( cioè da 100 a 250 ml per estrazione) 23 . Le estrazioni di macerazione richiedono un lungo tempo di contatto tra il campione e il solvente organico ( ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dal programma di cooperazione transfrontaliera IPA 2007-2013, nell'ambito del progetto DeFishGear (1 ° str / 00010).
Materiali
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
Riferimenti
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon