Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Extraction de pesticides organochlorés à partir de granulés en plastique et analyse de type plastique
Dans cet article
Résumé
Les microplastiques agissent comme vecteurs de contaminants organiques potentiellement toxiques avec des effets imprévisibles. Ce protocole décrit une méthodologie alternative pour évaluer les niveaux de pesticides organochlorés adsorbés sur des pastilles en plastique et l'identification de la structure chimique du polymère. L'accent est mis sur l'extraction de fluide sous pression et la spectroscopie infrarouge à transformée de Fourier à réflexion totale atténuée.
Résumé
Les granulés en résine plastique, classés en microplastiques (≤ 5 mm de diamètre), sont des petits granulés qui peuvent être rejetés involontairement dans l'environnement pendant la fabrication et le transport. En raison de leur persistance environnementale, ils sont largement distribués dans les océans et sur les plages du monde entier. Ils peuvent servir de vecteur de composés organiques potentiellement toxiques ( p. Ex., Polychlorobiphényles) et pourraient par conséquent Affecter négativement les organismes marins. Leurs impacts possibles sur la chaîne alimentaire ne sont pas encore bien compris. Afin d'évaluer les dangers associés à l'apparition de granulés de plastique dans le milieu marin, il est nécessaire de développer des méthodologies permettant une détermination rapide des niveaux de contaminants organiques associés. Le présent protocole décrit les différentes étapes requises pour l'échantillonnage des granulés de résine, l'analyse des pesticides organochlorés adsorbés (OCP) et l'identification du type plastique. L'accent est mis surL'extraction d'OCP à partir de granulés de plastique au moyen d'un extracteur de fluide sous pression (PFE) et sur l'analyse chimique du polymère en appliquant la spectroscopie Transformée par Fourier Transformée-InfraRed (FT-IR). La méthodologie développée se concentre sur 11 OCP et les composés apparentés, y compris le dichlorodiphényltrichloroéthane (DDT) et ses deux métabolites principaux, le lindane et deux isomères de production, ainsi que les deux isomères biologiquement actifs de l'endosulfan technique. Ce protocole constitue une alternative simple et rapide à la méthodologie existante pour évaluer la concentration de contaminants organiques adsorbés sur des pièces en plastique.
Introduction
La production mondiale de plastiques augmente continuellement depuis les années 1950 pour atteindre 311 millions de tonnes en 2014, avec environ 40% utilisés dans les emballages 1 . Parallèlement, des quantités croissantes de ces matières s'accumulent dans l'environnement, ce qui pourrait constituer une grave menace pour les écosystèmes 2 . Bien que déjà signalé dans les années 1970, l'apparition de débris plastiques dans le milieu marin n'a reçu qu'une attention accrue au cours de la dernière décennie. Surtout les microplastiques, les fragments plastiques d'un diamètre ≤ 5 mm, sont maintenant reconnus comme l'un des principaux problèmes de qualité de l'eau marine 3 .
Les granulés en résine plastique sont des petits granulés généralement sous la forme d'un cylindre ou d'un disque et d'un diamètre de quelques mm ( par exemple, 2 à 5 mm) 4 , 5 . Ils tombent dans la catégorie des microplastiques. Ces granulés en plastique sontMatière première industrielle à partir de laquelle les produits plastiques finaux sont fabriqués par refoulement et moulage à haute température 6 . Ils peuvent être transmis involontairement à l'environnement pendant la fabrication et le transport. Par exemple, ils peuvent être directement introduits dans l'océan par des déversements accidentels lors de l'expédition 4 , 7 , 8 . Ils peuvent être transportés de la terre à l'océan par écoulement de surface, cours d'eau et rivières. En raison de leur persistance environnementale, les granulés de plastique sont largement distribués dans les océans et se trouvent sur les plages du monde entier 4 . Ils peuvent affecter négativement les organismes marins et peuvent entrer dans la chaîne alimentaire, où leurs effets sont imprévisibles 6 , 7 . En outre, plusieurs études ont révélé la présence de contaminants environnementaux adsorbés sur des granulés de plastique recueillis dans une coastaL environnement, qui jouent le rôle de vecteur de ces produits chimiques potentiellement toxiques 4 , 9 , 10 . En fait, il existe des preuves de laboratoire suggérant que ces produits chimiques peuvent se bioaccumuler dans des tissus d'organismes après avoir été libérés à partir de fragments de plastique 11 , 12 impliqués .
Afin de mieux évaluer les dangers associés à l'apparition de granulés de plastique dans le milieu marin, il est nécessaire de développer des méthodologies qui permettent de déterminer les contaminants organiques absorbés. Une étape importante est l'extraction des produits chimiques à partir des matrices plastiques, qui peuvent présenter des caractéristiques physico-chimiques hétérogènes selon le type de polymère, son stade de dégradation et les prétraites. La plupart des enquêtes rapportées dans la littérature utilisent la macération ou les techniques Soxhlet 4 ,5 , 6 , 9 , 13 , 14 , 15 , 16 , 17 , 18 , qui sont solvants et / ou qui prennent beaucoup de temps. En ce qui concerne l'intérêt croissant pour ce problème, des solutions de rechange devraient être développées, pour une évaluation plus rapide des contaminants organiques adsorbés sur des pièces en plastique. En outre, l'analyse chimique en plastique fournit des informations sur la structure chimique des microplastiques. En conséquence, les types prédominants de polymères et de copolymères présents dans l'environnement peuvent être évalués. Bien que les fragments de plastique soient habituellement en polyéthylène (PE) et en polypropylène (PP) 5 , certains emplacements d'échantillonnage peuvent présenter un profil particulier où d'autres catégories sont représentées de manière significative ( p. Ex. Copolymère éthylène / acétate de vinyleEt le polystyrène (PS)). La spectroscopie FT-IR est une technique fiable et conviviale pour l'identification de polymères couramment utilisée pour identifier les microplastiques 19 , 20 .
L'objectif principal du présent travail est d'offrir une option rapide et simple pour l'extraction d'OCP et de composés apparentés à partir de granulés de plastique au moyen d'un PFE. Cependant, la conception du protocole comprend toutes les étapes menant à la détermination des OCP sèches, de l'échantillonnage des pastilles de résine à l'analyse des composés. Le procédé d'identification du type plastique est également décrit. La méthodologie développée se concentre sur 11 OCP et les composés apparentés: i) DDT (2,4'- et 4,4'-dichlorodiphényltrichloroéthane) et ses deux principaux métabolites DDE (2,4'- et 4,4'-dichlorodiphényldichloroéthylène) et DDD (2,4'- et 4,4'-dichlorodiphényldichloroéthane); Ii) l'isomère gamma-hexachlorocyclohexane (γ-HCH) comme principal ingrédient oF le pesticide lindane et les deux isomères α-HCH et β-HCH libérés lors de sa production 15 ; Iii) et les deux isomères biologiquement actifs endosulfan I (Endo I) et II (Endo II) présents dans l'endosulfan technique. Les pesticides étudiés sont des insecticides à large spectre, chimiquement stables, hydrophobes et classés comme polluants organiques persistants (POP) par la Convention de Stockholm 21 .
Protocole
1. Échantillonnage en pellets en plastique
- Avant d'aller sur le terrain, rincer trois fois tous les matériaux d'échantillonnage nécessaires ( p. Ex., Pinces et feuilles d'aluminium) avec de l'acétone ou de l'éthanol (99%). Dans le cas où le matériau ne peut pas être rincé au solvant, le faire chauffer à 450 ° C pendant la nuit dans un four ( p. Ex. Verrerie).
REMARQUE: Dans les zones touristiques, obtenir des informations sur les activités possibles de nettoyage de la plage qui élimineraient la plupart des déchets marins, y compris les microplastiques. Si possible, planifiez l'échantillonnage avant cette opération. En cas d'échantillonnage pendant la saison de nettoyage, précisez les détails de cette activité dans le formulaire d'identité ( par exemple, les dates, la méthode de nettoyage utilisée, etc. ) - Porter des gants, ramasser des boulettes en plastique de la plage avec des pinces en acier inoxydable rincées au solvant.
- Tirez 50 à 100 pastilles par emplacement, ce qui correspond à 5 à 10 répétitions par emplacement (10 pastilles par réplique). Si le nombre requis de pastilles ne peut pas être obtaIn, recueillez les granulés maximums et spécifiez-le dans la forme de la plage d'identité.
- À la fin de l'échantillonnage, enrouler les granulés collectés dans du papier d'aluminium rincé au solvant. Les bouteilles en verre peuvent être utilisées en alternative ou même en papier.
- Remplissez la forme d'identité de la plage sélectionnée avec les informations manquantes ( c.-à-d. Emplacement de la plage, conditions météorologiques, détails sur les granulés, etc. ).
- Transporter les échantillons au laboratoire dans une glacière si la température ambiante dépasse 25 ° C. Cette étape peut être ignorée dans le cas de voyages courts ( par exemple, <1 h).
- Une fois dans le laboratoire, essuyez doucement les particules amovibles ( par exemple, le sable) des pastilles. Sécher les échantillons si nécessaire dans un dessiccateur avant le stockage (obscurité, T <25 ° C). Évitez les salles où les OCP pourraient être utilisés ( p. Ex., Stockage de solutions standard).
- Conserver les granulés au réfrigérateur (4 ° C) pour de courtes périodes ( c.-à-d. Quelques jours) ouDans le congélateur (-18 ° C) pour des périodes plus longues dans du papier d'aluminium rincé au solvant.
- Évitez l'exposition des échantillons à la lumière artificielle ou à la lumière du soleil. Manipulez les échantillons le moins possible avant analyse afin de réduire le risque de contamination.
2. Extraction d'OCP à partir de granulés en plastique
- Pour réduire le risque de contamination, travaillez dans un laboratoire propre en utilisant des verreries soigneusement lavées comme suit: 2 rinçages avec de l'acétone analytique, du dichlorométhane et du n-hexane. Sécher la verrerie sous flux d'azote et protéger contre le contact avec l'air ambiant ( p. Ex., Recouvrir d'une feuille d'aluminium nettoyée). Appliquer cette procédure de nettoyage dans les autres étapes du protocole ( c.-à-d. Sections 3 et 4).
- À l'aide de pinces à rinçage au solvant, trier les granulés par couleur dans les catégories suivantes: blanc / transparent, blanchâtre / jaunâtre, jaune / orange, ambre / brun et pigmenté ( p. Ex. Rouge, vert, bleu, etc. )
- Rassemblez 10 pastillesS de couleur similaire au hasard ( c'est-à-dire, type plastique non considéré), ce qui constituera une réplique.
- Peser l'échantillon sur un bilan analytique et enregistrer la masse. À ce stade, les échantillons peuvent être remis au réfrigérateur ou au congélateur.
- Pour tenir compte de la contamination du fond, effectuez un échantillon vierge avec chaque ensemble de répétitions ( par exemple, 1 blanc pour 5 répétitions). À cette fin, appliquez le même protocole que décrit ci-dessus, mais n'ajoutez pas de pastilles en plastique dans la cellule d'extraction. Cet échantillon vierge sera soumis à d'autres étapes du protocole et sera analysé avec les échantillons.
- Allumez le PFE. Téléchargez la méthode d'extraction et réchauffez l'instrument à 60 ° C. Les détails de la méthode sont les suivants:
- Réglez la température à 60 ° C et la pression à 100 bar.
- Sélectionnez un cycle avec un temps de chauffage de 1 min, un temps de maintien de 25 minutes et un temps de décharge de 2 min.
- Mettre le solvantEt les temps de chasse de gaz (N 2 ) à 3 min chacun.
- Sélectionnez le n-hexane comme solvant d'extraction.
- Pendant que l'instrument réchauffe, préparez la cellule d'extraction comme décrit ci-dessous. Si nécessaire, adapter le protocole aux instructions du fournisseur de votre instrument:
- Placez le filtre inférieur et la fritte dans la cellule d'extraction. Fermez-le et tournez-le.
- Remplir environ la moitié de la cellule avec du sable quartz nettoyé à l'aide d'un entonnoir.
- Ajouter l'échantillon pesé ( c'est-à-dire une réplique de 10 pastilles). Les granulés de plastique congelés doivent être placés dans le réfrigérateur pendant la nuit avant l'extraction.
- Ajouter du sable à quartz jusqu'à 1 cm du haut de la cellule. Faites particulièrement attention à utiliser du sable de quartz ultra-propre (ou bien des perles de verre) car il est exposé aux mêmes conditions d'extraction que les échantillons. Pour nettoyer le sable, extrairez-le successivement dans le PFE dans du dichlorométhane analytique et du n-hexane, en appliquant 2 ouPlus de cycles par solvant ( par exemple, 30 min à 100 ° C sous 100 bars). Alternativement, utilisez un bain à ultrasons et / ou un évaporateur rotatif. Répétez la procédure de nettoyage, si nécessaire.
- Insérez le filtre supérieur dans la cellule et placez la cellule dans l'instrument.
- Placez les navires collecteurs dans l'instrument et commencez la méthode d'extraction (durée totale d'environ 35 minutes).
- Lorsque la méthode est terminée, vider la cellule d'extraction dans un récipient de verre nettoyé ( par exemple, un bécher, un plat de culture de cellules en verre) et récupérer les 10 granulés dans le sable. Rangez-les dans un récipient jusqu'à une analyse supplémentaire pour l'identification en plastique ( p. Ex., Sac à bandoulière ou flacon en verre).
3. Concentration et nettoyage de l'extrait
- Transférer l'extrait obtenu (environ 40 ml) du récipient collecteur à un tube de verre et l'évaporer à 1 ml dans un concentrateur rotatif réglé à 35 ° C pendant 20 minutes. D'autres méthodes pourraient être utilisées suCh comme évaporation sous débit d'azote ou évaporateur rotatif. La température et la durée doivent être optimisées en conséquence.
- En attendant, préparez l'extracteur en phase solide (SPE) en plaçant un tube à déchets dans le rack et une cartouche remplie d'un sorbant de silicate de magnésium activé (1 g) sur le collecteur dans la position de la soupape de fermeture. Le nettoyage est basé sur la méthode EPA 3620C 22 comme suit:
- Allumez le vide à la source et ajoutez 4 ml d'hexane dans la cartouche pour activer le sorbant.
- Ouvrez la vanne et laissez le solvant traverser tout le lit sorbant. Ensuite, fermez la vanne et laissez le sorbant tremper dans l'hexane pendant 5 min.
- Ouvrez la vanne et laissez le solvant passer, mais fermez la vanne avant que le sorbant ne sèche.
- Lorsque l'échantillon est concentré, transférez-le à la cartouche avec une pipette Pasteur en verre. Ouvrez doucement la vanne et laissez passer lentement. 1-2 gouttes par seconde estUne vitesse appropriée.
- Rincez le tube de verre contenant l'extrait avec 0,5 ml d'hexane et ajoutez-le à la cartouche lorsque l'extrait a traversé.
- Lorsque tout le solvant a traversé, fermez la vanne et éteignez le vide.
- Remplacez le tube à déchets par un tube collecteur et utilisez une aiguille de guidage pour solvant propre.
- Ajouter 9 ml d'acétone / hexane (10/90, v / v) sur la cartouche et allumer l'aspirateur à la source. Permettre au sorbant de tremper dans le solvant pendant 1 min.
- Ouvrir la soupape et collecter l'éluat entier dans le tube collecteur.
- Placer le tube collecteur dans le concentrateur et évaporer le solvant pendant 9 min à 35 ° C pour atteindre 1 ml d'éluat.
- Transférer l'éluat concentré dans un flacon auto-échantillonneur ambré avec une pipette Pasteur en verre. À ce stade, les échantillons peuvent être stockés dans le congélateur avant l'analyse.
4. Analyse du Cleaned et du ConcentraExtrait
- Téléchargez la méthode analytique sur le logiciel de contrôle de l'instrument GC-μECD (chromatographe à gaz équipé d'un détecteur de capture micro-électron). Les détails de la méthode sont les suivants:
- Réglez l'injecteur en mode sans fraction, sa température à 250 ° C et le temps de purge à 1 min.
- Réglez le débit du gaz porteur (He) à 1,5 mL min -1 .
- Programmer le four à colonne avec le gradient de température suivant: 60 ° C maintenir pendant 1 min, rampe de 30 ° C min -1 à 200 ° C, rampe de 5 ° C min -1 à 230 ° C, rampe de 3 ° C min -1 pour atteindre 250 ° C, maintenez cette température pendant 5 min.
- Réglez la température du détecteur à 300 ° C et le flux de gaz de secours (N 2 ) à 60 ml min -1 .
- Placez le flacon contenant l'échantillon (nettoyé et concentré) dans le rack d'échantillonnage automatique et exécutez la méthode (temps de fonctionnement de 23,3 min). je Njectif 2 μl d'échantillon.
- Après l'analyse, identifiez les différents composés sur le chromatogramme par leur temps de rétention et enregistrez les zones de pointe correspondantes.
- Compte tenu des récupérations (R) et des zones de pointe (A 1 ), calculer la concentration (C 1 ) de chaque OCP dans l'extrait en utilisant les équations des courbes d'étalonnage comme suit:
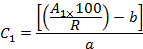
Où b est l'interception à l'origine et a est la pente de l'équation d'étalonnage,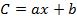
- En tenant compte de la masse (m) de la réplique ( c.-à-d., 10 pastilles, voir la section 2.4) et du volume (V) de l'extrait final ( c.-à-d. 1 mL), calculer la concentration (C 2 ) de chaque OCP adsorbé Les pastilles en plastique ( c.-à-d., Ng d'OCP par g de pastille de plastique):
/ftp_upload/55531/55531eq3.jpg "/>
5. Identification du type de plastique
- Transférez les pastilles dans une boîte en Pétri en verre et placez-la dans un sac en plastique.
- Tenir une pastille avec une pincette et couper une coupe de la pastille avec un scalpel. Le sac en plastique empêche la perte de pastilles pendant le processus de coupe.
- Nettoyez le cristal de réflectance totale atténué (ATR) de l'instrument FT-IR avec de l'éthanol.
- Enregistrez un spectre de fond.
- Placez le fragment sur le cristal ATR et visser le porte-échantillon. Le côté intérieur de la pièce doit être en contact avec le cristal.
- Scannez l'échantillon et enregistrez le spectre.
- Identifier le polymère constituant la pastille de plastique en comparant le spectre obtenu à une bibliothèque de spectres. Bien que plus longue, l'interprétation des spectres obtenus pourrait également être effectuée manuellement, mais sans doute sans atteindre le degré de spécificité atteint avec une bibliothèque de la merRch.
Résultats
Les granulés en plastique se trouvent habituellement le long des lignes de marée haute et basse des plages de sable ( figure 1A ). Ils peuvent également s'en tenir à des graminées fraîches sur les plages, par exemple après une tempête. On les trouve occasionnellement sur les galets et les plages pierreuses dans les zones d'accumulation de matériaux échoués.
Les granulés en plas...
Discussion
La plupart des études portant sur les contaminants organiques associés aux granulés de plastique reposent sur des méthodes classiques d'extraction des produits chimiques adsorbés. L'appareil Soxhlet est la technique la plus utilisée avec des temps d'extraction typiques allant de 12 à 24 h et avec une forte consommation de solvants organiques ( c.-à-d. De 100 à 250 mL par extraction) 23 . Les extractions de macération nécessitent un long temps de contact entre...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été financé par le programme de coopération transfrontalière Adriatique 2007-2013 de l'IPA, dans le cadre du projet DeFishGear (1 ° str / 00010).
matériels
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
Références
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon