Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Extracción de plaguicidas organoclorados de pellets de plástico y análisis de tipos de plástico
En este artículo
Resumen
Los microplásticos actúan como vector de contaminantes orgánicos potencialmente tóxicos con efectos impredecibles. Este protocolo describe una metodología alternativa para evaluar los niveles de plaguicidas organoclorados adsorbidos en los gránulos de plástico e identificar la estructura química del polímero. El foco está en la extracción de fluido presurizado y en la reflectancia total atenuada de la transformada de Fourier espectroscopía infrarroja.
Resumen
Los gránulos de resina plástica, categorizados como microplásticos (≤ 5 mm de diámetro), son pequeños gránulos que pueden liberarse involuntariamente al medio ambiente durante la fabricación y el transporte. Debido a su persistencia ambiental, están ampliamente distribuidos en los océanos y en las playas de todo el mundo. Pueden actuar como un vector de compuestos orgánicos potencialmente tóxicos ( por ejemplo, bifenilos policlorados) y, en consecuencia, podrían Afectan negativamente a los organismos marinos. Sus posibles repercusiones a lo largo de la cadena alimentaria aún no se conocen bien. Con el fin de evaluar los peligros asociados con la aparición de pellets de plástico en el medio marino, es necesario desarrollar metodologías que permitan una rápida determinación de los niveles de contaminantes orgánicos asociados. El presente protocolo describe los diferentes pasos requeridos para el muestreo de gránulos de resina, el análisis de plaguicidas organoclorados adsorbidos (OCP) e identificación del tipo de plástico. El foco está enLa extracción de OCP de gránulos de plástico por medio de un extractor de fluido presurizado (PFE) y sobre el análisis químico de polímeros aplicando la espectroscopía de Fourier Transform-InfraRed (FT-IR). La metodología desarrollada se centra en 11 OCPs y compuestos relacionados, incluyendo el diclorodifeniltricloroetano (DDT) y sus dos principales metabolitos, el lindano y dos isómeros de producción, así como los dos isómeros biológicamente activos del endosulfán técnico. Este protocolo constituye una alternativa simple y rápida a la metodología existente para evaluar la concentración de contaminantes orgánicos adsorbidos en piezas de plástico.
Introducción
La producción mundial de plásticos está aumentando continuamente desde los años 50 para llegar a 311 millones de toneladas en 2014, con alrededor del 40% en envases 1 . Paralelamente, se están acumulando cantidades cada vez mayores de estos materiales en el medio ambiente, lo que podría suponer una grave amenaza para los ecosistemas 2 . Aunque ya se informó en la década de 1970, la aparición de desechos plásticos en el medio marino sólo ha recibido una mayor atención en la última década. Especialmente los microplásticos, fragmentos de plástico con un diámetro de ≤ 5 mm, se reconocen ahora como uno de los principales problemas de calidad del agua marina 3 .
Los gránulos de resina plástica son pequeños gránulos generalmente en forma de cilindro o disco y con un diámetro de unos pocos mm ( por ejemplo, de 2 a 5 mm) 4 , 5 . Caen en la categoría de microplásticos. Estos gránulos de plásticoMateria prima industrial a partir de la cual se fabrican los productos finales de plástico mediante refundición y moldeado a alta temperatura 6 . Pueden liberarse involuntariamente al medio ambiente durante la fabricación y el transporte. Por ejemplo, pueden ser introducidos directamente al océano a través de derrames accidentales durante el envío 4 , 7 , 8 . Pueden ser llevados de la tierra a los océanos por la escorrentía superficial, los arroyos y los ríos. Debido a su persistencia ambiental, los pellets de plástico están ampliamente distribuidos en los océanos y se encuentran en las playas de todo el mundo 4 . Pueden afectar negativamente a los organismos marinos y pueden entrar en la cadena alimentaria, donde sus efectos son impredecibles 6 , 7 . Además, varios estudios han revelado la presencia de contaminantes ambientales adsorbidos sobre los gránulos de plástico recogidos en una coastaL ambiente, que actúan como vector de estos productos químicos potencialmente tóxicos 4 , 9 , 10 . De hecho, existen pruebas de laboratorio que sugieren que estos productos químicos pueden bioacumularse en tejidos de organismos después de haber sido liberados de los fragmentos de plástico ingeridos 11 , 12 .
Con el fin de evaluar mejor los peligros asociados con la aparición de pellets de plástico en el medio marino, es necesario desarrollar metodologías que puedan determinar contaminantes orgánicos sorbidos. Un paso importante es la extracción de las sustancias químicas de las matrices plásticas, que pueden presentar características físico-químicas heterogéneas dependiendo del tipo de polímero, su etapa de degradación y pretratamientos. La mayoría de las investigaciones reportadas en la literatura usan maceración o técnicas de Soxhlet 4 ,5 , 6 , 9 , 13 , 14 , 15 , 16 , 17 , 18 , que son disolventes y / o consumen tiempo. En cuanto al creciente interés por este tema, se deben desarrollar alternativas para una evaluación más rápida de contaminantes orgánicos adsorbidos en piezas de plástico. Además, el análisis químico de plástico proporciona información sobre la estructura química de los microplásticos. Como resultado, se pueden evaluar los tipos predominantes de polímeros y copolímeros presentes en el medio ambiente. Aunque los fragmentos de plástico están habitualmente hechos de polietileno (PE) y polipropileno (PP) 5 , algunas ubicaciones de muestreo pueden presentar un perfil particular en el que otras categorías están representadas de manera significativa ( por ejemplo, copolímero de etileno / acetato de viniloY poliestireno (PS)). La espectroscopia FT-IR es una técnica fiable y fácil de usar para la identificación de polímeros comúnmente utilizada para identificar microplásticos 19 , 20 .
El objetivo principal del presente trabajo es ofrecer una opción rápida y sencilla para la extracción de OCPs y compuestos relacionados a partir de pellets de plástico mediante un PFE. Sin embargo, el diseño del protocolo incluye todas las etapas que conducen a la determinación de OCPs sorbidas, desde el muestreo de los gránulos de resina hasta el análisis de los compuestos. También se describe el método de identificación del tipo de plástico. La metodología desarrollada se centra en 11 OCPs y compuestos relacionados: i) DDT (2,4'- y 4,4'-diclorodifeniltricloroetano) y sus dos principales metabolitos DDE (2,4'- y 4,4'-diclorodifenildicloroetileno) y DDD (2,4'- y 4,4'-diclorodifenildicloroetano); Ii) el isómero gamma-hexaclorociclohexano (γ-HCH) como ingrediente principal oF el plaguicida lindano y los dos isómeros α-HCH y β-HCH liberados durante su producción 15 ; Iii) y los dos isómeros biológicamente activos endosulfán I (Endo I) y II (Endo II) presentes en el endosulfán técnico. Los plaguicidas estudiados son insecticidas de amplio espectro, químicamente estables, hidrófobos y clasificados como contaminantes orgánicos persistentes (COP) por el Convenio de Estocolmo 21 .
Protocolo
1. Muestreo de pellets de plástico
- Antes de ir al campo, enjuague tres veces todos los materiales de muestreo requeridos ( por ejemplo, pinzas y papel de aluminio) con acetona o etanol (99%). En caso de que el material no pueda ser enjuagado con disolvente, caliéntelo a 450 ° C durante la noche en un horno ( por ejemplo, cristalería).
NOTA: En áreas turísticas, obtenga información sobre posibles actividades de limpieza de playas que eliminen la mayor parte de la basura marina incluyendo microplásticos. Si es posible, planifique el muestreo antes de esta operación. Si el muestreo durante la temporada de limpieza, especifique los detalles de esta actividad en el formulario de identidad ( por ejemplo, fechas, método de limpieza utilizado, etc. ) - Usando guantes, recoja bolitas de plástico de la playa con pinzas de acero inoxidable con enjuague con disolvente.
- Muestra de 50 a 100 gránulos por ubicación, lo que corresponde a 5 a 10 repeticiones por ubicación (10 gránulos por repetición). Si el número requerido de pellets no puede ser obtaRecoger el máximo de pellets posible y especificarlo en la forma de playa de identidad.
- Al final del muestreo, envuelva los gránulos recogidos en papel de aluminio lavado con disolvente. Las botellas de vidrio se pueden utilizar como una alternativa o incluso bolsas de papel.
- Rellene el formulario de identidad de la playa seleccionada con la información que falta ( es decir, la ubicación de la playa, las condiciones meteorológicas, detalles sobre pellets, etc. ).
- Transportar las muestras al laboratorio en una nevera si la temperatura ambiente supera los 25 ° C. Este paso se puede omitir en el caso de viajes cortos ( por ejemplo, <1 h).
- Una vez en el laboratorio, limpie suavemente las partículas removibles ( por ejemplo, arena) de los gránulos. Secar las muestras si es necesario en un desecador antes del almacenamiento (oscuridad, T <25 ° C). Evite las salas en las que se puedan utilizar OCP ( por ejemplo, almacenamiento de soluciones estándar).
- Guarde los gránulos en el frigorífico (4 ° C) por períodos cortos ( es decir, unos pocos días) oEn el congelador (-18 ° C) durante períodos más largos en papel de aluminio lavado con disolvente.
- Evite la exposición de las muestras a luz artificial o luz solar. Maneje las muestras lo menos posible antes del análisis para disminuir el riesgo de contaminación.
2. Extracción de OCPs de Pellets de Plástico
- Para reducir el riesgo de contaminación, trabaje en un laboratorio limpio usando cristalería cuidadosamente lavada de la siguiente manera: 2 enjuagues con acetona de grado analítico, diclorometano y n-hexano. Secar los cristales bajo flujo de nitrógeno y protegerlos del contacto con el aire ambiente ( por ejemplo, cubrir con papel de aluminio limpiado). Aplique este procedimiento de limpieza en los pasos adicionales del protocolo ( es decir, las secciones 3 y 4).
- Utilizando pinzas con enjuague con disolvente, clasifique los gránulos por color en las siguientes categorías: blanco / transparente, blanquecino / amarillento, amarillo / naranja, ámbar / marrón y pigmentado ( por ejemplo, rojo, verde, azul, etc. )
- Reúna 10 pelletsS de color similar aleatoriamente ( es decir, tipo plástico no considerado), que constituirán una réplica.
- Pesar la muestra sobre una balanza analítica y registrar la masa. En esta etapa, las muestras se pueden volver a colocar en la nevera o en el congelador.
- Para tener en cuenta la contaminación de fondo, realice una muestra en blanco con cada conjunto de repeticiones ( por ejemplo, 1 en blanco para 5 repeticiones). Para ello, aplique el mismo protocolo que el descrito anteriormente, pero no añada pastillas de plástico en la celda de extracción. Esta muestra en blanco experimentará las etapas adicionales del protocolo y se analizará junto con las muestras.
- Encienda el PFE. Descargue el método de extracción y caliente el instrumento a 60 ° C. Los detalles del método son los siguientes:
- Ajuste la temperatura a 60 ° C y la presión a 100 bar.
- Seleccione un ciclo con tiempo de calentamiento de 1 min, un tiempo de espera de 25 min y un tiempo de descarga de 2 min.
- Establecer el disolventeY el gas (N $ ₂ $) durante 3 min cada uno.
- Seleccione n-hexano como disolvente de extracción.
- Mientras el instrumento se está calentando, prepare la celda de extracción como se describe a continuación. Si es necesario, adapte el protocolo a las instrucciones del proveedor de su instrumento:
- Coloque el filtro inferior y la frita en la celda de extracción. Cierre y vuelva a girar.
- Llenar aproximadamente la mitad de la celda con arena de cuarzo limpiada utilizando un embudo.
- Añadir la muestra pesada ( es decir, una repetición de 10 gránulos). Las pastillas de plástico congeladas deben colocarse en la nevera durante la noche antes de la extracción.
- Añadir arena de cuarzo hasta 1 cm desde la parte superior de la celda. Tenga especial cuidado de utilizar arena de cuarzo limpio de ultra (o alternativamente perlas de vidrio), ya que está expuesta a las mismas condiciones de extracción como las muestras. Para limpiar la arena, sucesivamente extraerlo en el PFE en diclorometano de grado analítico y n-hexano, la aplicación de 2 oMás ciclos por disolvente ( por ejemplo, 30 min a 100ºC bajo 100 bar). Alternativamente, utilice un baño de ultrasonidos y / o un evaporador rotatorio. Repita el procedimiento de limpieza, si es necesario.
- Inserte el filtro superior en la celda y coloque la celda en el instrumento.
- Colocar los recipientes de recogida en el instrumento e iniciar el método de extracción (duración total de aproximadamente 35 minutos).
- Cuando el método se haya completado, vacíe la celda de extracción en un recipiente de vidrio limpiado ( por ejemplo, un vaso de precipitados, un recipiente de cultivo de células de vidrio) y recupere los 10 gránulos en la arena. Guárdelos en un recipiente hasta que se analice más para la identificación de plástico ( por ejemplo, una bolsa de cremallera o vial de vidrio).
3. Concentración y limpieza del extracto
- Transferir el extracto obtenido (aproximadamente 40 ml) del recipiente colector a un tubo de vidrio y evaporarlo a 1 ml en un concentrador rotatorio fijado a 35ºC durante 20 min. Se podrían utilizar métodos alternativosCh como evaporación bajo flujo de nitrógeno o evaporador rotativo. La temperatura y la duración deben ser optimizadas en consecuencia.
- Mientras tanto, prepare el extractor de fase sólida (SPE) colocando un tubo de desecho en la rejilla y un cartucho lleno con sorbente de silicato de magnesio activado (1 g) en el colector en la posición de válvula cerrada. La limpieza se basa en el método EPA 3620C 22 como sigue:
- Encienda el vacío en la fuente y agregue 4 mL de hexano en el cartucho para activar el sorbente.
- Abra la válvula y deje que el disolvente pase a través de todo el lecho sorbente. Luego, cierre la válvula y deje que el sorbente se remoje en hexano durante 5 min.
- Abra la válvula y deje pasar el disolvente, pero cierre la válvula antes de que el sorbente se seque.
- Cuando la muestra esté concentrada, transfiérala al cartucho con una pipeta Pasteur de vidrio. Abra suavemente la válvula y déjela pasar lentamente. 1-2 gotas por segundo esUna velocidad adecuada.
- Enjuague el tubo de vidrio que contiene el extracto con 0,5 ml de hexano y agréguelo al cartucho cuando el extracto haya pasado.
- Cuando todo el disolvente haya pasado, cierre la válvula y apague el vacío.
- Reemplace el tubo de desecho por un tubo colector y utilice una aguja de guía solvente limpia.
- Añadir 9 mL de acetona / hexano (10/90, v / v) al cartucho y activar el vacío en la fuente. Dejar que el sorbente se remoje en el disolvente durante 1 min.
- Abra la válvula y recoja todo el eluido en el tubo colector.
- Colocar el tubo de recogida en el concentrador y evaporar el disolvente durante 9 minutos a 35 ° C con el fin de alcanzar 1 ml de eluido.
- Transferir el concentrado de eluato en un frasco ampolla autoamplificador con una pipeta Pasteur de vidrio. En esta etapa, las muestras pueden almacenarse en el congelador antes del análisis.
4. Análisis de la limpieza y concentraciónExtracto
- Descargue el método analítico en el software de control del instrumento GC-μECD (cromatógrafo de gases equipado con un detector de captura de microelectrones). Los detalles del método son los siguientes:
- Ponga el inyector en modo splitless, su temperatura a 250 ° C, y el tiempo de purga a 1 min.
- Ajuste el flujo del gas portador (He) a 1,5 ml min -1 .
- Programar el horno de columna con el siguiente gradiente de temperatura: 60 ° C durante 1 min, rampa de 30 ° C min -1 a 200 ° C, rampa de 5 ° C min -1 a 230 ° C, rampa de 3 ° C min -1 para alcanzar 250 ° C, mantenga esta temperatura durante 5 min.
- Ajuste la temperatura del detector a 300 ° C y el flujo de gas de respaldo (N2) a 60 ml min -1 .
- Coloque el vial que contiene la muestra (limpiado y concentrado) en el bastidor automático y ejecute el método (tiempo de funcionamiento de 23,3 min). yo Inyectar 2 μl de muestra.
- Después del análisis, identificar los diferentes compuestos en el cromatograma por sus tiempos de retención y registrar las áreas de los picos correspondientes.
- Teniendo en cuenta las recuperaciones (R) y las áreas de los picos (A 1 ), calcule la concentración (C 1 ) de cada OCP en el extracto usando las ecuaciones de las curvas de calibración como sigue:
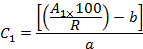
Donde b es la intersección en el origen y a es la pendiente de la ecuación de calibración,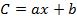
- Teniendo en cuenta la masa (m) del replicado ( es decir, 10 gránulos, ver sección 2.4) y el volumen (V) del extracto final ( es decir, 1 ml), calcule la concentración (C 2 ) de cada OCP adsorbida en Los gránulos de plástico ( es decir, ng de OCP por g de pellet de plástico):
/ftp_upload/55531/55531eq3.jpg "/>
5. Identificación de tipo de plástico
- Transferir los pellets en una placa de Petri de vidrio y colocarlo en una bolsa de plástico.
- Sostenga un pellet con pinzas y corte una rebanada del pellet con un bisturí. La bolsa de plástico evita la pérdida de pellets durante el proceso de corte.
- Limpie el cristal de reflectancia total atenuada (ATR) del instrumento FT-IR con etanol.
- Registre un espectro de fondo.
- Coloque el fragmento en el cristal ATR y atornille el soporte de la muestra. El lado interior de la pieza debe estar en contacto con el cristal.
- Escanee la muestra y grabe el espectro.
- Identificar el polímero que constituye la pastilla de plástico comparando el espectro obtenido con una biblioteca de espectros. Aunque con mayor tiempo, la interpretación de los espectros obtenidos podría llevarse a cabo manualmente también, pero muy probablemente sin llegar al grado de especificidad logrado con un mar de bibliotecaRch
Resultados
Los pellets de plástico suelen encontrarse a lo largo de las líneas de marea alta y baja de las playas arenosas ( Figura 1A ). También pueden pegarse a la hierba marina recién trenzada en las playas, después de una tormenta, por ejemplo. En ocasiones se pueden encontrar en playas de guijarros y piedras en áreas de acumulación de material trenzado.
Los gránulos de plástico suelen ser fáci...
Discusión
La mayoría de los estudios centrados en los contaminantes orgánicos asociados a los gránulos de plástico se han basado en métodos clásicos de extracción de los productos químicos adsorbidos. El aparato Soxhlet es la técnica más utilizada, con tiempos de extracción típicos de 12 a 24 h y con alto consumo de disolventes orgánicos ( es decir, de 100 a 250 ml por extracción) 23 . Las extracciones de maceración requieren un largo tiempo de contacto entre la muestra y el d...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Programa de Cooperación Transfronteriza Adriática del IPA 2007-2013, dentro del proyecto DeFishGear (1 ° str / 00010).
Materiales
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
Referencias
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados