このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
プラスチックペレットからの有機塩素系農薬の抽出と塑性解析
要約
マイクロプラスチックは、予想外の影響を及ぼす可能性のある有害な有機汚染物質のベクターとして機能します。このプロトコルは、プラスチックペレットに吸着された有機塩素系農薬のレベルを評価し、ポリマーの化学構造を特定するための代替方法論を記述しています。焦点は、加圧された液体抽出および減衰された全反射率フーリエ変換赤外分光法にある。
要約
マイクロプラスチック(直径5mm以下)に分類されるプラスチック樹脂ペレットは、製造および輸送中に意図せずに環境に放出される可能性のある小さな顆粒です。彼らの環境の永続性のために、彼らは世界中の海と海岸に広く分布しています。それらは、潜在的に有毒な有機化合物( 例えば、ポリ塩化ビフェニル)のベクターとして作用することができ、結果として 海洋生物に悪影響を及ぼす。食物連鎖に及ぼす可能性のある影響は、まだよく理解されていません。海洋環境でのプラスチックペレットの発生に伴う危険を評価するためには、関連する有機汚染レベルの迅速な決定を可能にする方法を開発することが必要である。現在の議定書は、樹脂ペレットのサンプリング、吸着された有機塩素系農薬(OCP)の分析、およびプラスチックタイプの特定に必要なさまざまなステップを記述しています。焦点は上にある加圧流体抽出器(PFE)によるプラスチックペレットからのOCPの抽出、およびフーリエ変換赤外分光法(FT-IR)分光法を用いたポリマー化学分析である。開発された方法論は、ジクロロジフェニルトリクロロエタン(DDT)およびその2つの主な代謝産物、リンダンおよび2つの生成異性体、ならびに技術的エンドスルファンの2つの生物学的に活性な異性体を含む、11のOCPおよび関連化合物に焦点を当てている。このプロトコルは、プラスチック片に吸着された有機汚染物質の濃度を評価するための既存の方法論に対する単純かつ迅速な代替物を構成する。
概要
世界のプラスチック生産量は1950年代から2014年に311百万トンに達しており、パッケージングには約40%が使用されています1 。並行して、これらの物質の量が増えているため、生態系に深刻な脅威を与える可能性があります2 。 1970年代には既に報告されているが、海洋環境でのプラスチックの破片の発生は過去10年間で大きな注目を集めているに過ぎない。特に、直径5mm以下のプラスチック小片であるマイクロプラスチックは、海洋の主要な水質問題の1つとして認識されています3 。
プラスチック樹脂ペレットは、一般にシリンダーまたはディスクの形状をし、数mm( 例えば、 2〜5mm)の直径を有する小さな顆粒である。彼らはマイクロプラスチックのカテゴリーに入る。これらのプラスチック顆粒は、最終的なプラスチック製品が高温で再溶融および成形によって製造される工業用原料。それらは、製造および輸送中に意図せず環境に放出される可能性がある。例えば、船積み中に偶発的な流出によって海洋に直接導入される可能性があります(4,7,8)。それらは、地表流出、河川、河川によって陸上から海洋に運ぶことができます。環境保全のために、プラスチックのペレットは海洋に広く分布し、世界中のビーチで発見されています4 。それらは海洋生物に悪影響を及ぼし、その影響が予測不可能な食物連鎖に入る可能性があります6,7 。さらに、いくつかの研究は、沿岸に集められたプラスチックペレットに吸着された環境汚染物質の存在を明らかにしているこれらの潜在的に有毒な化学物質4,9,10のベクターとして作用する。実際に、これらの化学物質は、摂取されたプラスチックの断片から放出された後、生物の組織内で生物蓄積する可能性があることを示唆する実験室の証拠がある11,12 。
海洋環境におけるプラスチックペレットの発生に関連する危険性をよりよく評価するためには、吸着された有機汚染物質を決定する方法を開発する必要がある。重要なステップは、ポリマータイプ、その分解段階、および前処理に依存して、不均一な物理化学的特性を示すことができるプラスチックマトリックスからの化学物質の抽出である。文献で報告された調査の大部分は、浸軟またはソックスレー法を用いている4 、溶媒および/または時間がかかる1,2,3,4,5,6,9,13,14,15,16,17,18の化合物である。この問題に対する関心が高まるにつれ、プラスチック片に吸着された有機汚染物質の迅速な評価のための代替策が開発されるべきである。さらに、プラスチック化学分析は、マイクロプラスチックの化学構造に関する情報を提供する。その結果、環境中に存在する主要な種類のポリマーおよびコポリマーを評価することができる。プラスチック断片は通常ポリエチレン(PE)とポリプロピレン(PP) 5で作られているが、いくつかのサンプリング位置は他のカテゴリーが顕著に示されている特定のプロファイルを示すことができる( 例えば、エチレン/酢酸ビニルコポリマーおよびポリスチレン(PS))を含む。 FT-IR分光法は、マイクロプラスチック19,20の識別に一般的に使用されるポリマー同定のための、信頼性が高く使いやすい技術です。
本研究の主な目的は、PFEを用いてプラスチックペレットからOCPおよび関連化合物を抽出するための迅速かつ簡単な選択肢を提供することである。しかし、プロトコールの設計には、樹脂ペレットのサンプリングから化合物の分析までの収着OCPの決定につながるすべてのステップが含まれる。プラスチックタイプの識別方法についても説明します。 i)DDT(2,4'-および4,4'-ジクロロジフェニルトリクロロエタン)およびその2つの主要な代謝産物DDE(2,4'-および4,4'-ジクロロジフェニルジクロロエチレン)およびDDD (2,4'-および4,4'-ジクロロジフェニルジクロロエタン); ii)異性体γ-ヘキサクロロシクロヘキサン(γ-HCH)を主成分とする。f殺虫剤リンダンおよびその製造中に放出される2つの異性体α-HCHおよびβ-HCH; iii)および工業的エンドスルファンに存在する2種の生物活性異性体エンドスルファンI(Endo I)およびII(Endo II)。調査された農薬は、ストックホルム条約21により広域スペクトルの殺虫剤であり、化学的に安定で疎水性であり、持続的有機汚染物質(POPs)として分類されている。
プロトコル
1.プラスチックペレットサンプリング
- 現場に行く前に、アセトンやエタノール(99%)で必要なすべてのサンプリング材料(ピンセットやアルミホイルなど)を3回すすいでください。材料を溶剤ですすぐことができない場合は、オーブン( 例:ガラス器具)で450℃で一晩加熱します。
注記:観光地では、マイクロプラスチックを含む海洋廃棄物のほとんどを除去する可能性のあるビーチクリーニング活動についての情報を入手してください。可能であれば、この操作の前にサンプリングを計画してください。クリーンアップシーズンにサンプリングする場合は、このアクティビティの詳細をIDフォームで指定します(日付、使用されたクリーンアップメソッドなど ) - 手袋を着用し、溶剤ですすいだステンレスピンセットでプラスチックペレットをビーチから回収する。
- 1箇所あたり50〜100個のペレットをサンプルし、これは1箇所あたり5〜10個の複製に相当する(1回のペレットあたり1個のペレット)。ペレットの必要数がobtaでない場合可能な限り最大のペレットを採取し、アイデンティティビーチのフォームで指定します。
- サンプリングの最後に、回収したペレットを溶剤ですすいだアルミニウム箔に包みます。ガラスびんは、代わりに紙袋として使用することもできます。
- 選択されたビーチのアイデンティティフォームに欠落した情報(ビーチの場所、天候、ペレットの詳細など )を入力します。
- 周囲温度が25℃を超える場合、サンプルを実験室に移送してください。このステップは、短いトリップ( 例えば、 1時間未満)の場合はスキップすることができる。
- 実験室に入ったら、ペレットの除去可能な粒子( 例えば、砂)を静かに拭き取ってください。保存の前にデシケーターで必要ならばサンプルを乾燥させる(暗さ、T <25℃)。 OCPが使用されている可能性のある部屋(標準的なソリューションの保管など)は避けてください。
- ペレットを冷蔵庫(4℃)に短期間( すなわち数日)保管するか、冷凍庫(-18℃)で、溶剤ですすいだアルミニウム箔の中で長期間放置してください。
- サンプルを人工光または日光に当てないでください。分析の前にサンプルをできるだけ少なく処理して、コンタミネーションのリスクを減らしてください。
プラスチックペレットからのOCPの抽出
- 汚染の危険性を減らすために、慎重に洗浄したガラス器具を使用して、次のように清潔な実験室で作業してください。分析用アセトン、ジクロロメタンおよびn-ヘキサンで2回洗浄します。窒素気流下でガラス製品を乾燥させ、周囲空気との接触から保護する( 例えば、清浄なアルミニウムホイルで覆う)。この洗浄手順をプロトコルのさらなるステップ( すなわち、セクション3およびセクション4)に適用する。
- 溶媒ですすがれたピンセットを使用して、ペレットを白色/透明、白/黄、黄/オレンジ、琥珀/茶、色素( 例:赤、緑、青など )の色でソートします。
- ペレットを10個集める( すなわち、プラスチックタイプは考慮されていない)、これは1つの複製を構成する。
- サンプルを分析天秤で計量し、質量を記録する。この段階で、サンプルを冷蔵庫または冷凍庫に戻すことができます。
- バックグラウンドの混入を考慮に入れるために、複製の各セット( 例えば、 5つの複製に対して1つのブランク)でブランクサンプルを実施する。この目的のために、上記と同じプロトコールを適用するが、抽出細胞にプラスチックペレットを添加しない。このブランクサンプルはプロトコルのさらなるステップを経て、サンプルと共に分析される。
- PFEのスイッチを入れます。抽出方法をダウンロードし、装置を60℃に温める。メソッドの詳細は次のとおりです。
- 温度を60℃に、圧力を100バールに設定します。
- 昇温時間1分、保持時間25分、放電時間2分のサイクルを1サイクル選択します。
- 溶媒を設定するガス(N 2 )をそれぞれ3分ずつ流す。
- 抽出溶媒としてn-ヘキサンを選択する。
- 機器がウォームアップしている間、下記のように抽出セルを準備します。必要に応じて、機器のサプライヤの指示にプロトコルを適合させます。
- 底部フィルターおよびフリットを抽出セルに入れる。それを閉じて、それを裏返しにします。
- 漏斗を使用して清浄な石英砂で細胞の約半分を満たす。
- 秤量したサンプル( すなわち、 10個のペレットの1つの複製)を加える。凍結したプラスチックペレットは、抽出する前に冷蔵庫に一晩置かなければならない。
- 石英砂をセルの上部から1cmまで追加します。超清浄な石英砂(または代替的にガラスビーズ)は、サンプルと同じ抽出条件に曝されるので、特に注意してください。砂を洗浄するには、分析級のジクロロメタンおよびn-ヘキサン中でPFE中で連続的に抽出し、2または溶媒あたりより多くのサイクル( 例えば 100バールで100℃ で 30分)。あるいは、超音波浴および/または回転蒸発器を使用する。必要に応じて、クリーニング手順を繰り返します。
- 上部のフィルターをセルに挿入し、セルを装置に置きます。
- 収集容器を装置に置き、抽出方法を開始する(約35分間の合計運転)。
- 方法が完了したら、洗浄したガラス容器( 例えば、ビーカー、ガラス細胞培養皿)中の抽出細胞を空にし、砂中の10個のペレットを回収する。プラスチック識別( 例えば、ジップバッグまたはガラスバイアル)のためにさらに分析するまで容器に保管してください。
3.抽出物の濃縮および浄化
- 得られた抽出液(約40mL)を採取容器からガラス管に移し、35℃に設定した回転濃縮器で20分間1mLまで蒸発させる。別の方法を使用することもできますchを窒素気流または回転蒸発器で蒸発させた。それに応じて温度と時間を最適化する必要があります。
- その間、廃棄チューブをラックに設置し、活性化マグネシウムシリケート吸着剤(1g)を充填したカートリッジをマニホールドのクローズバルブ位置に配置して固相抽出器(SPE)を調製します。この清掃はEPA法3620C 22に基づいて以下のように行われる。
- 供給元を真空にし、カートリッジにヘキサン4 mLを加えて吸着剤を活性化する。
- バルブを開き、溶剤が吸着剤床全体を通過するようにします。次に、バルブを閉じ、吸着剤をヘキサンに5分間浸漬させます。
- バルブを開き、溶媒を通過させますが、吸着剤が乾燥する前にバルブを閉じます。
- サンプルが濃縮されたら、ガラスパスツールピペットでカートリッジに移します。ゆっくりとバルブを開き、ゆっくりと通過させます。毎秒1〜2滴が適切な速度。
- 抽出液を含むガラス管を0.5mLのヘキサンですすぎ、抽出液が通過したらカートリッジに加えます。
- 溶媒全体が通過したら、バルブを閉じて真空を止めてください。
- 廃液チューブを回収チューブに交換し、清潔な溶剤ガイドニードルを使用してください。
- 9 mLのアセトン/ヘキサン(10/90、v / v)をカートリッジに加え、ソースで真空をオンにする。吸着剤を溶媒に1分間浸漬させます。
- バルブを開き、回収チューブ内の全溶出液を回収する。
- 回収チューブを濃縮装置に置き、35℃で9分間溶媒を蒸発させて1 mLの溶出液にします。
- ガラス製のパスツールピペットを用いて濃縮した溶出液を琥珀色のオートサンプラーバイアルに移す。この段階では、分析前にサンプルをフリーザーに保存することができます。
4.清掃された集落の分析テッドエクストラクト
- GC-μECD装置(マイクロ電子捕獲検出器を備えたガスクロマトグラフ)の制御ソフトウェア上で分析方法をダウンロードする。メソッドの詳細は次のとおりです。
- インジェクタをスプリットレスモードに設定し、温度を250℃に、パージ時間を1分に設定します。
- キャリアガス(He)の流量を1.5 mL min -1に設定します。
- 次の温度勾配でカラムオーブンをプログラムする:60℃1分間保持、30℃ -1分〜200℃の上昇、5℃分-1の上昇を230℃に、3℃分の上昇-1で 250℃に達したら、この温度を5分間保持する。
- 検出器の温度を300℃に設定し、バックアップガスの流量(N 2 )を60 mL min -1に設定します。
- オートサンプラーラックにサンプル(洗浄済みおよび濃縮済み)を入れたバイアルを置き、メソッド(実行時間23.3分)を実行します。私サンプル2μLを注入する。
- 分析後、保持時間によってクロマトグラム上の異なる化合物を同定し、対応するピーク面積を記録する。
- 回収率(R)とピーク面積(A 1 )を考慮して、次のように検量線の式を使用して抽出物中の各OCPの濃度(C 1 )を計算する:
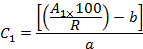
bは原点での切片であり、 aは較正方程式の傾きであり、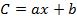
- 複製物の質量(m)( すなわち、ペレット10個;セクション2.4参照)および最終抽出物の体積(V)( すなわち、 1mL)を考慮して、吸着された各OCPの濃度プラスチックペレット( すなわち、プラスチックペレット1gあたりのOCPのng):
/ftp_upload/55531/55531eq3.jpg "/>
5.プラスチックタイプの識別
- ガラスペトリ皿にペレットを移し、ビニール袋に入れます。
- ピンセットで1つのペレットを保持し、メスでペレットのスライスを切断する。プラスチックバッグは、切断プロセス中のペレットの損失を防止する。
- FT-IR装置の減衰全反射率(ATR)結晶をエタノールで洗浄する。
- バックグラウンドスペクトルを記録する。
- フラグメントをATRクリスタル上に置き、サンプルホルダをねじ留めします。ピースの内側は結晶と接触していなければなりません。
- サンプルをスキャンし、スペクトルを記録します。
- 得られたスペクトルをスペクトルライブラリと比較することにより、プラスチックペレットを構成するポリマーを同定する。より時間がかかるものの、得られたスペクトルの解釈は手作業でも実施できるが、おそらく図書館の海で達成された特異度に達することなくrch。
結果
プラスチックペレットは、通常、砂浜の高潮および低潮に沿って見いだされる( 図1A )。彼らはまた、嵐の後に、海岸に新しく孤立した海草に固執することもできます。彼らは時折、撚り合わされた材料の蓄積領域にある小石や石のビーチで見つけることができます。
プラスチックペレットは、通?...
ディスカッション
プラスチックペレットに関連する有機汚染物質に焦点を当てたほとんどの研究は、吸着された化学物質の古典的な抽出方法に依存してきた。ソックスレー装置は、典型的な抽出時間が12〜24時間で、有機溶媒の消費量が高い( すなわち抽出当たり100〜250mL) 23が最も広く使用されています。マクセレーション抽出は、サンプルと有機溶媒( 例えば、 6日間)...
開示事項
著者は何も開示することはない。
謝辞
この作業は、DeFishGearプロジェクト(1°str / 00010)の中でIPA Adriatic Cross-border Cooperation Program 2007-2013によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
参考文献
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved