Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Plastik Peletlerden Organochlorine Pestisitlerin Çıkarılması ve Plastik Tipi Analizi
Bu Makalede
Özet
Mikroplastlar, öngörülemeyen etkileri olan potansiyel olarak toksik organik kirleticilerin vektörü gibi davranır. Bu protokol, plastik topaklara adsorbe edilen organochlorine böcek ilacı düzeylerini değerlendirmek ve polimer kimyasal yapısını belirlemek için alternatif bir metodoloji anlatmaktadır. Odaklı, basınçlı sıvı özütleme ve zayıflatılmış toplam yansıma Fourier dönüşümü kızıl ötesi spektroskopisi üzerine odaklanmaktadır.
Özet
Mikro plastik (çap ≤5 mm) olarak sınıflandırılan plastik reçine pelletleri, imalat ve nakliye esnasında çevreye istenmeden bırakılabilecek küçük granüllerdir. Çevresel sebatlarından dolayı, tüm dünyadaki okyanuslarda ve plajlarda yaygın bir şekilde dağılmıştır. Potansiyel olarak toksik organik bileşiklerden ( örneğin, poliklorlu bifeniller) oluşan bir vektör gibi davranabilirler ve dolayısıyla Deniz organizmalarını olumsuz yönde etkilemektedir. Besin zinciri boyunca olası etkileri henüz tam olarak anlaşılamamıştır. Deniz çevresindeki plastik topakların oluşumuyla ilişkili tehlikeleri değerlendirmek için, ilişkili organik kirletici seviyelerin hızlı bir şekilde tespit edilmesine izin veren metodolojilerin geliştirilmesi gereklidir. Bu protokol, reçine pelletlerinin numunelenmesi, adsorbe edilmiş organik klorür pestisitlerin (OCP'ler) analiz edilmesi ve plastik türün belirlenmesi için gerekli olan farklı aşamaları açıklamaktadır. Odak noktası açıkBasınçlı sıvı özütleyici (PFE) vasıtasıyla plastik topaklardan OCP'lerin çıkartılması ve Fourier Transform-InfraRed (FT-IR) spektroskopisini uygulayarak polimer kimyasal analizi. Geliştirilen metodoloji, teknik endosülfanın iki biyolojik açıdan aktif izomeri yanı sıra diklorodifenil trikloroetan (DDT) ve onun iki ana metaboliti lindan ve iki üretim izomeri de dahil olmak üzere 11 OCP'ye ve ilgili bileşiklere odaklanmaktadır. Bu protokol, plastik parçalara adsorbe edilen organik kirleticilerin konsantrasyonunu değerlendirmek için mevcut metodolojiye basit ve hızlı bir alternatif oluşturmaktadır.
Giriş
Küresel plastik üretimi, 1950'lerden bu yana sürekli artmakta ve 2014 yılında 311 milyon tona ulaşmakta ve yaklaşık% 40'ı ambalajlamada kullanılmaktadır 1 . Buna paralel olarak, bu materyallerin miktarları artmakta ve bu da ekosistemler için ciddi bir tehdit oluşturmaktadır 2 . 1970'lerde daha önce bildirilmiş olmasına rağmen, deniz çevresindeki plastik pisliklerin oluşumu son on yılda yalnızca daha fazla ilgi görmüştür. Özellikle mikroplastikler, ≤ 5 mm çapında plastik parçalar, ana deniz suyu kalitesi sorunlarından biri olarak kabul edilmektedir 3 .
Plastik reçine pelletleri, genellikle silindir veya disk şeklinde küçük granüller olup, birkaç mm çapında ( örneğin 2 ila 5 mm) 4 , 5 çapındadır. Mikroplastikler kategorisine girerler. Bu plastik granüllerNihai plastik ürünlerin yüksek sıcaklıkta yeniden eritme ve kalıplama yoluyla üretildiği endüstriyel hammadde 6 . Üretim ve nakliye sırasında istemeden çevreye salınabilirler. Örneğin, nakliyat sırasında kaza sonucu dökülmeler yoluyla okyanusa doğrudan gönderilebilirler 4 , 7 , 8 . Yüzey akışı, akarsuları ve nehirleri ile karadan okyanusa taşınabilirler. Çevresel sebatlarından ötürü, plastik topaklar okyanuslarda yaygın olarak dağılır ve tüm dünyada plajlarda bulunur 4 . Deniz organizmalarını olumsuz yönde etkileyebilir ve etkilerinin önceden belirlenemediği besin zincirine girebilirler 6 , 7 . Dahası, bir takım çalışmalar, bir kıyı şeridinde toplanan plastik peletlere adsorbe edilen çevresel kirleticilerin varlığını ortaya çıkarmıştırL çevre, bu potansiyel olarak toksik kimyasalların vektörü gibi davranır 4 , 9 , 10 . Aslında, bu kimyasalların yutulan plastik parçalardan 11 , 12 serbest bırakıldıktan sonra organizmaların dokularında biyolojik olarak birikebileceğini düşündüren laboratuar bulguları vardır.
Deniz ortamında plastik topakların oluşması ile ilişkili tehlikeleri daha iyi değerlendirmek için, emilen organik kirleticileri belirleyebilen yöntemlerin geliştirilmesi gereklidir. Polimerin türüne, bozunma evresine ve ön işlemlere bağlı olarak heterojen fiziksel-kimyasal özelliklere sahip olabilen plastik matrislerden kimyasalların çıkarılması önemli bir adımdır. Literatürde bildirilen araştırmaların çoğunda maserasyon veya Soxhlet teknikleri 4 ,5 , 6 , 9 , 13 , 14 , 15 , 16 , 17 , 18 , çözücü ve / veya zaman alıcıdır. Bu sayının artan ilgisi ile ilgili olarak, plastik parçalara adsorbe edilen organik kirleticilerin daha hızlı değerlendirilmesi için alternatifler geliştirilmelidir. Buna ek olarak, plastik kimyasal analiz, mikro plastiğin kimyasal yapısı hakkında bilgi sağlar. Sonuç olarak, ortamda bulunan baskın polimerler ve kopolimerler türleri değerlendirilebilir. Plastik parçalar çoğunlukla polietilen (PE) ve polipropilen (PP) 5'den yapılmış olmasına rağmen, bazı örnekleme yerleri, diğer kategorilerin önemli ölçüde temsil edildiği belirli bir profil sunabilir ( örn., Etilen / vinil asetat kopolimeriVe polistiren (PS)). FT-IR spektroskopisi, mikroplastı tanımlamak için yaygın olarak kullanılan polimer tanımlama için güvenilir ve kullanıcı dostu bir tekniktir 19,20 .
Mevcut çalışmanın temel amacı, bir PFE vasıtasıyla plastik topaklardan OCP'leri ve ilgili bileşikleri çıkarmak için hızlı ve basit bir seçenek sunmaktır. Bununla birlikte, protokolün tasarımı, reçine pelletlerinin örneklenmesinden bileşiklerin analizine kadar sorbed OCP'lerin saptanmasına yol açan tüm aşamaları kapsar. Plastik türünü belirleme yöntemi de açıklanmaktadır. Geliştirilen metodoloji, 11 OCP ve ilgili bileşiklere odaklanmaktadır: i) DDT (2,4'- ve 4,4'-diklorodifenil trikloroetan) ve iki ana metaboliti DDE (2,4'- ve 4,4'-diklorodifenildikloroetilen) ve DDD (2,4'- ve 4,4'-diklorodifenildikloroetan); Ii) ana madde o izomer gamma-heksachlorosikloheksan (γ-HCH)Pestisit lindane ve üretimi sırasında serbest bırakılan iki izomer α-HCH ve β-HCH; Iii) ve iki teknik olarak endosulfan I (Endo I) ve II (Endo II) biyolojik olarak aktif izomerleri. Çalışılan böcek ilacı geniş spektrumlu böcek ilaçları, kimyasal olarak kararlı, hidrofobik ve Stokholm Konvansiyon 21'in kalıcı organik kirleticiler (POP'ler) olarak sınıflandırılmış.
Protokol
1. Plastik Pelet Örnekleme
- Sahaya gitmeden önce, gerekli tüm numune malzemelerini ( örn. Cımbız ve alüminyum folyo) üçer kez aseton veya etanol (% 99) ile durulayın. Malzemenin çözücü ile durulanması mümkün değilse, bir fırında ( örn . Cam eşyalar) gece boyunca 450 ° C'de ısıtın.
NOT: Turistik bölgelerde, deniz temizliği maddesinin çoğunu mikroplastı da içine alacak olası plaj temizleme faaliyetleri hakkında bilgi edinin. Mümkünse, numuneyi bu işlemin öncesinde planlayın. Temizleme mevsiminde numune alımı yapılırsa, kimlik formundaki bu aktivitenin ayrıntılarını belirtin ( örneğin, tarihler, kullanılan temizleme yöntemi vb. ) - Eldiven takarak, solvent püskürtülmüş paslanmaz çelik cımbızla sahilden plastik topaklar toplamak.
- Yer başına 50 ila 100 pelet örneği, yer başına 5 ila 10 kopya karşılık gelir (çoğaltma başına 10 pelet). Gerekli pelet sayısı obta olamazsaMümkün olan en fazla peleti toplamak ve kimliğini sahil formunda belirtmek.
- Numunenin sonunda, toplanan topakları çözücü ile durulanmış alüminyum folyo ile sarın. Cam şişeler alternatif veya hatta kağıt torba olarak kullanılabilir.
- Seçilen kanın kimlik formunu eksik bilgi ile doldurun ( örn. Plaj yeri, hava koşulları, pelletlerde ayrıntılar vb. ).
- Ortam sıcaklığı 25 ° C'yi aşarsa numuneleri buz kutusunda laboratuara nakledin. Kısa adım atma durumunda bu adım atlanabilir ( örn., <1 saat).
- Laboratuvara girdikten sonra peletlerin çıkarılabilir parçacıklarını ( örn. Kum) yavaşça silin. Depolamadan önce bir desikatörde gerekirse numuneleri kurutun (karanlık, T <25 ° C). OCP'lerin kullanılabileceği odalardan kaçının ( örn . Standart çözümlerin depolanması).
- Peletleri buzdolabında (4 ° C) kısa süre saklayın ( yani, birkaç gün) veyaÇözücüyle durulanmış alüminyum folyo içinde daha uzun süre dondurucuda (-18 ° C).
- Örneklerin suni ışığa veya güneş ışığına maruz kalmasını önleyin. Kirlenme riskini azaltmak için örnekleri analizden önce mümkün olduğunca az tutun.
2. Plastik Peletlerden OCP'lerin Çıkarılması
- Kirlenme riskini azaltmak için, dikkatle yıkanmış cam eşyaları aşağıdaki gibi kullanarak temiz bir laboratuarda çalışın: analitik dereceli aseton, diklorometan ve n-hekzan ile 2 durulama. Camı azot akışı altında kurutun ve ortam havasıyla temasından koruyun ( örn . Temizlenmiş alüminyum folyo ile örtün). Bu temizleme prosedürünü protokolün diğer adımlarında uygulayın ( örn., Bölüm 3 ve 4).
- Çözücüyle yıkanmış cımbız kullanarak peletleri aşağıdaki kategorilerde renklere göre sıralayın: beyaz / şeffaf, beyaz / sarımsı, sarı / turuncu, kehribar / kahverengi ve pigmentli ( örneğin kırmızı, yeşil, mavi vb. )
- Topak 10 toplaBenzer rengin rastgele ( yani plastik tip dikkate alınmaz), bu da bir tekrarı oluşturacaktır.
- Numuneyi analitik bir denge üzerine tartın ve kütleyi kaydedin. Bu aşamada, numuneler buzdolabına veya dondurucuya geri konabilir.
- Arka plan kirliliğini göz önünde bulundurmak için, her kopyanın seti ile boş bir örnek gerçekleştirin ( örn., 5 kopya için 1 boşluk). Bu amaçla, yukarıda açıklanan protokolü uygulayın, ancak ekstraksiyon hücresine plastik topaklar eklemeyin. Bu boş örnek, protokolün diğer aşamalarını geçecek ve numuneler ile birlikte analiz edilecektir.
- PFE'yi açın. Çıkarma yöntemini indirin ve cihazı 60 ° C'ye ısıtın. Yöntemin ayrıntıları aşağıdaki gibidir:
- Sıcaklığı 60 ° C'ye ve basıncı 100 bar'a ayarlayın.
- Isıtma süresi 1 dk, tutma süresi 25 dk ve boşaltma süresi 2 dk ile bir devir seçin.
- Çözücüyü ayarlaVe gaz (N2) yıkama sürelerini her birinden 3 dakikaya çıkarın.
- Ekstraksiyon solventi olarak n-heksan seçin.
- Alet ısınırken, aşağıda açıklandığı gibi ekstraksiyon hücresini hazırlayın. Gerekirse, protokolü tedarikçinizin cihazınızın talimatlarına göre uyarlayın:
- Alt filtreyi ve friti ekstraksiyon hücresine yerleştirin. Kapatın ve çevirin.
- Huni kullanarak temizlenmiş kuvartz kumu ile hücrenin yaklaşık yarısını doldurun.
- Tartılan numuneyi ekleyin ( yani, 10 peletten bir kopya). Dondurulmuş plastik peletler ekstraksiyon öncesinde buzdolabında bir gece yerleştirilmelidir.
- Hücrenin üstünden 1 cm kadar kuvars kumu ekleyin. Ultra temiz kuvars kumu (veya alternatif olarak cam boncuklar), numunelerle aynı ekstraksiyon koşullarına maruz bırakıldığından özel dikkat gösterin. Kumu temizlemek için, analitik dereceli diklorometan ve n-hekzan içinde ard arda PFE içinde çıkarın, 2 veyaÇözücü başına daha fazla döngü ( örneğin, 100 bar'da 100 ° C'de 30 dakika). Alternatif olarak, bir ultrasonik banyo ve / veya döner buharlaştırıcı kullanın. Gerekirse temizleme prosedürünü tekrarlayın.
- Üst filtreyi hücrenin içine yerleştirin ve hücrenin içine yerleştirin.
- Toplama kablarını cihaza yerleştirin ve ekstraksiyon yöntemini başlatın (toplam süre yaklaşık 35 dk).
- Yöntem tamamlandığında, temizlenmiş bir cam kabın ( örn. , Cam kabı, cam hücre kültürü çanağı) boşaltma hücresini boşaltın ve kumdaki 10 pelleti alın. Plastik kimlik bilgileri için daha fazla analiz yapılıncaya kadar ( örneğin, fermuarlı çanta veya cam flakon) bir kapta saklayın.
3. Ekstraktın Konsantrasyonu ve Temizlenmesi
- Elde edilen ekstraktı (yaklaşık 40 mL) toplayıcı kaptan bir cam boruya aktarın ve 20 dakika boyunca 35 ° C'ye ayarlanmış dönen bir konsantratörde 1 mL'ye kadar buharlaştırın. Alternatif yöntemler su ile kullanılabilirCh, azot akışı veya döner buharlaştırıcı altında buharlaştırma olarak kullanılır. Sıcaklık ve süre buna göre optimize edilmelidir.
- Bu arada, bir katı atık özütleyiciyi (SPE), rafın içine atık boru yerleştirin ve manifolda kapalı valf konumunda aktif magnezyum silikat sorbent (1 g) ile dolu bir kartuş yerleştirin. Temizlik, EPA yöntemi 3620C 22'ye göre aşağıdaki şekilde yapılır:
- Kaynağı vakum açın ve sorbent etkinleştirmek için kartuş 4 mL heksan ekleyin.
- Valfi açın ve çözücünün tüm sorbent yatağından geçmesine izin verin. Ardından valfi kapatın ve sorbentin 5 dakika boyunca hekzan içine emdirmesine izin verin.
- Valfi açın ve solventin geçmesine izin verin, ancak sorbent kurumadan önce vanayı kapatın.
- Numune konsantre hale getirildiğinde, cam bir Pasteur pipetiyle kartuşa aktarın. Valfi yavaşça açın ve yavaş yavaş geçmesine izin verin. Saniyede 1-2 damlaUygun bir hız.
- Ekstraktı içeren cam tübü 0,5 mL hekzan ile durulayın ve özü geçtiğinde kartuşa ekleyin.
- Solventin tamamı geçtiğinde valfi kapatın ve vakumu kapatın.
- Atık borusunu toplama borusu ile değiştirin ve temiz bir solvent kılavuz iğnesi kullanın.
- Kartuşa 9 mL aseton / heksan (10/90, v / v) ilave edin ve kaynağı vakum açın. Çözeltinin çözücüye 1 dakika kadar ısınmasına izin verin.
- Valfi açın ve toplama tüpündeki eluatın tamamını toplayın.
- Toplama tüpünü yoğunlaştırıcıya yerleştirin ve 1 mL eluat'a erişmek için çözücüyü 35 ° C'de 9 dakika boyunca buharlaştırın.
- Konsantre edilen eluatı, cam bir Pasteur pipetiyle kehribar rengarenk otozimser şişeye aktarın. Bu aşamada, numuneler analiz öncesinde dondurucuda saklanabilir.
4. Temizlenmiş ve Konsantralı AnalizlerTed Extract
- Analitik yöntemi, GC-μECD cihazının kontrol yazılımı (bir mikro elektron yakalama dedektörü ile donatılmış gaz kromatografisi) üzerine indirin. Yöntemin ayrıntıları aşağıdaki gibidir:
- Enjektörü bölünmez moda, sıcaklığı 250 ° C'ye ve temizleme süresini 1 dakikaya ayarlayın.
- Taşıyıcı gazın akışını (He) 1.5 mL / dak'a ayarlayın .
- Kolon fırını aşağıdaki sıcaklık gradyeniyle programlayın: 1 dakika için 60 ° C tutun, 30 ° C min -1 ila 200 ° C rampa, 5 ° C min -1 ila 230 ° C rampa, 3 ° C min. Rampa -1 , 250 ° C'ye erişmek için bu sıcaklığı 5 dakika tutun.
- Dedektör sıcaklığını 300 ° C'ye ve yedek gaz akışı (N2) 60 mL / dak'a ayarlayın .
- Numuneyi ihtiva eden flakonu (temizlenmiş ve konsantre edilmiş) otomatik örnekleyici bölmesine yerleştirin ve yöntemi çalıştırın (çalışma süresi 23.3 dak.). ben Numuneyi 2 μL numara ile doldurun.
- Analiz sonrasında, kromatogramdaki farklı bileşikleri tutma sürelerine göre tanımlayın ve ilgili zirve alanlarını kaydedin.
- Geri kazanımları (R) ve zirve alanlarını (A 1 ) göz önüne alarak, kalibrasyon eğrilerinin denklemlerini kullanarak aşağıdaki ekstraktaki her OCP'nin konsantrasyonunu (C 1 ) hesaplayın:
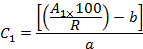
Burada b , orijin üzerindeki kesişim noktası ve a kalibrasyon denkleminin eğimi,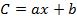
- Nihai ekstraktın ( yani, 1 mL) hacmi (V) olan kopyanın kütlesini (m) ( yani, 10 pelet; bkz. Bölüm 2.4) dikkate alarak , adsorbe edilen her OCP'nin konsantrasyonunu (C2) hesaplayın Plastik topaklar ( örn . Plastik topağın gramı başına OCP'nin ng'si):
/ftp_upload/55531/55531eq3.jpg "/>
5. Plastik Tip Tanımlaması
- Peletleri cam bir Petri kabına aktarın ve plastik torbaya koyun.
- Bir pelleti cımbızla tutun ve pelet dilimini bir bisturi ile kesin. Plastik torba, kesme işlemi sırasında pelet kaybını önler.
- FT-IR enstrümanının zayıflatılmış toplam yansıma (ATR) kristalini etanol ile temizleyin.
- Arka planda bir spektrum kaydedin.
- Parçayı ATR kristaline yerleştirin ve numune tutacağını vidalayın. Parçanın iç tarafı kristalle temas halinde olmalıdır.
- Numuneyi tarayın ve spektrum kaydedin.
- Elde edilen spektrumun bir spektrum kütüphanesine kıyasla plastik topağı oluşturan polimeri tanımlayın. Daha zaman alıcı olmakla birlikte, elde edilen spektrumların yorumu elle de yapılabilir, ancak büyük olasılıkla bir kütüphane deniziyle elde edilen özgüllük derecesine ulaşmadanrch.
Sonuçlar
Plastik peletler genelde kumlu plajların yüksek ve alçalmış çizgileri boyunca bulunur ( Şekil 1A ). Örneğin, fırtınadan sonra plajlarda yeni kurulmuş deniz çayırlarına da yapışabilirler. Bazen karaya oturmuş malzemelerin birikim alanlarındaki çakıllı ve taşlı plajlarda bulunurlar.
Plastik topaklar şekil 1B'de görüldüğü gibi şekli, bo...
Tartışmalar
Plastik topaklarla ilişkili organik kirleticilere odaklanan çoğu çalışma, adsorbe edilen kimyasalların klasik ekstraksiyon yöntemlerine dayanıyordu. Soxhlet aparatı, tipik ekstraksiyon süreleri 12 ila 24 saat arasında ve organik çözücülerin yüksek tüketimi ile ( yani ekstraksiyon başına 100 ila 250 mL arasında) en çok kullanılan tekniktir 23 . Maceration ekstraksiyonu, numune ile organik çözücü ( örn., 6 gün) arasında uzun bir temas zamanı ge...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma IPA Adriyatik Sınır Ötesi İşbirliği Programı 2007-2013 tarafından DeFishGear projesi (1 ° str / 00010) kapsamında finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
Referanslar
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır