Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Extraktion von Organochlor-Pestiziden aus Kunststoff-Pellets und Kunststoff-Typ-Analyse
In diesem Artikel
Zusammenfassung
Mikroplastiken wirken als Vektor potenziell toxischer organischer Verunreinigungen mit unvorhersehbaren Wirkungen. Dieses Protokoll beschreibt eine alternative Methode zur Beurteilung der Konzentrationen von Organochlor-Pestiziden, die an Kunststoff-Pellets adsorbiert sind, und die Identifizierung der chemischen Polymerstruktur. Der Schwerpunkt liegt auf der Druckfluid-Extraktion und der abgeschwächten Totalreflexion Fourier-Transformations-Infrarotspektroskopie.
Zusammenfassung
Kunststoff-Harz-Pellets, kategorisiert als Mikroplastik (≤5 mm im Durchmesser), sind kleine Granulate, die unbeabsichtigt in die Umwelt während der Herstellung und Transport freigegeben werden können. Wegen ihrer ökologischen Beharrlichkeit sind sie weit verbreitet in den Ozeanen und an Stränden auf der ganzen Welt. Sie können als Vektor von potentiell toxischen organischen Verbindungen ( zB polychlorierte Biphenyle) fungieren und könnten folglich sein Negativen Einfluss auf marine Organismen. Ihre möglichen Auswirkungen entlang der Nahrungskette sind noch nicht gut verstanden. Um die Gefahren, die mit dem Auftreten von Plastikpellets in der Meeresumwelt verbunden sind, zu beurteilen, ist es notwendig, Methoden zu entwickeln, die eine rasche Bestimmung der damit verbundenen organischen Verunreinigungsniveaus ermöglichen. Das vorliegende Protokoll beschreibt die verschiedenen Schritte, die für die Probenahme von Harzpellets erforderlich sind, die Analyse von adsorbierten Organochlor-Pestiziden (OCPs) und die Identifizierung des Plastiktyps. Der Fokus liegt aufDie Extraktion von OCPs aus Kunststoff-Pellets mittels eines unter Druck stehenden Fluid-Extraktors (PFE) und der polymerchemischen Analyse, die die Fourier-Transform-InfraRed (FT-IR) -Spektroskopie anwendet. Die entwickelte Methodik konzentriert sich auf 11 OCPs und verwandte Verbindungen, darunter Dichlordiphenyltrichlorethan (DDT) und seine beiden Hauptmetaboliten, Lindan und zwei Produktionsisomere sowie die beiden biologisch aktiven Isomeren des technischen Endosulfans. Dieses Protokoll stellt eine einfache und schnelle Alternative zur bestehenden Methodik zur Bewertung der Konzentration von organischen Verunreinigungen dar, die an Kunststoffstücken adsorbiert sind.
Einleitung
Die weltweite Produktion von Kunststoffen steigt seit den 1950er Jahren kontinuierlich auf 311 Millionen Tonnen im Jahr 2014 mit etwa 40% in der Verpackung 1 . Parallel dazu sammeln sich zunehmende Mengen dieser Materialien in der Umwelt an, was eine ernste Bedrohung für die Ökosysteme darstellen könnte 2 . Obwohl bereits in den 1970er Jahren berichtet, hat das Auftreten von Plastikschutt in der Meeresumwelt in den letzten zehn Jahren nur eine größere Aufmerksamkeit erhalten. Besonders Mikroplastik, Kunststofffragmente mit einem Durchmesser von ≤ 5 mm, werden heute als eines der wichtigsten Wasserqualitätsprobleme erkannt 3 .
Kunststoffharzpellets sind kleine Körner, die in der Regel in Form eines Zylinders oder einer Scheibe und mit einem Durchmesser von wenigen mm ( zB 2 bis 5 mm) 4 , 5 sind . Sie fallen in die Kategorie der Mikroplastik. Diese Kunststoffgranulate sindIndustrieller Rohstoff, aus dem die endgültigen Kunststoffprodukte durch erneutes Schmelzen und Formen bei hoher Temperatur hergestellt werden 6 . Sie können während der Herstellung und des Transports unabsichtlich in die Umwelt freigegeben werden. Zum Beispiel können sie direkt in den Ozean durch versehentliche Verschüttungen während der Schifffahrt 4 , 7 , 8 eingeführt werden . Sie können von Land zu Ozeanen durch Oberflächenabfluss, Bäche und Flüsse getragen werden. Wegen ihrer ökologischen Beharrlichkeit sind Plastikpellets weit verbreitet in den Ozeanen und fanden auf Stränden auf der ganzen Welt 4 . Sie können die Meeresorganismen negativ beeinflussen und können in die Nahrungskette gelangen, wo ihre Wirkungen unvorhersehbar sind 6 , 7 . Darüber hinaus haben mehrere Studien die Anwesenheit von Umweltverunreinigungen, die an Plastikpellets adsorbiert wurden, die in einer Küstenlage gesammelt wurden, aufgedecktL Umwelt, die als Vektor dieser potenziell toxischen Chemikalien 4 , 9 , 10 dienen . Tatsächlich gibt es Laboruntersuchungen, die darauf hindeuten, dass diese Chemikalien in Geweben von Organismen bioakkumulieren können, nachdem sie von den verschlossenen Plastikfragmenten 11 , 12 freigesetzt wurden.
Um die Gefahren, die mit dem Auftreten von Plastikpellets in der Meeresumwelt verbunden sind, besser zu beurteilen, ist es notwendig, Methoden zu entwickeln, die sorbierte organische Verunreinigungen bestimmen können. Ein wichtiger Schritt ist die Extraktion der Chemikalien aus den Kunststoffmatrizen, die je nach Polymertyp, deren Abbaustufe und Vorbehandlungen heterogene physikalisch-chemische Eigenschaften aufweisen können. Die meisten Untersuchungen, die in der Literatur berichtet wurden, verwenden Mazeration oder Soxhlet-Techniken 4 ,5 , 6 , 9 , 13 , 14 , 15 , 16 , 17 , 18 , die lösungsmittel- und / oder zeitaufwendig sind. In Bezug auf das wachsende Interesse für dieses Thema sollten Alternativen entwickelt werden, um eine schnellere Bewertung von organischen Verunreinigungen, die an Kunststoffstücken adsorbiert sind, zu entwickeln. Darüber hinaus informiert die plastische chemische Analyse über die chemische Struktur der Mikroplastik. Als Ergebnis können die vorherrschenden Typen von in der Umgebung vorhandenen Polymeren und Copolymeren ausgewertet werden. Obwohl Kunststofffragmente üblicherweise aus Polyethylen (PE) und Polypropylen (PP) 5 bestehen , können einige Probenahmestellen ein besonderes Profil aufweisen, bei dem andere Kategorien signifikant dargestellt sind ( z. B. Ethylen / Vinylacetat-CopolymerUnd Polystyrol (PS)). Die FT-IR-Spektroskopie ist eine zuverlässige und benutzerfreundliche Technik zur Polymeridentifizierung, die üblicherweise zur Identifizierung von Mikroplastiken verwendet wird 19 , 20 .
Das Hauptziel der vorliegenden Arbeit ist es, eine schnelle und einfache Möglichkeit zur Gewinnung von OCPs und verwandten Verbindungen aus Kunststoff-Pellets mittels PFE zu bieten. Der Entwurf des Protokolls umfasst jedoch alle Schritte, die zur Bestimmung von sorbierten OCPs führen, von der Probenahme der Harzpellets bis zur Analyse der Verbindungen. Das Verfahren zur Identifizierung des Plastiktyps wird ebenfalls beschrieben. Die entwickelte Methodik konzentriert sich auf 11 OCPs und verwandte Verbindungen: i) DDT (2,4'- und 4,4'-Dichlordiphenyltrichlorethan) und seine beiden Hauptmetaboliten DDE (2,4'- und 4,4'-Dichlordiphenyldichlorethylen) und DDD (2,4'- und 4,4'-Dichlordiphenyldichlorethan); Ii) das Isomer Gamma-Hexachlorcyclohexan (γ-HCH) als Hauptbestandteil oF das Pestizid-Lindan und die beiden Isomeren α-HCH und β-HCH, die während ihrer Herstellung freigesetzt wurden; Iii) und die beiden biologisch aktiven Isomere Endosulfan I (Endo I) und II (Endo II) im technischen Endosulfan. Die untersuchten Pestizide sind breitbandige Insektizide, chemisch stabil, hydrophob und klassifiziert als persistente organische Schadstoffe (POPs) nach dem Stockholmer Übereinkommen 21 .
Protokoll
1. Plastik Pellet Probenahme
- Bevor Sie auf das Feld gehen, spülen Sie alle erforderlichen Probenahme-Materialien ( zB Pinzette und Aluminiumfolie) mit Aceton oder Ethanol (99%). Falls das Material nicht lösungsmittelgespült werden kann, heizen Sie es bei 450 ° C über Nacht in einem Ofen ( zB Glaswaren).
HINWEIS: In touristischen Gebieten, erhalten Sie Informationen über mögliche Strand Reinigung Aktivitäten, die die meisten der maritimen Wurf einschließlich Mikroplastik entfernen würde. Wenn möglich, planen Sie die Probenahme vor dieser Operation. Wenn die Probenahme während der Aufräumsaison erfolgt, geben Sie die Details dieser Aktivität im Identitätsformular an ( zB Daten, Aufbereitungsmethode usw. ) - Tragen von Handschuhen, sammeln Plastikpellets vom Strand mit lösemittelhaltiger Edelstahlpinzette.
- Probe 50 bis 100 Pellets pro Ort, was 5 bis 10 Replikaten pro Standort entspricht (10 Pellets pro Replikat). Wenn die erforderliche Anzahl von Pellets nicht möglich istIned, sammeln die maximale Pellets möglich und spezifizieren sie in der Identity Beach Form.
- Am Ende der Probenahme wickeln Sie die gesammelten Pellets in lösemittelhaltige Aluminiumfolie ein. Glasflaschen können als Alternative oder sogar Papiertüten verwendet werden.
- Füllen Sie die Identitätsform des ausgewählten Strandes mit den fehlenden Informationen aus ( dh Strandlage, Wetterbedingungen, Details zu Pellets usw. ).
- Transportieren Sie die Proben zum Labor in einer Eisbox, wenn die Umgebungstemperatur 25 ° C übersteigt. Dieser Schritt kann bei Kurzstrecken ( zB <1 Std.) Übersprungen werden.
- Einmal im Labor, wischen Sie vorsichtig abnehmbare Partikel ( zB Sand) der Pellets ab. Trocknen Sie die Proben ggf. in einem Exsikkator vor der Lagerung (Dunkelheit, T <25 ° C). Vermeiden Sie Räume, in denen OCPs verwendet werden können ( zB Lagerung von Standardlösungen).
- Lagern Sie die Pellets im Kühlschrank (4 ° C) für kurze Zeit ( dh wenige Tage) oderIm Gefrierschrank (-18 ° C) für längere Zeit in lösemittelhaltiger Aluminiumfolie.
- Vermeiden Sie die Belichtung von Proben mit künstlichem Licht oder Sonnenlicht. Behandeln Sie die Proben so wenig wie möglich vor der Analyse, um das Risiko einer Kontamination zu verringern.
2. Extraktion von OCPs aus Kunststoff-Pellets
- Um das Risiko einer Kontamination zu reduzieren, arbeiten Sie in einem sauberen Labor mit sorgfältig gewaschenen Glaswaren wie folgt: 2 Spülungen mit analytischem Aceton, Dichlormethan und n-Hexan. Trocknen Sie die Glaswaren unter Stickstoffstrom und schützen Sie sie vor Kontakt mit Umgebungsluft ( zB Deckel mit gereinigter Aluminiumfolie). Wenden Sie diese Reinigung in den weiteren Schritten des Protokolls ( dh Abschnitte 3 und 4) an.
- Mit Hilfe von lösungsmittelgespülten Pinzetten die Pellets nach Farbe in den folgenden Kategorien sortieren: weiß / transparent, weißlich / gelblich, gelb / orange, gelb / braun und pigmentiert ( zB rot, grün, blau usw. )
- Sammle 10 PelletsS von ähnlicher Farbe zufällig ( dh Plastikart nicht betrachtet), die ein Replikat bilden wird.
- Wiegen Sie die Probe auf eine analytische Balance und notieren Sie die Masse. In diesem Stadium können die Proben wieder in den Kühlschrank oder Gefrierschrank gebracht werden.
- Um die Hintergrundkontamination zu berücksichtigen, führen Sie eine Blindprobe mit jedem Satz von Replikaten aus ( zB 1 Leerzeichen für 5 Wiederholungen). Zu diesem Zweck, wenden Sie das gleiche Protokoll wie oben beschrieben, aber nicht hinzufügen Kunststoff Pellets in der Extraktionszelle. Diese Blindprobe wird den weiteren Schritten des Protokolls unterzogen und zusammen mit den Proben analysiert.
- Schalte den PFE ein. Laden Sie die Extraktionsmethode herunter und erwärmen Sie das Gerät auf 60 ° C. Die Einzelheiten der Methode sind wie folgt:
- Stellen Sie die Temperatur auf 60 ° C und den Druck auf 100 bar.
- Wählen Sie einen Zyklus mit einer Aufheizzeit von 1 min, einer Haltezeit von 25 min und einer Entladezeit von 2 min.
- Stellen Sie das Lösungsmittel einUnd Gas (N 2 ) bündig mal auf 3 min.
- Wählen Sie n-Hexan als Extraktionslösungsmittel.
- Während das Gerät aufwärmt, bereiten Sie die Extraktionszelle wie unten beschrieben vor. Falls erforderlich, das Protokoll an die Anweisungen des Anbieters des Gerätes anpassen:
- Legen Sie den Bodenfilter und die Fritte in die Extraktionszelle. Schließen Sie es und drehen Sie es um.
- Füllen Sie etwa die Hälfte der Zelle mit gereinigtem Quarzsand mit einem Trichter.
- Füge die gewogene Probe hinzu ( dh ein Replikat von 10 Pellets). Gefrorene Plastikpellets sollten vor der Extraktion über Nacht in den Kühlschrank gestellt werden.
- Fügen Sie Quarzsand bis zu 1 cm von der Oberseite der Zelle hinzu. Achten Sie besonders darauf, ultra sauberen Quarzsand (oder alternativ Glasperlen) zu verwenden, da es den gleichen Extraktionsbedingungen wie den Proben ausgesetzt ist. Um den Sand zu reinigen, ziehen Sie ihn nacheinander in das PFE in analytischem Grad Dichlormethan und n-Hexan, wobei 2 oderMehr Zyklen pro Lösungsmittel ( zB 30 min bei 100 ° C unter 100 bar). Alternativ verwenden Sie ein Ultraschallbad und / oder Rotationsverdampfer. Wiederholen Sie den Reinigungsvorgang, falls erforderlich.
- Setzen Sie den oberen Filter in die Zelle und legen Sie die Zelle in das Instrument.
- Legen Sie die Sammelgefäße in das Instrument und starten Sie die Extraktionsmethode (Gesamtlauf von ca. 35 min).
- Wenn die Methode abgeschlossen ist, entleeren Sie die Extraktionszelle in einem gereinigten Glasgefäß ( zB Becherglas, Glaszellkulturschale) und holen Sie die 10 Pellets im Sand ab. Lagern Sie sie in einem Behälter bis zur weiteren Analyse zur Plastikidentifizierung ( zB Reißverschluss oder Glasfläschchen).
3. Konzentration und Aufräumung des Extraktes
- Den erhaltenen Extrakt (ca. 40 ml) aus dem Sammelgefäß in ein Glasröhrchen überführen und in einem Rotationskonzentrator auf 1 ml auf 20 ° C für 20 min verdampfen. Alternative Methoden könnten verwendet werden suCh als Verdampfung unter Stickstoffstrom oder rotierendem Verdampfer. Temperatur und Dauer sollten entsprechend optimiert werden.
- In der Zwischenzeit den Festphasenextraktor (SPE) vorbereiten, indem man ein Abfallrohr in die Zahnstange legt und eine mit aktiviertem Magnesiumsilikat-Sorptionsmittel (1 g) gefüllte Patrone auf dem Verteiler in der Schließventilposition Die Aufräumung basiert auf der EPA-Methode 3620C 22 wie folgt:
- Drehen Sie das Vakuum an der Quelle und fügen Sie 4 ml Hexan in die Patrone, um das Sorptionsmittel zu aktivieren.
- Öffnen Sie das Ventil und lassen Sie das Lösungsmittel durch das gesamte Sorptionsmittelbett laufen. Dann schließen Sie das Ventil und lassen Sie das Sorptionsmittel in Hexan für 5 min einweichen.
- Öffnen Sie das Ventil und lassen Sie das Lösungsmittel durchlaufen, aber schließen Sie das Ventil, bevor das Sorptionsmittel abtrocknet.
- Wenn die Probe konzentriert ist, transportiere sie mit einer Glaspasteurpipette in die Patrone. Öffnen Sie das Ventil vorsichtig und lassen Sie es langsam durchlaufen. 1-2 Tropfen pro Sekunde istEine angemessene Geschwindigkeit.
- Spülen Sie das Glasrohr, das den Extrakt enthält, mit 0,5 ml Hexan und fügen Sie es der Patrone hinzu, wenn der Extrakt durchgegangen ist.
- Wenn das gesamte Lösungsmittel durchgegangen ist, schließen Sie das Ventil und schalten Sie das Vakuum aus.
- Ersetzen Sie das Abfallrohr mit einem Sammelrohr und verwenden Sie eine saubere Lösungsmittelführungsnadel.
- Füge 9 ml Aceton / Hexan (10/90, v / v) der Patrone hinzu und schalte das Vakuum an der Quelle ein. Lassen Sie das Sorptionsmittel 1 Minute lang in das Lösungsmittel einwirken.
- Öffnen Sie das Ventil und sammeln Sie das gesamte Eluat im Sammelrohr.
- Setzen Sie das Sammelrohr in den Konzentrator und verdampfen das Lösungsmittel für 9 min bei 35 ° C, um 1 ml Eluat zu erreichen.
- Übertragen Sie das konzentrierte Eluat in eine bernsteinfarbene Autosampler-Durchstechflasche mit einer Glaspasteurpipette. In diesem Stadium können die Proben vor der Analyse im Gefrierschrank gelagert werden.
4. Analyse der gereinigten und ConcentraAuszug
- Laden Sie die analytische Methode auf die Steuerungssoftware des GC-μECD-Instruments herunter (Gaschromatograph mit Mikroelektronen-Erfassungsmelder). Die Einzelheiten der Methode sind wie folgt:
- Stellen Sie den Injektor auf den Splitless-Modus, seine Temperatur auf 250 ° C und die Spülzeit auf 1 min.
- Stellen Sie den Fluss des Trägergases (He) auf 1,5 mL min -1 ein .
- Programmieren Sie den Säulenofen mit dem folgenden Temperaturgradienten: 60 ° C für 1 min halten, Rampe von 30 ° C min -1 bis 200 ° C, Rampe von 5 ° C min -1 bis 230 ° C, Rampe von 3 ° C min -1 bis 250 ° C erreichen, diese Temperatur für 5 min halten.
- Stellen Sie die Detektortemperatur auf 300 ° C und den Back-up-Gasstrom (N 2 ) auf 60 mL min -1 ein .
- Legen Sie die Durchstechflasche mit der Probe (gereinigt und konzentriert) in die Autosampler Rack und führen Sie die Methode (Laufzeit von 23,3 min). ich 2 μl Probe projizieren
- Nach der Analyse identifizieren Sie die verschiedenen Verbindungen auf dem Chromatogramm durch ihre Retentionszeiten und notieren die entsprechenden Peak-Bereiche.
- Unter Berücksichtigung der Wiederfindungen (R) und der Peakflächen (A 1 ) berechnen Sie die Konzentration (C 1 ) jedes OCP im Extrakt unter Verwendung der Gleichungen der Eichkurven wie folgt:
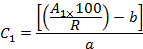
Wo b der Intercept am Ursprung ist und a die Steigung der Kalibriergleichung ist,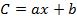
- Unter Berücksichtigung der Masse (m) des Replikats ( dh 10 Pellets, siehe Abschnitt 2.4) und des Volumens (V) des endgültigen Extrakts ( dh 1 mL), wird die Konzentration (C 2 ) jedes angeschützten OCP berechnet Die Plastikpellets ( dh ng OCP pro g Plastikpellet):
/ftp_upload/55531/55531eq3.jpg "/>
5. Kunststoff-Typenbezeichnung
- Übertragen Sie die Pellets in eine Glas Petrischale und legen Sie sie in eine Plastiktüte.
- Halten Sie ein Pellet mit Pinzette und schneiden Sie eine Scheibe des Pellets mit einem Skalpell. Die Plastiktüte verhindert den Verlust von Pellets während des Schneidprozesses.
- Reinigen Sie den abgeschwächten Totalreflexions- (ATR-) Kristall des FT-IR-Instruments mit Ethanol.
- Notieren Sie ein Hintergrundspektrum.
- Legen Sie das Fragment auf den ATR-Kristall und schrauben Sie den Probenhalter. Die Innenseite des Stückes muss mit dem Kristall in Berührung kommen.
- Scannen Sie die Probe und notieren Sie das Spektrum.
- Identifizieren Sie das Polymer, das das Plastikpellet bildet, durch Vergleich des erhaltenen Spektrums mit einer Spektrenbibliothek. Obwohl zeitaufwendiger, könnte die Interpretation der erhaltenen Spektren auch manuell durchgeführt werden, aber höchstwahrscheinlich ohne den Grad der Spezifität zu erreichen, die mit einem Bibliotheksmeer erreicht wurdeRch.
Ergebnisse
Plastikpellets werden normalerweise entlang der hohen und niedrigen Gezeitenlinien der sandigen Strände gefunden ( Abbildung 1A ). Sie können auch an der Seegras frisch stranded auf Strände, nach einem Sturm zum Beispiel halten. Sie können gelegentlich auf Kies und steinigen Stränden in Anhäufungsgebieten von gestrandeten Material gefunden werden.
Kunststoffpellets sind in der Regel leicht d...
Diskussion
Die meisten Studien, die sich auf organische Verunreinigungen im Zusammenhang mit Kunststoff-Pellets konzentrieren, haben sich auf klassische Extraktionsmethoden der adsorbierten Chemikalien verlassen. Der Soxhlet-Apparat ist die am weitesten verbreitete Technik mit typischen Extraktionszeiten von 12 bis 24 h und mit hohem Verbrauch an organischen Lösungsmitteln ( dh von 100 bis 250 ml pro Extraktion) 23 . Mazerationsextraktionen erfordern eine lange Kontaktzeit zwischen der Probe...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde im Rahmen des Programms "DeFishGear" (1 ° str / 00010) im Rahmen des Programms für grenzüberschreitende Zusammenarbeit 2007-2013 im Rahmen des Programms für grenzübergreifende Zusammenarbeit 2007-2013 gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Alpha–HCH | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C14071000 | H301, H351, H400, H410, H312 |
| Beta–HCH | Fluka, Sigma-Aldrich, St. Louis, USA | 33376-100MG | H301, H312, H351, H410 |
| Lindane | Fluka, Sigma-Aldrich, St. Louis, USA | 45548-250MG | H301, H312, H332, H362, H410 |
| Endosufan I | Supleco, Sigma-Aldrich Bellefonte, PA, USA | 48576-25MG | H301, H410 |
| Endosulfan II | Supleco, Sigma-Aldrich, Bellefonte, PA, USA | 48578-25MG | H301, H410 |
| 2,4'–DDD | Fluka, Sigma-Aldrich, St. Louis, USA | 35485-250MG | H351 |
| 4,4’–DDD | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12031000 | H301, H351, H400, H410, H312 |
| 2,4’–DDE | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12040000 | H351, H400, H410, H302 |
| 4,4’-DDE | Fluka , Sigma-Aldrich, St. Louis, USA | 35487-250MG | H302, H351, H410 |
| 2,4’–DDT | Dr. Ehrenstorfer, Augsburg, Germany | DRE-C12081000 | H301, H311, H330, H351, H400, H410 |
| 4,4’–DDT | National Institute of Standards and Technology, Gaithersburg, USA | RM8469-4,4'-DDT | H301, H311, H351, H372, H410 |
| n-Hexane | VWR International GmbH, Graumanngasse, Viena, Austria | 83992.320 | H225, H315, H336, H373, H304, H411 |
| Acetone for HPLC | J.T.Baker, Avantor performance Materials B.V., Teugseweg, Netherlands | 8142 | H225, H319, H 336 |
| FL-PR Florisil 1000mg/6mL | Phenomenex, Torrance, CA, USA | 8B-S013-JCH | |
| Fat free quartz sand 0.3-0.9 mm | Buchi, Flawil, Switzerland | 37689 | |
| Gas chromatograph Hawlett Packard HP 6890 Series gas chromatograph with GERSTEL MultiPurpose Sampler MPS 2XL with ECD and FID detector | Agilent technologies, Santa Clara USA | ||
| Presure fluid extractor, Speed Extractor E-916 | Buchi, Flawil, Switzerland | ||
| Solid phase extractor | Supleco, Sigma-Aldrich Bellefonte, PA, USA | ||
| Concentrator miVac DUO | Genevac SP Scientific, Suffolk UK | ||
| GC capillary column Zebron ZB-XLB (30 x 0.25 x 0.25) | Phenomenex, Torrance, CA, USA | 122-1232 | |
| ATR FT-IR Spectrometer, Spectrum-Two | Perkin Elmer |
Referenzen
- Plastic Europe. . Plastics - the Facts 2015. An analysis of European plastics production, demand and waste data. , (2017).
- Wang, J., Tan, Z., Peng, J., Qiu, Q., Li, M. The behaviors of microplastics in the marine environment. Mar Environ Res. 113, 7-17 (2016).
- UNEP. . Marine plastic debris and microplastics - Global lessons and research to inspire action and guide policy change. , (2016).
- Ogata, Y., et al. International Pellet Watch: Global monitoring of persistent organic pollutants (POPs) in coastal waters. 1. Initial phase data on PCBs, DDTs, and HCHs. Mar Pollut Bull. 58 (10), 1437-1446 (2009).
- Andrady, A. L. Microplastics in the marine environment. Mar Pollut Bull. 62 (8), 1596-1605 (2011).
- Antunes, J. C., Frias, J. G. L., Micaelo, A. C., Sobral, P. Resin pellets from beaches of the Portuguese coast and adsorbed persistent organic pollutants. Estuarine Coastal Shelf Sci. 130, 62-69 (2013).
- Cole, M., Lindeque, P., Halsband, C., Galloway, T. S. Microplastics as contaminants in the marine environment: A review. Mar Pollut Bull. 62 (12), 2588-2597 (2011).
- Takada, H. Call for pellets! International Pellet Watch Global Monitoring of POPs using beached plastic resin pellets. Mar Pollut Bull. 52 (12), 1547-1548 (2006).
- Teuten, E. L. Transport and release of chemicals from plastics to the environment and to wildlife. Phil Trans R Soc B. 364, 2027-2045 (2009).
- Heskett, M., et al. Measurement of persistent organic pollutants (POPs) in plastic resin pellets from remote islands: Toward establishment of background concentrations for International Pellet Watch. Mar Pollut Bull. 64 (2), 445-448 (2012).
- Besseling, E., Wegner, A., Foekema, E., Van Den Heuvel-Greve, M., Koelmans, A. A. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina (L.). Environ Sci Technol. 47 (1), 593-600 (2013).
- Rochman, C. M., Hoh, E., Kurobe, T. The SJ Ingested plastic transfers hazardous chemicals to fish and induces hepatic stress. Sci Rep. 3, 3263 (2013).
- Endo, S., et al. Concentration of polychlorinated biphenyls (PCBs) in beached resin pellets: Variability among individual particles and regional differences. Mar Pollut Bull. 50 (10), 1103-1114 (2005).
- Frias, J. P. G. L., Sobral, P., Ferreira, A. M. Organic pollutants in microplastics from two beaches of the Portuguese coast. Mar Pollut Bull. 60 (11), 1988-1992 (2010).
- Karapanagioti, H. K., Endo, S., Ogata, Y., Takada, H. Diffuse pollution by persistent organic pollutants as measured in plastic pellets sampled from various beaches in Greece. Mar Pollut Bull. 62 (2), 312-317 (2011).
- Mizukawa, K., et al. Monitoring of a wide range of organic micropollutants on the Portuguese coast using plastic resin pellets. Mar Pollut Bull. 70 (1-2), 296-302 (2013).
- Gauquie, J., Devriese, L., Robbens, J., De Witte, B. A qualitative screening and quantitative measurement of organic contaminants on different types of marine plastic debris. Chemosphere. 138, 348-356 (2015).
- Yeo, B. G., et al. POPs monitoring in Australia and New-Zealand using plastic resin pellets, and International Pellet Watch as a tool for education and raising public awareness on plastic debris and POPs. Mar Pollut Bull. 101 (1), 137-145 (2015).
- Kovač Viršek, M., Palatinus, A., Koren, &. #. 3. 5. 2. ;., Peterlin, M., Horvat, P., Kržan, A. Protocol for microplastics sampling on the sea surface and sample analysis. J Vis Exp. (118), e55161 (2016).
- Löder, M. G. J., Kuczera, M., Mintenig, S., Lorenz, C., Gerdts, G. Focal plane array detector- based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples. Environ Chem. 12 (5), 563-581 (2015).
- . . Stockholm Convention on Persistent Organic Pollutants (POPs) as amended in 2009 . , (2017).
- EPA - Environmental protection Agency. . Method 3620C: Florisil Cleanup, part of Test Methods for Evaluating Solid Waste, Physical/Chemical Methods (2014). , (2017).
- Hirai, H., et al. Organic micropollutants in marine plastics debris from the open ocean and remote and urban beaches. Mar Pollut Bull. 62 (8), 1683-1692 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten