Method Article
بروتوكول لتمييز الخلايا الجذعية المحفزة البشرية المستحثة في الثقافات المختلطة من الخلايا العصبية والجلد للاختبار العصبي
In This Article
Summary
وتعتبر الخلايا الجذعية المحفزة البشرية (هيبسس) أداة قوية للكشف عن المخدرات والكيمياء ولتطوير نماذج جديدة في المختبر لاختبار السمية، بما في ذلك السمية العصبية. هنا، ويرد وصف بروتوكول مفصل للتمايز هيبس في الخلايا العصبية والدبقية.
Abstract
يمكن الخلايا الجذعية المحفزة الإنسان التفريق في أنواع الخلايا المختلفة التي يمكن تطبيقها على المقايسات سمية في المختبر البشري. ميزة رئيسية هي أن إعادة برمجة الخلايا الجسدية لإنتاج الخلايا الجذعية المحفزة البشرية (هيبسس) يتجنب القضايا الأخلاقية والتشريعية المتعلقة باستخدام الخلايا الجذعية الجنينية البشرية (هيسس). يمكن توسيع هبسس وتمييزها بكفاءة في أنواع مختلفة من الخلايا العصبية والدبقية، بمثابة نظم اختبار لاختبار السمية، وعلى وجه الخصوص، لتقييم مسارات مختلفة تشارك في العصبية. يصف هذا العمل بروتوكول لتمايز هيبس في الثقافات المختلطة من الخلايا العصبية والدبقية. يتم تعريف مسارات الإشارات التي يتم تنظيمها و / أو تفعيلها من قبل التمايز العصبية. هذه المعلومات حاسمة لتطبيق نموذج الخلية على النموذج الجديد اختبار السمية، والتي يتم تقييم المواد الكيميائية على أساس قدرتها على بيرترب مسارات بيولوجية. وكدليل على المفهوم، تم استخدام روتنون، وهو مثبط للميتوكوندريا المعقدة الجهاز التنفسي الأول، لتقييم تفعيل مسار الإشارات Nrf2، وهو منظم رئيسي لآلية الدفاع الخلوية المضادة للأكسدة الاستجابة للعنصر (أر) المدفوعة ضد الإجهاد التأكسدي .
Introduction
وقد توخى تقرير مجلس البحوث الوطني الأمريكي ( 1) نموذجا جديدا لاختبار السمية يتم فيه نقل اختبار السمية التنظيمية من نهج يعتمد على التغيرات المظهرية التي لوحظت في الحيوانات إلى نهج يركز على المقايسات الآلية في المختبر باستخدام الخلايا البشرية. وقد تمثل مشتقات الخلايا الجذعية المحفزة (بسك) بدائل لنماذج الخلايا السرطانية، حيث أن الخلايا التي تم الحصول عليها قد تشبه بشكل وثيق الظروف الفسيولوجية للأنسجة البشرية وتوفر أدوات أكثر صلة لدراسة التأثيرات الضارة الناجمة عن المواد الكيميائية. إن النوعين الرئيسيين من ثقافات ال بسك التي تعد أكثر واعدة لاختبار السمية هي الخلايا الجذعية الجنينية البشرية (هيسس) والخلايا الجذعية المحفزة البشرية (هيبسس)، والتي تستخدم حاليا على نطاق واسع في مجالات البحوث الأساسية والطب التجديدي 2 ، 3 . ويمكن الآن الاستفادة من هذه الخبرة لتطوير فئة جديدة من السميةجيكال في المختبر الاختبارات التي تهدف إلى تحديد مسارات الفسيولوجية المضطربة المعنية مع تطور الآثار السلبية في الجسم الحي . ومع ذلك، من غير المرجح أن تقبل جميع الدول الأعضاء في الاتحاد الأوروبي والبلدان من جميع أنحاء العالم طرق الاختبار لتقييمات السلامة التنظيمية على أساس هيسس بسبب الشواغل الأخلاقية المحتملة والسياسات التشريعية الوطنية المتنوعة التي تنظم استخدام الخلايا المستمدة من الجنين.
هبسس خصائص حصة مماثلة ل هيسس 4 ، 5 وعقد إمكانات كبيرة لطرق في المختبر ، سواء لتحديد الأهداف العلاجية، فضلا عن تقييمات السلامة. وبالإضافة إلى ذلك، التكنولوجيا هيبسك يخفف من القيود من تجمع المانحين محدود والشواغل الأخلاقية المرتبطة الخلايا المستمدة من الجنين. ويتمثل أحد التحديات الرئيسية ل هبسس في الدليل على أن هذه الخلايا يمكن أن تولد بشكل متكرر مجموعة كبيرة من مشتقات الخلايا ذات الصلة السمية،مع الخصائص والاستجابات نموذجية من الأنسجة البشرية. وتستخدم عادة مستويات محددة مسبقا من علامات مختارة لتوصيف السكان الخلية بعد عملية التمايز وتقديم رؤى في استقرار عملية التمايز.
قيمت الأعمال السابقة مدى ملاءمة هيبس لتوليد ثقافات مختلطة من الخلايا العصبية والدبقية ولتقييم آثار روتينون، وهو مثبط للميتوكوندريا الجهاز التنفسي معقدة I، على تفعيل مسار Nrf2، منظم رئيسي للآليات الدفاع المضادة للأكسدة في العديد من أنواع الخلايا 6 ، 7 .
يصف هذا العمل بروتوكول يستخدم للتمايز من هبسس إلى الثقافات العصبية وبلقية مختلطة، وتوفير تفاصيل عن مسارات الإشارات (الجينات ومستوى البروتين) التي يتم تفعيلها على التمايز العصبية / الدبقية. بالإضافة إلى ذلك، يظهر العمل نتائج تمثيلية توضح كيفية ذلكيمكن استخدام نموذج الخلايا العصبية و الدبقية المستمدة من هيبسك لتقييم تنشيط الإشارات Nrf2 الناجم عن العلاج الحاد (24 ساعة) مع روتينون، مما يسمح بتقييم تحريض الإجهاد التأكسدي.
وقد أعيد برمجة الخلايا الليفية IMR90 في هبسس في I-ستيم (فرنسا) عن طريق التنبيغ الفيروسي من 2 عوامل النسخ (Oct4 و Sox2) باستخدام ناقلات بميغ 6 . ويمكن أيضا تطبيق نماذج هيبسك مماثلة. البروتوكولات الموصوفة أدناه تلخص جميع مراحل تمايز هبسس في الخلايا الجذعية العصبية (نسس) وكذلك إلى الثقافات المختلطة من الخلايا العصبية ما بعد الانقسامية والخلايا الدبقية (الخطوات 1 و 2، انظر أيضا موقع إورل إكفام دبالم على وصف مفصل ل البروتوكول) 8 .
يتم تفصيل بروتوكول إضافي للعزل، والتوسع، الحفظ بالتبريد، ومزيد من التمايز نسس في الخلايا العصبية مختلطة والخلايا الدبقية في الخطوات 3 و 4 (راجع أيضا إلى إورل إكفام دبالم نحنبسيت للحصول على وصف مفصل لهذا البروتوكول) 9 . وتصف الخطوة 5 التحليلات التي يمكن القيام بها لتقييم الهوية المظهرية للخلايا خلال مراحل عديدة من الالتزام والتمايز.
Protocol
1. الإنسان المستحثة الخلايا الجذعية المحفزة (هيبسك) التوسع
ملاحظة: هيبسس يمكن تربيتها على مناسبة الركيزة مزيج البروتين في وجود المتوسطة mTeSR1 تحتوي على ملاحق mTeSR1 5X (أعدت بعد تعليمات الشركة المصنعة، لوحة ~ 100 شظايا مستعمرة / طبق بتري 60 ملم). عندما تصل مستعمرات هيبسك الحجم المناسب (انظر مثال لمستعمرة في الشكل 2A )، مرور الخلايا كما هو موضح أدناه (مرة واحدة في الأسبوع).
- أطباق معطف مع مصفوفة غشاء الطابق السفلي هيسك المؤهلين (ويسمى فيما بعد "مصفوفة المؤهلين") أو أي الركيزة البروتين مناسبة أخرى.
- تخزين مصفوفة المؤهلين (انظر جدول المواد ) في -80 درجة مئوية في قسائم 200 ميكرولتر في أنابيب 1.5 مل الباردة والمبرد 5 أو 10 مل ماصات.
- قبل تمرير، ذوبان الجليد 200 ميكرولتر من مصفوفة المؤهلين على الجليد.
- تمييع 200 ميكرولتر من مصفوفة المؤهلين في 20 ملتر من دمم / F12 المتوسطة (1: 100 التخفيف).
- معطف 60 ملم أطباق بتري مع هذا الحل (5 مل / طبق).
- احتضان الأطباق المغلفة في 37 درجة مئوية لمدة 1 ساعة على الأقل.
- هيبسك جزء مستعمرة الحفظ بالتبريد والتذويب
- بعد قطع المستعمرات هيبسك (انظر الخطوة 1.3 لإجراء قطع مستعمرة هيبسك)، بلطف و ببطء ريسوسبيند شظايا مستعمرة هيبسك في وسط تجميد الخلايا الجذعية، ~ 100 شظايا / 250 ميكرولتر (انظر جدول المواد).
- قسامة شظايا مستعمرة في قارورة مناسبة لحفظ بالتبريد (250 ميكرولتر / قارورة).
- وضع قارورة في حاوية مليئة 2-بروبانول ووضع الحاوية في -80 درجة مئوية لمدة لا تقل عن 2 ساعة وما يصل إلى 2 أسابيع.
- نقل القوارير إلى مرحلة بخار خزان النيتروجين السائل.
- لإعادة تشغيل الثقافة، ذوبان الجليد 1 قارورة مجمدة في حمام مائي عند 37 درجة مئوية.
- جمع بلطف شظايا مستعمرة هيبسك في 7 مل من هيبسك قبل تحسنت كاملةمتوسطة (انظر جدول المواد ) في أنبوب 15 مل باستخدام 1، 2، أو 5 مل ماصة.
- أجهزة الطرد المركزي شظايا مستعمرة هيبسك في 130 x ج لمدة 3 دقائق.
- إزالة طاف و ريسوسبيند بلطف شظايا مستعمرة هيبسك في 1 مل من المتوسطة هيبسك كاملة باستخدام ماصة 1 أو 2 أو 5 مل.
- مزيد من تمييع تعليق الخلية في 3 أو 4 مل من المتوسطة هيبسك كاملة.
- لوحة شظايا مستعمرة هيبسك في مصفوفة المغلفة مصفوفة طبق بتري 60 ملم (~ 100 شظايا / طبق؛ معطف الأطباق كما هو موضح في الخطوة 1.1).
- احتضان هيبسس عند 37 درجة مئوية و 5٪ كو 2 .
- إجراء التغيير المتوسط الكلي كل يوم.
- مرور المستعمرات هيبسك
ملاحظة: يجب أن تكون هيبسس غير متمايزة جولة في الشكل، مع نوى كبيرة وبدون السيتوبلازم وفيرة. وينبغي أن تتميز المستعمرات غير المتمايزة من قبل المورفولوجيا شقة ومعبأة بإحكام. فقط مستعمرات غير متمايزة (حوالي 1 ملم طن القطر) يجب قطع لمزيد من المرور.- قطع المستعمرات الخلايا الجذعية في الساحات من حوالي 200 ميكرون × 200 ميكرون باستخدام حقنة 1 مل مع إبرة 30G أو أي غيرها من الأدوات المتاحة تجاريا (انظر جدول المواد). استخدام مجهر مجسمة في التكبير 4x في مجلس الوزراء تدفق الصفحي في درجة حرارة الغرفة.
- فصل شظايا مستعمرة من سطح الطبق باستخدام ماصة 200 ميكرولتر من قبل بيبتينغ بلطف وسط تحتها لرفع القطع.
- نقل شظايا مستعمرة (~ 100 قطعة) إلى مصفوفة مؤهلة-دمم / F12 المغلفة لوحة مليئة 4 مل من المتوسطة هيبسك كاملة (انظر جدول المواد؛ معطف الأطباق كما هو موضح في الخطوة 1.1).
- احتضان لوحة جديدة (ق) في 37 درجة مئوية و 5٪ كو 2 .
- إجراء التغيير المتوسط الكلي كل يوم وفحص التشكل من المستعمرات باستخدام مرحلة التباينميكروسكوب في 4X و 10 X التكبير.
2. هبسك ديفيرنتياتيون إلى الخلايا العصبية المختلطة و غليا
ملاحظة: يستغرق الإجراء حوالي 28 يوما لإكمال، مع الخطوات الرئيسية المبينة في الشكل 1 (الجزء العلوي).
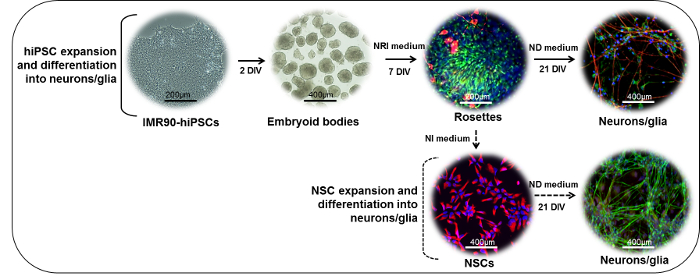
الشكل 1: التمثيل التخطيطي لبروتوكول التمايز العصبية. (الجزء العلوي) يمكن تقسيم مستعمرات IMR90-هيبسك إلى شظايا لتشكيل الأجسام الجنينية (إبس). بعد يومين في المختبر (ديف)، يمكن أن تكون مطلية إبس على أطباق laminin- أو المصفوفة المغلفة القياسية والمثقفة في وجود وسط تحريض الظهارية (نري) لتوليد مشتقات نيوروكتوديرمال (وريدات، ملطخة هنا ل نستن (الأخضر) و β -III-توبولين (أحمر)). روزيتس يمكن فصلها، وجمعها، أعدت على laminin- أو أطباق مصفوفة المغلفة القياسية، ومزيد من التفريق في الخلايا العصبية ناضجة (NF200 والأحمر) وبيقية(غفاب، الأخضر) الخلايا في وجود التمايز الخلايا العصبية (ند) المتوسطة. (الجزء السفلي) نسس المستمدة من روزيت (نستن والأحمر) يمكن توسيعها في وجود الحث العصبي (ني) المتوسطة، كريوبريزرفيد، أو أكثر متباينة في وجود وسط ند لتشكيل الخلايا العصبية مختلطة (NF200 والأخضر) وبيضاوية ( غفاب، الأحمر) الثقافات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- جيل من الأجسام الجنينية (إبس) (أيام 0 → 1)
ملاحظة: يتطلب هذا الإجراء مهارات يدوية جيدة والدقة. يجب أن تكون شظايا مستعمرة هيبسك متساوية الحجم للحصول على أجسام متجانسة متجانسة (إبس) في الخطوات التالية. وينبغي استبعاد المستعمرات متباينة شكليا (مع الكسور السيتوبلازمية الكبيرة والنوى الصغيرة).- تحديث المتوسطة هيبسك (3 مل / 60 ملم طبق بتري) قبل قطع مستعمرات هيبسك غير متمايزة (حوالي 1 ملم في ديامإيتر، انظر الشكل 2A ) في ظل ظروف معقمة (كما هو موضح في الخطوة 1).
- قطع المستعمرات غير متمايزة (كما هو مبين في الشكل 2A والشكل 2B ) إلى شظايا ما يقرب من 200 ميكرون × 200 ميكرون باستخدام حقنة 1 مل مع إبرة 30G. استخدام مجهر مجسمة في 4X التكبير في مجلس الوزراء تدفق الصفحي في درجة حرارة الغرفة.
- فصل شظايا مستعمرة من سطح الطبق باستخدام ماصة 200 ميكرولتر من قبل بيبتينغ بلطف المتوسطة تحتها لرفع القطع.
- نقل جميع شظايا منفصلة والمتوسطة إلى أنبوب 15 مل باستخدام 1، 2، أو 5 مل ماصة.
- شطف الطبق مع 2 مل من المتوسطة هيبسك كاملة لاسترداد جميع شظايا.
- أجهزة الطرد المركزي في 112 x ج لمدة 1 دقيقة.
- نضح طاف و ريسوسبيند بلطف شظايا في 5 مل من هبسك إب المتوسطة المتوسطة (انظر جدول المواد ).
- لوحة المشاركشظايا لوني في مرفق منخفض جدا 60 ملم طبق بتري (5 مل / 60 ملم طبق بتري).
- احتضان طبق بيتري بين عشية وضحاها في 37 درجة مئوية و 5٪ كو 2 .
- في اليوم التالي (يوم 1)، وجمع إبس والمتوسطة في أنبوب 15 مل باستخدام 1، 2، أو 5 مل ماصة.
- أجهزة الطرد المركزي إبس في 112 x ج لمدة 1 دقيقة.
- نضح بعناية طاف و ريسوسبيند بلطف إبس في 5 مل من هبسك إب المتوسطة المتوسطة باستخدام ماصة 1 أو 2 أو 5 مل.
- ريبليت إبس على جديد 60 ملم منخفضة جدا مرفق طبق بتري (5 مل / 60 ملم طبق بتري).
- احتضان طبق بيتري بين عشية وضحاها في 37 درجة مئوية و 5٪ كو 2 .
- في يوم 1، معطف الأطباق مع مصفوفة الغشاء القاعدي (على سبيل المثال، ماتريجيل، المشار إليها فيما يلي باسم "مصفوفة القياسية") أو أي الركيزة البروتين مناسبة أخرى (على سبيل المثال ، لامينين).
- تخزين مصفوفة القياسية (انظر جدول المواد ) في -80 درجة مئوية في200-ميكرولتر أليكوتس باستخدام الباردة 1.5 مل أنابيب والمبرد 5 أو 10 مل ماصات.
- ذوبان الجليد 200 ميكرولتر من المصفوفة القياسية على الجليد.
- تمييع 200 ميكرولتر من مصفوفة القياسية في 20 مل من دمم / F12 المتوسطة (1: 100 التخفيف).
- معطف 60 ملم أطباق بتري مع هذا الحل (5 مل / طبق).
- احتضان الأطباق المغلفة عند 37 درجة مئوية خلال الليل.
ملاحظة: سيتم استخدام هذه الأطباق لصفيحة إبس (حوالي 50 إبس / طبق) وتوليد المجاميع العصبية الظهارية (وريدات). راجع الخطوة 2.3.
- جيل من المجاميع العصبية الظهارية (روزيتس) (أيام 2 → 7)
- في يوم 2، وإزالة حل مصفوفة طلاء القياسية من أطباق بتري 60 ملم (لا حاجة لشطف لوحات) وملء لهم 5 مل / طبق من وسط الحث العصبي الكامل (نري)؛ انظر جدول المواد .
- نقل إبس العائمة (من الخطوة 2.1.14) إلى الأطباق المغلفة (~ 50 إبس / طبق) باستخدام ماصة 200 ميكرولتر تحت ميري مجسمةكروسكوب في التكبير 4x ووضعها في مجلس الوزراء تدفق الصفحي.
ملاحظة: من الأهمية بمكان لتحديد متجانسة، متوسطة الحجم إبس (~ 200-300 ميكرون في القطر). إبس صغيرة جدا قد لا البقاء على قيد الحياة بشكل جيد خلال التمايز نيوروكتوديرمال، في حين أن إبس كبيرة جدا تميل إلى الخضوع نخر الأساسية. - احتضان الأطباق في 37 درجة مئوية و 5٪ كو 2 .
- في اليوم التالي (يوم 3)، والتحقق من الأطباق تحت المجهر في التكبير 10X لضمان أن يتم إرفاق جميع إبس.
- قم بإجراء تغيري متوسط إمجايل مع وسط غري كامل.
- تغيير المتوسطة نري كل يوم حتى يوم 7، عندما المجاميع العصبية الظهارية (روزيتس) يجب أن تكون مرئية.
- في يوم 7، مصفوفة القياسية معطف (أو لامينين)، كما هو موضح في الخطوة 2.2، على أي لوحة المطلوبة أو شكل طبق: لوحات 96 جيدا (100 ميكرولتر / جيدا)، لوحات 24 جيدا (250 ميكرولتر / جيدا)، 12- (500 ميكرولتر / جيدا)، رقائق ميي (للنشاط الكهربائي، 1 مل / رقاقة واحدة جيدا)، أو 60 ملم بيتري ديش(4 مل / طبق).
- احتضان لوحات المغلفة / أطباق لمدة 2 ساعة على الأقل عند 37 درجة مئوية و 5٪ كو 2 .
- روزيت التفكك والتمايز الخلايا العصبية (أيام 8 → 28)
ملاحظة: يتطلب هذا الإجراء مهارات يدوية جيدة والدقة. لتجنب جمع الأديم الأديم وخلايا الأديم، يجب أن تفكك فقط الأديم الظاهر الأودية مثل هياكل وجمعها.- في يوم 8، وقطع الهياكل تشبه روزيت في شظايا تحت المجهر مجسمة في 10X التكبير في ظروف معقمة. استخدام حقنة 1 مل مع إبرة 30G. لاحظ أن ورود تميل إلى فصل بسهولة من الطبق عند لمسها مع الإبرة.
- استكمال مفرزة شظايا روزيت باستخدام ماصة 200 ميكرولتر.
- نقل الطبق تحت غطاء محرك السيارة تدفق الصفحي وجمع شظايا روزيت ووسطها في أنبوب مخروطي 15 مل باستخدام 1، 2، أو 5 مل ماصة. شطف الطبق مع 2 مل من نري المتوسطة لاستردادكل شظايا.
- تدور أسفل شظايا روزيت في 112 x ج لمدة 2 دقيقة.
- نضح طاف.
- ريسوسبيند بلطف بيليه في 1 مل من دبس 1X (دون الكالسيوم والمغنيسيوم) وماصة بلطف شظايا روزيت صعودا وهبوطا باستخدام ماصة 1000 ميكرولتر لفصلها جزئيا.
- إضافة 4 مل من المتوسطة نري كاملة واعتماد الخلايا التي تستخدم الأزرق التريبان وعداد الخلية الآلي (انظر جدول المواد )
ملاحظة: تمييع 20 ميكرولتر من تعليق خلية في 20 ميكرولتر من الأزرق تريبان. قد يتم حذف هذه الخطوة إذا كان لا يمكن جلب الخلايا إلى تعليق خلية واحدة. إذا شظايا روزيت لا تبدو منفصلة تماما، ورود شظايا المستمدة من حوالي 50 إبس / 60 ملم طبق يمكن معلق في 50 مل من نري كاملة المتوسطة ومطلي، كما هو مبين في الجدول 1 . - نضح المصفوفة القياسية (أو لامينين) حل طلاء من أطباق بتري، لوحات، و / أو رقائق ميي (من الخطوة 2.3.7). لا تدع لهم الجافة.
- لوحة الخلايا في وسط نري كاملة وفقا لخطة الدراسة (حوالي 15،000 خلية / سم 2 ؛ انظر الجدول 1 للطلاء مؤشرات حجم).
- احتضان لوحات بين عشية وضحاها في 37 درجة مئوية و 5٪ كو 2 .
- في يوم 10، إجراء التغيير المتوسط الكلي باستخدام كامل التمايز الخلايا العصبية (ند). انظر جدول المواد.
- تحديث وسط ند الكامل مرتين في الأسبوع حتى يوم 28.
- تميز مشتقات الخلايا العصبية / الدبقية، كما هو موضح في الخطوة 5 (انظر الجدول 2 لمعايير القبول العامة).
3. الخلايا الجذعية العصبية المستمدة من هيبسك (نسك) التوسع والتمايز في الخلايا العصبية المختلطة و غليا
ملاحظة: نسس المستمدة من شظايا روزيت يمكن توسيعها وصيانتها بعد الإجراء الموصوف أدناه ( الشكل 1 ، الجزء السفلي). وهذا يسمح لزيادة ثه عدد من الخلايا للتمايز والاختبار الكيميائي.
- معطف طبق بتري 60 ملم (أو قارورة T-25) مع 5 مل من مصفوفة معيار دمم / F12 حل طلاء واحتضان ذلك لمدة 2 ساعة على الأقل في 37 درجة مئوية و 5٪ كو 2 (كما هو موضح في الخطوة 2.2).
- تدور أسفل شظايا روزيت المستمدة من الخطوات 1-2 (انظر الخطوة 2.4) في أنبوب مخروطي 15 مل في 112 x ج لمدة 2 دقيقة.
- ريسوسبيند بلطف بيليه في 5 مل من الوسط الحث العصبي (ني). انظر جدول المواد.
- نقل الخلايا على مصفوفة القياسية طبق بتري مصفوفة 60 مم (أو قارورة T-25).
- ثقافة نسس المستمدة من روزيت في وجود ني المتوسطة، منعش المتوسطة كل يوم حتى تصل الخلايا تصل التقاء.
- عندما متموجة، مرور نسس كما هو موضح في الخطوات التالية.
ملاحظة: مرور نسس عن مرة واحدة في الأسبوع. والنظر في استخدام أطباق المغلفة طازجة، قوارير، أو لوحات، اعتمادا على خطة الدراسة. - إزالة المتوسطة ني كاملة و جينتلش شطف نسس مع دبس (دون الكالسيوم والمغنيسيوم).
- إضافة 1.5 مل من 0.05٪ التربسين إدتا قبل تحسنت إلى 37 درجة مئوية إلى طبق بتري 60 ملم (أو قارورة T-25) التي تحتوي على الخلايا ووضعه في الحاضنة لمدة 1 دقيقة.
- اضغط بلطف على الطبق (أو قارورة) لفصل الخلايا.
- إضافة 1.5 مل من المانع التربسين قبل تحسنت إلى 37 درجة مئوية ونقل الخلايا إلى أنبوب 15 مل.
- شطف طبق بتري (أو قارورة T-25) مع حجم مساو من ني المتوسطة (1.5 مل) وجمع حجم في نفس أنبوب 15 مل.
- أجهزة الطرد المركزي الخلايا في 130 x ج لمدة 3 دقائق.
- إزالة ريسوسبيند طاف وبلطف الخلايا في 1 مل من المتوسطة ني كاملة باستخدام ماصة 1000 ميكرولتر.
- مزيد من تمييع تعليق الخلية في 3 أو 4 مل من المتوسطة ني كاملة وعد الخلايا باستخدام التريبان الأزرق وعداد الخلية الآلي.
- لوحة نسس على طبق بتري 60 ملم (أو قارورة T-25) من الخطوة 3.1 في كثافة حوالي 50،000 خلية / سم 2 .
- إجراء التغيير المتوسط الكلي مع المتوسطة ني كاملة كل يوم.
- تميز الخلايا لوجود مشتقات الخلايا العصبية / الدبقية، كما هو موضح في الخطوة 5.
ملاحظة: نسس يمكن أن تكون متباينة في الثقافات المختلطة من الخلايا العصبية والدبقية في وسط ند الكامل (كما هو موضح في الخطوات 2.4.11-2.4.13)، ومنعش ند المتوسطة كاملة مرتين في الأسبوع لمدة 21 يوما.
4. المستمدة من هسك-نسك الحفظ بالتبريد والتذويب
ملاحظة: عند مرور، نسس يمكن تجميد وإعادة ذوبان بعد هذا الإجراء.
- أجهزة الطرد المركزي ممر نسس (من الخطوة 3.12) في 130 x ج لمدة 3 دقائق.
ملاحظة: يجب أن تحسب الخلايا في الخطوة 3.14. - ببطء وببطء ريسوسبيند نسس في 3 × 10 6 / مل من التجميد المتوسطة (انظر جدول المواد ).
- قسامة الخلايا في قارورة مناسبة لحفظ بالتبريد (حوالي 0.5 مل = 1.5 × 10 6 / قارورة).
- ضع القوارير في وعاء فيمع 2-بروبانول ووضع الحاوية في -80 درجة مئوية لمدة لا تقل عن 2 ساعة وحتى 2 أسابيع.
- نقل القوارير إلى مرحلة بخار خزان النيتروجين السائل.
- لإعادة تشغيل ثقافة الخلية، ذوبان الجليد 1 قارورة المجمدة في حمام مائي عند 37 درجة مئوية.
- جمع بلطف الخلايا في 7 مل من قبل تحسنت المتوسطة ني المتوسطة في أنبوب 15 مل باستخدام ماصة 1000 ميكرولتر.
- أجهزة الطرد المركزي الخلايا في 130 x ج لمدة 3 دقائق.
- إزالة طاف و ريسوسبيند بلطف الخلايا في 1 مل من المتوسطة ني كاملة باستخدام ماصة 1000 ميكرولتر.
- مزيد من تمييع تعليق الخلية في 3 أو 4 مل من المتوسطة ني كاملة و عد الخلايا باستخدام الأزرق التريبان و عداد الخلية الآلي (ملاحظة: تمييع 20 ميكرولتر من تعليق الخلية في 20 ميكرولتر من الأزرق التريبان، وينبغي أن تكون الجدوى بعد الذوبان ≥ 80 ٪).
- لوحة نسس في المغلفة طبق بتري 60 ملم (أو قارورة T25) بكثافة حوالي 50،000 خلية / سم 2 .
5 - شاراتبلس الخلايا المستمدة من الخلايا العصبية والخلايا الدبقية
ملاحظة: عند التمايز، يمكن تمييز المشتقات العصبية و الدبقية باستخدام تقنيات مختلفة، مثل تلك الموصوفة في الأقسام التالية.
- الكمي في الوقت الحقيقي ير (قر) يحلل 10
- تدور أسفل شظايا مستعمرة هيبسك، إبس، و / أو نسس في 130 x ج لمدة 3 دقائق.
- ريسوسبيند الخلية بيليه في 100 ميكرولتر من العازلة رنا الباردة تحلل المنصوص عليها في عدة مناسبة لاستخراج الحمض النووي الريبي.
- بدلا من ذلك، وجمع المشتقات العصبية / الدبقية مباشرة من لوحات عن طريق الشفط المتوسطة وإضافة الباردة رنا تحلل العازلة إلى الآبار لجمع الخلايا.
- عزل الرنا بعد تعليمات الشركة الصانعة.
- عكس النسخ 500 نانوغرام من الحمض النووي الريبي مجموع باستخدام مجموعة مناسبة ل رنا إلى كدنا ريتروترانسكريبتيون.
- تشغيل ردود الفعل قر في تكرار باستخدام مزيج الرئيسي المناسب والتمهيديمجموعات (انظر جدول المواد ).
- تسجيل الانبعاث الفلورسنت في الوقت الحقيقي: 45 دورات مع الاشعال الصلب في 60 درجة مئوية.
- تطبيع كميات رنا النسبية ل غابد و β-أكتين كجينات مرجعية واستخدام هبسس غير متمايزة أو الخلايا غير المعالجة لظروف معايرة (طريقة ΔΔCt). بدلا من ذلك، استخدم طريقة أخرى مناسبة.
- إمونوسيتوشيميستري والتصوير عالية المحتوى (هسي) 6 ، 11
- إصلاح المستعمرات هيبسك، نسس، و / أو المشتقات العصبية / الدبقية مع بارافورمالدهيد باردة 4٪ لمدة 15 دقيقة في درجة حرارة الغرفة.
- غسل بلطف الخلايا في برنامج تلفزيوني 1X وتخزين لوحات في 4 درجات مئوية لمدة تصل إلى 1 شهر.
- عندما تكون جاهزة للتلطيخ، بيرمابيليز الخلايا في بيرمابيليزاتيون العازلة (1X دبس تحتوي على 0.1٪ تريتون-X-100 و 3٪ بسا) لمدة 15 دقيقة في درجة حرارة الغرفة.
- إزالة بيرمابيليزاتيون بوفر واحتضان الخلايا في عرقلة العازلة (3٪ بسا / 1X دبس) لمدة 15 دقيقة في درجة حرارة الغرفة لمنع ملزمة غير محددة من الأجسام المضادة.
- إزالة العازلة حظر واحتضان الخلايا بين عشية وضحاها في 4 درجات مئوية في عرقلة عازلة تحتوي على الأجسام المضادة الأولية المناسبة (انظر جدول المواد ).
- غسل الخلايا 3 مرات مع برنامج تلفزيوني 1X.
- احتضان الخلايا لمدة 45 دقيقة في درجة حرارة الغرفة في عرقلة العازلة التي تحتوي على الأجسام المضادة الثانوية مترافق فلوريوكروم مترافق (انظر جدول المواد )، كونترستينينغ النوى مع صبغ دابي.
- تحديد متوسط كثافة مضان والنسب المئوية النسبية لأنواع الخلايا باستخدام منصة التصوير عالية المحتوى مناسبة، إذا كانت متوفرة (انظر جدول المواد ).
ملاحظات: لتحديد مستوى شدة الخلفية الفلورسنت، احتضان بعض الخلايا / الآبار مع الأجسام المضادة الثانوية وحدها. تحليل تدفق سايتوميتريك من العيش (غير ثابتة)، أونديمكن تنفيذ هبسس غير متمايزة لتقييم التعبير عن علامات محددة بسك، مثل SSEA4 (انظر جدول المواد ). ويمكن تحليل مستعمرات هيبسك غير المتمايزة لنشاط الفوسفاتيز القلوي باستخدام مجموعات بسيب / نبت المتاحة تجاريا، وفقا لتعليمات الشركات الصانعة (انظر جدول المواد ). بالإضافة إلى ذلك، يمكن إجراء مقايسات مجموعة البروتينات العكسية (ربا) والتحليلات، كما هو موضح في المرجع 12 (للحصول على قائمة الأجسام المضادة التي تم اختبارها، انظر جدول المواد ).
- القياسات الكهربية 13
- لوحة شظايا روز منفصلة (بعد 7 ديف) أو نسس مشتقة من وريدات على صفائف مولتيلكترود المغلفة (الاتفاقات البيئية المتعددة الأطراف؛ انظر جدول المواد ) في وسط ند الكامل (~ 1 × 10 5 خلايا / واحدة جيدا رقاقة ميي ).
- التفريق بين الخلايا لمدة 3 أسابيع في وسط ند كاملة، منعش ثe متوسط مرتين في الأسبوع.
- في نهاية التمايز، ختم رقائق الشرق الأوسط وأفريقيا مع غشاء شبه نفاذية تحت غطاء تدفق الصفحي للحفاظ على الثقافات العقيمة للقياسات المتكررة.
- استبدال واحد من الأقطاب مع إشارة أرضية واحدة، مما يسمح للتسجيلات من الأقطاب المتبقية.
- تسجيل معدل اطلاق متوسط (مفر؛ عدد من المسامير / دقيقة) باستخدام مكبر للصوت ميي مع التحكم في درجة الحرارة المتكاملة عملية تعديلها إلى 37 درجة مئوية و 5٪ كو 2 .
- كشف القمم من البيانات الخام ميي باستخدام حد عتبة -4.7σ (σ يمثل الانحراف المعياري للضوضاء القاعدية).
- معالجة بيانات ما بعد التسجيل مع برنامج مناسب.
النتائج
توصيف هبسس غير متمايزة
لتقييم النمط الظاهري لل هيبسس، وتحليل المستعمرة / خلية التشكل، وتحديد علامات بسك محددة، وفحص التعبير الجيني والنشاط الفوسفات القلوية يجب أن يؤديها. وينبغي أن تكون هبسس غير متمايزة جولة، مع نوى كبيرة وبدون السيتوبلازم وفيرة. يجب أن تتسم غالبية المستعمرات من التشكل شقة ومعبأة بإحكام، مؤشرا على النمط الظاهري غير متمايزة ( الشكل 2A والشكل 2B ). بالإضافة إلى ذلك، أكثر من 80٪ من المستعمرات يجب أن تكون إيجابية لالقلوية الفوسفاتيز تلطيخ النشاط ( الشكل 2C ).
حوالي 80٪ من الخلايا يجب أن تكون إيجابية للعلامات ذات الصلة متعددة القدرات الكلاسيكية، مثل Oct4، S( 2-H )، كما هو موضح من قبل الكيمياء المناعية والتدفق الخلوي، في حين أن نسب نستين + و β-إي-توبولين + الخلايا يجب أن تكون منخفضة بشكل ملحوظ (حوالي 8٪ و 3٪ على التوالي، كما هو مبين في الشكل 2H ). وينبغي أن تكون هذه النتائج قابلة للتكرار عبر المقاطع.
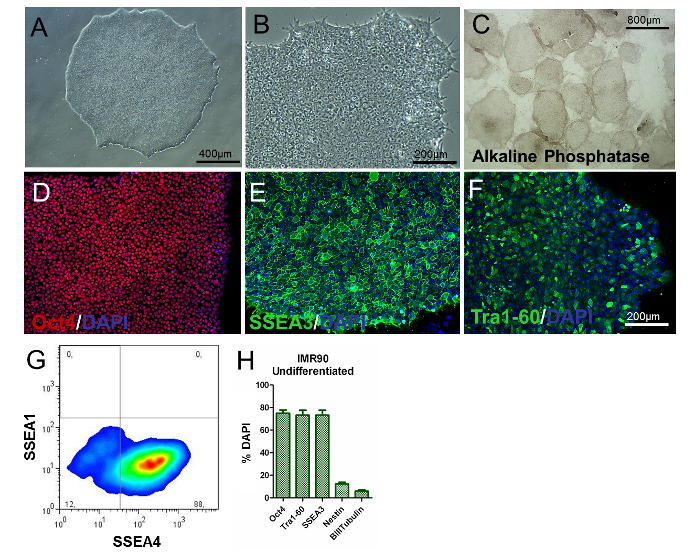
الشكل 2. توصيف IMR90-هيبس غير متمايزة. (A و B) الصور المتناظرة على الطور (10X و 20X التكبير) من مستعمرات IMR90-هيبسك غير متمايزة. (C) صور تمثيلية من المستعمرات الملطخة الفوسفاتيز القلوية (4X التكبير). ( دف ) ممثل الصور إمونوسيتوشيميكال من (D) Oct4 (الأحمر)، (E) SSEA3 (الأخضر)، و (F) ترa1-60 (أخضر). (G) ممثل نقطة مؤامرة من SSEA1 (CD15) و SSEA4 تلطيخ، وتحليلها عن طريق التدفق الخلوي. (H) يظهر الرسم البياني شريط النسب المئوية من Oct4 + (~ 75-80٪)، ترا1-60 + (~ 75-80٪)، SSEA3 + (~ 75-80٪)، نستن + (~ 10 - 15٪ )، و β-إي-توبولين + (~ 3 - 7٪) الخلايا، كونترستيند مع دابي وكميتها من قبل هسي، مع متوسط من 3 إلى 5 مكررات البيولوجية ± سيم (الرسم البياني تعديل من المرجع 6). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تقييم تعدد القدرات عن طريق تشكيل إب
هبسس هي متعددة القدرات، وهذا يعني أنها تعبر عن ثلاث جينات ذات صلة بالطبقة الجرثومية في ظل ظروف مناسبة. لتقييم تعدد القدرات هبسك، فمن الممكن تطبيق مشتركالنهج القائم على تشكيل إب عفوية، مما يدفع تشكيل الطبقات الجرثومية الثلاثة 14 . يجب أن تشير تحاليل الجينات الخاصة بالطبقة الجرثومية إلى زيادة تعتمد على الوقت من الأديم الباطن (α-فيتوبروتين (أف) و سيتوكيراتين 18 (KRT18))، الأديم الظاهر (نيستين، سري-بوكس 1 (Sox1)، والمربع المقترن 6 (Pax6) )، والأديم المتوسط (الببتيد الناتريوتريك A (نبا) و براشيوري-T) ذات الصلة التعبير الجيني ( الشكل 3A والشكل 3B ). انظر جدول المواد.
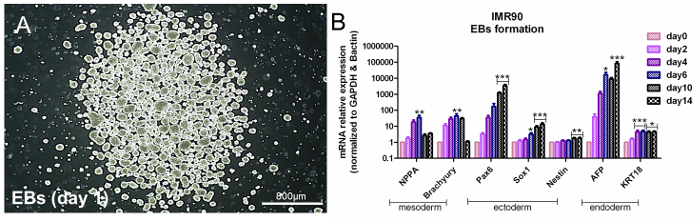
الشكل 3. تقييم تعدد القدرات عن طريق تشكيل إب. (A) ممثل صورة على النقيض من المرحلة إبس في اليوم 1. (B) يظهر الرسم البياني شريط تحليلات قر من الأديم المتوسط (نبا و براشيوري)، الأديم الظاهر (Pax6، Sox1، نستن)، والأديم (أف و KRT18 ) الجينات، تطبيع إلى الجينات المرجعية، β-أكتين و غابد، ومعايرة إلى خلايا غير متمايزة (يوم 0). هذه هي الطريقة ΔΔCt، بمتوسط 5 تحليلات مستقلة ± سيم = p <0،05، ** p <0.01، *** p <0.001؛ رسم بياني تعديل من مرجع 6. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تحريض التمايز العصبي و الدبقية
IMR90-إيبسس يمكن أن تكون متباينة في الثقافات المختلطة من الخلايا العصبية بعد الانقسامية والخلايا الدبقية التالية الخطوات الموجزة في الشكل 1 وفي أقسام البروتوكول. 5-8 أيام بعد تصفيح إبس على أطباق مصفوفة القياسية أو لامينين في وجود المتوسطة نري كاملة، يجب أن تبدأ الهياكل مثل روزي تصبح مرئية (= "زفيغ"> الشكل 4A). وتتميز روزيتس بوجود نستين + الخلايا (السلائف العصبية، ~ 90٪)، مع عدد قليل من β-إي-توبولين + الخلايا (الخلايا العصبية الملتزمة، ~ 5-10٪)، وهذا الأخير عموما مترجمة بشكل رئيسي في محيط وزيت ( الشكل 4B ، ورود في يوم 12).
على تفكك روزيت و ريبلاتينغ على laminin- أو أطباق المصفوفة المغلفة القياسية أو لوحات في وجود المتوسطة ند كاملة، والخلايا تبدأ تمر التمايز إلى الثقافات المختلطة من الخلايا العصبية والدبقية، وتشكيل تدريجيا مجموعات من الهيئات الخلايا العصبية متصلة من قبل حزم من نيوريتس ( الشكل 4C والشكل 4D ). وينبغي الحصول على نتائج مماثلة عند تحليل السكان العصبية التي تم الحصول عليها عن طريق توسيع نسس المستمدة من روزي وتمييزها في الخلايا العصبية والدبقية. نسس الموسعة من ورود يجب أن يكون ناستين + ( الشكل 4E ، أقحم تظهر نستن + الخلايا).
بعد 21 يوما من التمايز، يجب أن تكون الخلايا إيجابية ل β-إي-توبولين. NF200. تاو. و MAP2، علامة الراحل من التشعبات ( الشكل 4D ، 4F، والشكل 4H)، مع ما لا يقل عن 10-15٪ من الخلايا إيجابية للبروتين الحمضية الليفي الحمضية (غفاب)، علامة أستروجليال ( الشكل 4G والشكل 4H) . وعلاوة على ذلك، ~ 20-30٪ من الخلايا يجب أن تحتفظ التعبير عن نستن بعد التمايز ( الشكل 4H ). من المهم أن نرى أن النسبة المئوية لكل نوع من الخلايا ( أي الخلايا العصبية ، الخلايا النجمية، نستين + الخلايا) قد تختلف عبر المقاطع، ويمكن ملاحظة التقلب التي تعتمد على المستخدم.
من خلال تحليل مجموعات فرعية فرعية الخلايا العصبية، الخلايا العصبية غابايرجيك ريبري(15 - 20٪ من مجموع الخلايا، والخلايا العصبية الدوبامين ~ 13 - 20٪، والخلايا العصبية غلوتاماترجيك ~ 35 - 42٪، كما هو موضح من قبل إمونوستينينغ للحمض غاما أمينوبوتيريك (غابا)، هيدروكسيلاز التيروزين (ث)، والجلوتامات الحويصلي الناقل 1 (VGlut1)، على التوالي (انظر الكمي ممثل في الشكل 4H ). ويمكن أيضا تقييم تحريض التمايز من خلال تحليل علامات ذات الصلة متعددة القدرات (على سبيل المثال، أكتوبر 4، ترا1-60، و SSEA3)، والتي ينبغي أن تكون أقل بكثير في خلايا متباينة مقابل هبسس غير متمايزة (لا يظهر، انظر المرجع 6). ويمكن أيضا أن يتم تأكيد هذا من خلال تحليل التعبير الجيني عن طريق قر، والتي ينبغي أن تشير إلى انخفاض في Oct4 و نانوغ و أوبريغولاتيون من الجينات العصبية، مثل الخلية العصبية التصاق جزيء 1 (NCAM1) والبروتين المرتبط ببولي إثيلين 2 (MAP2). الجين بريسينابتيك، سينابتوفيسين (سيب)؛ وجين ما بعد التشابك، تاو البروتين المرتبطة تبيب (مابت)، كما هو مبين في < سترونغ كلاس = "زفيغ"> الشكل 4I. وعلاوة على ذلك، فإن الدوبامين (ث و NR4A1)، نوادرينرجيك (PHOX2A و PHOX2B)، غلوتاماترجيك (NARG2، GRIA1 و GAP43)، غابايرجيك (GABRA1 و GABRA3)، والخلايا العصبية الحركية (ISL1 و LHX3)، و كولينرجيك (SLC5A7 و SLC18A13) والنتيجة في أوبريغولاتد الخلايا العصبية مقارنة الخلايا غير متمايزة ( الشكل 4J ).
تحليل النشاط الكهربائي عفوية، عن طريق ميي، هو قراء قيمة لتقييم وظائف الشبكة العصبية في هيبس متباينة. في نهاية فترة التمايز، وتتميز المشتقات العصبية عموما بمعدل اطلاق النار (مفر) لا يقل عن 60 طفرات / دقيقة (انظر مؤامرة النقطية ممثل في الشكل 4K ). ومع ذلك، لا يتم رصد رشقات نارية.
55702fig4.jpg "/>
الشكل 4. التمايز بين IMR90-هبسس في الثقافات المختلطة من الخلايا العصبية و غليا. (A و B) صور ممثل من روزيتس بعد 7 ديف (A) وبعد 12 ديف (B) ، ملطخة نستن (الأخضر) و β-إي-توبولين (أحمر)). (C و D) صور ممثل للخلايا متباينة بعد 22 ديف (C) و 28 ديف (D) ، ملطخة β-إي-توبولين (الأحمر) و NF200 (الأخضر)). (E) صورة ممثل نسس المستمدة من تفكك روزيت والتوسع (يظهر أقحم نستن + الخلايا والأحمر). (F و G) صور الممثل للخلايا العصبية ( F ، ملطخة ل NF200 (الأحمر) وتاو (الأخضر)) والخلايا الدبقية ( G ، ملطخة ل غفاب (الأحمر)) متباينة نسس (بعد 21 ديف). (H) الكمي من نستين، MAP2، غفاب، حمض غاما أمينوبوتيريك (غابا)، الناقل الغلوتامات الحويصلي 1 (فغلوت1)، و هيدروكسيلاز التيروزين (ث) - الخلايا الإيجابية من قبل هسي، مقارنة مشتقات IMR90-هيبسك وخلايا متباينة من نسس المستمدة من IMR90-هيبسك (رسم بياني معدلة من المرجع 7). (I و J) التي تظهر تحاليل قر للجينات متعددة القدرات (أكتوبر و نانوغ) والجينات العصبية (NCAM1 و MAP2 و سيب و مابت) (I) والدوبامين (ث و NR4A1) و نورادرينيك (PHOX2A و PHOX2B) (NARG2، GRIA1، GAP43)، غابايرجيك (GABRA1 و GABRA3)، والخلايا العصبية الحركية (ISL1 و LHX3)، و كولينرجيك (SLC5A7 و SLC18A13) الجينات المرتبطة (J) . تم تطبيع جميع التحاليل للجينات المرجعية، β-أكتين و غابد، ومعايرة إلى خلايا غير متمايزة (أشرطة خضراء). هذه هي الطريقة ΔΔCt، بمتوسط 5 تحليلات مستقلة ± سيم * p <0،05، ** p <0.01، *** p <0.001. تم تعديل الرسوم البيانية في I و J من المرجع 6. (K) مؤامرة الممثلة النقطية من العصبية المستمدة من IMR90-نسك(تم إجراء التسجيل بحد أدنى 600 ثانية؛ والقضبان العمودية تمثل طفرات واحدة). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
يتم تنظيم توقيع معين من علامات الخلايا العصبية في متباينة IMR90-هبسس
في النموذج الجديد لاختبار السمية، من الضروري تحديد الأحداث الجزيئية والخلوية التي تحدث داخل خلية بعد التعرض لسمية سمية معينة. ولذلك، فمن المهم أن يصف مسارات الإشارات التي يتم تنشيط و / أو أوبريغولاتد داخل النموذج الخلوي قيد التحقيق.
المصفوفات المتاحة تجاريا لتحليل بروتين كيناز التعبير الجيني يمكن استخدامها لمقارنة هيبس غير متمايزة مقابل خلايا متباينة. مختلفا(إمر90-هبسك) الخاضعة للتحكم فوق الجينات في السيطرة على مستقبلات نيوروتروفين، تنظيم التوجيه المحوري، تعديل نمو نيوريت، مستقبلات العصبية المستمدة من الدبقية (غنف)، بروتين عظمي مورفوجينيتيك (بمب) / تغف بيتا المسار، مستقبلات النمو المشتقة (بدغف) مستقبلات ( الشكل 5A والشكل 5B ).
تحليل ربا يظهر أوبريغولاتيون من توقيع الخلايا العصبية محددة في متباينة IMR90-هبسس. على وجه الخصوص، يتم تنشيط إرك / كريب، أكت / PDK1 / متور، ومسارات إشارات Notch1 على التمايز ( الشكل 5C ).
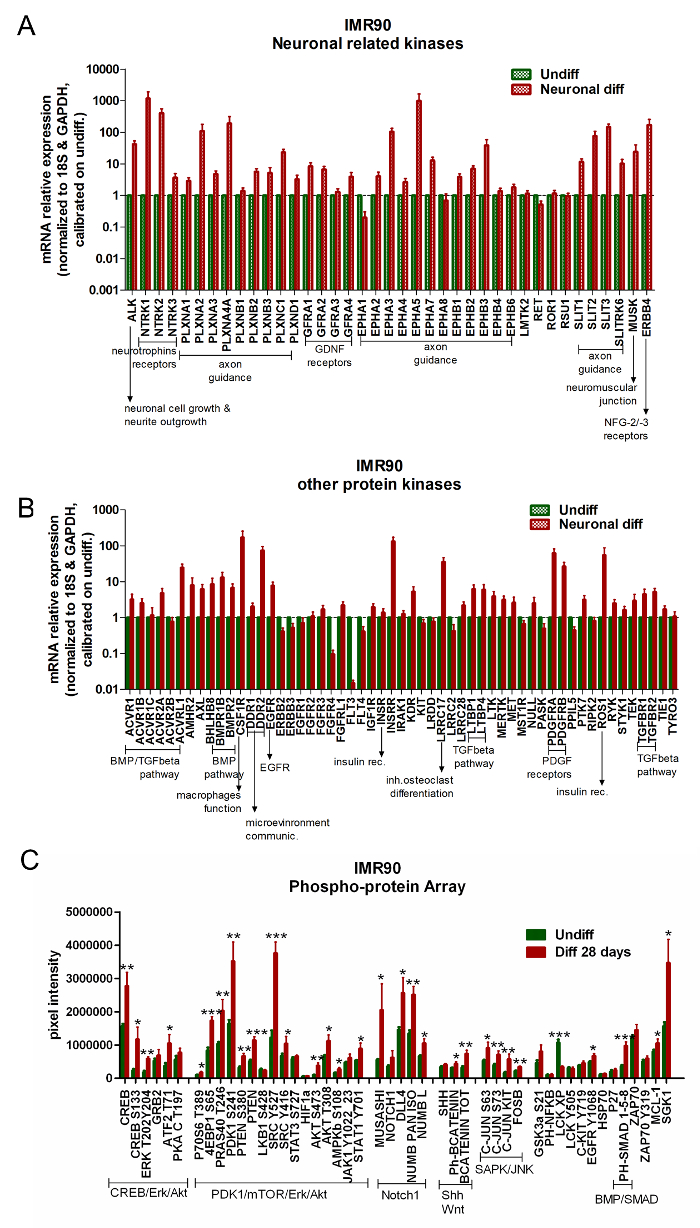
الشكل 5. الخلايا العصبية متباينة وخلايا الدبقية عرض تفعيل مسارات المرتبطة العصبون. (او B) الرسوم البيانية شريط تقرير التحاليل قر من كيناس ذات الصلة الخلايا العصبية (A) وغيرها من الجينات ذات الصلة كيناز (B) . تم تطبيع البيانات التعبير الجيني إلى الجينات المرجعية 18S و غابد (المنصوص عليها في الصفيف) ومعايرة إلى خلايا غير متمايزة. لهذه التحاليل، اعتبر الجين أعلى تنظيما عندما كان تعبيره على الأقل 2x أعلى مما هو عليه في الخلايا غير المتمايزة (2 -ΔΔ كت 2)؛ يعني 3 تحليلات مستقلة ± سيم). (C) يظهر الرسم البياني شريط الكميات البروتين المطلق عن طريق تحليل رببا، مقارنة متباينة (أشرطة حمراء) وخلايا غير متمايزة (أشرطة خضراء). يتم تجميع البروتينات التي تنتمي إلى نفس المسارات تشوير المسار معا على النحو التالي: كريب / إرك / أكت، PDK1 / متور / إرك / أكت، Notch1، ش و ونت، سابك / جنك، و بمب / سماد. يعني ± سيم من 4 تحليلات مستقلة. * p <0،05، ** p <0.01، *** p <0.001؛ الرسم البياني المعدلة fروم مرجع 6. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
IMR90-هيبسك المستمدة من الخلايا العصبية / الدبقية الثقافات يمكن استخدامها لتقييم آثار روتينون
روتينون، مثبط I معقدة من سلسلة الجهاز التنفسي الميتوكوندريا، ومن المعروف أن يسبب الاكسدة عن طريق اثار تفعيل مسار Nrf2. في ظل ظروف هادئة، Nrf2 هو الراسية في السيتوبلازم من قبل Keap1 (كيلش مثل البروتين المرتبطة إش 1)، و Nrf2 الضاغطة، مما يسهل Nrf2 أوبيكيتيناتيون والتحلل البروتيني 15 . عند تحريض الإجهاد التأكسدي، Nrf2 يترجم إلى النواة وينشط التعبير عن الجينات المستهدفة Nrf2-أر 16 .
IMR90-هيبسك المستمدة من الخلايا العصبيةد الخلايا الدبقية يمكن استخدامها لتقييم آثار روتينون على تفعيل Nrf2 عن طريق تعريض الخلايا لتركيزات مختلفة من روتينون (على سبيل المثال، 1، 10، و 100 نانومتر) لمدة 24 ساعة. تم تأسيس هذه التركيزات وفقا للدراسات السابقة 17 ، 18 .
في هذه التركيزات وأوقات التعرض، لم روتينون لم يؤدي إلى السمية الخلوية، كما هو مبين من خلال تحديد الكمي الحية نواة الخلية + دابي ( الشكل 6A ). روتينون الناجم عن Nrf2 النووية نقل، وخاصة بعد تعريض الخلايا إلى 100 نانومتر روتينون ( الشكل 6B والشكل 6E ). في نفس التركيز، لوحظ انخفاض كبير في Kib1 السيتوبلازمية ( الشكل 6C )، جنبا إلى جنب مع زيادة في كل من ناد (P) H كينون أوكسيدوريدوكتاس 1 (NQO1) و سولفيروكسين 1 (SRXN1)، واثنين من Nrf2 المستهدفة أرزيمس 19 ، 20 ( الشكل 6D ).
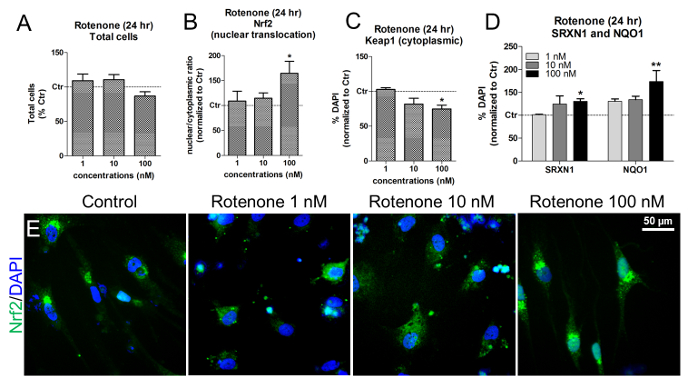
الشكل 6. آثار روتينون على Nrf2 النووية نقل، Keap1، SRXN1، و NQO1 مستويات البروتين. (A) الكمي للخلايا دابي + + الحية ( أي نوى غير بيكنوتيك) على 24 ساعة العلاج مع 1، 10، 100 نانومتر روتينون وتطبيع إلى الخلايا غير المعالجة (السيطرة، كتر). (B) Nrf2 البروتين النووي نقل ( أي، النسب النووية / السيتوبلازمية) بعد 24 ساعة من التعرض ل روتينون، التي قيمتها قياسات كثافة مضان باستخدام تحليل هسي. (C) الكمي من مستويات البروتين Keop1 السيتوبلازمية على العلاج روتنون، التي قيمها تحليل هسي. (D) الكمي من ناد (P) H كينون أوكسيدوريدوكتاس 1 (NQO1) وسلفيالأكسدة 1 (SRXN1) عن طريق المناعي و هسي بعد 24 ساعة من العلاج مع روتينون. (E) صور الممثل من Nrf2 توطين البروتين (الأخضر). وتظهر جميع القيم كمتوسط ± سيم من 3 مكررات البيولوجية. * p <0،05، ** p <0.01؛ الرقم المعدل من المرجع 7. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
في هذه التركيزات وأوقات العلاج، كما أثار روتينون زيادة تعتمد على تركيز من ستروغليال (غفاب + ) نسبة الخلية ( الشكل 7A والشكل 7B )، دون التأثير على نسب نسس (نستن + ) والخلايا العصبية (MAP2 + ) ( الشكل 7B ). من خلال النظر في نسب أنواع فرعية الخلايا العصبية محددة، والعلاج روتنون (10 نانومتر و 100 نانومتر)انخفاض كبير في عدد الخلايا العصبية الدوبامين (ث + ) ( الشكل 7C و D )، في حين أن النسب المئوية لل غابايرجيك (غابا + ) و غلوتاماترجيك (VGlut1 + ) الخلايا العصبية لم تتغير ( الشكل 7D ). على نحو مماثل، السابقة في الجسم الحي وفي الدراسات المختبرية وصفت تعتمد على روتينون وانتقائية الدوبامين الخلايا العصبية الموت 21 ، 22 ، 23 .
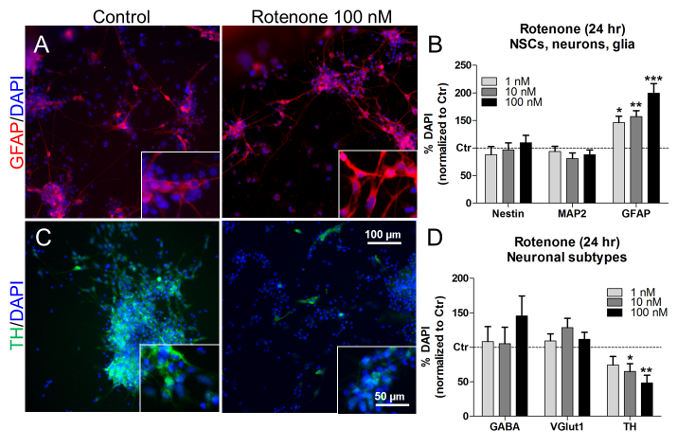
الشكل 7. آثار روتينون على الخلايا الدبقية والخلايا العصبية الدوبامين. (A) صور ممثل من الخلايا + غفاب (الأحمر)، مع التكبير 40X في إينيتس، غير المعالجة أو تعامل مع 100 نانومتر روتينون لمدة 24 ساعة. (ب) الكمي من نستين + ، MAP2 + ، و غفاب + الخلايا، تطبيع إلى الخلايا غير المعالجة (السيطرة، كتر). (C) صور ممثل الدوبامين ث + الخلايا العصبية (الأخضر)، مع التكبير 40X في إينيتس، غير المعالجة أو تعامل مع 100 نانومتر روتينون لمدة 24 ساعة. (D) الكمي للخلايا غابا + ، VGlut1 + ، و ث + الخلايا العصبية، تطبيع إلى الخلايا غير المعالجة (كتر). وتظهر جميع القيم كمتوسط ± سيم من 3 مكررات البيولوجية. * p <0،05، ** p <0.01، *** p <0.001؛ الرقم المعدل من المرجع 7. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تم تقييم الدلالة الإحصائية بواسطة أنوفا في اتجاه واحد مع اختبار المقارنة المتعددة دونيت كاختبار ما بعد (مقارنة جميع الأعمدة مقابل عمود التحكم)كريف "> 24 أو عن طريق اثنين من الذيل غير المقنن أو الاقتران t- اختبار وفقا لنوع التحليل.جميع البيانات تمثل متوسط ما لا يقل عن ثلاثة مكررات البيولوجية ± الخطأ المعياري للمتوسط (سيم) وتشير علامة النجمة على شريط يشير فارق معنوي مع مجموعة السيطرة.
الجدول 1.
ملاحظة على فصل وضوح كثافة الطلاء: إذا شظايا روزيت لا تبدو منفصلة تماما، من أجل الوصول إلى كثافة الطلاء خلية من حوالي 15.000 خلية / سم 2 ، فصل وريدات شظايا المشتقة من حوالي 50 إبس / 1 × 60MM طبق يمكن معلق في 50 مل من نري كاملة ومطلي على النحو التالي (اعتمادا على شكل لوحة):
| لوحات مولتيويل / ميي | منطقة النمو (سم 2 / جيد) | حجم تعليق الخلية إلى لوحة لكل بئر (أو رقاقة ميي) | الحد الأقصى لعدد لوحات التي يمكن مطلي (مع 50 مل من تعليق الخلية) |
| 96 بئرا | 0.3 | 100 أول | 5 |
| 48 بئرا | 0.7 | 220 أول | 4 |
| 24 بئرا | 2 | 625 أول | 3 |
| 12 بئرا | 4 | 1.25 مل | 3 |
| 6 آبار | 10 | 3.125 مل | 2 |
| واحد جيدا ميي رقاقة | 3.5 | 1.1 مل | 45 |
الجدول 2: معايير القبول
| علامة /الجسم المضاد | النسبة المئوية (على خلايا دابي + (الحية) بعد 28 ديف |
| B-إي-توبولين (Tuj1) | 35-45٪ |
| MAP2 | 50-60٪ |
| NF200 | 45-55٪ |
| GFAP | 10-25٪ |
| Nestin | 15-25٪ |
Discussion
يصف هذا العمل بروتوكول قوي وسريع نسبيا للتمييز بين IMR90-هبسس في الخلايا العصبية ما بعد الانقسامية والخلايا الدبقية. نشرت سابقا بروتوكولات التمايز الخلايا العصبية على أساس هيسس و هيبسس عادة ما تسفر عن نسب عالية من السلائف العصبية 25 و 26 وعدد كبير من الخلايا المستهدفة الخلايا العصبية 27 و 28 و 29 و 30 و 31 و 32 و 33 . على نحو مماثل، بروتوكول التمايز الموصوفة هنا هو مناسبة لتوليد الثقافات غير المتجانسة من غابايرجيك، غلوتاماترجيك، والخلايا العصبية الدوبامين، جنبا إلى جنب مع الدبقية ونسبة منفصلة من نستين + الخلايا. ويشير وجود غلوتاماترجيك (~ 35-42٪) و غابايرجيك (~ 15-20٪) الخلايا العصبية أنهذه الثقافة تمتلك الدماغ الأمامي، والميزات القشرية مثل، ووجود عدد منفصل من الخلايا العصبية الدوبامين (~ 13-20٪) قد تشير أيضا إلى خصوصية الدماغ المتوسط. بالإضافة إلى ذلك، فإن استمرار نسبة متواضعة من نستين + الخلايا قد تكون مناسبة لدراسة تكوين الخلايا العصبية والآثار المحتملة للمواد الكيميائية على نسس، التي تقتصر أساسا على كل من الحصين والمنطقة تحت البطين (سفز) من الدماغ الأمامي 34 . المزيد من التحليلات إمونوسيتوشيميكال والتعبير الجيني من شأنه أن يساعد على تحديد أفضل خصوصية إقليمية للمشتقات الخلية متباينة.
أهم خطوتين في بروتوكول التمايز الموصوفة في هذه الوثيقة هي: (1) قطع مستعمرات هيبسك إلى شظايا متجانسة (وهو أمر حاسم لتوليد إبس مع أحجام متجانسة) و (إي) قطع الهياكل العصبية السرطانية (الورود ) ل نسك التمايز، الأمر الذي يتطلب مهارة يدوية كبيرةوالدقة لتجنب جمع الأديم المتوسط وخلايا الأديم التي قد تقلل من نسب الخلايا العصبية والخلايا الدبقية التي تم الحصول عليها على التمايز.
فمن الأهمية بمكان لوصف المظاهر من الخلايا أثناء التوسع (كمستعمرات غير متمايزة أو نسس) وخلال جميع خطوات التمايز. على وجه الخصوص، يجب أن تظهر ملامح التعبير الجيني والبروتين من مشتقات الخلايا العصبية / الدبقية أوبريغولاتيون وتنشيط مسارات الإشارات العصبية ذات الصلة، في حين أن التعبير عن علامات تعدد القدرات يجب أن تنخفض.
يمكن أن يكون توليد إبس والمشتقات نيوروكتوديرمال (وريدات) تحديا يدويا وعرضة للتغير. لهذا السبب، وضعنا بروتوكول لتوسيع نسس المستمدة من روزي ومزيد من التمايز في الخلايا العصبية / الدبقية.
القيود المحتملة لهذا البروتوكول التمايز هي أساسا (1) نسبة منخفضة نسبيا من د(2) عدم وجود وظائف الشبكة العصبية الناضجة (كما يتضح من عدم وجود رشقات نارية). وعلاوة على ذلك، يمكن أن مجموعات فرعية فرعية محددة من الخلايا النجمية تعمل أسلاف الأولية أو نسس 35 . في حين لم يتم ملاحظة نستين / غفاب خلايا إيجابية مزدوجة في هذه الخلية الخلوية متباينة (لا تظهر البيانات)، فمن المفترض أن الخلايا + غفاب في هذه الثقافات المختلطة هي الأسلاف نجمي والنجمية. ومن المعقول أنه من خلال تمديد وقت التمايز، قد يزيد عدد الخلايا النجمية، ويمكن مورفولوجيا تصبح أكثر نضجا، كما أشير من قبل الأعمال السابقة من مجموعة تشانغ 36 ، 37 .
وفي النموذج الجديد لاختبار السمية، تكتسب المعارف المتعلقة بالاضطرابات الناجمة عن المواد الكيميائية في المسارات البيولوجية أهمية قصوى عند تقييم الشدائد الكيميائية. ولذلك، ينبغي أن تكون أنظمة الاختبار في المختبر قادرة علىتربط الآثار الضارة باضطرابات مسارات التشوير، وفقا لمفهوم مسار النتائج المعاكسة (أوب). كدليل على مفهوم، روتنون يمكن استخدامها لتقييم تفعيل مسار Nrf2، التي تشارك في الدفاع الخلوي ضد الأكسدة أو الإجهاد الكهربي 38 ، والإجهاد التأكسدي هو الحدث الرئيسي المهم والمشترك في مختلف العمليات التشغيلية ذات الصلة ل السمية العصبية التنموية والكبار 39 .
يجب أن يستحث روتينون تفعيل مسار Nrf2، والذي يمكن أن يبرهن عليه البروتين النووي Nrf2، وزيادة التعبير عن الانزيمات Nrf2 المستهدفة، بما في ذلك NQO1 و SRXN1. وقد وجد أن روتنون يدفع زيادة تعتمد على الجرعة من مستويات البروتين غفاب، مما يدل على تفعيل الخلايا النجمية 40 ، 41 . روتينون أيضا يقلل من عدد من الدوبامين (ث + ) الخلايا، وهو ما يتفق مع بريفيأوس في المختبر وفي الجسم الحي الدراسات التي تبين روتينون تعتمد على موت الخلايا الدوبامين، لأن هذا النوع من الخلايا العصبية حساسة بشكل خاص للإجهاد التأكسدي 21 ، 22 ، 23 .
في الختام، هذه هيبسك المستمدة الخلايا العصبية و الدبقية نموذج زراعة الخلايا هو أداة قيمة لتقييم الآثار السمية العصبية للمواد الكيميائية التي تثير الإجهاد التأكسدي مما أدى إلى تنشيط مسار Nrf2. كما يسمح هذا البروتوكول التمايز لتوليد الثقافات المختلطة للخلايا العصبية (غابايرجيك، الدوبامين، والخلايا العصبية غلوتاماترجيك) والنجمية، فإنه قد يثبت مناسبة لدراسة الحديث المتبادل بين الخلايا العصبية والدبقية في الظروف الفسيولوجية والمرضية، كما هو الحال في الأمراض العصبية التنكسية ( على سبيل المثال، مرض باركنسون). وعلاوة على ذلك، فإن وجود نسبة كبيرة من نسس قد تساعد على تقييم الآثار المحتملة للمواد الكيميائية على بروغ العصبيالتي يعرف أنها الهدف الرئيسي للطفرات التي يسببها كيميائيا أو الالتهابات الفيروسية 42 .
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
ويود المؤلفون أن يشكروا الدكتور مارك بيشانسكي (I-ستيم، إيفري، فرنسا)، لتقديمه IMR90-هبسس؛ الدكتور جيوفانا لازاري والدكتورة سيلفيا كوليوني (أفانتي سرل، كريمونا، إيطاليا)؛ الدكتور سيمون هوبت (جامعة بون، ألمانيا)؛ الدكتور تيزيانا سانتيني (المعهد الإيطالي للتكنولوجيا، روما)، لتقديم المشورة بشأن تقييم تلطيخ المناعي. الدكتور بينيدتا أكوردي، د. إيلينا رامبازو، والدكتور لوكا بيرسانو (جامعة بادوا، إيطاليا)، لمساهماتهم في تحليل ربا والتحقق من الأجسام المضادة. التمويل: تم دعم هذا العمل من قبل المشروع الممول من الاتحاد الأوروبي "سر & توكس" (اتفاق منحة رقم 266753).
Materials
| Name | Company | Catalog Number | Comments |
| Complete hiPSC medium: | |||
| mTeSR1 Basal Medium | Stem Cell Technologies | 05851 | (Step 1.2.6). Complete mTeSR1 is stable when stored at 2 - 8°C for up to 2 weeks. 5X Supplements can be dispensed into working aliquots and stored at -20°C. Use frozen aliquots within 3 months. |
| mTeSR1 5X Supplements | Stem Cell Technologies | 05852 | |
| Matrigel hESC-qualified Matrix | Corning | 354277 | 1:100 (Step 1.1). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200ul aliquot in 20 ml of DMEM/F12 medium. |
| CryoStem Freezing Medium | Stemgent | 01-0013-50 | Freeze ~ 100 fragments/250 ul/vial (Step 1.2.1) |
| Name | Company | Catalog Number | Comments |
| hiPSC EB medium: | |||
| Knockout DMEM | Thermo-Fisher | 10829-018 | (Step 2.1.7) |
| Knockout Serum Replacement (KOSR) | Thermo-Fisher | 10828-028 | 20% final concentration (Step 2.1.7) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.1.7) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.1.7) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 2.1.7) |
| β-Mercaptoethanol | Thermo-Fisher | 31350-010 | 50 µM final concentration (Step 2.1.7) |
| Name | Company | Catalog Number | Comments |
| Complete neuroepithelial induction medium (NRI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 2.3.1) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.3.1) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.3.1) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.3.1) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 2.3.1) |
| bFGF | Thermo-Fisher | 13256-029 | 20 ng/ml final concentration added before use (Step 2.3.1) |
| Matrigel Basement Membrane Matrix | Corning | 354234 | 1:100 (Step 2.2). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200 ul aliquot in 20 ml of cold DMEM/F12 medium. |
| Laminin | Sigma-Aldrich | L2020 | 1:100 (Step 2.2). Dilute in PBS 1X. |
| Name | Company | Catalog Number | Comments |
| Complete Neuronal Differentiation medium (ND): | |||
| Neurobasal Medium | Thermo-Fisher | 21103049 | (Step 2.4.11) |
| B-27 Supplements (50x) | Thermo-Fisher | 17504044 | (Step 2.4.11) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.4.11) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.4.11) |
| GDNF | Thermo-Fisher | PHC7045 | 1 ng/ml final concentration. Added before use. (Step 2.4.11) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use. (Step 2.4.11) |
| Name | Company | Catalog Number | Comments |
| Neural induction medium (NI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 3.3) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 3.3) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 3.3) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 3.3) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 3.3) |
| B-27 Supplement (50X), minus vitamin A | Thermo-Fisher | 12587010 | (Step 3.3) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 3.3) |
| bFGF | Thermo-Fisher | 13256-029 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| EGF | Thermo-Fisher | PHG6045 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use (Step 3.3) |
| Defined Trypsin Inhibitor (DTI) | Thermo-Fisher | R007-100 | Pre-warm at 37°C. Add an equal amount of DTI to Trypsin-EDTA (Step 3.10) |
| Trypsin-EDTA (0.5%), no phenol red | Thermo-Fisher | 15400054 | 1:10. Dilute Trypsin-EDTA in PBS 1x (without calcium and magnesium), pre-warm the solution at 37°C (Step 3.8) |
| CryoStor cell cryopreservation medium | Sigma-Aldrich | C2874-100ML | (Step 4.2) |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| Name | Company | Catalog Number | Comments |
| TaqMan Probesets and reagents for gene expression analysis: | |||
| RNAqueous-Micro kit | Thermo-Fisher | AM1931 | (Step 5.1.6) |
| High Capacity cDNA Reverse Transcription Kits | Thermo-Fisher | 4368814 | |
| TaqMan Gene Expression Master Mix | Thermo-Fisher | 4369016 | |
| GFAP | Thermo-Fisher | Hs00909233_m1 | |
| MAP2 | Thermo-Fisher | Hs00258900_m1 | |
| NQO1 | Thermo-Fisher | Hs02512143_s1 | |
| SRXN1 | Thermo-Fisher | Hs00607800_m1 | |
| HMOX1 | Thermo-Fisher | Hs01110250_m1 | |
| GSR | Thermo-Fisher | Hs00167317_m1 | |
| PAX6 | Thermo-Fisher | Hs01088112_m1 | |
| NES | Thermo-Fisher | Hs00707120_s1 | |
| GRIA1 | Thermo-Fisher | Hs00181348_m1 | |
| GAP43 | Thermo-Fisher | Hs00967138_m1 | |
| GABRA3 | Thermo-Fisher | Hs00968132_m1 | |
| GABRA1 | Thermo-Fisher | Hs00168058_m1 | |
| NR4A2 | Thermo-Fisher | Hs00428691_m1 | |
| TH | Thermo-Fisher | Hs00165941_m1 | |
| GAPDH | Thermo-Fisher | Hs02758991_g1 | |
| ACTB | Thermo-Fisher | Hs99999903_m1 | |
| MAPT | Thermo-Fisher | Hs00902194_m1 | |
| SYP | Thermo-Fisher | Hs00300531_m1 | |
| NANOG | Thermo-Fisher | Hs04260366_g1 | |
| POU5F1 (OCT4) | Thermo-Fisher | Hs04195369_s1 | |
| SOX1 | Thermo-Fisher | Hs01057642_s1 | |
| AFP | Thermo-Fisher | Hs00173490_m1 | |
| KRT18 | Thermo-Fisher | Hs01941416_g1 | |
| NPPA | Thermo-Fisher | Hs00383230_g1 | |
| T | Thermo-Fisher | Hs00610080_m1 | |
| NCAM1 | Thermo-Fisher | Hs00941821_m1 | |
| NR4A1 | Thermo-Fisher | Hs00374226_m1 | |
| PHOX2A | Thermo-Fisher | Hs00605931_mH | |
| PHOX2B | Thermo-Fisher | Hs00243679_m1 | |
| NARG2 | Thermo-Fisher | Hs00973298_g1 | |
| SLC18A3 | Thermo-Fisher | Hs00268179_s1 | |
| SLC5A7 | Thermo-Fisher | Hs00222367_m1 | |
| ISL1 | Thermo-Fisher | Hs00158126_m1 | |
| LHX3 | Thermo-Fisher | Hs01033412_m1 | |
| TaqMan Human Protein Kinase Array | Thermo-Fisher | 4418721 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and reagents for immunostaining: | |||
| B-III-tubulin (Tuj1) | Covance | MMS-435P | 1:500 (Step 5.2.5). Other antibodies may also be used. |
| MAP2 | Sigma Aldrich | M4403 | 1:500 |
| NF200 | Sigma Aldrich | N4142 | 1:1000 |
| GFAP | Acris Antibodies GmbH | AP02002SU-N | 1:500 |
| Nestin | Sigma-Aldrich | N5413 | 1:200 |
| synaptophysin (SYN) | Abcam | AB14692 | 1:200 |
| Tau | Thermo-Fisher | MA5-12808 | 1:100 |
| Nrf2 | Abcam | AB62352 | 1:200 |
| Keap1 | Abcam | AB66620 | 1:200 |
| sulfiredoxin1 (SRXN1) | Abcam | AB92298 | 1:200 |
| NAD(P)H quinone oxidoreductase 1 (NQO1) | Abcam | AB2346 | 1:200 |
| OCT4 | Millipore | MAB4401 | 1:100 |
| SSEA3 | Millipore | MAB4303 | 1:100 |
| Tra1-60 | Millipore | MAB4360 | 1:250 |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | 1:200 |
| Gamma-aminobutyric acid (GABA) | Sigma-Aldrich | A0310 | 1:100 |
| Vesicular glutamate transporter 1 (VGlut1) | Abcam | AB72311 | 1:500 |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | 4% (4% formaldehyde can also be used) |
| DPBS, no calcium, no magnesium | Thermo-Fisher | 14190144 | |
| Triton-X-100 Solution | Sigma-Aldrich | 93443-100ML | 0.1% |
| BSA 35% | Sigma-Aldrich | A7979-50ML | 3.5% |
| Donkey anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 594 conjugate | Thermo-Fisher | SA5-10040 | 1:500. (Step 5.2.7) Other fluorochrome-conjugated secondary antibodies may also be used. In this case, appropriate dilutions should be tested by the enduser. |
| Donkey anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10166 | 1:500 |
| Donkey anti-Goat IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10086 | 1:500 |
| DAPI Solution (1 mg/ml) | Thermo-Fisher | 62248 | 1:1000 (Step 5.2.7) |
| Name | Company | Catalog Number | Comments |
| Antibodies for Reverse Phase Protein Array (RPPA): | |||
| 4E-BP1 (S65) | Abcam | AB81297 | 1:250 (Note after step 5.2.8) |
| Akt (T308) | Cell Signaling | 9275 | 1:100 |
| Akt (S473) | Cell Signaling | 9271 | 1:100 |
| AMPKalpha (T172) | Cell Signaling | 2531 | 1:100 |
| AMPKbeta1 (S108) | Cell Signaling | 4181 | 1:100 |
| ATF-2 (T71) | Cell Signaling | 9221 | 1:100 |
| c-Jun (S63) | Cell Signaling | 9261 | 1:200 |
| c-Jun (S73) | Cell Signaling | 9164 | 1:200 |
| c-Kit (Y719) | Cell Signaling | 3391 | 1:250 |
| CREB (S133) | Cell Signaling | 9191 | 1:100 |
| EGFR (Y1068) | Cell Signaling | 2234 | 1:50 |
| ErbB2/HER2 (Y1248) | Cell Signaling | 2247 | 1:100 |
| ERK 1/2, p44/42 (T202/Y204) | Cell Signaling | 9101 | 1:2000 |
| GSK-3alpha (S21) | Cell Signaling | 9337 | 1:50 |
| Jak1 (Y1022/1023) | Cell Signaling | 3331 | 1:100 |
| Lck (Y505) | Cell Signaling | 2751 | 1:500 |
| LKB1 (S428) | Cell Signaling | 3051 | 1:100 |
| mTOR (S2448) | Cell Signaling | 5536 | 1:100 |
| NFkB p65 (S536) | Cell Signaling | 3031 | 1:50 |
| p70 S6 Kinase (T389) | Cell Signaling | 9205 | 1:200 |
| PDK1 (S241) | Cell Signaling | 3061 | 1:100 |
| PKA C (T197) | Cell Signaling | 4781 | 1:250 |
| PRAS40 (T246) | BioSource | 44-1100 | 1:2000 |
| PTEN (S380) | Cell Signaling | 9551 | 1:500 |
| Smad1 (S463/465), Smad5 (S463/465), Smad8 (S426/428) | Cell Signaling | 9511 | 1:500 |
| Src (Y527) | Cell Signaling | 2105 | 1:500 |
| Src Family (Y416) | Cell Signaling | 2101 | 1:200 |
| Stat1 (Y701) | Cell Signaling | 9171 | 1:200 |
| Stat3 (S727) | Cell Signaling | 9134 | 1:200 |
| Zap-70 (Y319) | Enogene | E011159 | 1:100 |
| βCatenin (S33/37/T41) | Cell Signaling | 9561 | 1:250 |
| CREB | Upstate Biotechnologies | 06-863 | 1:100 |
| Fos B | Cell Signaling | 2251 | 1:200 |
| GRB2 | Cell Signaling | 3972 | 1:2000 |
| HSP70 | Stressgen | SPA-810 | 1:100 |
| c-Jun | Cell Signaling | 9165 | 1:100 |
| Kip1/p27 | BD | 610241 | 1:100 |
| Lck | Cell Signaling | 2984 | 1:250 |
| Mcl-1 | Cell Signaling | 4572 | 1:80 |
| Musashi | Cell Signaling | 2154 | 1:100 |
| NOTCH1 | Cell Signaling | 3439 | 1:100 |
| PTEN | Cell Signaling | 9552 | 1:500 |
| SGK1 | Abnova | PAB4590 | 1:250 |
| Zap-70 | Cell Signaling | 2705 | 1:250 |
| β-Catenin | Abcam | AB32572 | 1:1000 |
| Dll4 | Abcam | AB7280 | 1:500 |
| Shh | Abcam | AB53281 | 1:250 |
| HIF-1α | BD | 610958 | 1:50 |
| NUMB PAN-ISO | Upstate Biotechnologies | 07-207 | 1:400 |
| NUMB-L | Chemicon | AB15145 | 1:750 |
| Cyclin B | BD | 610220 | 1:75 |
| c-Myc | Calbiochem | OP-10 | 1:100 |
| BCIP/NBT Kit | Thermo-Fisher | 002209 | (Note after step 5.2.8). Kit used to measure alkaline phosphatase activity, similar kits can be used. |
| Name | Company | Catalog Number | Comments |
| Antibodies for Flow Cytometry: | |||
| SSEA1 Antibody, Pacific Blue conjugate | Thermo-Fisher | MHCD1528 | 1:100 (Note after step 5.2.8) |
| SSEA4 Antibody (MC813-70), Alexa Fluor 647 | Thermo-Fisher | SSEA421 | 1:100 |
| Name | Company | Catalog number | Comments |
| Specific instruments, tools and softwares: | |||
| Countess Automated Cell Counter | Thermo-Fisher | C10227 | Neubauer chamber or other suitable glass hemocytometer can be used. |
| MEA1060-Inv-BC | Multichannel Systems | MEA1060-Inv-BC | (Step 5.3) |
| MEA1060-BC control software | Multichannel Systems | MEA1060-BC | (Step 5.3) |
| NeuroExplorer | Multichannel Systems | NeuroExplorer (NE) | (Step 5.3) For post-processing of MEA data |
| Multielectrode arrays (MEA) | Multichannel Systems | 60MEA100/10iR-Ti-gr | (Step 5.3) Single-well MEA chip |
| ArrayScan XTI High Content Platform | Thermo-Fisher | ASN00002P | (Step 5.2.8) Mean fluorescence can be quantified by using specific ArrayScan algorithms (e.g., Cytotoxicity V.4 and NucTrans V.4 bioapplications). It is recommended to take minimum 20 pictures/well, and have 7-8 internal replicates per condition |
| 7900HT Fast Real-Time PCR System | Thermo-Fisher | 4351405 | (Step 5.1.6) |
| BD ULTRA-FINE Needle Insulin Syringe (with 30G needle) | BD | 328280 | (Steps 1.3.1, 2.1.2, and 2.4.1) |
| StemPro EZPassage Disposable Stem Cell Passaging Tool | ThermoFisher | 23181010 | This colony cutting tool can be used as an alternative to the use of 30G needle 1 mL syringes (Step 1.3.1) |
| Ultra-Low attachment Petri dish (60 mm) | Corning | 10010582 | (Step 2.1.8) Also other brands can be used. |
| Mr. Frosty Freezing container | Sigma-Aldrich | C1562-1EA | |
References
- NRC. . Toxicity Testing in the 21st Century: A Vision and a Strategy. , (2007).
- Drews, K., Jozefczuk, J., Prigione, A., Adjaye, J. Human induced pluripotent stem cells--from mechanisms to clinical applications. J Mol Med (Berl). 90 (7), 735-745 (2012).
- Ho, P. J., Yen, M. L., Yet, S. F., Yen, B. L. Current applications of human pluripotent stem cells: possibilities and challenges. Cell Transplant. 21 (5), 801-814 (2012).
- Krueger, W. H., Swanson, L. C., Tanasijevic, B., Rasmussen, T. P. Natural and artificial routes to pluripotency. Int J Dev Biol. 54 (11-12), 1545-1564 (2010).
- Pistollato, F., Bremer-Hoffmann, S., Healy, L., Young, L., Stacey, G. Standardization of pluripotent stem cell cultures for toxicity testing. Expert Opin Drug Metab Toxicol. 8 (2), 239-257 (2012).
- Pistollato, F., et al. Development of a pluripotent stem cell derived neuronal model to identify chemically induced pathway perturbations in relation to neurotoxicity: effects of CREB pathway inhibition. Toxicol Appl Pharmacol. 280 (2), 378-388 (2014).
- Zagoura, D., Canovas-Jorda, D., Pistollato, F., Bremer-Hoffmann, S., Bal-Price, A. Evaluation of the rotenone-induced activation of the Nrf2 pathway in a neuronal model derived from human induced pluripotent stem cells. Neurochem Int. , (2016).
- Standard operating procedure for differentiation of human induced pluripotent stem cells into post-mitotic neurons and glial cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-differentiation-of-human-induced-pluripotent-stem-cells-into-post-mitotic-neurons-and-glial-cells-%28mixed-culture%29-protocol-no.-165/key/p_1570 (2016)
- Standard operating procedure for expansion of rosette-derived neural stem cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-expansion-of-rosette-derived-neural-stem-cells-protocol-no.-166/key/p_1571 (2016)
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Brien, P. J., et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening. Arch Toxicol. 80 (9), 580-604 (2006).
- Accordi, B., et al. Functional protein network activation mapping reveals new potential molecular drug targets for poor prognosis pediatric BCP-ALL. PLoS One. 5 (10), e13552 (2010).
- Vassallo, A., et al. A multi-laboratory evaluation of microelectrode array-based measurements of neural network activity for acute neurotoxicity testing. Neurotoxicology. , (2016).
- Shamblott, M. J., et al. Human embryonic germ cell derivatives express a broad range of developmentally distinct markers and proliferate extensively in vitro. Proc Natl Acad Sci U S A. 98 (1), 113-118 (2001).
- Bryan, H. K., Olayanju, A., Goldring, C. E., Park, B. K. The Nrf2 cell defence pathway: Keap1-dependent and -independent mechanisms of regulation. Biochem Pharmacol. 85 (6), 705-717 (2013).
- Tufekci, K. U., Civi Bayin, E., Genc, S., Genc, K. The Nrf2/ARE Pathway: A Promising Target to Counteract Mitochondrial Dysfunction in Parkinson's Disease. Parkinsons Dis. , 314082 (2011).
- Kovac, S., et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase. Biochim Biophys Acta. 1850 (4), 794-801 (2015).
- Lee, J. M., Shih, A. Y., Murphy, T. H., Johnson, J. A. NF-E2-related factor-2 mediates neuroprotection against mitochondrial complex I inhibitors and increased concentrations of intracellular calcium in primary cortical neurons. J Biol Chem. 278 (39), 37948-37956 (2003).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236 (2), 313-322 (1997).
- Li, L., et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling. Chem Biol Interact. , 56-67 (2014).
- Cannon, J. R., et al. A highly reproducible rotenone model of Parkinson's disease. Neurobiol Dis. 34 (2), 279-290 (2009).
- Sherer, T. B., Kim, J. H., Betarbet, R., Greenamyre, J. T. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation. Exp Neurol. 179 (1), 9-16 (2003).
- Testa, C. M., Sherer, T. B., Greenamyre, J. T. Rotenone induces oxidative stress and dopaminergic neuron damage in organotypic substantia nigra cultures. Brain Res Mol Brain Res. 134 (1), 109-118 (2005).
- Zhou, J., et al. High-efficiency induction of neural conversion in human ESCs and human induced pluripotent stem cells with a single chemical inhibitor of transforming growth factor beta superfamily receptors. Stem Cells. 28 (10), 1741-1750 (2010).
- Topol, A., Tran, N. N., Brennand, K. J. A Guide to Generating and Using hiPSC Derived NPCs for the Study of Neurological Diseases. J Vis Exp. (96), e52495 (2015).
- Jiang, Y., Zhang, M. J., Hu, B. Y. Specification of functional neurons and glia from human pluripotent stem cells. Protein Cell. 3 (11), 818-825 (2012).
- Parsons, X. H., et al. Efficient derivation of human neuronal progenitors and neurons from pluripotent human embryonic stem cells with small molecule induction. J Vis Exp. (56), e3273 (2011).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7 (10), 1836-1846 (2012).
- Zeng, H., et al. Specification of region-specific neurons including forebrain glutamatergic neurons from human induced pluripotent stem cells. PLoS One. 5 (7), e11853 (2010).
- Zeng, X., et al. An in vitro model of human dopaminergic neurons derived from embryonic stem cells: MPP+ toxicity and GDNF neuroprotection. Neuropsychopharmacology. 31 (12), 2708-2715 (2006).
- Paşca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12 (7), 671-678 (2015).
- Almeida, S., et al. Modeling key pathological features of frontotemporal dementia with C9ORF72 repeat expansion in iPSC-derived human neurons. Acta Neuropathol. 126 (3), 385-399 (2013).
- Urbán, N., Guillemot, F. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front Cell Neurosci. 8, 396 (2014).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. J., Zhang, S. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nat Biotechnol. 29 (6), 528-534 (2011).
- Krencik, R., Zhang, S. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nat Protoc. 6 (11), 1710-1717 (2011).
- Nguyen, T., Nioi, P., Pickett, C. B. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress. J Biol Chem. 284 (20), 13291-13295 (2009).
- Bal-Price, A., et al. Putative adverse outcome pathways relevant to neurotoxicity. Crit Rev Toxicol. 45 (1), 83-91 (2015).
- Cabezas, R., El-Bacha, R. S., Gonzalez, J., Barreto, G. E. Mitochondrial functions in astrocytes: neuroprotective implications from oxidative damage by rotenone. Neurosci Res. 74 (2), 80-90 (2012).
- Swarnkar, S., et al. Astrocyte activation: a key step in rotenone induced cytotoxicity and DNA damage. Neurochem Res. 37 (10), 2178-2189 (2012).
- Canovas-Jorda, D., Louisse, J., Pistollato, F., Zagoura, D., Bremer, S. Regenerative toxicology: the role of stem cells in the development of chronic toxicities. Expert Opin Drug Metab Toxicol. 10 (1), 39-55 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved