Method Article
Протокол дифференцирования индуцированных человеком стволовых клеток с плюрипотентными клетками в смешанные культуры нейронов и глии для тестирования нейротоксичности
В этой статье
Резюме
Связанные с человеком плюрипотентные стволовые клетки (hiPSC) считаются мощным инструментом для скрининга на наркотики и химические вещества и для разработки новых моделей in vitro для тестирования токсичности, включая нейротоксичность. Здесь описан подробный протокол для дифференциации hiPSCs в нейроны и глии.
Аннотация
Человеческие плюрипотентные стволовые клетки могут дифференцироваться в различные типы клеток, которые могут быть применены к анализу токсичности in vitro человека. Одним из основных преимуществ является то, что перепрограммирование соматических клеток для продуцирования индуцированных человеком стволовых клеток (hiPSC) позволяет избежать этических и законодательных вопросов, связанных с использованием эмбриональных стволовых клеток человека (hESC). HiPSC могут быть расширены и эффективно дифференцированы в различные типы нейронных и глиальных клеток, которые служат в качестве тестовых систем для тестирования токсичности и, в частности, для оценки различных путей, связанных с нейротоксичностью. В этой работе описывается протокол дифференциации hiPSCs в смешанные культуры нейронных и глиальных клеток. Определены сигнальные пути, которые регулируются и / или активируются дифференцированием нейронов. Эта информация имеет решающее значение для применения модели клетки к новой парадигме тестирования токсичности, в которой химические вещества оцениваются на основе их способности к peБиологические пути. В качестве доказательства концепции ротенон, ингибитор митохондриального дыхательного комплекса I, был использован для оценки активации сигнального пути Nrf2, ключевого регулятора антиокислительного реагирующего элемента (ARE) -дренажного клеточного защитного механизма против окислительного стресса ,
Введение
В докладе Национального исследовательского совета США 1 предусматривалась новая парадигма тестирования токсичности, в которой нормативное тестирование токсичности было бы смещено от подхода, основанного на фенотипических изменениях, наблюдаемых у животных, к подходу, ориентированному на механистические анализы in vitro с использованием человеческих клеток. Производные плурипотентных стволовых клеток (PSC) могут представлять собой альтернативы моделям раковых клеток, поскольку полученные клетки могут более близко напоминать физиологические условия тканей человека и предоставлять более подходящие инструменты для изучения химически индуцированных побочных эффектов. Двумя основными типами культур PSC, наиболее перспективными для тестирования на токсичность, являются эмбриональные стволовые клетки человека (hESC) и индуцированные человеком плюрипотентные стволовые клетки (hiPSC), которые в настоящее время широко используются в областях фундаментальных исследований и регенеративной медицины 2 , 3 . Теперь этот опыт может быть использован для разработки нового класса токсикологическихКоторые были направлены на выявление нарушенных физиологических путей, связанных с развитием неблагоприятных эффектов in vivo . Тем не менее, методы испытаний для оценки безопасности безопасности, основанные на hESC, вряд ли будут приняты всеми государствами-членами ЕС и странами мира из-за возможных этических проблем и разнообразной национальной законодательной политики, регулирующей использование клеток, полученных из эмбрионов.
HiPSCs разделяют характеристики, подобные hESCs 4 , 5, и обладают большим потенциалом для методов in vitro как для определения терапевтических целей, так и для оценки безопасности. Кроме того, технология hiPSC смягчает ограничения ограниченного пула доноров и этические проблемы, связанные с клетками, полученными из эмбрионов. Основной проблемой для hiPSC является демонстрация того, что эти клетки могут воспроизводимо генерировать значительный спектр токсикологически значимых клеточных производных,С характеристиками и ответами, характерными для тканей человека. Предопределенные уровни выбранных маркеров обычно используются для характеристики популяций клеток после процесса дифференциации и для обеспечения понимания стабильности процесса дифференциации.
Предыдущие работы оценивали пригодность hiPSC для создания смешанных культур нейронных и глиальных клеток и для оценки влияния ротенона, ингибитора митохондриального дыхательного комплекса I, на активацию пути Nrf2, ключевого регулятора антиоксидантных защитных механизмов в Многие типы клеток 6 , 7 .
В этой работе описывается протокол, используемый для дифференциации hiPSCs в смешанные нейронные и глиальные культуры, с подробной информацией о сигнальных путях (ген и уровень белка), которые активируются при дифференцировке нейронов / глиальных клеток. Кроме того, в работе показаны репрезентативные результаты, демонстрирующиеМодель нейронов и клеток глиальных клеток hiPSC может использоваться для оценки активации сигнализации Nrf2, вызванной острой (24-часовой) обработкой ротеноном, что позволяет оценить индукцию окислительного стресса.
Фибробласты IMR90 перепрограммировали в hiPSC в I-Stem (Франция) путем вирусной трансдукции 2 транскрипционных факторов (Oct4 и Sox2) с использованием векторов pMIG 6 . Аналогичные модели hiPSC также могут применяться. Описанные ниже протоколы суммируют все этапы дифференциации hiPSC в нервные стволовые клетки (NSC) и далее в смешанные культуры постмитотических нейронов и глиальных клеток (этапы 1 и 2 также см. На веб-сайте EURL ECVAM DBALM для подробного описания Протокол).
Дополнительный протокол для выделения, расширения, криоконсервации и дальнейшей дифференциации НСК в смешанные нейроны и глиальные клетки подробно описан в шагах 3 и 4 (также см. EURL ECVAM DBALM weBsite для подробного описания этого протокола). 9 . Шаг 5 описывает анализ, который можно сделать для оценки фенотипической идентичности клеток в течение нескольких этапов приверженности и дифференциации.
протокол
1. Расширение индуцированной индуцированной флуоресцентной стволовыми клетками человека (hiPSC)
ПРИМЕЧАНИЕ. HiPSCs можно культивировать на подходящем субстрате для белковой смеси в присутствии среды mTeSR1, содержащей mTeSR1 5x добавок (приготовленных по инструкциям изготовителя, пластинчатых фрагментов 100 колоний / 60-миллиметровой чашки Петри). Когда колонии hiPSC достигают соответствующего размера (см. Пример колонии на рисунке 2A ), пройдите по ячейкам, как описано ниже (один раз в неделю).
- Пальто посуду с hESC-квалифицированной базой мембранной матрицы (далее называемой «квалифицированной матрицей») или любым другим подходящим белковым субстратом.
- Храните квалифицированную матрицу (см. Таблицу материалов ) при -80 ° C в аликвотах по 200 мкл в холодных пробирках объемом 1,5 мл и холодных 5 или 10 мл пипетках.
- Перед прохождением оттепели 200 мкл квалифицированной матрицы на льду.
- Разбавьте 200 мкл квалифицированной матрицы в 20 мL среды DMEM / F12 (разведение 1: 100).
- Покройте 60-миллиметровые чашки Петри с этим раствором (5 мл / блюдо).
- Инкубируйте покрытые блюда при 37 ° C в течение не менее 1 часа.
- Криоконсервация и оттаивание колонии HiPSC
- После резки колоний hiPSC (см. Шаг 1.3 для процедуры резки колонии hiPSC) осторожно и медленно ресуспендируйте фрагменты колонии hiPSC в замораживающей среде стволовых клеток, ~ 100 фрагментов / 250 мкл (см. Таблицу материалов).
- Аликвоте фрагменты колонии в подходящих флаконах для криоконсервации (250 мкл / флакон).
- Поместите флаконы в контейнер, заполненный 2-пропанолом, и поместите контейнер при -80 ° C минимум на 2 часа и до 2 недель.
- Перенесите флаконы в парообразную фазу резервуара с жидким азотом.
- Чтобы перезапустить культуру, оттереть 1 замороженный флакон в водяной бане при 37 ° C.
- Нежно собирайте фрагменты колонии hiPSC в 7 мл предварительно разогретого полного hiPSC(См. Таблицу материалов ) в пробирке объемом 15 мл, используя пипетку 1, 2 или 5 мл.
- Центрифугируют фрагменты колонии hiPSC при 130 xg в течение 3 мин.
- Удалите супернатант и осторожно ресуспендируйте фрагменты колонии hiPSC в 1 мл полной среды hiPSC с использованием пипетки 1, 2 или 5 мл.
- Дальнейшее разбавление клеточной суспензии в 3 или 4 мл полной среды hiPSC.
- Нанесите фрагменты колонии hiPSC в квалифицированную покрытую матрицей 60-миллиметровую чашку Петри (~ 100 фрагментов / блюдо, нанесите посуду, как описано в шаге 1.1).
- Инкубируйте hiPSC при 37 ° C и 5% CO 2 .
- Выполните ежедневное изменение среднего уровня.
- Пассирование колоний hiPSC
ПРИМЕЧАНИЕ. Недифференцированные hiPSC должны быть округлой формы с большими ядрышками и без обильной цитоплазмы. Недифференцированные колонии должны характеризоваться плоской и плотно упакованной морфологией. Только недифференцированные колонии (около 1 мм iN диаметр) должны быть разрезаны для дальнейшего прохождения.- Вырежьте колонии стволовых клеток на квадратах около 200 мкм × 200 мкм, используя 1-мл шприц с иглой 30G или любым другим коммерчески доступным инструментом (см. Таблицу материалов). Используйте стереоскопический микроскоп с 4-кратным увеличением в шкафу с ламинарным потоком при комнатной температуре.
- Отделите фрагменты колонии с поверхности блюда, используя пипетку 200 мкл, осторожно пипетируя среду под ней, чтобы поднять кусочки.
- Перенесите фрагменты колонии (~ 100 шт.) На квалифицированную матрицу с покрытием DMEM / F12, заполненную 4 мл полной среды hiPSC (см. Таблицу материалов, нанесите посуду, как описано на шаге 1.1).
- Инкубируйте новую пластину (ы) при 37 ° C и 5% CO 2 .
- Выполняйте полное изменение среды каждый день и проверяйте морфологию колоний с использованием фазоконтрастного микроскопа с увеличением 4X и 10X.
2. HiPSC DiffereВ смешанные нейроны и глии
ПРИМЕЧАНИЕ. Процедура занимает приблизительно 28 дней, с основными шагами, описанными на рисунке 1 (верхняя часть).
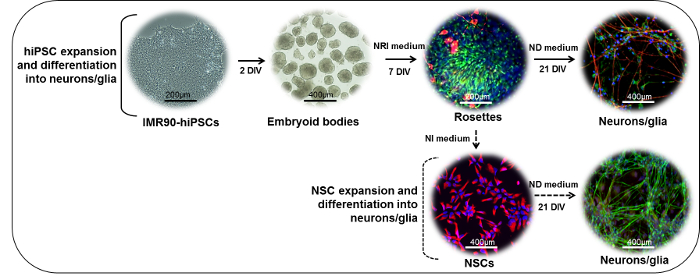
Рисунок 1: Схематическое представление протокола нейрональной дифференциации. (Верхняя часть) колонии IMR90-hiPSC могут быть разрезаны на фрагменты с образованием эмбриоидных тел (EBs). Через 2 дня in vitro (DIV) EB можно наносить на ламининовые или стандартные таблетки с матричным покрытием и культивировать в присутствии нейроэпителиальной индукционной (NRI) среды для получения нейроэктодермальных производных (розетки, окрашиваемые здесь для нестина (зеленого) и β -III-тубулин (красный)). Розетки могут быть диссоциированы, собраны, заменены на ламининовые или стандартные таблетки с матричным покрытием и дополнительно дифференцированы в зрелые нейроны (NF200, красный) и глиальные(GFAP, зеленых) клеток в присутствии среды дифференцировки нейронов (ND). (Nestin, red) могут быть расширены в присутствии нейронной индукционной (NI) среды, криоконсервированы или дополнительно дифференцированы в присутствии ND-среды с образованием смешанных нейронов (NF200, зеленый) и глиальных (NF200, зеленый) GFAP, красные). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Генерация эмбриоидных тел (ЭБ) (дни 0 → 1)
ПРИМЕЧАНИЕ. Эта процедура требует хороших ручных навыков и точности. Фрагменты колонии HiPSC должны быть одинакового размера для получения гомогенных эмбриоидных тел (ЭБ) на следующих этапах. Морфологически дифференцированные колонии (с большими цитоплазматическими фракциями и небольшими ядрышками) следует отбросить.- Обновите среду hiPSC (3 мл / 60-миллиметровая чашка Петри) перед резкой недифференцированных колоний hiPSC (около 1 мм в диаметреEter, см . Фиг.2А ) в стерильных условиях (как описано в шаге 1).
- Разрежьте недифференцированные колонии (как показано на фиг. 2А и фиг. 2В ) на фрагменты размером приблизительно 200 мкм × 200 мкм с использованием 1 мл шприца с иглой 30G. Используйте стереоскопический микроскоп с 4-кратным увеличением в шкафу с ламинарным потоком при комнатной температуре.
- Отделите фрагменты колонии с поверхности посуды, используя пипетку 200 мкл, осторожно пипетируя среду поднять куски.
- Перенесите все отдельные фрагменты и среду в 15-мл пробирку, используя пипетку 1, 2 или 5 мл.
- Промойте блюдо 2 мл полной среды hiPSC, чтобы восстановить все фрагменты.
- Центрифуга при 112 × g в течение 1 мин.
- Аспирируют супернатант и осторожно ресуспендируют фрагменты в 5 мл полной среды hiPSC EB (см. Таблицу материалов ).
- Пластируйте coLony в 60-миллиметровой ультранизкой насадке Петри (чашка Петри 5 мл / 60 мм).
- Инкубируйте чашку Петри в течение ночи при 37 ° С и 5% СО 2 .
- На следующий день (День 1) собирайте ЭБ и их среду в пробирке объемом 15 мл, используя пипетку 1, 2 или 5 мл.
- Центрифугируют ЭБ при 112 мкг в течение 1 мин.
- Осторожно аспирируйте супернатант и осторожно ресуспендируйте EB в 5 мл полной среды hiPSC EB с использованием пипетки 1, 2 или 5 мл.
- Поднимите EB на новую 60-миллиметровую чашку с чашкой Petri (5 мл / 60 мм Петри).
- Инкубируйте чашку Петри в течение ночи при 37 ° С и 5% СО 2 .
- В первый день нанесите посуду матричной мембраной ( например, матригелем, далее называемой «стандартной матрицей») или любым другим подходящим белковым субстратом ( например , ламинином).
- Храните стандартную матрицу (см. Таблицу материалов ) при -80 ° C в200 мкл аликвот с использованием холодных 1,5 мл пробирки и холодных 5 или 10 мл пипеток.
- Оттепель 200 мкл стандартной матрицы на льду.
- Разбавьте 200 мкл стандартной матрицы в 20 мл среды DMEM / F12 (разведение 1: 100).
- Покройте 60-миллиметровые чашки Петри с этим раствором (5 мл / блюдо).
- Инкубируйте покрытые блюда при 37 ° С в течение ночи.
ПРИМЕЧАНИЕ. Эти блюда будут использоваться для тарелки EB (около 50 EBs / тарелок) и создания нейроэпителиальных агрегатов (розетки); См. Шаг 2.3.
- Генерация нейроэпителиальных агрегатов (розетки) (дни 2 → 7)
- На второй день удалите стандартный раствор для матричного покрытия из 60-миллиметровых чашек Петри (нет необходимости промывать пластины) и заполните их 5 мл / чашкой полной нейроэпителиальной индукционной среды (NRI); См. Таблицу материалов .
- Перенесите плавающие EB (начиная с шага 2.1.14) на посуду с покрытием (~ 50 EBs / тарелка), используя пипетку 200 мкл под стереоскопическим миромCroscope с 4-кратным увеличением и помещается в шкаф ламинарного потока.
ПРИМЕЧАНИЕ. Очень важно выбирать гомогенные EB-средние (~ 200-300 мкм в диаметре). Слишком мелкие ЭБ могут не выживать хорошо во время нейроэктодермальной дифференциации, в то время как слишком большие ЭБ имеют тенденцию к некрозу. - Инкубируйте блюда при 37 ° C и 5% CO 2 .
- На следующий день (3-й день) проверьте посуду под микроскопом с 10-кратным увеличением, чтобы убедиться, что все элементы подключены.
- Аккуратно выполните полное изменение среды с помощью полной среды NRI.
- Измените среду NRI каждый день до 7 дня, когда должны быть видны нейроэпителиальные агрегаты (розетки).
- На 7-й день стандартная матрица покрытия (или ламинин), как описано на этапе 2.2, на любой необходимый формат тарелки или тарелки: 96-луночные планшеты (100 мкл / лунка), 24-луночные планшеты (250 мкл / лунка), 12- (500 мкл / лунка), чипы MEA (для электрической активности, 1 мл / одночиповый чип) или 60 мм ПетриС (4 мл / чашка).
- Инкубируйте покрытые пластины / чашки в течение не менее 2 часов при 37 ° C и 5% CO 2 .
- Россометная диссоциация и дифференцировка нейронов (дни 8 → 28)
ПРИМЕЧАНИЕ. Эта процедура требует хороших ручных навыков и точности. Чтобы избежать сбора мезодермальных и энтодермальных клеток, следует разделить и собрать только клетки, подобные розовому типу эктодермы.- На 8-й день вырезать розетоподобные структуры на фрагменты под стереоскопическим микроскопом при 10-кратном увеличении в стерильных условиях. Используйте 1 мл шприц с иглой 30G. Обратите внимание, что розетки обычно легко отсоединяются от тарелки при касании иглы.
- Завершите отрыв фрагментов розетки с помощью пипетки 200 мкл.
- Перенесите блюдо под ламинарным вытяжным колпаком и соберите фрагменты розетки и их среду в 15 мл коническую трубку, используя пипетку 1, 2 или 5 мл. Промойте блюдо 2 мл среды NRI, чтобы восстановитьВсе фрагменты.
- Скрутите фрагменты розетки при 112 × g в течение 2 мин.
- Аспирируйте супернатант.
- Аккуратно ресуспендируйте гранулу в 1 мл 1x DPBS (без кальция и магния) и аккуратно пипетируйте фрагменты розетки вверх и вниз, используя пипетку объемом 1000 мкл для частичного диссоциации.
- Добавить 4 мл полной среды NRI и подсчитать клетки с использованием трипанового синего и автоматизированного счетчика клеток (см. Таблицу материалов )
ПРИМЕЧАНИЕ. Разбавьте 20 мкл клеточной суспензии в 20 мкл трипанового синего. Этот этап может быть опущен, если клетки не могут быть введены в суспензию с одной клеткой. Если фрагменты розеток не выглядят полностью диссоциированными, фрагменты розеток, полученные из примерно 50 мкл / 60-миллиметровой чашки, могут быть ресуспендированы в 50 мл полной среды NRI и покрыты, как указано в таблице 1 . - Аспирируйте раствор стандартной матрицы (или ламинина) из чашек Петри, тарелок и / или чипов MEA (с шага 2.3.7). Не позволяйте им высохнуть.
- Платируйте клетки в полной среде NRI в соответствии с планом исследования (около 15 000 клеток / см 2 , см. Таблицу 1 для показаний объема покрытия).
- Инкубируйте планшеты в течение ночи при 37 ° C и 5% CO 2 .
- В 10-й день выполните полное изменение среды, используя полную среду дифференцировки нейронов (ND); См. Таблицу материалов.
- Обновите всю среду ND два раза в неделю до 28-го дня.
- Охарактеризуйте производные нейронов / глиальных клеток, как описано в шаге 5 (см. Таблицу 2 для общих критериев приемлемости).
3. Расширение и дифференциация нейронных стволовых клеток (НБК) на основе HiPSC в смешанные нейроны и глии
ПРИМЕЧАНИЕ. НСК, полученные из фрагментов розеток, могут быть расширены и поддерживаться в соответствии с процедурой, описанной ниже ( рисунок 1 , нижняя часть). Это позволяет увеличитьE количество ячеек для дифференциации и химического тестирования.
- Покройте 60-миллиметровую чашку Петри (или колбу T-25) с 5 мл стандартного раствора для нанесения покрытий DMEM / F12 и инкубируйте его в течение по меньшей мере 2 ч при 37 ° С и 5% СО 2 (как описано на этапе 2.2).
- Скрутите фрагменты розетки, полученные на этапах 1-2 (см. Шаг 2.4), в конической 15-миллиметровой пробирке при 112 × g в течение 2 мин.
- Аккуратно ресуспендируйте гранулу в 5 мл нейронной индукционной среды (NI); См. Таблицу материалов.
- Перенесите клетки на стандартную матричную чашку Петри 60 мм (или колбу T-25).
- Культурные розетки, полученные из розетки, в присутствии среды NI, освежающие среду через день, пока клетки не достигнут слияния.
- Когда сливаются, пройдите НСК, как описано в следующих шагах.
ПРИМЕЧАНИЕ. Пройдите NSC один раз в неделю; Рассмотрите использование свежесваренных блюд, колб или тарелок, в зависимости от плана исследования. - Удалите всю среду NI и gentlY промыть NSCs DPBS (без кальция и магния).
- Добавьте 1,5 мл 0,05% трипсина-ЭДТА, предварительно нагретого до 37 ° С, в 60-миллиметровую чашку Петри (или колбу Т-25), содержащую клетки, и поместите ее в инкубатор в течение 1 мин.
- Аккуратно нажмите на блюдо (или колбу), чтобы отсоединить клетки.
- Добавьте 1,5 мл трипсинового ингибитора, предварительно нагретого до 37 ° С, и перенесите клетки в пробирку объемом 15 мл.
- Промойте чашку Петри (или колбу Т-25) равным объемом среды NI (1,5 мл) и соберите объем в той же пробирке объемом 15 мл.
- Центрифугировать клетки при 130 мкг в течение 3 мин.
- Удалите супернатант и осторожно ресуспендируйте клетки в 1 мл полной среды NI, используя пипетку объемом 1000 мкл.
- Дальнейшее разбавление клеточной суспензии в 3 или 4 мл полной среды NI и подсчет клеток с использованием трипанового синего и автоматизированного счетчика клеток.
- Нанесите НСК на 60-миллиметровую чашку Петри (или колбу Т-25) со стадии 3.1 при плотности около 50 000 клеток / см 2 .
- Выполните полное изменение среды с помощью полной среды NI через день.
- Характеризуют клетки для присутствия производных нейронов / глиальных клеток, как описано в шаге 5.
ПРИМЕЧАНИЕ: NSC можно дифференцировать в смешанные культуры нейронов и глии в полной среде ND (как описано в п. 2.4.11-2.4.13), обновляя полную среду ND два раза в неделю в течение 21 дня.
4. Криптоконсервирование и оттаивание НБК на основе HiPSC
ПРИМЕЧАНИЕ. При прохождении NSC можно заморозить и повторно разморозить после этой процедуры.
- Центрифугированные пассированные НСК (от этапа 3.12) при 130 мкг в течение 3 мин.
ПРИМЕЧАНИЕ. Клетки должны учитываться на этапе 3.14. - Аккуратно и медленно ресуспендировать НСК при 3 × 10 6 / мл замораживающей среды (см. Таблицу материалов ).
- Аликвоты клеток в подходящих флаконах для криоконсервации (около 0,5 мл = 1,5 × 10 6 / флакон).
- Поместите флаконы в контейнер fiС 2-пропанолом и помещают контейнер при -80 ° C в течение минимум 2 часов и до 2 недель.
- Перенесите флаконы в парообразную фазу резервуара с жидким азотом.
- Чтобы перезапустить культуру клеток, оттереть 1 замороженный флакон на водяной бане при 37 ° C.
- Аккуратно собирайте клетки в 7 мл предварительно нагретой полной NI-среды в пробирке объемом 15 мл, используя пипетку объемом 1000 мкл.
- Центрифугировать клетки при 130 мкг в течение 3 мин.
- Удалите супернатант и осторожно ресуспендируйте клетки в 1 мл полной среды NI, используя пипетку объемом 1000 мкл.
- Дальнейшее разбавление клеточной суспензии в 3 или 4 мл полной среды NI и подсчет клеток с использованием трипанового синего и автоматизированного счетчика клеток (примечание: разбавить 20 мкл клеточной суспензии в 20 мкл трипанового синего, жизнеспособность после оттаивания должна быть ≥ 80 %).
- Нанесите НСК в покрытую 60-миллиметровую чашку Петри (или колбу Т25) с плотностью около 50 000 клеток / см 2 .
5. ЧараCterization hiPSC-производных нейронных и глиальных клеток
ПРИМЕЧАНИЕ. После дифференцировки нейронные и глиальные производные можно охарактеризовать с использованием различных методов, таких как те, которые описаны в следующих разделах.
- Количественный анализ ПЦР в реальном времени (qPCR) 10
- Выкрутите фрагменты колонии hiPSC, EB и / или NSC при 130 xg в течение 3 мин.
- Ресуспендируют клеточный осадок в 100 мкл холодного буфера для лизиса РНК, поставляемого в подходящем наборе для экстракции РНК.
- Альтернативно, собирайте производные нейронов / глиальных клеток непосредственно из пластинок путем аспирации среды и добавления буфера для лизиса холодного РНК в лунки для сбора клеток.
- Изолируйте РНК, следуя инструкциям производителя.
- Обратно-транскрибируйте 500 нг общей РНК, используя подходящий набор для ретротрансляции РНК к кДНК.
- Выполнять реакции qPCR в двух экземплярах, используя соответствующий мастер-микс и праймер(См. Таблицу материалов ).
- Запишите флуоресцентную эмиссию в режиме реального времени: 45 циклов с отжигом праймеров при 60 ° C.
- Нормализовать относительные количества РНК в GAPDH и β-актин в качестве эталонных генов и использовать недифференцированные hiPSC или необработанные клетки для условий калибровки (метод ΔΔCt). Альтернативно, используйте другой подходящий метод.
- Иммуноцитохимия и высококонтрастная визуализация (HCI) 6 , 11
- Исправьте колонии hiPSC, NSC и / или производные нейронов / глиальных с холодным 4% параформальдегидом в течение 15 мин при комнатной температуре.
- Осторожно промойте клетки в 1X PBS и храните планшеты при температуре 4 ° C в течение 1 месяца.
- При готовности к окрашиванию пермеабилизируйте клетки в пермеабилизационном буфере (1x DPBS, содержащем 0,1% тритона-X-100 и 3% BSA) в течение 15 мин при комнатной температуре.
- Удалить пермеабилизацию buFfer и инкубировать клетки в блокирующем буфере (3% BSA / 1X DPBS) в течение 15 мин при комнатной температуре для предотвращения неспецифического связывания антител.
- Удалите блокирующий буфер и инкубируйте клетки в течение ночи при 4 ° C в блокирующем буфере, содержащем подходящие первичные антитела (см. Таблицу материалов ).
- Промойте клетки 3 раза 1x PBS.
- Инкубируйте клетки в течение 45 мин при комнатной температуре в блокирующем буфере, содержащем вторичные антитела, конъюгированные с флуорохромом (см. Таблицу материалов ), контрастируя ядра с DAPI красителем.
- Определите среднюю интенсивность флуоресценции и относительные проценты типов клеток, используя подходящую платформу для изображений с высоким содержанием, если таковая имеется (см. Таблицу материалов ).
ПРИМЕЧАНИЯ. Чтобы определить уровень интенсивности флуоресцентного фона, инкубируйте некоторые клетки / лунки только с вторичными антителами. Потоковый цитометрический анализ живых (не фиксированных), undIfferentiated hiPSC могут быть выполнены для оценки экспрессии маркеров, специфичных для PSC, таких как SSEA4 (см. Таблицу материалов ). Недифференцированные колонии hiPSC могут быть проанализированы на активность щелочной фосфатазы с использованием имеющихся в продаже наборов BCIP / NBT в соответствии с инструкциями производителей (см. Таблицу материалов ). Кроме того, анализы и анализы белковой матрицы (RPPA) с обращенной фазой могут быть выполнены, как описано в ссылке 12 (список тестируемых антител см. В Таблице материалов ).
- Электрофизиологические измерения 13
- Пластины диссоциированных фрагментов розетки (после 7 DIV) или NSC, полученных из розеток на многоэлектродных массивах с покрытием (MEA, см. Таблицу материалов ) в полной среде ND (~ 1 × 10 5 клеток / однопоточный MEA-чип).
- Дифференцируйте клетки в течение 3 недель в полной среде ND, освежаяДва раза в неделю.
- В конце дифференциации запечатывайте микросхемы MEA с помощью полупроницаемой мембраны под ламинарным вытяжным потоком, чтобы поддерживать стерильность культур для повторных измерений.
- Замените один из электродов одним опорным заземлением, что позволяет записывать остаточные электроды.
- Запишите среднюю скорость стрельбы (MFR, количество спайков / мин) с использованием MEA-усилителя с интегрированным температурным контролем процесса, настроенным на 37 ° C и 5% CO 2 .
- Обнаружение пиков из исходных данных MEA с использованием порогового предела -4.7σ (σ представляет собой стандартное отклонение базального шума).
- Обработать данные после записи с помощью подходящего программного обеспечения.
Результаты
Характеристика недифференцированных hiPSCs
Для оценки фенотипа hiPSC необходимо провести анализ морфологии колоний / клеток, определения маркеров, специфичных для PSC, и изучения экспрессии генов и активности щелочного фосфата. Недифференцированные hiPSC должны быть круглыми, с большими ядрышками и без обильной цитоплазмы. Большинство колоний следует характеризовать плоской и плотно упакованной морфологией, указывающей на недифференцированный фенотип ( рис. 2А и рис. 2В ). Кроме того, более 80% колоний должны быть положительными для окрашивания щелочной фосфатазы ( рисунок 2С ).
Около 80% клеток должны быть положительными для классических маркеров, связанных с плюрипотентностью, таких как Oct4, SSEA3, SSEA4 и Tra1-60 ( рисунок 2D-H ), как показано иммуноцитохимией и проточной цитометрией, в то время как проценты клеток нестина + и β-III-тубулина + должны быть значительно низкими (около 8% и 3% соответственно, Как показано на фиг.2Н ). Эти результаты должны воспроизводиться над проходами.
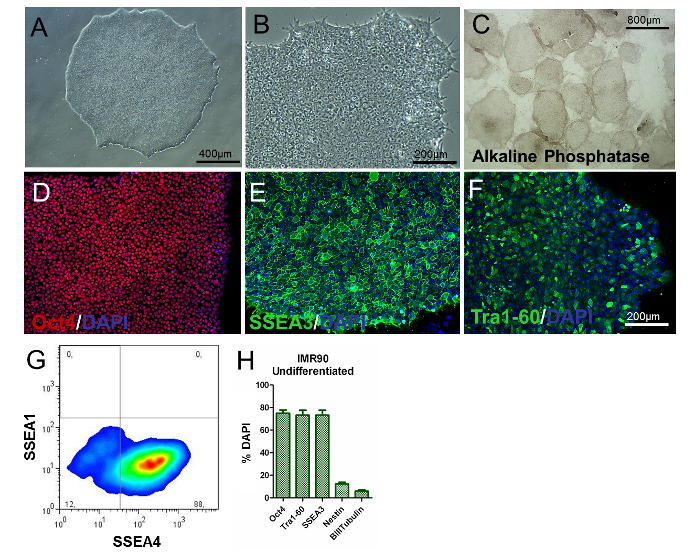
Рисунок 2. Характеристика недифференцированных IMR90-hiPSC. (A и B) Репрезентативные фазово-контрастные изображения (увеличение 10X и 20X) недифференцированных колоний IMR90-hiPSC. (C) типичные изображения колоний, окрашенных щелочной фосфатазой (4-кратное увеличение). (DF) Типичные иммуноцитохимические изображения (D) Oct4 (красный), (E) SSEA3 (зеленый) и (F) TrA1-60 (зеленый). (G) Репрезентативный точечный график окрашивания SSEA1 (CD15) и SSEA4, проанализированный с помощью проточной цитометрии. (H) Гистограмма показывает процентное соотношение Oct4 + (~ 75 - 80%), Tra1-60 + (~ 75 - 80%), SSEA3 + (~ 75 - 80%), nestin + (~ 10 - 15% ) И β-III-тубулин + (~ 3 - 7%) клеток, контрастировали с DAPI и определяли количественно HCI со средним значением от 3 до 5 биологических повторов ± SEM (график, модифицированный из ссылки 6). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Оценка плюрипотентности через образование EB
HiPSC являются плюрипотентными, а это означает, что они выражают три гена, связанные с гербицидным слоем, в соответствующих условиях. Чтобы оценить плюрипотентность hiPSC, можно применить общийПодход, основанный на спонтанном формировании EB, который индуцирует образование трех зародышевых слоев 14 . Анализ генов, специфичных к зародышевому слою, должен указывать на зависящее от времени увеличение энтодермы (α-фетопротеин (AFP) и Cytokeratin 18 (KRT18)), эктодерма (Nestin, SRY-box 1 (Sox1) и спаренная коробка 6 (Pax6) ) И экспрессии мезодермы (натрийуретический пептид A (NPPA) и Brachyury-T) ( фиг. 3A и фиг. 3B ); См. Таблицу материалов.
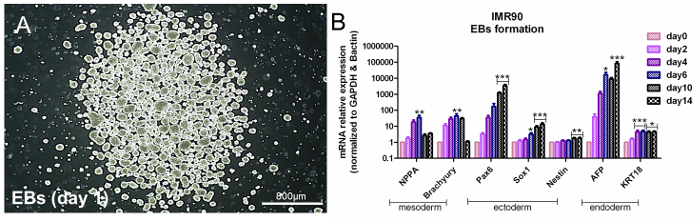
Рисунок 3. Оценка плюрипотентности с помощью образования EB. (A) Репрезентативное фазово-контрастное изображение EB на 1-й день. (B) Гистограмма показывает qPCR-анализ мезодермальных (NPPA и brachyury), эктодермальных (Pax6, Sox1 и нестин) и эндодермальных (AFP и KRT18 ), Нормированные на контрольные гены, β-актин и GAPDH, и откалиброванные в недифференцированные клетки (день 0). Это метод ΔΔCt со средним значением 5 независимых анализов ± SEM * p <0,05, ** p <0,01, *** p <0,001; График, измененный из ссылки 6. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Индукция нейронной и глиальной дифференцировки
IMR90-iPSCs можно дифференцировать в смешанные культуры постмитотических нейронов и глиальных клеток в соответствии с этапами, представленными на рисунке 1 и в разделах протокола. Через 5-8 дней после нанесения ЭБ на стандартные таблетки, покрытые матрицей или ламинином, в присутствии полной среды NRI, розетообразные структуры должны стать видимыми (= "Xfig"> Рисунок 4A). Розетки характеризуются наличием нестиновых + клеток (предшественников нейронов, ~ 90%), с немногими клетками β-III-тубулина + (клетками нейронов, ~ 5-10%), последние обычно локализованы главным образом на периферии Розетки ( рис. 4B , розетки в день 12).
При диссоциации розетки и репликации на ламининовые или стандартные покрытые матрицей блюда или пластины в присутствии полной ND-среды клетки начинают дифференцироваться в смешанные культуры нейронов и глии, постепенно образуя кластеры тел нейрональных клеток, связанных пучками нейритов ( рис. 4С и фиг.4D ). Аналогичные результаты должны быть получены при анализе популяций нейронов, полученных путем расширения NSC розеток и их дифференцирования в нейроны и глии. НСК, расширенные из розеток, должны быть nEstin + ( рис. 4Е , вставка, показывающая нестин + клетки).
Через 21 день дифференцировки клетки должны быть положительными для β-III-тубулина; NF200; Тау; И MAP2, поздний маркер дендритов ( рис. 4D , 4F и рисунок 4H), причем по меньшей мере 10-15% клеток положительны для глиального фибриллярного кислого белка (GFAP), астроглиального маркера ( фиг. 4G и фиг.4H) , Более того, ~ 20-30% клеток должны сохранять экспрессию нестина после дифференцировки ( рис. 4H ). Важно учитывать, что процент каждого типа клеток ( т. Е. Нейрон, астроцит, нестин + клетки) может варьироваться в зависимости от проходов, и может наблюдаться зависящая от пользователя изменчивость.
Анализируя специфические субпопуляции нейронов, GABAergic neurons repreОтсылают ~ 15-20% от общей массы клеток, дофаминергических нейронов ~ 13-20% и глутаматергических нейронов ~ 35-42%, как показано иммуноокрашиванием гамма-аминомасляной кислоты (ГАМК), тирозингидроксилазы (ТГ) и везикулярного глутамата Транспортера 1 (VGlut1) соответственно (см. Репрезентативную количественную оценку на рисунке 4H ). Индукция дифференцировки также может быть оценена путем анализа маркеров, связанных с плюрипотентностью ( например, Oct4, Tra1-60 и SSEA3), которые должны быть значительно подавлены в дифференцированных клетках по сравнению с недифференцированными hiPSC (не показаны, см. Ссылку 6). Это также может быть подтверждено анализом экспрессии гена qPCR, что должно указывать на уменьшение Oct4 и Nanog и повышение активности нейронных генов, таких как молекула адгезии нейронов 1 (NCAM1) и связанный с микротрубочками белок 2 (MAP2); Пресинаптический ген, синаптофизин (SYP); И постсинаптический ген, связанный с микротрубочками белок tau (MAPT), как показано в < Strong class = "xfig"> Рисунок 4I. Кроме того, дофаминергические (TH и NR4A1), норадренергические (PHOX2A и PHOX2B), глутаматергические (NARG2, GRIA1 и GAP43), GABAergic (GABRA1 и GABRA3), моторные нейроны (ISL1 и LHX3) и холинергические (SLC5A7 и SLC18A13) Приводят к повышению активности нейрональных клеток по сравнению с недифференцированными клетками ( рис. 4J ).
Анализ спонтанной электрической активности с помощью MEA является ценным показанием для оценки функциональности нейронной сети в дифференцированных hiPSC. В конце периода дифференциации производные нейронов обычно характеризуются средней скоростью обжига (MFR) не менее 60 пиков / мин (см. Репрезентативный растровый график на рисунке 4K ). Однако всплески не наблюдаются.
55702fig4.jpg "/>
Рисунок 4. Дифференциация IMR90-hiPSCs в смешанные культуры нейронов и глии. (A и B) Репрезентативные изображения розеток после 7 DIV (A) и после 12 DIV (B) , окрашенных для нестина (зеленый) и β-III-тубулина (красный)). (C и D) Репрезентативные изображения дифференцированных клеток после 22 DIV (C) и 28 DIV (D) , окрашенных для β-III-тубулина (красный) и NF200 (зеленый)). (E) Репрезентативное изображение НСК, полученных из диссоциации и расширения розетки (вставка показывает нестин + клетки, красный). (F и G) Репрезентативные изображения нейронных клеток ( F , окрашенных для NF200 (красный) и Tau (зеленый)) и глиальных клеток ( G , окрашенных для GFAP (красный)), отличающихся от NSC (после 21 DIV). (H) Количественная оценка нестина, MAP2, GFAP, гамма-аминомасляной кислоты (ГАМК), переносчика везикулярного глутамата 1 (VGlut1) и тирозингидроксилазы (TH) -положительные клетки с помощью HCl, сравнивая производные IMR90-hiPSC и клетки, дифференцированные от NSCs, полученных из IMR90-hiPSC (график, модифицированный из ссылки 7). (I и J) Гистограммы, показывающие qPCR-анализ плюрипотентных генов (Oct4 и Nanog) и нейронных генов (NCAM1, MAP2, SYP и MAPT) (I) и дофаминергических (TH и NR4A1), норадренергических (PHOX2A и PHOX2B) Глутаматергические (NARG2, GRIA1 и GAP43), GABAergic (GABRA1 и GABRA3), моторные нейроны (ISL1 и LHX3) и холинергические (SLC5A7 и SLC18A13) -соединенные гены (J) . Все анализы были нормализованы для эталонных генов, β-актина и GAPDH и откалиброваны в недифференцированные клетки (зеленые полосы). Это метод ΔΔCt со средним значением 5 независимых анализов ± SEM * p <0,05, ** p <0,01, *** p <0,001. Графики в I и J были изменены из ссылки 6. (K) Репрезентативная растровая диаграмма IMR90-NSC-производного нейра(Запись проводилась не менее 600 с, вертикальные полосы - одиночные пики). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Конкретная подпись маркеров нейронов регулируется в дифференцированных IMR90-hiPSCs
В новой парадигме тестирования токсичности важно определить молекулярные и клеточные события, происходящие внутри клетки после воздействия данного токсиканта. Поэтому важно охарактеризовать, какие сигнальные пути активированы и / или регулируются в исследуемой клеточной модели.
Коммерчески доступные массивы для анализа экспрессии гена протеинкиназы могут использоваться для сравнения недифференцированных hiPSC по сравнению с дифференцированными клетками. диффере(IMP90-hiPSCs) подвергаются усилению генов, участвующих в контроле рецепторов нейротрофинов, регуляции наведения аксонов, модуляции выроста нейритов, рецепторах нейротрофического фактора глиального происхождения (GDNF), костного морфогенетического белка (BMP) / TGF-бета-пути и тромбоцитов, (PDGF) ( фиг. 5A и фиг. 5B ).
Анализ RPPA показывает усиление специфической нейронной сигнатуры в дифференцированных IMR90-hiPSC. В частности, при дифференцировании активируются сигнальные пути Erk / CREB, Akt / PDK1 / mTOR и Notch1 ( рис. 5C ).
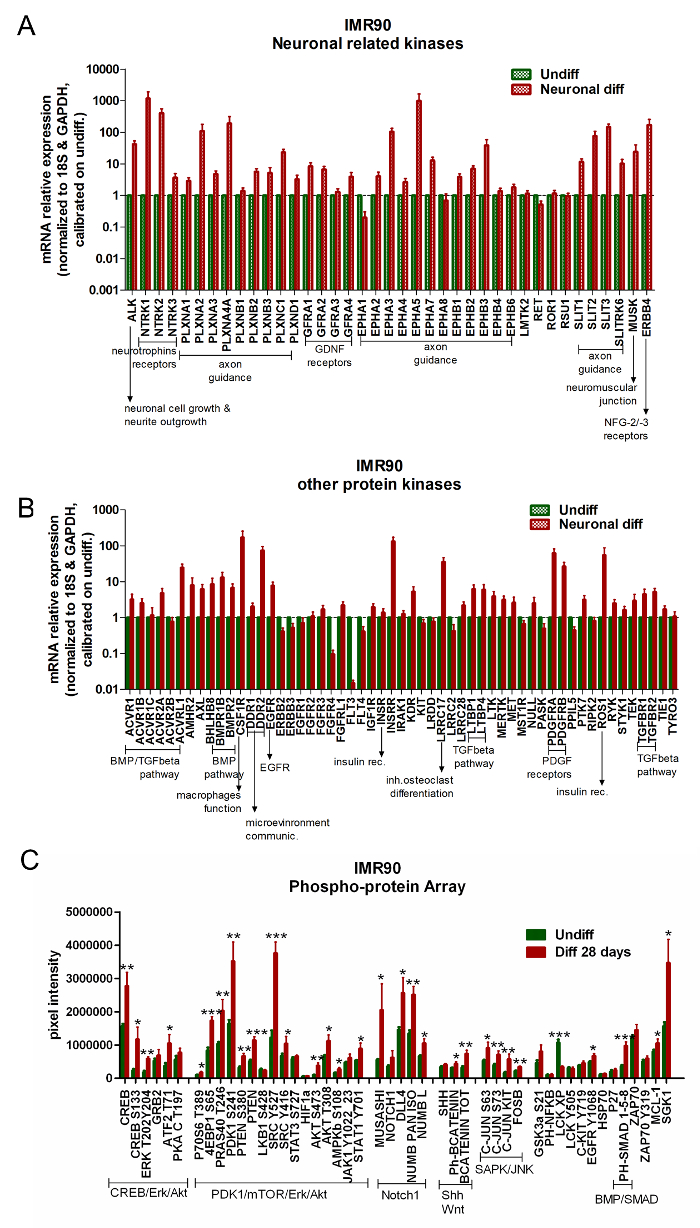
Рисунок 5. Дифференцированные нейронные и глиальные клетки демонстрируют активацию нейронов. (AИ B). Гистограммы представляют анализ qPCR нейрона-связанных киназ (A) и других родственных киназе генов (B) . Данные экспрессии гена были нормированы на контрольные гены 18S и GAPDH (предоставлены в массиве) и откалиброваны в недифференцированные клетки. Для этих анализов ген считался значительно повышенным, когда его экспрессия была по меньшей мере в 2 раза выше, чем в недифференцированных клетках (2 -ΔΔt ≥ 2); Среднее из 3 независимых анализов - SEM). (C) Гистограмма показывает абсолютные количественные показатели белка с помощью анализа RPPA, сравнивая дифференцированные (красные полосы) и недифференцированные клетки (зеленые полосы). Белки, относящиеся к одним и тем же каналам сигнального пути, группируются следующим образом: CREB / Erk / Akt, PDK1 / mTOR / Erk / Akt, Notch1, Shh и Wnt, SAPK / JNK и BMP / SMAD. Среднее ± SEM из 4 независимых анализов. * P <0,05, ** p <0,01, *** p <0,001; Измененный граф fRom Ссылка 6. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
IMR90-hiPSC-производные нейронные / глиальные культуры могут быть использованы для оценки влияния ротенона
Известно, что ротенон, ингибитор комплекса I митохондриальной дыхательной цепи, вызывает окислительный стресс, вызывая активацию пути Nrf2. В условиях покоя Nrf2 закрепляется в цитоплазме Keap1 (келхоподобный ECH-ассоциированный белок 1), Nrf2-репрессор, который облегчает Nrf2 убиквитинирование и протеолиз 15 . При индукции окислительного стресса Nrf2 транслоцирует в ядро и активирует экспрессию генов-мишеней Nrf2-ARE 16 .
IMR90-hiPSC-производные нейроны иГ глиальных клеток можно использовать для оценки влияния ротенона на активацию Nrf2, подвергая клетки воздействию различных концентраций ротенона ( например, 1, 10 и 100 нМ) в течение 24 часов. Эти концентрации были установлены в соответствии с предыдущими исследованиями 17 , 18 .
При этих концентрациях и времени воздействия ротенон не приводил к цитотоксичности, как показано количественной оценкой живых клеток DAPI + клеток ( фиг. 6A ). Ротенон индуцировал ядерную транслокацию Nrf2, особенно после обнажения клеток до 100 нМ ротенона ( рис. 6В и рис. 6Е ). При такой же концентрации наблюдалось значительное снижение цитоплазматического Keap1 ( рис. 6C ), а также увеличение как NAD (P) H-хинон-оксидоредуктазы 1 (NQO1), так и Sulfiredoxin 1 (SRXN1), двух Nrf2-мишеней enЗимы 19 , 20 ( фиг. 6D ).
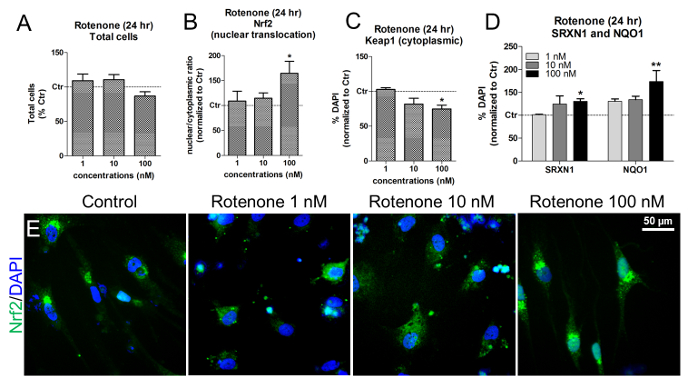
Рисунок 6. Влияние Ротенона на уровни Nrf2-транслокации крови, Keap1, SRXN1 и NQO1. (A) Количественная оценка живых клеток DAPI + ( т.е. непикнотических ядер) при 24-часовом лечении 1, 10, 100 нМ ротеноном и нормализуется к необработанным клеткам (Control, Ctr). (B) Ядерная транслокация белка Nrf2 ( т. Е. Ядерные / цитоплазматические отношения) через 24 часа воздействия ротенона, определяемая путем измерения интенсивности флуоресценции с использованием анализа HCI. (C) Количественная оценка уровней белка цитоплазмы Keap1 при лечении ротеноном, оцениваемая по анализу HCI. (D) Количественная оценка NAD (P) H-хинон-оксидоредуктазы 1 (NQO1) и сульфидаРедоксин 1 (SRXN1) с помощью иммунофлюоресценции и HCI после 24 часов лечения ротеноном. (E) Репрезентативные изображения локализации белка Nrf2 (зеленый). Все значения показаны как среднее ± SEM из 3 биологических повторов. * P <0,05, ** p <0,01; Рисунок изменен из ссылки 7. Пожалуйста , нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В этих концентрациях и времени лечения ротенон также вызывал зависящее от концентрации увеличение доли астроглиальных (GFAP + ) клеток ( рис. 7A и рис. 7B ), не влияя на пропорции NSC (nestin + ) и нейронов (MAP2 + ) ( рис. 7B ). Рассматривая пропорции специфических подтипов нейронов, лечение ротеноном (10 нМ и 100 нМ)Значительно уменьшилось количество допаминергических нейронов (TH + ) ( рис. 7C и D ), в то время как проценты GABAergic (GABA + ) и глутаматергических (VGlut1 + ) нейронов не изменились ( рис. 7D ). Аналогично, предыдущие исследования in vivo и in vitro описали ротенон-зависимую и селективную дофаминергическую гибель нейронных клеток 21 , 22 , 23 .
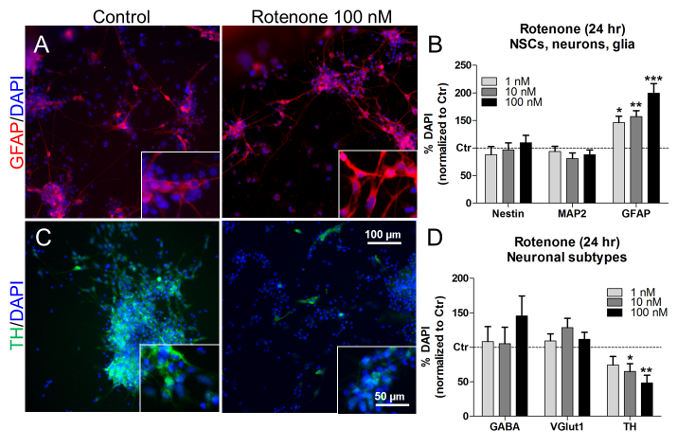
Рисунок 7. Влияние ротенона на глиальные клетки и дофаминергические нейроны. (A) Репрезентативные снимки клеток GFAP + (красный) с увеличением 40X на вставках, необработанные или обработанные 100 нМ ротеноном в течение 24 часов. (B) Количественная оценка Клеток nestin + , MAP2 + и GFAP + , нормированных на необработанные клетки (контроль, Ctr). (C) Репрезентативные изображения дофаминергических TH + нейронов (зеленые) с увеличением 40X на вставках, необработанные или обработанные 100 нМ ротеноном в течение 24 часов. (D) Количественная оценка клеток ГАМК + , VGlut1 + и TH + , нормированных на необработанные клетки (Ctr). Все значения показаны как среднее ± SEM из 3 биологических повторов. * P <0,05, ** p <0,01, *** p <0,001; Рисунок изменен из ссылки 7. Пожалуйста , нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Статистическое значение оценивали односторонним ANOVA с помощью теста множественного сравнения Dunnett в качестве пост-теста (сравнивая все столбцы с контрольным столбцом)Xref "> 24 или двухсторонним непарным или парным t-тестом в соответствии с типом анализа. Все данные представляют собой среднее по меньшей мере три биологических повторения ± стандартную ошибку среднего (SEM). Звездочка над полосой указывает Значительная разница с контрольной группой. * P <0,05, ** p <0,01, *** p <0,001.
Таблица 1.
Обратите внимание на плотность диссоциированного покрытия розеток: если фрагменты розеток не выглядят полностью диссоциированными, чтобы достичь плотности клеточного покрытия около 15 000 клеток / см 2 , фрагменты диссоциированных розеток, происходящие из примерно 50 мкг / 1 х 60 мм, могут быть ресуспендированы в 50 мл полной среды NRI и покрывали следующим образом (в зависимости от формата пластины):
| Multiwell plate / MEA | Площадь роста (см 2 / лунка) | Объем клеточной суспензии на планшет на лунку (или чип MEA) | Максимальное количество пластин, которые могут быть покрыты (с 50 мл клеточной суспензии) |
| 96 лунок | 0,3 | 100 уль | 5 |
| 48 скважин | 0.7 | 220 м | 4 |
| 24 лунки | 2 | 625 ул. | 3 |
| 12 лунок | 4 | 1,25 мл | 3 |
| 6 лунок | 10 | 3,125 мл | 2 |
| Одиночный чип MEA | 3,5 | 1,1 мл | 45 |
Таблица 2: Критерии приема
| Маркер /антитело | Процент (по DAPI + (живым) клеткам) после 28 DIV |
| B-III-тубулин (Tuj1) | 35-45% |
| MAP2 | 50-60% |
| NF200 | 45-55% |
| GFAP | 10-25% |
| Nestin | 15-25% |
Обсуждение
Эта работа описывает надежный и относительно быстрый протокол для дифференциации IMR90-hiPSC в постмитотические нейроны и глиальные клетки. Ранее опубликованные протоколы дифференцировки нейронов на основе hESC и hiPSC обычно дают высокие проценты нейронных предшественников 25 , 26 и значительное количество нейронных клеток-мишеней 27 , 28 , 29 , 30 , 31 , 32 , 33 . Аналогично описанный здесь протокол дифференцирования подходит для генерации гетерогенных культур ГАМКергических, глутаматергических и допаминергических нейронных клеток, а также глии и дискретной доли нестиновых + клеток. Наличие глутаматергических (~ 35-42%) и ГАМКергических (~ 15-20%) нейронных клеток предполагает, чтоЭта культура обладает передним мозгом, кортикальными особенностями, а наличие дискретного числа дофаминергических нейронов (~ 13-20%) также может указывать на специфичность среднего мозга. Кроме того, постоянство умеренной доли нестин + клеток может оказаться подходящим для изучения нейрогенеза и возможных эффектов химических веществ на НСК, которые в основном ограничены как гиппокампом, так и субвентрикулярной зоной (СВЗ) переднего мозга 34 . Дальнейшие анализы на иммуноцитохимические и генные экспрессии помогут лучше определить региональную специфичность дифференцированных клеточных производных.
Двумя наиболее важными шагами в протоколе дифференцирования, описанными в этом документе, являются: (i) разрезание колоний hiPSC на гомогенные фрагменты (что имеет решающее значение для генерации EB с однородными размерами) и (ii) резка нейроэктодермальных структур (розетки ) Для дифференциации НБК, что требует значительного ручного уменияИ точность, чтобы избежать сбора мезодермальных и эндодермальных клеток, которые могут уменьшить пропорции нейронов и глиальных клеток, полученных при дифференцировке.
Крайне важно охарактеризовать фенотипы клеток во время расширения (как недифференцированные колонии или НСК) и на всех этапах дифференциации. В частности, профили экспрессии гена и белка производных нейронов / глиальных клеток должны проявлять повышенную регуляцию и активацию нейронов, связанных с сигнальными путями, тогда как выражение плюрипотентных маркеров должно быть уменьшено.
Генерация EB и нейроэктодермальных производных (розеток) может быть рутинной и подверженной изменчивости. По этой причине мы разработали протокол для расширения NSC розеток и их дальнейшей дифференциации в нейронные / глиальные клетки.
Возможные ограничения этого протокола дифференциации заключаются в основном (i) относительно низкий процент dДифференцированные глиальные производные и (ii) отсутствие зрелых функций нейронной сети (как показывает отсутствие всплесков). Более того, специфические субпопуляции астроцитов могут функционировать в качестве первичных предшественников или НСК 35 . Хотя в этой дифференцированной клеточной культуре (данные не показаны) не наблюдались двухполюсные клетки нестина / GFAP, предполагается, что клетки GFAP + в этих смешанных культурах являются астроцитарными предшественниками и астроцитами. Правдоподобно, что, расширяя время дифференциации, число астроцитов может увеличиваться, и их морфология может стать более зрелой, как уже указывалось в предыдущих работах из группы 36 , 37 Чжан.
В новой парадигме тестирования токсичности знания об индуцированных химическими веществами возмущениях биологических путей имеют огромное значение при оценке химической невзгоды. Поэтому в тестовых системах in vitro должны бытьОтносятся к неблагоприятным последствиям для нарушений сигнальных путей в соответствии с концепцией неблагоприятного пути исхода (АОП). В качестве доказательства концепции ротенон можно использовать для оценки активации пути Nrf2, который участвует в клеточной защите от окислительного или электрофильного стресса 38 , а окислительный стресс является важным и общим ключевым событием в различных АОП, относящихся к Развивающая и нейротоксичность взрослых 39 .
Ротенон должен вызывать активацию пути Nrf2, что может быть продемонстрировано путем транслокации белка Nrf2 белка и повышенной экспрессии ферментов Nrf2-мишеней, включая NQO1 и SRXN1. Было обнаружено, что ротенон вызывает зависящее от дозы увеличение уровней белка GFAP, что указывает на активацию астроцитов 40 , 41 . Rotenone также уменьшает количество допаминергических (TH + ) клеток, что согласуется сИсследования in vitro и in vivo , показывающие гибель ротенон-зависимой гибели дофаминергических клеток, поскольку этот тип нейронов особенно чувствителен к окислительному стрессу 21 , 22 , 23 .
В заключение, эта модель культивирования нейронов и глиальных клеток hiPSC является ценным инструментом для оценки нейротоксических эффектов химических веществ, которые вызывают окислительный стресс, приводящий к активации пути Nrf2. Поскольку этот протокол дифференциации позволяет генерировать смешанные культуры нейронных клеток (ГАМКергические, дофаминергические и глутаматергические нейроны) и астроциты, он может оказаться подходящим для изучения перекрестных помех между нейронами и глиями в физиологических и патологических состояниях, таких как нейродегенеративные заболевания ( Например, болезнь Паркинсона). Более того, наличие значительной доли НСК может помочь оценить возможные последствия химических веществ для нейронных прогКоторые, как известно, являются основной мишенью химически индуцированных мутаций или вирусных инфекций 42 .
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить доктора Марка Пещански (I-Stem, Évry, Франция) за предоставление IMR90-hiPSC; Д-р Джованна Лаззари и д-р Сильвия Коллени (Avantea srl, Кремона, Италия); Д-р Симоне Хаупт (Университет Бонна, Германия); Д-р Tiziana Santini (Итальянский технологический институт, Рим) за предоставление рекомендаций по оценке окраски иммунофлюоресценцией; Д-р Бенедетта Аккорди, д-р Елена Рампаццо и д-р Лука Персано (Университет Падуи, Италия) за их вклад в анализ RPPA и проверку антител. Финансирование: эта работа была поддержана финансируемым ЕС проектом «SCR & Tox» (Соглашение о гранте № 266753).
Материалы
| Name | Company | Catalog Number | Comments |
| Complete hiPSC medium: | |||
| mTeSR1 Basal Medium | Stem Cell Technologies | 05851 | (Step 1.2.6). Complete mTeSR1 is stable when stored at 2 - 8°C for up to 2 weeks. 5X Supplements can be dispensed into working aliquots and stored at -20°C. Use frozen aliquots within 3 months. |
| mTeSR1 5X Supplements | Stem Cell Technologies | 05852 | |
| Matrigel hESC-qualified Matrix | Corning | 354277 | 1:100 (Step 1.1). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200ul aliquot in 20 ml of DMEM/F12 medium. |
| CryoStem Freezing Medium | Stemgent | 01-0013-50 | Freeze ~ 100 fragments/250 ul/vial (Step 1.2.1) |
| Name | Company | Catalog Number | Comments |
| hiPSC EB medium: | |||
| Knockout DMEM | Thermo-Fisher | 10829-018 | (Step 2.1.7) |
| Knockout Serum Replacement (KOSR) | Thermo-Fisher | 10828-028 | 20% final concentration (Step 2.1.7) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.1.7) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.1.7) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 2.1.7) |
| β-Mercaptoethanol | Thermo-Fisher | 31350-010 | 50 µM final concentration (Step 2.1.7) |
| Name | Company | Catalog Number | Comments |
| Complete neuroepithelial induction medium (NRI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 2.3.1) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.3.1) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.3.1) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.3.1) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 2.3.1) |
| bFGF | Thermo-Fisher | 13256-029 | 20 ng/ml final concentration added before use (Step 2.3.1) |
| Matrigel Basement Membrane Matrix | Corning | 354234 | 1:100 (Step 2.2). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200 ul aliquot in 20 ml of cold DMEM/F12 medium. |
| Laminin | Sigma-Aldrich | L2020 | 1:100 (Step 2.2). Dilute in PBS 1X. |
| Name | Company | Catalog Number | Comments |
| Complete Neuronal Differentiation medium (ND): | |||
| Neurobasal Medium | Thermo-Fisher | 21103049 | (Step 2.4.11) |
| B-27 Supplements (50x) | Thermo-Fisher | 17504044 | (Step 2.4.11) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.4.11) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.4.11) |
| GDNF | Thermo-Fisher | PHC7045 | 1 ng/ml final concentration. Added before use. (Step 2.4.11) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use. (Step 2.4.11) |
| Name | Company | Catalog Number | Comments |
| Neural induction medium (NI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 3.3) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 3.3) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 3.3) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 3.3) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 3.3) |
| B-27 Supplement (50X), minus vitamin A | Thermo-Fisher | 12587010 | (Step 3.3) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 3.3) |
| bFGF | Thermo-Fisher | 13256-029 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| EGF | Thermo-Fisher | PHG6045 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use (Step 3.3) |
| Defined Trypsin Inhibitor (DTI) | Thermo-Fisher | R007-100 | Pre-warm at 37°C. Add an equal amount of DTI to Trypsin-EDTA (Step 3.10) |
| Trypsin-EDTA (0.5%), no phenol red | Thermo-Fisher | 15400054 | 1:10. Dilute Trypsin-EDTA in PBS 1x (without calcium and magnesium), pre-warm the solution at 37°C (Step 3.8) |
| CryoStor cell cryopreservation medium | Sigma-Aldrich | C2874-100ML | (Step 4.2) |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| Name | Company | Catalog Number | Comments |
| TaqMan Probesets and reagents for gene expression analysis: | |||
| RNAqueous-Micro kit | Thermo-Fisher | AM1931 | (Step 5.1.6) |
| High Capacity cDNA Reverse Transcription Kits | Thermo-Fisher | 4368814 | |
| TaqMan Gene Expression Master Mix | Thermo-Fisher | 4369016 | |
| GFAP | Thermo-Fisher | Hs00909233_m1 | |
| MAP2 | Thermo-Fisher | Hs00258900_m1 | |
| NQO1 | Thermo-Fisher | Hs02512143_s1 | |
| SRXN1 | Thermo-Fisher | Hs00607800_m1 | |
| HMOX1 | Thermo-Fisher | Hs01110250_m1 | |
| GSR | Thermo-Fisher | Hs00167317_m1 | |
| PAX6 | Thermo-Fisher | Hs01088112_m1 | |
| NES | Thermo-Fisher | Hs00707120_s1 | |
| GRIA1 | Thermo-Fisher | Hs00181348_m1 | |
| GAP43 | Thermo-Fisher | Hs00967138_m1 | |
| GABRA3 | Thermo-Fisher | Hs00968132_m1 | |
| GABRA1 | Thermo-Fisher | Hs00168058_m1 | |
| NR4A2 | Thermo-Fisher | Hs00428691_m1 | |
| TH | Thermo-Fisher | Hs00165941_m1 | |
| GAPDH | Thermo-Fisher | Hs02758991_g1 | |
| ACTB | Thermo-Fisher | Hs99999903_m1 | |
| MAPT | Thermo-Fisher | Hs00902194_m1 | |
| SYP | Thermo-Fisher | Hs00300531_m1 | |
| NANOG | Thermo-Fisher | Hs04260366_g1 | |
| POU5F1 (OCT4) | Thermo-Fisher | Hs04195369_s1 | |
| SOX1 | Thermo-Fisher | Hs01057642_s1 | |
| AFP | Thermo-Fisher | Hs00173490_m1 | |
| KRT18 | Thermo-Fisher | Hs01941416_g1 | |
| NPPA | Thermo-Fisher | Hs00383230_g1 | |
| T | Thermo-Fisher | Hs00610080_m1 | |
| NCAM1 | Thermo-Fisher | Hs00941821_m1 | |
| NR4A1 | Thermo-Fisher | Hs00374226_m1 | |
| PHOX2A | Thermo-Fisher | Hs00605931_mH | |
| PHOX2B | Thermo-Fisher | Hs00243679_m1 | |
| NARG2 | Thermo-Fisher | Hs00973298_g1 | |
| SLC18A3 | Thermo-Fisher | Hs00268179_s1 | |
| SLC5A7 | Thermo-Fisher | Hs00222367_m1 | |
| ISL1 | Thermo-Fisher | Hs00158126_m1 | |
| LHX3 | Thermo-Fisher | Hs01033412_m1 | |
| TaqMan Human Protein Kinase Array | Thermo-Fisher | 4418721 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and reagents for immunostaining: | |||
| B-III-tubulin (Tuj1) | Covance | MMS-435P | 1:500 (Step 5.2.5). Other antibodies may also be used. |
| MAP2 | Sigma Aldrich | M4403 | 1:500 |
| NF200 | Sigma Aldrich | N4142 | 1:1000 |
| GFAP | Acris Antibodies GmbH | AP02002SU-N | 1:500 |
| Nestin | Sigma-Aldrich | N5413 | 1:200 |
| synaptophysin (SYN) | Abcam | AB14692 | 1:200 |
| Tau | Thermo-Fisher | MA5-12808 | 1:100 |
| Nrf2 | Abcam | AB62352 | 1:200 |
| Keap1 | Abcam | AB66620 | 1:200 |
| sulfiredoxin1 (SRXN1) | Abcam | AB92298 | 1:200 |
| NAD(P)H quinone oxidoreductase 1 (NQO1) | Abcam | AB2346 | 1:200 |
| OCT4 | Millipore | MAB4401 | 1:100 |
| SSEA3 | Millipore | MAB4303 | 1:100 |
| Tra1-60 | Millipore | MAB4360 | 1:250 |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | 1:200 |
| Gamma-aminobutyric acid (GABA) | Sigma-Aldrich | A0310 | 1:100 |
| Vesicular glutamate transporter 1 (VGlut1) | Abcam | AB72311 | 1:500 |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | 4% (4% formaldehyde can also be used) |
| DPBS, no calcium, no magnesium | Thermo-Fisher | 14190144 | |
| Triton-X-100 Solution | Sigma-Aldrich | 93443-100ML | 0.1% |
| BSA 35% | Sigma-Aldrich | A7979-50ML | 3.5% |
| Donkey anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 594 conjugate | Thermo-Fisher | SA5-10040 | 1:500. (Step 5.2.7) Other fluorochrome-conjugated secondary antibodies may also be used. In this case, appropriate dilutions should be tested by the enduser. |
| Donkey anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10166 | 1:500 |
| Donkey anti-Goat IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10086 | 1:500 |
| DAPI Solution (1 mg/ml) | Thermo-Fisher | 62248 | 1:1000 (Step 5.2.7) |
| Name | Company | Catalog Number | Comments |
| Antibodies for Reverse Phase Protein Array (RPPA): | |||
| 4E-BP1 (S65) | Abcam | AB81297 | 1:250 (Note after step 5.2.8) |
| Akt (T308) | Cell Signaling | 9275 | 1:100 |
| Akt (S473) | Cell Signaling | 9271 | 1:100 |
| AMPKalpha (T172) | Cell Signaling | 2531 | 1:100 |
| AMPKbeta1 (S108) | Cell Signaling | 4181 | 1:100 |
| ATF-2 (T71) | Cell Signaling | 9221 | 1:100 |
| c-Jun (S63) | Cell Signaling | 9261 | 1:200 |
| c-Jun (S73) | Cell Signaling | 9164 | 1:200 |
| c-Kit (Y719) | Cell Signaling | 3391 | 1:250 |
| CREB (S133) | Cell Signaling | 9191 | 1:100 |
| EGFR (Y1068) | Cell Signaling | 2234 | 1:50 |
| ErbB2/HER2 (Y1248) | Cell Signaling | 2247 | 1:100 |
| ERK 1/2, p44/42 (T202/Y204) | Cell Signaling | 9101 | 1:2000 |
| GSK-3alpha (S21) | Cell Signaling | 9337 | 1:50 |
| Jak1 (Y1022/1023) | Cell Signaling | 3331 | 1:100 |
| Lck (Y505) | Cell Signaling | 2751 | 1:500 |
| LKB1 (S428) | Cell Signaling | 3051 | 1:100 |
| mTOR (S2448) | Cell Signaling | 5536 | 1:100 |
| NFkB p65 (S536) | Cell Signaling | 3031 | 1:50 |
| p70 S6 Kinase (T389) | Cell Signaling | 9205 | 1:200 |
| PDK1 (S241) | Cell Signaling | 3061 | 1:100 |
| PKA C (T197) | Cell Signaling | 4781 | 1:250 |
| PRAS40 (T246) | BioSource | 44-1100 | 1:2000 |
| PTEN (S380) | Cell Signaling | 9551 | 1:500 |
| Smad1 (S463/465), Smad5 (S463/465), Smad8 (S426/428) | Cell Signaling | 9511 | 1:500 |
| Src (Y527) | Cell Signaling | 2105 | 1:500 |
| Src Family (Y416) | Cell Signaling | 2101 | 1:200 |
| Stat1 (Y701) | Cell Signaling | 9171 | 1:200 |
| Stat3 (S727) | Cell Signaling | 9134 | 1:200 |
| Zap-70 (Y319) | Enogene | E011159 | 1:100 |
| βCatenin (S33/37/T41) | Cell Signaling | 9561 | 1:250 |
| CREB | Upstate Biotechnologies | 06-863 | 1:100 |
| Fos B | Cell Signaling | 2251 | 1:200 |
| GRB2 | Cell Signaling | 3972 | 1:2000 |
| HSP70 | Stressgen | SPA-810 | 1:100 |
| c-Jun | Cell Signaling | 9165 | 1:100 |
| Kip1/p27 | BD | 610241 | 1:100 |
| Lck | Cell Signaling | 2984 | 1:250 |
| Mcl-1 | Cell Signaling | 4572 | 1:80 |
| Musashi | Cell Signaling | 2154 | 1:100 |
| NOTCH1 | Cell Signaling | 3439 | 1:100 |
| PTEN | Cell Signaling | 9552 | 1:500 |
| SGK1 | Abnova | PAB4590 | 1:250 |
| Zap-70 | Cell Signaling | 2705 | 1:250 |
| β-Catenin | Abcam | AB32572 | 1:1000 |
| Dll4 | Abcam | AB7280 | 1:500 |
| Shh | Abcam | AB53281 | 1:250 |
| HIF-1α | BD | 610958 | 1:50 |
| NUMB PAN-ISO | Upstate Biotechnologies | 07-207 | 1:400 |
| NUMB-L | Chemicon | AB15145 | 1:750 |
| Cyclin B | BD | 610220 | 1:75 |
| c-Myc | Calbiochem | OP-10 | 1:100 |
| BCIP/NBT Kit | Thermo-Fisher | 002209 | (Note after step 5.2.8). Kit used to measure alkaline phosphatase activity, similar kits can be used. |
| Name | Company | Catalog Number | Comments |
| Antibodies for Flow Cytometry: | |||
| SSEA1 Antibody, Pacific Blue conjugate | Thermo-Fisher | MHCD1528 | 1:100 (Note after step 5.2.8) |
| SSEA4 Antibody (MC813-70), Alexa Fluor 647 | Thermo-Fisher | SSEA421 | 1:100 |
| Name | Company | Catalog number | Comments |
| Specific instruments, tools and softwares: | |||
| Countess Automated Cell Counter | Thermo-Fisher | C10227 | Neubauer chamber or other suitable glass hemocytometer can be used. |
| MEA1060-Inv-BC | Multichannel Systems | MEA1060-Inv-BC | (Step 5.3) |
| MEA1060-BC control software | Multichannel Systems | MEA1060-BC | (Step 5.3) |
| NeuroExplorer | Multichannel Systems | NeuroExplorer (NE) | (Step 5.3) For post-processing of MEA data |
| Multielectrode arrays (MEA) | Multichannel Systems | 60MEA100/10iR-Ti-gr | (Step 5.3) Single-well MEA chip |
| ArrayScan XTI High Content Platform | Thermo-Fisher | ASN00002P | (Step 5.2.8) Mean fluorescence can be quantified by using specific ArrayScan algorithms (e.g., Cytotoxicity V.4 and NucTrans V.4 bioapplications). It is recommended to take minimum 20 pictures/well, and have 7-8 internal replicates per condition |
| 7900HT Fast Real-Time PCR System | Thermo-Fisher | 4351405 | (Step 5.1.6) |
| BD ULTRA-FINE Needle Insulin Syringe (with 30G needle) | BD | 328280 | (Steps 1.3.1, 2.1.2, and 2.4.1) |
| StemPro EZPassage Disposable Stem Cell Passaging Tool | ThermoFisher | 23181010 | This colony cutting tool can be used as an alternative to the use of 30G needle 1 mL syringes (Step 1.3.1) |
| Ultra-Low attachment Petri dish (60 mm) | Corning | 10010582 | (Step 2.1.8) Also other brands can be used. |
| Mr. Frosty Freezing container | Sigma-Aldrich | C1562-1EA | |
Ссылки
- NRC. . Toxicity Testing in the 21st Century: A Vision and a Strategy. , (2007).
- Drews, K., Jozefczuk, J., Prigione, A., Adjaye, J. Human induced pluripotent stem cells--from mechanisms to clinical applications. J Mol Med (Berl). 90 (7), 735-745 (2012).
- Ho, P. J., Yen, M. L., Yet, S. F., Yen, B. L. Current applications of human pluripotent stem cells: possibilities and challenges. Cell Transplant. 21 (5), 801-814 (2012).
- Krueger, W. H., Swanson, L. C., Tanasijevic, B., Rasmussen, T. P. Natural and artificial routes to pluripotency. Int J Dev Biol. 54 (11-12), 1545-1564 (2010).
- Pistollato, F., Bremer-Hoffmann, S., Healy, L., Young, L., Stacey, G. Standardization of pluripotent stem cell cultures for toxicity testing. Expert Opin Drug Metab Toxicol. 8 (2), 239-257 (2012).
- Pistollato, F., et al. Development of a pluripotent stem cell derived neuronal model to identify chemically induced pathway perturbations in relation to neurotoxicity: effects of CREB pathway inhibition. Toxicol Appl Pharmacol. 280 (2), 378-388 (2014).
- Zagoura, D., Canovas-Jorda, D., Pistollato, F., Bremer-Hoffmann, S., Bal-Price, A. Evaluation of the rotenone-induced activation of the Nrf2 pathway in a neuronal model derived from human induced pluripotent stem cells. Neurochem Int. , (2016).
- Standard operating procedure for differentiation of human induced pluripotent stem cells into post-mitotic neurons and glial cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-differentiation-of-human-induced-pluripotent-stem-cells-into-post-mitotic-neurons-and-glial-cells-%28mixed-culture%29-protocol-no.-165/key/p_1570 (2016)
- Standard operating procedure for expansion of rosette-derived neural stem cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-expansion-of-rosette-derived-neural-stem-cells-protocol-no.-166/key/p_1571 (2016)
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Brien, P. J., et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening. Arch Toxicol. 80 (9), 580-604 (2006).
- Accordi, B., et al. Functional protein network activation mapping reveals new potential molecular drug targets for poor prognosis pediatric BCP-ALL. PLoS One. 5 (10), e13552 (2010).
- Vassallo, A., et al. A multi-laboratory evaluation of microelectrode array-based measurements of neural network activity for acute neurotoxicity testing. Neurotoxicology. , (2016).
- Shamblott, M. J., et al. Human embryonic germ cell derivatives express a broad range of developmentally distinct markers and proliferate extensively in vitro. Proc Natl Acad Sci U S A. 98 (1), 113-118 (2001).
- Bryan, H. K., Olayanju, A., Goldring, C. E., Park, B. K. The Nrf2 cell defence pathway: Keap1-dependent and -independent mechanisms of regulation. Biochem Pharmacol. 85 (6), 705-717 (2013).
- Tufekci, K. U., Civi Bayin, E., Genc, S., Genc, K. The Nrf2/ARE Pathway: A Promising Target to Counteract Mitochondrial Dysfunction in Parkinson's Disease. Parkinsons Dis. , 314082 (2011).
- Kovac, S., et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase. Biochim Biophys Acta. 1850 (4), 794-801 (2015).
- Lee, J. M., Shih, A. Y., Murphy, T. H., Johnson, J. A. NF-E2-related factor-2 mediates neuroprotection against mitochondrial complex I inhibitors and increased concentrations of intracellular calcium in primary cortical neurons. J Biol Chem. 278 (39), 37948-37956 (2003).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236 (2), 313-322 (1997).
- Li, L., et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling. Chem Biol Interact. , 56-67 (2014).
- Cannon, J. R., et al. A highly reproducible rotenone model of Parkinson's disease. Neurobiol Dis. 34 (2), 279-290 (2009).
- Sherer, T. B., Kim, J. H., Betarbet, R., Greenamyre, J. T. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation. Exp Neurol. 179 (1), 9-16 (2003).
- Testa, C. M., Sherer, T. B., Greenamyre, J. T. Rotenone induces oxidative stress and dopaminergic neuron damage in organotypic substantia nigra cultures. Brain Res Mol Brain Res. 134 (1), 109-118 (2005).
- Zhou, J., et al. High-efficiency induction of neural conversion in human ESCs and human induced pluripotent stem cells with a single chemical inhibitor of transforming growth factor beta superfamily receptors. Stem Cells. 28 (10), 1741-1750 (2010).
- Topol, A., Tran, N. N., Brennand, K. J. A Guide to Generating and Using hiPSC Derived NPCs for the Study of Neurological Diseases. J Vis Exp. (96), e52495 (2015).
- Jiang, Y., Zhang, M. J., Hu, B. Y. Specification of functional neurons and glia from human pluripotent stem cells. Protein Cell. 3 (11), 818-825 (2012).
- Parsons, X. H., et al. Efficient derivation of human neuronal progenitors and neurons from pluripotent human embryonic stem cells with small molecule induction. J Vis Exp. (56), e3273 (2011).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7 (10), 1836-1846 (2012).
- Zeng, H., et al. Specification of region-specific neurons including forebrain glutamatergic neurons from human induced pluripotent stem cells. PLoS One. 5 (7), e11853 (2010).
- Zeng, X., et al. An in vitro model of human dopaminergic neurons derived from embryonic stem cells: MPP+ toxicity and GDNF neuroprotection. Neuropsychopharmacology. 31 (12), 2708-2715 (2006).
- Paşca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12 (7), 671-678 (2015).
- Almeida, S., et al. Modeling key pathological features of frontotemporal dementia with C9ORF72 repeat expansion in iPSC-derived human neurons. Acta Neuropathol. 126 (3), 385-399 (2013).
- Urbán, N., Guillemot, F. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front Cell Neurosci. 8, 396 (2014).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. J., Zhang, S. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nat Biotechnol. 29 (6), 528-534 (2011).
- Krencik, R., Zhang, S. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nat Protoc. 6 (11), 1710-1717 (2011).
- Nguyen, T., Nioi, P., Pickett, C. B. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress. J Biol Chem. 284 (20), 13291-13295 (2009).
- Bal-Price, A., et al. Putative adverse outcome pathways relevant to neurotoxicity. Crit Rev Toxicol. 45 (1), 83-91 (2015).
- Cabezas, R., El-Bacha, R. S., Gonzalez, J., Barreto, G. E. Mitochondrial functions in astrocytes: neuroprotective implications from oxidative damage by rotenone. Neurosci Res. 74 (2), 80-90 (2012).
- Swarnkar, S., et al. Astrocyte activation: a key step in rotenone induced cytotoxicity and DNA damage. Neurochem Res. 37 (10), 2178-2189 (2012).
- Canovas-Jorda, D., Louisse, J., Pistollato, F., Zagoura, D., Bremer, S. Regenerative toxicology: the role of stem cells in the development of chronic toxicities. Expert Opin Drug Metab Toxicol. 10 (1), 39-55 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены