Method Article
Nörotoksisite Testi İçin İnsan Kaynaklı Pluripotent Kök Hücrelerin Nöronlar ve Glia Karışık Kültürlerine Ayrıştırılması Protokolü
Bu Makalede
Özet
İnsan kaynaklı pluripotent kök hücreler (hiPSC), ilaç ve kimyasal tarama için ve nörotoksisiteyi de içeren toksisite testi için yeni in vitro modellerin geliştirilmesi için güçlü bir araç olarak düşünülür. Burada, hiPSC'lerin nöronlara ve glia'ya diferansiyelleştirilmesi için ayrıntılı bir protokol anlatılmıştır.
Özet
İnsan pluripotent kök hücreleri, insan kaynaklı in vitro toksisite deneylerine uygulanabilen çeşitli hücre tiplerine ayrılabilir. En önemli avantajı, insan kaynaklı pluripotent kök hücreler (hiPSC) üretmek için somatik hücrelerin yeniden programlanmasının, insan embriyonik kök hücrelerinin (hESC'ler) kullanımıyla ilgili etik ve yasama konularından kaçınmasıdır. HiPSC'ler, toksisite testi için ve özellikle de nörotoksite dahil olan farklı yolların değerlendirilmesi için test sistemleri olarak işlev gören, nöronal ve glial hücrelere farklı tiplerde genişletilebilir ve etkili şekilde ayırt edilebilir. Bu çalışma hiPSC'lerin nöronal ve glial hücrelerin karışık kültürlerine ayrılması için bir protokolü açıklamaktadır. Nöronal farklılaştırma ile düzenlenen ve / veya aktive edilen sinyal yolları tanımlanmıştır. Bu bilgi, hücre modelinin yeni toksisite testi paradigmasına uygulanması için kritiktir; burada, kimyasalların,Rturb biyolojik yollar. Konseptin bir kanıtı olarak, mitokondriyal solunum kompleksi I'in bir inhibitörü olan rotenon, oksidatif strese karşı antioksidan-tepki-element- (ARE) tarafından tetiklenen hücresel savunma mekanizmasının anahtar regülatörü Nrf2 sinyal yolağının aktivasyonunu değerlendirmek için kullanılmıştır .
Giriş
ABD Ulusal Araştırma Konseyi raporu 1, düzenleyici toksisite testinin, hayvanlarda görülen fenotipik değişikliklere dayalı bir yaklaşımdan , insan hücrelerini kullanarak mekanik in vitro deneylere odaklanan bir yaklaşıma kaydırılmasını öngören yeni bir toksisite testi paradigması öngördü. Elde edilen hücreler, insan dokularının fizyolojik koşullarına daha yakından benzeyebilir ve kimyasal kaynaklı olumsuz etkileri incelemek için daha alakalı araçlar sağlayabileceğinden, çok hücreli kök hücre (PSC) türevleri kanser hücresi modellerine alternatif olabilir. Toksisite testi için en umut vericidir PSC kültürlerinin iki ana türü, şu anda temel araştırma ve rejeneratif tıp alanlarında yaygın olarak kullanılan insan embriyonik kök hücrelerinden (hESC'ler) ve insan kaynaklı pluripotent kök hücrelerden (hiPSC'ler) oluşur 2 , 3 . Bu uzmanlık artık toksikoloğun yeni bir sınıfının geliştirilmesi için kullanılabilirIn vivo advers etkilerin gelişimi ile ilgili rahatsız edici fizyolojik yolları belirlemeyi amaçlayan in vitro deneyler. Bununla birlikte, hESC'lere dayanan düzenleyici güvenlik değerlendirmeleri için test yöntemleri, muhtemel etik kaygılardan ve embriyo kaynaklı hücrelerin kullanımını düzenleyen çeşitli ulusal yasama politikalarından dolayı tüm AB Üyesi Devletler tarafından ve dünya ülkelerince kabul edilmeyecektir.
HiPSCs, hESC 4 , 5'e benzer özellikleri paylaşır ve hem tedavi hedeflerini tanımlamak hem de güvenlik değerlendirmeleri için in vitro yöntemler için büyük potansiyel taşır. Buna ek olarak, hiPSC teknolojisi, sınırlı bir donör havuzun kısıtlamalarını ve embriyo kökenli hücrelerle bağlantılı etik kaygıları hafifletir. HiPSC'ler için büyük bir zorluk, bu hücrelerin, toksikolojik olarak ilgili hücre türevleri,Insan dokularına özgü karakteristikler ve tepkilerle. Seçilen belirteçlerin önceden tanımlanmış seviyeleri genellikle hücre popülasyonlarını farklılaşma sürecinden sonra karakterize etmek için ve farklılaşma sürecinin kararlılığı hakkında bilgi sağlamak için kullanılır.
Önceki çalışmalar, hiPSC'lerin nöronal ve glial hücrelerin karışık kültürlerini üretmeye uygunluğunu ve mitotondrial solunum kompleksi I inhibitörü olan rotenonun, antioksidan savunma mekanizmalarının anahtar bir düzenleyicisi olan Nrf2 yolağının aktivasyonu üzerindeki etkilerini değerlendirdi. Birçok hücre tipi 6 , 7 .
Bu çalışma, hiPSC'lerin karışık nöronal ve glial kültürlere ayrılması için kullanılan ve nöronal / glial diferansiyasyon üzerine aktive edilen sinyal yolları (gen ve protein seviyesi) hakkında ayrıntılar sağlayan bir protokolü açıklamaktadır. Buna ek olarak, çalışma, bunun nasılHiPSC türevi nöronal ve glial hücre modeli oksitlenme stres indüksiyonunun değerlendirilmesine izin veren, rotenon ile akut (24 saat) tedaviyle indüklenen Nrf2 sinyal aktivasyonunu değerlendirmek için kullanılabilir.
IMR90 fibroblastları, pMIG vektörleri 6 kullanılarak 2 transkripsiyon faktörünün (Oct4 ve Sox2) viral transdüksiyonuyla I-Stem'de (Fransa) hiPSC'lere yeniden programlandı. Benzer hiPSC modelleri de uygulanabilir. Aşağıda açıklanan protokoller, hiPSClerin sinir kök hücrelerine (NSC'ler) ve daha sonra mitotik sonrası nöronların ve glial hücrelerin karışık kültürlerine ayrılmasının tüm aşamalarını özetler (adım 1 ve 2, ayrıca ayrıntılı bir açıklama için EURL ECVAM DBALM web sitesine bakın) Protokol) 8 .
NSC'lerin karışık nöronlara ve glial hücrelere ayrılması, genişletilmesi, kriyoprezervasyonu ve daha ileri farklılaşması için ek bir protokol, 3. ve 4. adımlarda detaylandırılmıştır (aynı zamanda EURL ECVAM DBALM'eBu protokolün ayrıntılı bir açıklaması için bsite) 9 . Adım 5, taahhüt ve farklılaşma aşamalarında hücrelerin fenotipik kimliğini değerlendirmek için yapılabilecek analizleri açıklar.
Protokol
1. İnsan Kaynaklı Pluripotent Kök Hücre (hiPSC) Genleşmesi
NOT: hiPSC'ler mTeSRl 5x takviyeleri içeren mTeSR1 ortamı varlığında (üreticinin talimatlarına göre hazırlanmış plakaya ~ 100 koloni fragmanları / 60 mm Petri kabı) uygun bir protein karışımı substratı üzerinde kültürlenebilir. HiPSC kolonileri uygun bir boyuta ulaştığında ( Şekil 2A'daki bir koloni örneğine bakın), hücreleri aşağıda anlatıldığı gibi (haftada bir kez) geçirin.
- HESC-nitelikli bazal membran matrisi (bundan sonra "nitelikli matris" olarak adlandırılır) veya herhangi bir uygun protein substratı ile kaplama.
- Soğuk 1,5 mL tüpler ve soğuk 5 veya 10 mL'lik pipetlerde 200 μL'lik alikotlar halinde , -80 ° C'de nitelikli matrisi ( Malzeme Listesine bakın ) saklayın .
- Geçişten önce, buz üzerinde 200 μL nitelikli matrisi çözdürün.
- 200 mcL nitelikli matris 20 m'de seyreltinL DMEM / F12 ortamı (1: 100 seyrelti).
- Bu solüsyon ile 60 mm Petri kaplarını kaplayın (5 mL / çanak).
- Kaplanmış tabakları 37 ° C'de en az 1 saat inkübe edin.
- HiPSC koloni fragmanı kriyoprezervasyon ve çözülme
- HiPSC kolonileri kesildikten sonra (hiPSC koloni kesim prosedürü için adım 1.3'e bakın), hiPSC koloni parçalarını kök hücre dondurma ortamında, ~ 100 fragman / 250 μL (Malzeme Tablosuna bakınız) nazikçe ve yavaşça tekrar süspanse edin.
- Kriyoprezervasyon için uygun şişelerde koloni parçalarını alın (250 uL / flakon).
- Şişeleri 2-propanol dolu bir kaba yerleştirin ve kabı -80 ° C'de en az 2 saat ve en fazla 2 hafta süreyle yerleştirin.
- Şişeleri bir sıvı azot tankının buhar fazına aktarın.
- Kültürü yeniden başlatmak için, 1 adet dondurulmuş flakonu su banyosunda 37 ° C'de çözdürün.
- 7 mL önceden ısıtılmış komple hiPSC içinde hafifçe hiPSC koloni parçalarını toplayın1, 2 veya 5 mL'lik bir pipet kullanarak 15 mL'lik bir tüp içinde orta (bakınız Malzeme Tablosu ).
- HiPSC koloni parçalarını 130 xg'de 3 dakika boyunca santrifüjleyin.
- Süpernatantı çıkarın ve 1, 2 veya 5 mL'lik bir pipet kullanarak 1 mL'lik komple hiPSC ortamında hiPSC koloni parçalarını hafifçe tekrar süspanse edin.
- Hücre süspansiyonunu 3 veya 4 mL komple hiPSC ortamda seyreltin.
- Kaliteli bir matris ile kaplanmış 60 mm'lik Petri kabına (~ 100 parça / çanak; adım 1.1'de anlatıldığı gibi tabakları kaplayın) hiPSC koloni parçalarını plaklayın.
- HiPES'leri 37 ° C'de ve% 5 CO 2'de inkübe edin.
- Her gün orta düzeyde bir değişiklik yapın.
- HiPSC kolonilerinin geçişi
NOT: Farklılaşmamış hiPSC'ler büyük nükleolide ve bol sitoplazma şekli ile yuvarlak olmalıdır. Ayırt edilmemiş koloniler, düz ve sıkı dolaşan bir morfoloji ile karakterize edilmelidir. Sadece ayrışmamış koloniler (yaklaşık 1 mm iN çap) daha pasaj için kesilmelidir.- Kök hücre kolonilerini 30G'lik bir iğne veya diğer ticari olarak temin edilebilir aletler bulunan 1 mL'lik bir şırınga kullanarak yaklaşık 200 μm x 200 μm kareler halinde kesin (Malzeme Tablosuna bakın). Oda sıcaklığında laminer bir kabin içinde 4 kat büyütmede bir stereoskopik mikroskop kullanın.
- Parçaları kaldırmak için yavaşça altına besleyerek 200 μL'lik bir pipet kullanarak çanak yüzeyinden koloni parçalarını ayırın.
- Koloni parçalarını (~ 100 parça), 4 mL'lik komple hiPSC ortamı ile dolu, nitelikli bir matriks-DMEM / F12 kaplı plakaya aktarın (Malzemelerin Tablosuna bakın, kapları adım 1.1'de tarif edildiği gibi kaplayın).
- Yeni plakaları 37 ° C'de ve% 5 C02'de inkübe edin.
- Her gün toplam orta değişim gerçekleştirin ve 4X ve 10X büyütmede bir faz-kontrast mikroskopu kullanarak kolonilerin morfolojisini inceleyin.
2. HiPSC DiffereKarışık Nöronlar ve Glia'ya ntiasyon
NOT: İşlemin tamamlanması yaklaşık 28 gün sürer, ana adımlar Şekil 1'de (üst kısımda) özetlenmiştir.
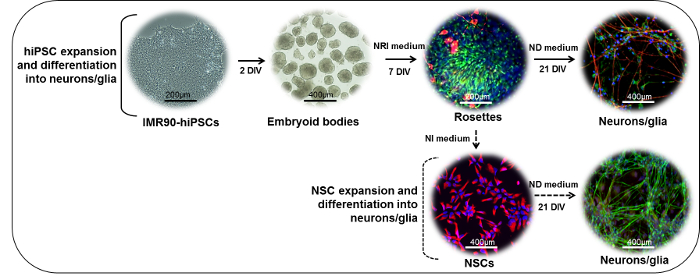
Şekil 1: Nöronal Farklılaşma Protokolünün Şematik Temsil Edilmesi. (Üst kısım) IMR90-hiPSC kolonileri, embriyonik gövdeleri (EB'ler) oluşturmak için fragmanlara kesilebilir. In vitro (DIV) 2 gün sonra EB'ler, laminin veya standart matris kaplı kaplara kaplanabilir ve nöroektodermal türevler (burada nestin (yeşil) ve β için boyanan rozetler) üretmek için nöroepitelyal indüksiyon (NRI) ortamı varlığında kültürlenebilir -III-tübülin (kırmızı)). Rosettes ayrıştırabilir, toplanır, laminin veya standart matris kaplı tabaklar üzerinde replike edilebilir ve ayrıca olgun nöronal (NF200, kırmızı) ve glial olarak ayırt edilebilir(GFAP, yeşil) hücrelerin nöronal farklılaşma (ND) ortamı varlığında. (Alt bölüm) rozet türevi NSC'ler (nestin, kırmızı) nöral indüksiyon (NI) ortamı varlığında genleşebilir, dondurulmuş olarak saklanabilir veya karışık nöronal (NF200, yeşil) ve glial oluşturmak için ND ortamı varlığında daha da farklılaştınlabilir GFAP, kırmızı) kültürleri. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
- Embriyoid cisimlerin üretimi (Günler 0 → 1)
NOT: Bu prosedür, iyi manuel beceri ve hassaslık gerektirir. HiPSC koloni fragmanları bir sonraki adımlarda homojen embriyot gövdeleri (EB'ler) elde etmek için eşit büyüklükte olmalıdır. Morfolojik olarak farklılaşmış koloniler (büyük sitoplazmik fraksiyonlar ve küçük nükleolide) atılmalıdır.- Farklılaşmamış hiPSC kolonilerini kesmeden önce hiPSC ortamını (3 mL / 60 mm petri kabı) yenileyin (diamin yaklaşık 1 mm'siEter, bakınız Şekil 2A ) steril koşullar altında (1. adımda tarif edildiği gibi).
- 30G iğne ile 1 mL'lik bir şırınga kullanarak yaklaşık 200 μm x 200 μm'lik parçalara ayrışmamış kolonileri kesin ( Şekil 2A ve Şekil 2B'de gösterildiği gibi). Oda sıcaklığında laminer bir akış dolabında 4X büyütmede bir stereoskopik mikroskop kullanın.
- Parçaları kaldırmak için yavaşça orta altına pipetleme yapılarak 200 μL'lik bir pipet kullanarak bulaşık yüzeyinden koloni parçalarını ayırın.
- Tüm ayrılmış parçaları ve ortam 1, 2 veya 5 mL pipet kullanarak 15 mL'lik bir tüp içine aktarın.
- Tüm parçaları kurtarmak için çanağı 2 mL eksiksiz hiPSC ortamı ile durulayın.
- 1 dakika 112 x g'de santrifüjleyin.
- Süpernatantı aspire edin ve parçaları 5 mL'lik komple hiPSC EB ortamında hafifçe yeniden süspansiyon haline getirin (Malzeme Tablosuna bakın ).
- Plaka koLony parçaları 60 mm'lik ultra düşük bağlanmış bir Petri kabında (5 mL / 60 mm Petri kabı) ekledi.
- Petri kabı gece boyunca 37 ° C'de ve% 5 C02'de inkübe edin.
- Ertesi gün (1. Gün), 1, 2 veya 5 mL'lik bir pipet kullanarak EB'leri ve bunların ortamını 15 mL'lik bir tüp içerisinde toplamayın.
- EB'leri 112 xg'de 1 dakika boyunca santrifüjleyin.
- Dikkatle süpernatantı aspire edin ve 1, 2 veya 5 mL'lik bir pipet kullanarak 5 mL'lik komple hiPSC EB ortamında EB'leri yavaşça tekrar süspanse edin.
- EB'leri yeni bir 60 mm ultra düşük ekli Petri kabı (5 mL / 60 mm Petri kabı) üzerine yerleştirin.
- Petri kabı gece boyunca 37 ° C'de ve% 5 C02'de inkübe edin.
- Gün 1'de, bulguları temel membran matrisi ( örn., Matrigel, bundan sonra "standart matris" olarak anılacaktır) veya başka herhangi bir uygun protein substratı ( örn ., Laminin) ile kaplayın.
- Standart matrisi ( Malzeme Listesine bakın ) -80 ° C'de saklayın.Soğuk 1.5 mL tüpler ve soğuk 5 veya 10 mL'lik pipetleri kullanarak 200 uL'lik alikotlar.
- Buz üzerinde 200 μL standart matrisi çözünür.
- Standart matris 200 mcL 20 ml DMEM / F12 orta (1: 100 seyreltme) sulandırınız.
- Bu solüsyon ile 60 mm Petri kaplarını kaplayın (5 mL / çanak).
- Kaplanmış yemekleri gece boyunca 37 ° C'de inkübe edin.
NOT: Bu yemekler EB'leri plaklamak (yaklaşık 50 EB / çanak) ve nöroepitelyal agrega (rozet) üretmek için kullanılacaktır; Adım 2.3'e bakın.
- Nöroepitelyal agrega (rozet) üretimi (2. gün → 7 gün)
- 2. Gün, 60 mm'lik Petri kaplarından standart matris kaplama solüsyonunu çıkarın (plakları durulamaya gerek yoktur) ve bunları 5 mL / çanak komple nöroepitelyal indüksiyon ortamı (NRI) ile doldurun; Malzeme Tablosu'na bakın .
- Bir stereoskopik mi altındaki bir 200 | ig pipet kullanarak kayan EB'leri (adım 2.1.14'ten) kaplanmış bulaşıklara (~ 50 EB / çanak) aktarın4x büyütmede croscope ve laminer bir akış dolabına yerleştirilir.
NOT: Homojen, orta büyüklükte EB'ler (~ 200-300 μm çapında) seçmek önemlidir. Çok küçük EB'ler nöroektodermal diferansiyasyon sırasında iyi bir şekilde ayakta kalamazken, çok büyük EB'ler çekirdek nekroza uğrar. - Bulguları 37 ° C'de ve% 5 CO 2'de inkübe edin.
- Günler sonra (3. Gün), EB'lerin hepsinin bağlı olduğundan emin olmak için 10x büyütmede mikroskop altındaki bulguları kontrol edin.
- Komple NRI aracı ile nazikçe toplam orta değişiklik yapın.
- NRI ortamını her gün nöroepitelyal agregalar (rozetler) görülebilecek 7 güne kadar değiştirin.
- 7. günde adım 2.2'de tarif edildiği gibi standart matrisi (veya laminin) kaplayınız; 96 oyuklu plakalar (100 uL / oyuk), 24 oyuklu plakalar (250 mcL / oyuk), 12- (500 μL / çukur), MEA cipsi (elektriksel aktivite için, 1 mL / tekli çip) veya 60 mm Petri disheS (4 mL / çanak) ilave edildi.
- Kaplanmış plakaları 37 ° C'de ve% 5 C02'de en az 2 saat inkübe edin.
- Rosette ayrılması ve nöronal farklılaşma (8. gün → 28 gün)
NOT: Bu prosedür, iyi manuel beceri ve hassaslık gerektirir. Mezodermal ve endodermal hücrelerin toplanmasını önlemek için sadece ektoderm rozet benzeri yapıların ayrışması ve toplanması gerekir.- 8. günde, rozet benzeri yapıları steril koşullar altında 10X büyütmeyle bir stereoskopik mikroskop altında parçalara kesin. 30G iğneli 1 mL şırınga kullanın. İğne ile dokunulduğunda rozetlerin çanaktan kolaylıkla ayrılma eğiliminde olduklarına dikkat edin.
- 200-μL'lik bir pipet kullanarak rozet parçalarının ayrılmasını tamamlayın.
- Çanağı laminer akış davlumbazının altına aktarın ve 1, 2 veya 5 mL pipet kullanarak rozet parçalarını ve ortamlarını 15 mL'lik bir konik tüp içine alın. Kurutmak için çanağı 2 mL NRI ortamı ile durulayınTüm parçalar.
- Rozet parçalarını 112 xg'de 2 dakika döndürün.
- Süpernatantı aspire.
- Pelet 1 mL 1x DPBS'de (kalsiyum ve magnezyum olmadan) yavaşça tekrar süspansiyon haline getirin ve rozet parçalarını kısmen ayrıştırmak için 1.000 μL'lik bir pipet kullanarak aşağı yukarı pipetleyin.
- 4 mL komple NRI ortamı ekleyin ve tripan mavisi ve otomatik bir hücre sayacı kullanarak hücreleri sayın (Malzeme Tablosuna bakın )
NOT: 20 μL hücre süspansiyonunu 20 μL Tripan mavisi ile seyreltin. Hücreler tek hücreli bir süspansiyon haline getirilemezse, bu adım atılabilir. Rozet parçaları tamamen ayrışmış görünmüyorsa, yaklaşık 50 EBs / 60 mm çanaktan türetilen rozet parçaları, Tablo 1'de belirtildiği üzere, 50 mL tamamlanmış NRI ortamında yeniden süspansiyon haline getirilebilir ve kaplanabilir. - Petri tabaklarından, plakalarından ve / veya MEA cipslerinden standart matris (veya laminin) kaplama solüsyonunu aspire edin (adım 2.3'ten.7). Onların kurumasına izin verme.
- Çalışma planına göre hücreleri komple NRI ortamında plaklayın (yaklaşık 15.000 hücre / cm2, kaplama hacmi göstergeleri için Tablo 1'e bakın).
- Plakaları gece boyunca 37 ° C'de ve% 5 C02'de inkübe edin.
- 10. günde, tam nöronal farklılaşma ortamı (ND) kullanarak toplam orta değişim gerçekleştirin; Malzeme Tablosu'na bakın.
- 28. güne kadar haftanın her günü ND medyasını yenileyin.
- Adım 5'te açıklandığı gibi nöronal / glial hücre türevlerini karakterize edin (genel kabul kriterleri için Tablo 2'ye bakın).
3. HiPSC'den türetilmiş Sinirsel Kök Hücre (NSC) Genişletme ve Karışık Nöronlar ve Glia'ya Farklılaşma
NOT: Rozet parçacıklarından türetilen NSC'ler, aşağıda açıklanan prosedürü izleyerek genişletilebilir ve muhafaza edilebilir ( Şekil 1 , alt kısım). Bu sayımın artmasını sağlar.Farklılaşma ve kimyasal testler için hücre sayısı.
- 5 mL standart matris DMEM / F12 kaplama çözeltisi ile 60 mm'lik bir Petri kabını (veya bir T-25 şişesi) kaplayın ve en az 2 saat süreyle 37 ° C'de ve% 5 CO 2'de inkübe edin (adım 2.2'de açıklandığı gibi).
- 1-2. Adımlardan türetilen rozet parçalarını, 112 xg'de konik bir 15 mL'lik tüp içerisinde 2 dakika boyunca döndürün.
- 5 mL nötr indüksiyon ortamında (NI) nazikçe topağı tekrar süspanse edin; Malzeme Tablosu'na bakın.
- Hücreleri, standart bir matris kaplı 60 mm Petri kabı (veya T-25 şişesi) üzerine aktarın.
- Kültür rozet türevi NSC'ler, NI ortamı varlığında, hücreleri konfluansa gelene kadar besiyeri her geçen gün yenilemektedir.
- Birleştiğinde MGK'ları aşağıdaki adımlarda anlatıldığı şekilde geçirin.
NOT: MGK'ları haftada bir kez geçirin; Çalışma planına bağlı olarak yeni kaplamalı tabaklar, şişeler veya tabaklar kullanmayı düşünün. - Tüm NI orta ve zararlı maddenin çıkarılmasıNSC'leri DPBS ile durulayın (kalsiyum ve magnezyum olmadan).
- Hücreleri içeren 60 mm Petri kabı (veya T-25 şişesi) 37 ° C'ye önceden ısıtılan 1.5 mL% 0.05'lik tripsin-EDTA ilave edin ve 1 dakika boyunca kuluçka makinesine yerleştirin.
- Hücreleri ayırmak için hafifçe çanağa (veya balona) dokunun.
- 37 ° C'ye önceden ısıtılan 1.5 mL tripsin önleyicisini ekleyin ve hücreleri 15 mL tüpe aktarın.
- Petri kabını (veya T-25 şişesini) eşit miktarda NI maddesiyle (1.5 mL) durulayın ve hacmi aynı 15 mL'lik tüp içinde toplamayın.
- Hücreleri 130 x g'de 3 dakika boyunca santrifüjleyin.
- Süpernatantı kaldırın ve 1000 μL'lik bir pipet kullanarak 1 mL'lik tam NI ortamında hücreleri nazikçe tekrar süspanse edin.
- Hücre süspansiyonunu 3 veya 4 mL'lik komple NI ortamda seyreltin ve tripan mavisi ve otomatik hücre sayıcısı kullanarak hücreleri sayın.
- NSC'leri adım 3.1'den yaklaşık 50.000 hücre / cm2'lik bir yoğunlukta 60 mm'lik Petri kabına (veya T-25 şişesine) plaka edin.
- Her geçen gün eksiksiz NI aracı ile toplam orta değişiklik yapın.
- Adım 5'te açıklandığı gibi hücrelerin nöronal / glial hücre türevleri varlığı için karakterize edin.
NOT: NSC'ler komple ND ortamında (2.4.11-2.4.13 adımlarında anlatıldığı gibi) nöronlar ve glia karışık kültürlerine ayırt edilebilir, 21 günlük süre boyunca haftada iki kez komple yenileyebilir.
4. HiPSC türevli NSC Kriyoprezervasyon ve Çözdürme
NOT: Geçiş esnasında, NSC'ler bu prosedürü izleyerek dondurulabilir ve yeniden çözülür.
- Paslanmaz NSC'leri (adım 3.12'den itibaren) 130 xg'de 3 dakika boyunca santrifüjleyin.
NOT: Hücreler adım 3.14'te sayılmalıdır. - NSC'leri yavaşça ve yavaşça 3 x 10 6 / mL dondurucu ortamda yeniden süspansiyon haline getirin (Malzeme Tablosuna bakın ).
- Kriyoprezervasyon için uygun tüplerdeki hücreleri ayırın (yaklaşık 0.5 mL = 1.5 x 106 / şişe).
- Şişeleri bir kutuya yerleştirin fi2-propanol ile doldurulur ve kabı -80 ° C'de en az 2 saat ve en fazla 2 hafta süreyle yerleştirin.
- Şişeleri bir sıvı azot tankının buhar fazına aktarın.
- Hücre kültürünü yeniden başlatmak için 37 ° C'de bir su banyosunda 1 adet dondurulmuş flakonu çözdürün.
- Bir 1,000-μL pipet kullanarak 15 mL'lik bir tüpteki 7 mL'lik önceden ısıtılmış eksiksiz NI ortamındaki hücreleri hafifçe toplayın.
- Hücreleri 130 x g'de 3 dakika boyunca santrifüjleyin.
- Süpernatantı kaldırın ve 1000 μL'lik bir pipet kullanarak 1 mL'lik tam NI ortamında hücreleri nazikçe yeniden süspanse edin.
- Daha da iyisi, 3 veya 4 mL'lik komple NI ortamında hücre süspansiyonunu seyreltin ve tripan mavisi ve otomatik bir hücre sayıcısı (not: trypan mavisinin 20 μL'sinde hücre süspansiyonunun 20 μL'sini seyreltin, çözülmeden sonra canlılığı ≥ 80 olmalıdır %).
- Yaklaşık 50.000 hücre / cm2'lik bir yoğunluğa sahip NSC'leri kaplanmış bir 60 mm'lik Petri kabı (veya T25 şişesi) içine yerleştirin.
5. CharaHiPSC kaynaklı nöronal ve glial hücrelerin cterizasyonu
NOT: Farklılaştıkça, nöronal ve glial türevleri, aşağıdaki bölümlerde açıklananlar gibi farklı teknikler kullanılarak karakterize edilebilir.
- Kantitatif gerçek zamanlı PCR (qPCR) analizleri 10
- HiPSC koloni parçalarını, EB'leri ve / veya NSC'leri 130 xg'de 3 dakika döndürün.
- RNA ekstraksiyonu için uygun bir kitte sağlanan 100 μL soğuk RNA liziz tamponuna hücre topağını tekrar süspanse edin.
- Alternatif olarak, ortamı aspire ederek ve plakalarından nöronal / glial türevleri toplayın ve hücreleri toplamak için oyuklara soğuk RNA liziz tamponu ilave edin.
- RNA'yı üreticinin talimatlarını izleyerek izole edin.
- RNA'dan cDNA'ya yeniden transkripsiyona kadar uygun bir kit kullanılarak toplam RNA'nın 500 ng'ini ters transkribe edin.
- Uygun ana karışım ve primer kullanılarak qPCR reaksiyonlarını çift olarak çalıştırın( Malzeme Tablosuna bakınız ).
- Flüoresan emisyonunu gerçek zamanlı olarak kaydedin: 60 ° C'de tavlanmış primerlerle 45 devir.
- Göreceli RNA miktarlarını referans genler olarak GAPDH ve β-aktine göre normalleştirin ve kalibre edici koşullar için farklılaşmamış hiPSC'ler veya işlem görmemiş hücreler kullanın (ΔΔCt yöntemi). Alternatif olarak, başka uygun bir yöntem kullanın.
- İmmunositokimya ve yüksek içerikli görüntüleme (HCI) 6 , 11
- Oda sıcaklığında 15 dakika süreyle hiPSC kolonileri, NSC'ler ve / veya nöronal / glial türevleri soğuk% 4 paraformaldehid ile fikse edin.
- 1X PBS'de yavaşça hücreleri yıkayın ve plakları 1 aya kadar 4 ° C'de saklayın.
- Boyama için hazır olduğunuzda, oda sıcaklığında 15 dakika boyunca permeabilizasyon tamponu (% 0.1 triton-X-100 ve% 3 BSA içeren 1x DPBS) içindeki hücreleri permeabilize edin.
- Geçirgen hale getirme işlemini kaldırFfer ve antikorların spesifik olmayan bağlanmasını önlemek için 15 dakika süreyle oda sıcaklığında hücreleri bloke edici tampon (% 3 BSA / 1X DPBS) içerisinde inkübe edin.
- Bloke edici tamponu çıkarın ve hücreleri gece boyunca 4 ° C'de uygun primer antikorları içeren bloke edici tampon içerisinde inkübe edin ( Malzeme Tablosuna bakın ).
- Hücreleri 3 kez 1x PBS ile yıkayın.
- Hücreleri, DAPI boya ile çekirdekleri karşıt boyama fluorochrome-konjuge ikinci antikorlar (Malzeme Tablosu'na bakın) içeren bloke edici tampon içinde oda sıcaklığında 45 dakika inkübe edin.
- Mümkünse uygun bir yüksek içerik görüntüleme platformu kullanarak ortalama floresan yoğunluğunu ve hücre tiplerinin göreceli yüzdesini ölçün ( Materyal Tablosuna bakın ).
NOTLAR: Flüoresan arka planın yoğunluk seviyesini belirlemek için, bazı hücreleri / çukurları ikincil antikorlarla tek başına inkübe edin. Canlı (sabit değil) akış sitometrik analizi,SSEA4 gibi PSC'ye özel belirteçlerin ekspresyonunu değerlendirmek için ifferentifiye hiPSC'ler gerçekleştirilebilir (bkz . Malzeme Tablosu ). Farklılaşmamış hiPSC kolonileri alkalin fosfataz aktivitesi için üreticinin talimatlarını takip ederek piyasada bulunan BCIP / NBT kitleri kullanılarak analiz edilebilir (bkz . Malzeme Tablosu ). Ek olarak, Referans 12'de (test edilen antikorların bir listesi için, Malzeme Tablosuna bakınız) tarif edildiği gibi ters faz protein dizisi (RPPA) tahlilleri ve analizleri gerçekleştirilebilir .
- Elektrofizyolojik ölçümler 13
- Tam ND ortamında (~ 1 x 105 hücre / tek oyuklu MEA çipi) kaplanmış çok elektrotlu dizilerde (MEA'lar; Malzemelerin Tablosuna bakınız ) ayrışmış rozet parçalarını (7 DIV'den sonra) veya rozetlerden türetilen NSC'leri plaklayın.
- Tam ND ortamında hücreleri 3 hafta boyunca tazeleyin, yenileyin.Haftada iki kez orta.
- Farklılaşmanın sonunda, kültürleri tekrarlanan ölçümler için steril tutmak için, laminer bir akış kapağının altında yarı geçirgen bir membran ile MEA cipsini kapatın.
- Kalan elektrotlardan kayıt yapılmasına olanak tanıyan elektrotlardan birini bir yer referansı ile değiştirin.
- 37 ° C ve% 5 CO 2'ye ayarlanmış entegre sıcaklık proses kontrolüne sahip bir MEA amplifikatörü kullanarak ortalama ateşleme oranını (MFR; sivri uçların / dakika sayısı) kaydedin.
- MEA ham verilerinden tepe noktalarını, -4.7σ eşik sınırı kullanarak algıla (σ, bazal gürültünün standart sapmasını gösterir).
- Kayıt sonrası verileri uygun bir yazılımla işleyin.
Sonuçlar
Farklılaşmamış hiPSC'lerin karakterizasyonu
HiPSC'lerin fenotipini değerlendirmek için koloni / hücre morfolojisinin analizi, PSC'ye özel belirteçlerin belirlenmesi ve gen ekspresyonunun ve alkalin fosfat aktivitesinin incelenmesi gerçekleştirilmelidir. Ayırt edilmemiş hiPSC'ler yuvarlak, büyük nükleolide ve bol miktarda sitoplazma içermemelidir. Kolonilerin çoğunluğu, farklılaşmamış bir fenotipe işaret eden düz ve sıkı dolgulu bir morfoloji ile karakterize edilmelidir ( Şekil 2A ve Şekil 2B ). Ek olarak, kolonilerin% 80'den fazlası alkalin fosfataz aktivite boyaması için pozitif olmalıdır ( Şekil 2C ).
Hücrelerin yaklaşık% 80'i, Oct4, S gibi klasik pluripotensili belirteçler için pozitif olmalıdırNestin + ve β-III-Tubulin + hücrelerinin yüzdeleri önemli derecede düşük olmakla birlikte (sırasıyla yaklaşık% 8 ve% 3, SEA3, SSEA4 ve Tra1-60 ( Şekil 2D-H ), immünositokimya ve akış sitometrisi Şekil 2H'de gösterildiği gibi ). Bu sonuçlar pasajlar üzerinde çoğaltılabilir olmalıdır.
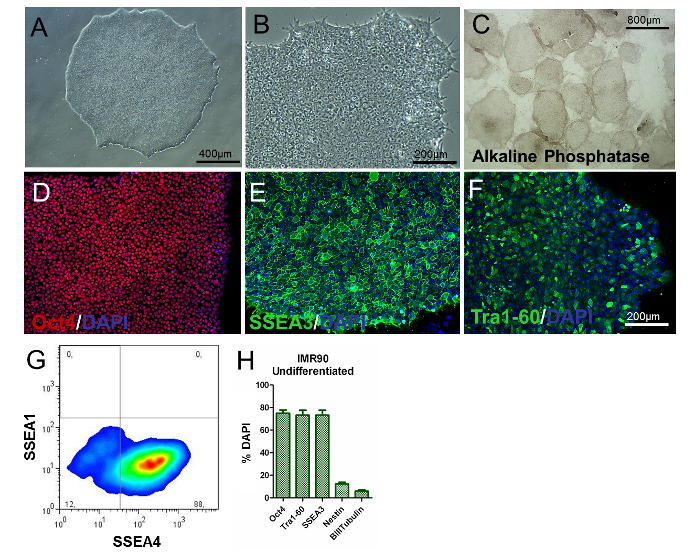
Şekil 2. Farklılaşmamış IMR90-hiPSC'lerin Karakterizasyonu. (A ve B) Farklılaşmamış IMR90-hiPSC kolonilerinin temsili faz kontrast görüntüleri (10X ve 20X büyütmeler). (C) alkalin fosfataz lekeli kolonilerin temsili görüntüleri (4X büyütme). (DF) (D) Oct4 (kırmızı), (E) SSEA3 (yeşil) ve (F) Tr'nin (DF) temsili immünositokimyasal görüntüleriA1-60 (yeşil). (G) SSEA1 (CD15) ve SSEA4 boyamasının temsili nokta çizgisi, akış sitometrisi ile analiz edildi. (H) Çubuk grafik, Oct4 + (~% 75-80), Tra1-60 + (~% 75-80), SSEA3 + (~% 75-80), nestin + (~% 10-15, ) Ve DAPI ile karşıt boyalı ve HC1 ile nicelendirilen, ortalama 3 ila 5 biyolojik çoğaltma ± SEM (referans 6'dan modifiye edilmiş grafik) ile, β-III-tübulin + (~% 3-7) hücrelerine bağlandı. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
EB oluşumu yoluyla pluripotensin değerlendirilmesi
HiPSCler pluripotenttir, yani uygun koşullar altında üç germ tabakası ile ilgili geni ifade ettikleri anlamına gelir. HiPSC pluripotansı değerlendirmek için, bir ortakYaklaşım, üç germ tabakasının oluşumunu indükleyen spontan EB oluşumuna dayanır 14 . Germe katmanına spesifik genlerin analizi, endodermin (α-fetoprotein (AFP) ve Cytokeratin 18 (KRT18)), ektodermin (Nestin, SRY-box 1 (Sox1) ve eşleştirilmiş kutu 6'nın (Pax6) ) Ve mezoderm (natriüretik peptid A (NPPA) ve Brachyury-T) ilişkili gen ifadesi ( Şekil 3A ve Şekil 3B ); Malzeme Tablosu'na bakın.
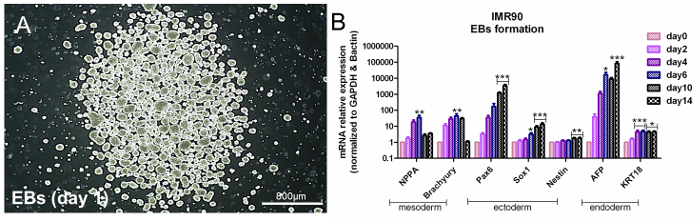
Şekil 3. EB oluşumu ile Pluripotansın değerlendirilmesi. (A) 1. gün EB'lerin temsili faz kontrastlı görüntüsü (B) Çubuk grafik mezodermal (NPPA ve brakury), ektodermal (Pax6, Sox1 ve nestin) ve endodermal (AFP ve KRT18) qPCR analizlerini gösterir ) Genleri, referans genlere, β-aktin ve GAPDH'ye normalize edildi ve diferansiye edilmemiş hücrelere kalibre edildi (Gün 0). Bu, 5 ayrı analizin ortalaması olan ΔΔCt yöntemidir. ± SEM * p <0,05, ** p <0.01, *** p <0.001; Grafiği Referans 6'dan değiştirildi . Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız .
Nöronal ve glial farklılaşmayı indükleme
IMR90-iPSC'ler, Şekil 1'de ve protokol bölümlerinde özetlenen adımları takiben mitotik sonrası nöronlar ve glial hücrelerin karışık kültürlerine ayırdedilebilir. EB'leri komple NRI ortamı varlığında standart matris veya laminin kaplı tabaklar üzerine kapladıktan 5-8 gün sonra, rozet benzeri yapılar görünür hale gelmelidir (= "Xfig"> Şekil 4A). Rosettes, nestin + hücrelerinin (nöronal prekürsörler, ~% 90), birkaç β-III-tubulin + hücreler (taahhüt edilen nöronal hücreler, ~% 5-10) ile karakterizedir ve sonuncusu genel olarak Rozetler ( Şekil 4B , gün 12 rozetler).
Rozet ayrışması üzerine ve laminin veya standart matris kaplı kaplar veya plakalar üzerinde tam ND ortamı varlığında tekrar yerleştirildiğinde, hücreler nöronlar ve glia karışık kültürlerinde farklılaşmaya başlar ve nörit demetleri ile bağlı nöronal hücre cesetleri kümeleri giderek oluşturulur ( Şekil 4C ve Şekil 4D ). Benzer sonuçlar, rozet türevi NSC'leri genişleterek ve onları nöronlara ve glia'ya ayırarak elde edilen nöronal popülasyonları analiz ederken elde edilmelidir. Rozetlerden genişletilmiş NSC'ler n olmalıdırEstin + ( Şekil 4E , nestin + hücreleri gösteren yerleştirme).
21 günlük farklılıktan sonra, hücreler β-III-tübülin için pozitif olmalıdır; NF200; Tau; Ve bir astroglial belirteç olan glial fibriler asidik protein (GFAP) için pozitif hücrelerin en az% 10-15'i olan dendritlerin geç işaretleyicisi olan MAP2 ( Şekil 4D , 4F ve Şekil 4H) ( Şekil 4G ve Şekil 4H) . Dahası, hücrelerin ~% 20-30'u diferansiyondan sonra nestin ekspresyonunu muhafaza etmelidir ( Şekil 4H ). Her bir hücre türünün yüzdesinin ( örn., Nöron, astrosit, nestin + hücreler) pasajlar üzerinde farklılık gösterebileceği ve kullanıcıya bağlı değişebilirlik gözlenebilir.
Spesifik nöronal alt popülasyonları analiz ederek, GABAerjik nöronlarGama-aminobütirik asit (GABA), tirozin hidroksilaz (TH) ve veziküler glutamat için immün boyama ile gösterildiği gibi toplam hücrelerin ~% 15-20'si, dopaminerjik nöronlar ~% 13-20'si ve glutamaterjik nöronlar ~% 35-42'dir Transporter 1 (VGlut1) 'dir (bkz. Şekil 4H'deki temsilci niceleme). Farklılaşmanın indüksiyonu, farklılaşmamış hücreler ile undifferentiated hiPSC'ler arasında önemli derecede downregüle edilmelidir (gösterilmemiştir, bkz. Referans 6), plurıpotikliğe bağlı işaretleyicilerin ( örneğin Oct4, Tra1-60 ve SSEA3) analizi ile de değerlendirilebilir. Bu ayrıca Oct4 ve Nanog'un azalması ve nöronal hücre yapışma molekülü 1 (NCAM1) ve mikrotübüle bağlı protein 2 (MAP2) gibi nöronal genlerin upregülasyonunu göstermesi gereken qPCR ile gen ifadesinin analizi yoluyla da doğrulanabilir; Presinaptik gen, sinaptofizin (SYP); Ve post-sinaptik gen, mikrotübüle bağlı protein tau (MAPT) Strong class = "xfig"> Şekil 4I. Ayrıca dopaminerjik (TH ve NR4A1) noradrenerjik (PHOX2A ve PHOX2B), glutamaterjik (NARG2, GRIA1 ve GAP43), GABAerjik (GABRA1 ve GABRA3), motor nöronlar (ISL1 ve LHX3) ve kolinerjik (SLC5A7 ve SLC18A13) ilişkili genler Farklılaşmamış hücrelere kıyasla upregüle nöronal hücrelerle sonuçlanır ( Şekil 4J ).
MEA aracılığıyla spontan elektrik aktivitesinin analizi, ayırt edilen hiPSC'lerdeki nöronal ağın işlevselliğini değerlendirmek için değerli bir okundu. Farklılaşma periyodunun sonunda nöronal türevler genel olarak ortalama ateşleme hızı (MFR) en az 60 sivri / dakika ile karakterize edilir ( Şekil 4K'deki temsili raster çizime bakınız). Ancak patlamalar gözlenmez.
55702fig4.jpg "/>
Şekil 4. IMR90-hiPSC'lerin Nöronlar ve Glia'nın Karışık Kültürlerine Farklılaşması. (A ve B) Nestin (yeşil) ve β-III-tübülin (kırmızı) lekelenen 7 DIV'den (A) sonra ve 12 DIV'den ( B) sonra rozetlerin temsili görüntüleri. (C ve D) β-III-tübülin (kırmızı) ve NF200 (yeşil) için boyanan 22 DIV (C) ve 28 DIV'den (D) sonra farklılaşmış hücrelerin temsili görüntüleri. (E) Rozet ayrışması ve genişlemesinden türetilmiş NSC'lerin temsili imgesi (inset, nestin + hücreleri, kırmızı gösterir). (F ve G) NSC'lerden ( 21 DIV'den sonra ) farklılaşan nöronal hücrelerin ( F , NF200 (kırmızı) ve Tau (yeşil) için boyanan) ve glial hücrelerin ( G , GFAP için boyanmış (kırmızı)) temsil eden görüntüleri. (H) Nestin, MAP2, GFAP, gamma-aminobütirik asit (GABA), veziküler glutamat taşıyıcısı 1'in (VGlut1) ve tirozin hidroksilaz (TH) -pozitif hücrelerin HCI ile karşılaştırılması, IMR90-hiPSC türevleri ve IMR90-hiPSC türevi NSC'lerden farklılaşan hücrelerin karşılaştırılması (Referans 7'den modifiye edilmiş grafik). (I ve J) pluripotik genlerin (Oct4 ve Nanog) ve nöronal genlerin (NCAM1, MAP2, SYP ve MAPT) (I ve dopaminerjik (TH ve NR4A1) noradrenerjik (PHOX2A ve PHOX2B) qPCR analizlerini gösteren çubuk grafikleri, Glutamaterjik (NARG2, GRIA1 ve GAP43), GABAerjik (GABRA1 ve GABRA3), motor nöron (ISL1 ve LHX3) ve kolinerjik (SLC5A7 ve SLC18A13) ilişkili genler (J) . Tüm analizler, referans genler olan β-aktin ve GAPDH için normalize edildi ve farklılaşmamış hücrelere kalibre edildi (yeşil çubuklar). Bu, 5 ayrı analizin ortalama ± SEM * p <0,05, ** p <0.01, *** p <0.001 olan ΔΔCt yöntemidir. I ve J'deki grafikler Referans 6'dan değiştirildi. (K) IMR90-NSC'den türetilen nörün temsili raster çizimi(En az 600 saniye süreyle kayıt yapıldı; dikey çubuklar tek sivri uçları temsil ediyor). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Nöronal belirteçlerin spesifik bir imgesi, farklılaşmış IMR90-hiPSC'lerde yukarı doğru düzenlenir
Yeni toksisite testi paradigmasında belirli bir toksik maddeye maruz kaldıktan sonra bir hücre içinde oluşan moleküler ve hücresel olayların tanımlanması gereklidir. Bu nedenle, araştırılan hücresel model içinde hangi sinyal yollarının aktive edildiğini ve / veya yukarı doğru düzenlendiğini karakterize etmek önemlidir.
Protein kinaz gen ekspresyonunun analizleri için piyasada bulunan diziler, ayırt edilmemiş hiPSC'leri ayırt edilen hücrelere kıyaslamak için kullanılabilir. differen(GDNF) reseptörleri, kemik morfogenetik proteini (BMP) / TGF-beta yolu ve trombosit kökenli nörotrofik faktör (GDNF) reseptörleri, nörotrofin reseptörlerinin kontrolü, akson kılavuzlama düzenlemesi, nevrit büyüme modülasyonu, glial türevi nörotrofik faktör (PDGF) reseptörlerine ( Şekil 5A ve Şekil 5B ) sahiptir.
RPPA'nın analizi, ayırt edilmiş IMR90-hiPSC'lerdeki spesifik bir nöronal imzanın upregülasyonunu gösterir. Özellikle, Erk / CREB, Akt / PDKl / mTOR ve Notch1 sinyal yolakları farklılaşma üzerine aktive edilir ( Şekil 5C ).
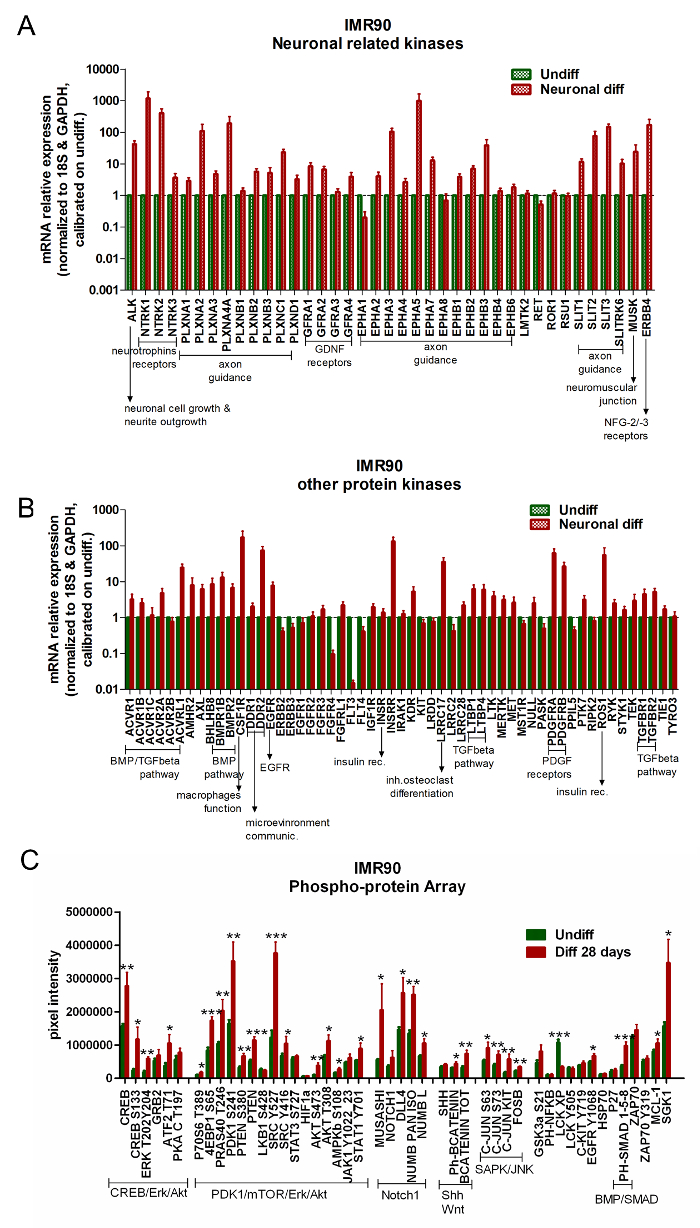
Şekil 5. Farklılaşmış Nöronal ve Glial Hücreler Nörona İlişkin Yolların Aktivasyonunu Sergilemektedir. (AVe B) Çubuk grafikler, nöronla ilgili kinazların (A) ve diğer kinazla ilgili genlerin (B) qPCR analizlerini rapor eder. Gen ekspresyon verileri, 18S ve GAPDH referans genlerine (dizi sağlandı) normalize edildi ve farklılaşmamış hücrelere kalibre edildi. Bu analizler için bir gen ifadesi, tanımlanmamış hücrelerden (2- ΔΔCt ≥ 2) en az 2 kat yüksek olduğunda önemli ölçüde yukarı doğru düzenlendiği kabul edildi; 3 bağımsız analizin ortalama ± SEM). (C) Çubuk grafik mutlak protein miktarlarını RPPA analizi vasıtasıyla gösterir; farklılaşmış (kırmızı çubuklar) ve farklılaşmamış hücreleri (yeşil çubuklar) karşılaştırır. Aynı sinyal yoluna ait kaskadlara ait proteinler, CREB / Erk / Akt, PDKl / mTOR / Erk / Akt, Notchl, Shh ve Wnt, SAPK / JNK ve BMP / SMAD gibi birlikte kümelenmiştir. Ortalama ± 4 bağımsız analizin SEM'i. * P <0,05, ** p <0.01, *** p <0.001; Grafiği değiştirildi fRom Referans 6. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız .
IMR90-hiPSC kaynaklı nöronal / glial kültürler rotenonun etkilerini değerlendirmek için kullanılabilir
Mitokondriyal solunum zincirinin bir kompleks I inhibitörü olan Rotenone'un, Nrf2 yolağının aktivasyonunu tetikleyerek oksidatif strese neden olduğu bilinmektedir. Sessiz koşullar altında, Nrf2, Nrf2 ubiquitinasyonu ve proteolizi kolaylaştıran bir Nrf2 baskılayıcı olan Keap1 (Kelch benzeri ECH-bağlantılı protein 1) tarafından sitoplazmada sabitlenir. Oksidatif stresin indüksiyonu üzerine, Nrf2 çekirdeğe translokasyon yapar ve Nrf2-ARE hedef genlerin ekspresyonunu aktive eder 16 .
IMR90-hiPSC türetilmiş nöronlar veD glial hücreler, hücreleri, 24 saat boyunca farklı konsantrasyonlarda rotenon ( örn., 1, 10 ve 100 nM) maruz bırakarak Nöf2 aktivasyonu üzerindeki rotenon etkilerini değerlendirmek için kullanılabilir. Bu konsantrasyonlar önceki çalışmalara göre kurulmuştur 17,18.
Bu konsantrasyonlarda ve maruz kalma zamanlarında, canlı DAPI + hücre çekirdeğinin miktarıyla gösterildiği gibi, rotenon sitotoksite neden olmamıştır ( Şekil 6A ). Rotenon, özellikle hücreleri 100 nM rotenona maruz bıraktıktan sonra Nrf2 nükleer translokasyonunu başlattı ( Şekil 6B ve Şekil 6E ). Aynı konsantrasyonda hem NAD (P) H kinon oksidoredüktaz 1 (NQO1) hem de Sulfiredoxin 1 (SRXN1), iki Nrf2-hedefi en yüksek artış ile birlikte sitoplazmik Keapl'de belirgin bir düşüş gözlendi ( Şekil 6C )Zymes 19 , 20 ( Şekil 6D ).
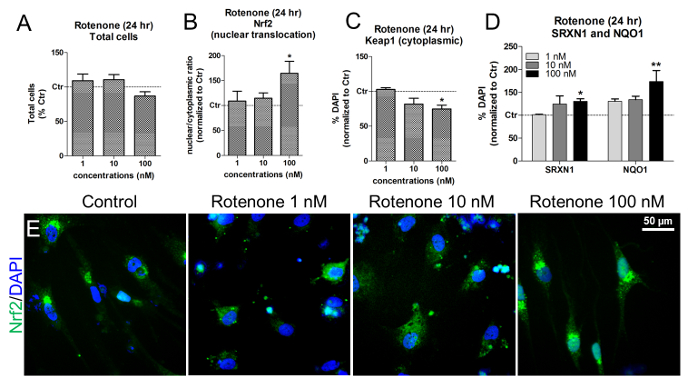
Şekil 6. Rotenonun Nrf2 Nükleer Translokasyonu, Keap1, SRXN1 ve NQO1 protein seviyelerine Etkileri. (A) 24 saat süreyle 1, 10, 100 nM rotenon ile işleme tabi tutulan ve işlemden geçirilmemiş hücrelere normalize edilen canlı DAPI + hücrelerinin ( yani, piknotik olmayan çekirdekler) nicelendirilmesi (Control, Ctr). (B) rotenona maruz bırakıldıktan 24 saat sonra Nrf2 proteini çekirdek translokasyonu ( yani, nükleer / sitoplazmik oranlar), floresan yoğunluğunun HCI analizi kullanılarak ölçülmesi ile değerlendirildi. (C) HCI analizi ile değerlendirilen, rotenon tedavisi üzerine sitoplazmik Keap1 protein seviyelerinin nicelendirilmesi. (D) NAD (P) H kinon oksidoredüktaz 1 (NQO1) ve SülfitRodepton ile 24 saat muamele edildikten sonra immünofloresan ve HC1 ile redoksin 1 (SRXN1) elde edildi. (E) Nrf2 protein lokalizasyonunun temsilci görüntüleri (yeşil). Tüm değerler, 3 biyolojik çoğaltmanın ortalama ± SEM'i olarak gösterilir. * P <0,05, ** p <0.01; Şekil 7'den değiştirildi. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız .
Bu konsantrasyonlarda ve tedavi zamanlarında, rotenon ayrıca, NSC (nestin + ) ve nöronların (MAP2 + ) oranlarını etkilemeksizin, astroglial (GFAP + ) hücre yüzdesinin konsantrasyona bağlı bir artışını ( Şekil 7A ve Şekil 7B ) ortaya çıkardı ( Şekil 7A ve Şekil 7B ) 7B ). Spesifik nöronal alt tiplerin oranlarına bakarak, rotenon tedavisi (10 nM ve 100 nM)(GABA + ) ve glutamaterjik (VGlutl + ) nöronlarının yüzdeleri değişmedi iken ( Şekil 7D ve D ) dopaminerjik nöronların (TH + ) sayısını önemli ölçüde azalttı ( Şekil 7D ). Benzer şekilde, önceki in vivo ve in vitro çalışmalar rotenon bağımlı ve selektif dopaminerjik nöronal hücre ölümünü 21 , 22 , 23 olarak tanımlamıştır.
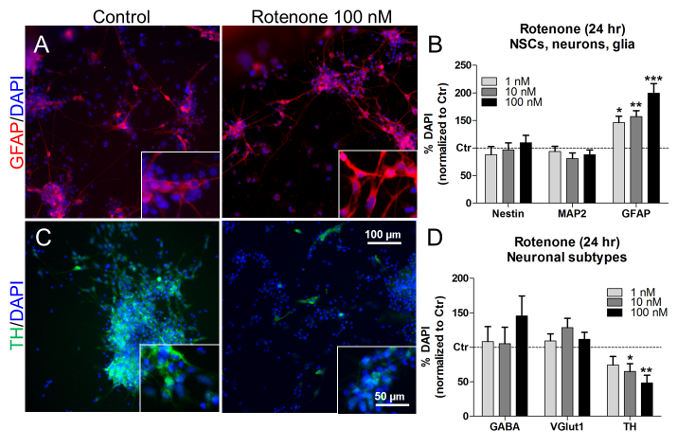
Şekil 7. Rotenonun Glial Hücreler ve Dopaminerjik Nöronlar Üzerindeki Etkileri. (A) GFAP + hücrelerinin temsilcili resimleri (kırmızı), eklerde 40X büyütme, tedavi edilmemiş veya 24 saat süreyle 100 nM rotenon ile muamele edilmiştir. (B) Niceleme Nestin + , MAP2 + ve GFAP + hücrelerinin, tedavi edilmemiş hücrelere normalleştirilmesi (kontrol, Ctr). (C) Temas eden dopaminerjik TH + nöronlarının (yeşil), yerleştirmelerde 40X büyütme, tedavi edilmemiş veya 100 nM rotenon ile 24 saat işleme tabi tutulan temsilcisi resimleri. (D) GABA + , VGlut1 + ve TH + nöronal hücrelerin, tedavi edilmemiş hücrelere normalleştirilen (Ctr) tayini. Tüm değerler, 3 biyolojik çoğaltmanın ortalama ± SEM'i olarak gösterilir. * P <0,05, ** p <0.01, *** p <0.001; Şekil 7'den değiştirildi. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız .
İstatistiksel önem, Dunnett'in Çoklu Karşılaştırma Testi ile bir tek yönlü ANOVA ile değerlendirildi (kontrol sütununa karşı tüm sütunların karşılaştırılması)Xref "> 24 veya analiz türüne göre iki-kuyruklu eşleşmemiş veya eşleştirilmiş t-testi ile gösterilen tüm veriler, en az üç biyolojik çoğaltma ortalamasını ± ortalamanın standart hatasını (SEM) temsil etmektedir Bir çubuk üzerindeki bir yıldız işareti, Kontrol grubu ile anlamlı bir fark vardı. * P <0.05, ** p <0.01, *** p <0.001.
Tablo 1.
Ayrıştırılmış rozet kaplama yoğunluğu hakkında not: eğer rozet parçaları tamamen ayrışmış görünmüyorsa, yaklaşık 15.000 hücre / cm2'lik bir hücre kaplama yoğunluğuna erişmek için, yaklaşık 50 EB / 1 x 60 mm-çanaktan ayrışmış çözülmüş rozet parçaları tekrar süspansiyon haline getirilebilir 50 mL komple NRI ortamı ve aşağıdaki gibi kaplanır (plakaya göre değişir):
| Çoklu plakalar / ÇÇA | Büyüme alanı (cm 2 / Kuyu yukarı | Hücre süspansiyonunun kuyuya (veya MEA çipi başına) plaka hacmi | Kaplanabilen maksimum plaka sayısı (50 ml hücre süspansiyonu ile) |
| 96 oyuk | 0.3 | 100 ul | 5 |
| 48 kuyu | 0.7 | 220 ul | 4 |
| 24 kuyu | 2 | 625 ul | 3 |
| 12 kuyu | 4 | 1.25 ml | 3 |
| 6 kuyu | 10 | 3.125 ml | 2 |
| Tek kuyu MEA çipi | 3.5 | 1.1 ml | 45 |
Tablo 2: Kabul Kriterleri
| İşaretleyici /Antikor | Yüzde (DAPI + (canlı) hücrelerde) 28 DIV'den sonra |
| B-III-tübülin (Tujl) | % 35-45 |
| map2 | % 50-60 |
| NF200 | % 45-55 |
| GFAP | % 10-25 |
| Nestin | % 15-25 |
Tartışmalar
Bu çalışma, IMR90-hiPSC'lerin post mitotik nöronlar ve glial hücrelere diferansiyelleştirilmesi için sağlam ve nispeten hızlı bir protokolü açıklamaktadır. HESC'lere ve hiPSC'lere dayalı daha önce yayınlanmış nöronal farklılaşma protokolleri genellikle yüksek yüzdeli nöral öncüllerin 25 , 26 ve anlamlı sayıda nöronal hedef hücreleri 27 , 28 , 29 , 30 , 31 , 32 , 33 getirir. Benzer şekilde, burada açıklanan farklılaşma protokolü, glia ve nestin + hücrelerinin ayrı bir oranı ile birlikte heterojen kültür GABAergic, glutamaterjik ve dopaminerjik nöronal hücreler üretmek için uygundur. Glutamaterjik (~% 35-42) ve GABAerjik (~% 15-20) sinir hücrelerinin varlığı,Bu kültür, ön beyin, kortikal benzeri özellikler taşır ve ayrı sayıda dopaminerjik nöronların varlığı (~% 13-20) orta beyin özgüllüğünü de gösterebilir. Buna ek olarak, nestin + hücrelerinin mütevazı bir oranının kalıcılığı, nörogenezin çalışılması ve öncelikle ön beyin 34'ün hipokampus ve subventriküler bölgesi (SVZ) ile sınırlı olan NSC'ler üzerindeki kimyasalların olası etkileri için uygun olduğunu ispatlayabilir. Daha ileri immünositokimyasal ve gen ekspresyon analizleri, farklılaşmış hücre türevlerinin bölgesel özgüllüğünü daha iyi tanımlamaya yardımcı olur.
Bu belgede tanımlanan farklılaştırma protokolündeki en kritik adımlar şunlardır: (i) hiPSC kolonilerinin homojen fragmanlara (homojen boyutlara sahip EB'lerin üretilmesi için kritik önemi olan) kesilmesi ve (ii) nöroektodermal yapıların kesilmesi (rozetler ), Önemli manuel beceri gerektiren NSC farklılaştırması içinVe farklılık üzerine elde edilen nöronların ve glial hücrelerin oranlarını azaltabilecek mesodermal ve endodermal hücrelerin toplanmasını önlemek için hassasiyet.
Genişleme sırasında (tanımlanmamış koloniler veya NSC'ler olarak) hücrelerin fenotiplerini karakterize etmek ve tüm farklılaşma adımları boyunca önemlidir. Özellikle, nöronal / glial hücre türevlerinin gen ve protein ekspresyon profilleri, nöronla ilgili sinyal yollarının upregülasyonunu ve aktivasyonunu göstermekle birlikte pluripotens belirteçlerinin ekspresyonu azaltılmalıdır.
EB'lerin ve nöroektodermal türevlerin (rozetlerin) üretimi elle zorluk çekebilir ve değişkenliğe eğilimli olabilir. Bu nedenle, rozet türevi NSC'lerin genleşmesi ve nöronal / glial hücrelere daha da farklılaşması için bir protokol geliştirdik.
Bu farklılaşma protokolünün olası sınırlamaları esas olarak (i) d'nin nispeten düşük yüzdesi(Ii) olgun nöronal ağ fonksiyonlarının olmaması (patlama olmaması ile gösterildiği gibi). Dahası, astrositlerin spesifik alt popülasyonları birincil öncü veya NSC olarak işlev görebilir 35 . Bu farklılaşmış hücre kültüründe nestin / GFAP çift pozitif hücreler gözlenmemiştir (veriler gösterilmemiştir), bu karışık kültürlerdeki GFAP + hücrelerinin astrositik progenitler ve astrositler olduğu varsayılmıştır. Farklılaşmanın zamanını uzatarak astrositlerin sayısı artabilir ve bunların morfolojisi daha önce Zhang'ın 36 , 37.'deki önceki çalışmalar tarafından da gösterildiği gibi daha olgunlaşabilir.
Yeni toksisite testi paradigmasında, kimyasal adversiteyi değerlendirirken biyolojik yolların kimyasal kaynaklı bozulmalara ilişkin bilgi çok önemlidir. Bu nedenle, in vitro test sistemleri,Olumsuz sonuç yolağı (AOP) kavramına göre, yan etkileri sinyal yollarının bozulmalarıyla ilişkilendirin. Bir kanıt ispatı olarak rotenon, oksidatif veya elektrofilik strese karşı hücresel savunmaya katılan Nrf2 yolağının aktivasyonunu değerlendirmek için kullanılabilir 38 ve oksidatif stres, çeşitli AOP'lerde önemli ve ortak bir anahtar olaydır. Gelişimsel ve erişkin nörotoksisite 39 .
Rotenon, Nrf2 protein nükleer translokasyonu ve NQO1 ve SRXN1 dahil olmak üzere Nrf2 hedef enzimlerin artmış ekspresyonu ile gösterilebilen Nrf2 yolağının aktivasyonunu sağlamalıdır. Rotenonun, astrosit aktivasyonunu gösteren 40 ila 41 arası doz bağımlı GFAP protein seviyeleri artışı indüklediği bulunmuştur. Rotenone ayrıca dopaminerjik (TH + ) hücrelerinin sayısını azaltmakta olup previ ile uyumludurBu tür nöronlar özellikle oksitlenme stresine duyarlı oldukları için, rotenona bağımlı dopaminerjik hücre ölümünü gösteren in vitro ve in vivo çalışmalar Bu , 21 , 22 , 23 .
Sonuç olarak, bu hiPSC kaynaklı nöronal ve glial hücre kültürü modeli, Nrf2 yolağının aktivasyonuyla sonuçlanan oksidatif stres yaratan kimyasalların nörotoksik etkilerini değerlendirmek için değerli bir araçtır. Bu farklılaşma protokolü, nöronal hücrelerin karışık kültürlerinin (GABAerjik, dopaminerjik ve glutamaterjik nöronlar) ve astrositlerin üretilmesine izin verdiğinden, nörodejeneratif hastalıklar gibi fizyolojik ve patolojik koşullarda nöronlar ve glia arasındaki karışma incelemesine uygun olabileceğini kanıtlayabilir Örneğin Parkinson hastalığı). Dahası, NSC'lerin önemli bir bölümünün varlığı, kimyasalların sinirsel progresyona olası etkilerini değerlendirmeye yardımcı olabilirKimyasal nedenli mutasyonların veya viral enfeksiyonların ana hedefi olarak bilinen enitorler 42 .
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar IMR90-hiPSC'leri sağlamak için Dr. Marc Peschanski'ye (I-Stem, Évry, Fransa) teşekkür etmek istiyor; Giovanna Lazzari ve Dr. Silvia Colleoni (Avantea srl, Cremona, İtalya); Simone Haupt (Bonn Üniversitesi, Almanya); Tiziana Santini (İtalyan Teknoloji Enstitüsü, Roma), immünofloresan boyama değerlendirmesine ilişkin tavsiyelerde bulundu; Dr. Benedetta Accordi, Dr. Elena Rampazzo ve Dr. Luca Persano (Padua Üniversitesi, İtalya), RPPA analizine ve antikor doğrulamasına katkılarından ötürü. Finansman: Bu çalışma AB fonlu "SCR & Tox" projesi (Hibe Anlaşması N ° 266753) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Complete hiPSC medium: | |||
| mTeSR1 Basal Medium | Stem Cell Technologies | 05851 | (Step 1.2.6). Complete mTeSR1 is stable when stored at 2 - 8°C for up to 2 weeks. 5X Supplements can be dispensed into working aliquots and stored at -20°C. Use frozen aliquots within 3 months. |
| mTeSR1 5X Supplements | Stem Cell Technologies | 05852 | |
| Matrigel hESC-qualified Matrix | Corning | 354277 | 1:100 (Step 1.1). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200ul aliquot in 20 ml of DMEM/F12 medium. |
| CryoStem Freezing Medium | Stemgent | 01-0013-50 | Freeze ~ 100 fragments/250 ul/vial (Step 1.2.1) |
| Name | Company | Catalog Number | Comments |
| hiPSC EB medium: | |||
| Knockout DMEM | Thermo-Fisher | 10829-018 | (Step 2.1.7) |
| Knockout Serum Replacement (KOSR) | Thermo-Fisher | 10828-028 | 20% final concentration (Step 2.1.7) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.1.7) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.1.7) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 2.1.7) |
| β-Mercaptoethanol | Thermo-Fisher | 31350-010 | 50 µM final concentration (Step 2.1.7) |
| Name | Company | Catalog Number | Comments |
| Complete neuroepithelial induction medium (NRI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 2.3.1) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.3.1) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.3.1) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.3.1) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 2.3.1) |
| bFGF | Thermo-Fisher | 13256-029 | 20 ng/ml final concentration added before use (Step 2.3.1) |
| Matrigel Basement Membrane Matrix | Corning | 354234 | 1:100 (Step 2.2). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200 ul aliquot in 20 ml of cold DMEM/F12 medium. |
| Laminin | Sigma-Aldrich | L2020 | 1:100 (Step 2.2). Dilute in PBS 1X. |
| Name | Company | Catalog Number | Comments |
| Complete Neuronal Differentiation medium (ND): | |||
| Neurobasal Medium | Thermo-Fisher | 21103049 | (Step 2.4.11) |
| B-27 Supplements (50x) | Thermo-Fisher | 17504044 | (Step 2.4.11) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.4.11) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.4.11) |
| GDNF | Thermo-Fisher | PHC7045 | 1 ng/ml final concentration. Added before use. (Step 2.4.11) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use. (Step 2.4.11) |
| Name | Company | Catalog Number | Comments |
| Neural induction medium (NI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 3.3) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 3.3) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 3.3) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 3.3) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 3.3) |
| B-27 Supplement (50X), minus vitamin A | Thermo-Fisher | 12587010 | (Step 3.3) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 3.3) |
| bFGF | Thermo-Fisher | 13256-029 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| EGF | Thermo-Fisher | PHG6045 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use (Step 3.3) |
| Defined Trypsin Inhibitor (DTI) | Thermo-Fisher | R007-100 | Pre-warm at 37°C. Add an equal amount of DTI to Trypsin-EDTA (Step 3.10) |
| Trypsin-EDTA (0.5%), no phenol red | Thermo-Fisher | 15400054 | 1:10. Dilute Trypsin-EDTA in PBS 1x (without calcium and magnesium), pre-warm the solution at 37°C (Step 3.8) |
| CryoStor cell cryopreservation medium | Sigma-Aldrich | C2874-100ML | (Step 4.2) |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| Name | Company | Catalog Number | Comments |
| TaqMan Probesets and reagents for gene expression analysis: | |||
| RNAqueous-Micro kit | Thermo-Fisher | AM1931 | (Step 5.1.6) |
| High Capacity cDNA Reverse Transcription Kits | Thermo-Fisher | 4368814 | |
| TaqMan Gene Expression Master Mix | Thermo-Fisher | 4369016 | |
| GFAP | Thermo-Fisher | Hs00909233_m1 | |
| MAP2 | Thermo-Fisher | Hs00258900_m1 | |
| NQO1 | Thermo-Fisher | Hs02512143_s1 | |
| SRXN1 | Thermo-Fisher | Hs00607800_m1 | |
| HMOX1 | Thermo-Fisher | Hs01110250_m1 | |
| GSR | Thermo-Fisher | Hs00167317_m1 | |
| PAX6 | Thermo-Fisher | Hs01088112_m1 | |
| NES | Thermo-Fisher | Hs00707120_s1 | |
| GRIA1 | Thermo-Fisher | Hs00181348_m1 | |
| GAP43 | Thermo-Fisher | Hs00967138_m1 | |
| GABRA3 | Thermo-Fisher | Hs00968132_m1 | |
| GABRA1 | Thermo-Fisher | Hs00168058_m1 | |
| NR4A2 | Thermo-Fisher | Hs00428691_m1 | |
| TH | Thermo-Fisher | Hs00165941_m1 | |
| GAPDH | Thermo-Fisher | Hs02758991_g1 | |
| ACTB | Thermo-Fisher | Hs99999903_m1 | |
| MAPT | Thermo-Fisher | Hs00902194_m1 | |
| SYP | Thermo-Fisher | Hs00300531_m1 | |
| NANOG | Thermo-Fisher | Hs04260366_g1 | |
| POU5F1 (OCT4) | Thermo-Fisher | Hs04195369_s1 | |
| SOX1 | Thermo-Fisher | Hs01057642_s1 | |
| AFP | Thermo-Fisher | Hs00173490_m1 | |
| KRT18 | Thermo-Fisher | Hs01941416_g1 | |
| NPPA | Thermo-Fisher | Hs00383230_g1 | |
| T | Thermo-Fisher | Hs00610080_m1 | |
| NCAM1 | Thermo-Fisher | Hs00941821_m1 | |
| NR4A1 | Thermo-Fisher | Hs00374226_m1 | |
| PHOX2A | Thermo-Fisher | Hs00605931_mH | |
| PHOX2B | Thermo-Fisher | Hs00243679_m1 | |
| NARG2 | Thermo-Fisher | Hs00973298_g1 | |
| SLC18A3 | Thermo-Fisher | Hs00268179_s1 | |
| SLC5A7 | Thermo-Fisher | Hs00222367_m1 | |
| ISL1 | Thermo-Fisher | Hs00158126_m1 | |
| LHX3 | Thermo-Fisher | Hs01033412_m1 | |
| TaqMan Human Protein Kinase Array | Thermo-Fisher | 4418721 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and reagents for immunostaining: | |||
| B-III-tubulin (Tuj1) | Covance | MMS-435P | 1:500 (Step 5.2.5). Other antibodies may also be used. |
| MAP2 | Sigma Aldrich | M4403 | 1:500 |
| NF200 | Sigma Aldrich | N4142 | 1:1000 |
| GFAP | Acris Antibodies GmbH | AP02002SU-N | 1:500 |
| Nestin | Sigma-Aldrich | N5413 | 1:200 |
| synaptophysin (SYN) | Abcam | AB14692 | 1:200 |
| Tau | Thermo-Fisher | MA5-12808 | 1:100 |
| Nrf2 | Abcam | AB62352 | 1:200 |
| Keap1 | Abcam | AB66620 | 1:200 |
| sulfiredoxin1 (SRXN1) | Abcam | AB92298 | 1:200 |
| NAD(P)H quinone oxidoreductase 1 (NQO1) | Abcam | AB2346 | 1:200 |
| OCT4 | Millipore | MAB4401 | 1:100 |
| SSEA3 | Millipore | MAB4303 | 1:100 |
| Tra1-60 | Millipore | MAB4360 | 1:250 |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | 1:200 |
| Gamma-aminobutyric acid (GABA) | Sigma-Aldrich | A0310 | 1:100 |
| Vesicular glutamate transporter 1 (VGlut1) | Abcam | AB72311 | 1:500 |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | 4% (4% formaldehyde can also be used) |
| DPBS, no calcium, no magnesium | Thermo-Fisher | 14190144 | |
| Triton-X-100 Solution | Sigma-Aldrich | 93443-100ML | 0.1% |
| BSA 35% | Sigma-Aldrich | A7979-50ML | 3.5% |
| Donkey anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 594 conjugate | Thermo-Fisher | SA5-10040 | 1:500. (Step 5.2.7) Other fluorochrome-conjugated secondary antibodies may also be used. In this case, appropriate dilutions should be tested by the enduser. |
| Donkey anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10166 | 1:500 |
| Donkey anti-Goat IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10086 | 1:500 |
| DAPI Solution (1 mg/ml) | Thermo-Fisher | 62248 | 1:1000 (Step 5.2.7) |
| Name | Company | Catalog Number | Comments |
| Antibodies for Reverse Phase Protein Array (RPPA): | |||
| 4E-BP1 (S65) | Abcam | AB81297 | 1:250 (Note after step 5.2.8) |
| Akt (T308) | Cell Signaling | 9275 | 1:100 |
| Akt (S473) | Cell Signaling | 9271 | 1:100 |
| AMPKalpha (T172) | Cell Signaling | 2531 | 1:100 |
| AMPKbeta1 (S108) | Cell Signaling | 4181 | 1:100 |
| ATF-2 (T71) | Cell Signaling | 9221 | 1:100 |
| c-Jun (S63) | Cell Signaling | 9261 | 1:200 |
| c-Jun (S73) | Cell Signaling | 9164 | 1:200 |
| c-Kit (Y719) | Cell Signaling | 3391 | 1:250 |
| CREB (S133) | Cell Signaling | 9191 | 1:100 |
| EGFR (Y1068) | Cell Signaling | 2234 | 1:50 |
| ErbB2/HER2 (Y1248) | Cell Signaling | 2247 | 1:100 |
| ERK 1/2, p44/42 (T202/Y204) | Cell Signaling | 9101 | 1:2000 |
| GSK-3alpha (S21) | Cell Signaling | 9337 | 1:50 |
| Jak1 (Y1022/1023) | Cell Signaling | 3331 | 1:100 |
| Lck (Y505) | Cell Signaling | 2751 | 1:500 |
| LKB1 (S428) | Cell Signaling | 3051 | 1:100 |
| mTOR (S2448) | Cell Signaling | 5536 | 1:100 |
| NFkB p65 (S536) | Cell Signaling | 3031 | 1:50 |
| p70 S6 Kinase (T389) | Cell Signaling | 9205 | 1:200 |
| PDK1 (S241) | Cell Signaling | 3061 | 1:100 |
| PKA C (T197) | Cell Signaling | 4781 | 1:250 |
| PRAS40 (T246) | BioSource | 44-1100 | 1:2000 |
| PTEN (S380) | Cell Signaling | 9551 | 1:500 |
| Smad1 (S463/465), Smad5 (S463/465), Smad8 (S426/428) | Cell Signaling | 9511 | 1:500 |
| Src (Y527) | Cell Signaling | 2105 | 1:500 |
| Src Family (Y416) | Cell Signaling | 2101 | 1:200 |
| Stat1 (Y701) | Cell Signaling | 9171 | 1:200 |
| Stat3 (S727) | Cell Signaling | 9134 | 1:200 |
| Zap-70 (Y319) | Enogene | E011159 | 1:100 |
| βCatenin (S33/37/T41) | Cell Signaling | 9561 | 1:250 |
| CREB | Upstate Biotechnologies | 06-863 | 1:100 |
| Fos B | Cell Signaling | 2251 | 1:200 |
| GRB2 | Cell Signaling | 3972 | 1:2000 |
| HSP70 | Stressgen | SPA-810 | 1:100 |
| c-Jun | Cell Signaling | 9165 | 1:100 |
| Kip1/p27 | BD | 610241 | 1:100 |
| Lck | Cell Signaling | 2984 | 1:250 |
| Mcl-1 | Cell Signaling | 4572 | 1:80 |
| Musashi | Cell Signaling | 2154 | 1:100 |
| NOTCH1 | Cell Signaling | 3439 | 1:100 |
| PTEN | Cell Signaling | 9552 | 1:500 |
| SGK1 | Abnova | PAB4590 | 1:250 |
| Zap-70 | Cell Signaling | 2705 | 1:250 |
| β-Catenin | Abcam | AB32572 | 1:1000 |
| Dll4 | Abcam | AB7280 | 1:500 |
| Shh | Abcam | AB53281 | 1:250 |
| HIF-1α | BD | 610958 | 1:50 |
| NUMB PAN-ISO | Upstate Biotechnologies | 07-207 | 1:400 |
| NUMB-L | Chemicon | AB15145 | 1:750 |
| Cyclin B | BD | 610220 | 1:75 |
| c-Myc | Calbiochem | OP-10 | 1:100 |
| BCIP/NBT Kit | Thermo-Fisher | 002209 | (Note after step 5.2.8). Kit used to measure alkaline phosphatase activity, similar kits can be used. |
| Name | Company | Catalog Number | Comments |
| Antibodies for Flow Cytometry: | |||
| SSEA1 Antibody, Pacific Blue conjugate | Thermo-Fisher | MHCD1528 | 1:100 (Note after step 5.2.8) |
| SSEA4 Antibody (MC813-70), Alexa Fluor 647 | Thermo-Fisher | SSEA421 | 1:100 |
| Name | Company | Catalog number | Comments |
| Specific instruments, tools and softwares: | |||
| Countess Automated Cell Counter | Thermo-Fisher | C10227 | Neubauer chamber or other suitable glass hemocytometer can be used. |
| MEA1060-Inv-BC | Multichannel Systems | MEA1060-Inv-BC | (Step 5.3) |
| MEA1060-BC control software | Multichannel Systems | MEA1060-BC | (Step 5.3) |
| NeuroExplorer | Multichannel Systems | NeuroExplorer (NE) | (Step 5.3) For post-processing of MEA data |
| Multielectrode arrays (MEA) | Multichannel Systems | 60MEA100/10iR-Ti-gr | (Step 5.3) Single-well MEA chip |
| ArrayScan XTI High Content Platform | Thermo-Fisher | ASN00002P | (Step 5.2.8) Mean fluorescence can be quantified by using specific ArrayScan algorithms (e.g., Cytotoxicity V.4 and NucTrans V.4 bioapplications). It is recommended to take minimum 20 pictures/well, and have 7-8 internal replicates per condition |
| 7900HT Fast Real-Time PCR System | Thermo-Fisher | 4351405 | (Step 5.1.6) |
| BD ULTRA-FINE Needle Insulin Syringe (with 30G needle) | BD | 328280 | (Steps 1.3.1, 2.1.2, and 2.4.1) |
| StemPro EZPassage Disposable Stem Cell Passaging Tool | ThermoFisher | 23181010 | This colony cutting tool can be used as an alternative to the use of 30G needle 1 mL syringes (Step 1.3.1) |
| Ultra-Low attachment Petri dish (60 mm) | Corning | 10010582 | (Step 2.1.8) Also other brands can be used. |
| Mr. Frosty Freezing container | Sigma-Aldrich | C1562-1EA | |
Referanslar
- NRC. . Toxicity Testing in the 21st Century: A Vision and a Strategy. , (2007).
- Drews, K., Jozefczuk, J., Prigione, A., Adjaye, J. Human induced pluripotent stem cells--from mechanisms to clinical applications. J Mol Med (Berl). 90 (7), 735-745 (2012).
- Ho, P. J., Yen, M. L., Yet, S. F., Yen, B. L. Current applications of human pluripotent stem cells: possibilities and challenges. Cell Transplant. 21 (5), 801-814 (2012).
- Krueger, W. H., Swanson, L. C., Tanasijevic, B., Rasmussen, T. P. Natural and artificial routes to pluripotency. Int J Dev Biol. 54 (11-12), 1545-1564 (2010).
- Pistollato, F., Bremer-Hoffmann, S., Healy, L., Young, L., Stacey, G. Standardization of pluripotent stem cell cultures for toxicity testing. Expert Opin Drug Metab Toxicol. 8 (2), 239-257 (2012).
- Pistollato, F., et al. Development of a pluripotent stem cell derived neuronal model to identify chemically induced pathway perturbations in relation to neurotoxicity: effects of CREB pathway inhibition. Toxicol Appl Pharmacol. 280 (2), 378-388 (2014).
- Zagoura, D., Canovas-Jorda, D., Pistollato, F., Bremer-Hoffmann, S., Bal-Price, A. Evaluation of the rotenone-induced activation of the Nrf2 pathway in a neuronal model derived from human induced pluripotent stem cells. Neurochem Int. , (2016).
- Standard operating procedure for differentiation of human induced pluripotent stem cells into post-mitotic neurons and glial cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-differentiation-of-human-induced-pluripotent-stem-cells-into-post-mitotic-neurons-and-glial-cells-%28mixed-culture%29-protocol-no.-165/key/p_1570 (2016)
- Standard operating procedure for expansion of rosette-derived neural stem cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-expansion-of-rosette-derived-neural-stem-cells-protocol-no.-166/key/p_1571 (2016)
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Brien, P. J., et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening. Arch Toxicol. 80 (9), 580-604 (2006).
- Accordi, B., et al. Functional protein network activation mapping reveals new potential molecular drug targets for poor prognosis pediatric BCP-ALL. PLoS One. 5 (10), e13552 (2010).
- Vassallo, A., et al. A multi-laboratory evaluation of microelectrode array-based measurements of neural network activity for acute neurotoxicity testing. Neurotoxicology. , (2016).
- Shamblott, M. J., et al. Human embryonic germ cell derivatives express a broad range of developmentally distinct markers and proliferate extensively in vitro. Proc Natl Acad Sci U S A. 98 (1), 113-118 (2001).
- Bryan, H. K., Olayanju, A., Goldring, C. E., Park, B. K. The Nrf2 cell defence pathway: Keap1-dependent and -independent mechanisms of regulation. Biochem Pharmacol. 85 (6), 705-717 (2013).
- Tufekci, K. U., Civi Bayin, E., Genc, S., Genc, K. The Nrf2/ARE Pathway: A Promising Target to Counteract Mitochondrial Dysfunction in Parkinson's Disease. Parkinsons Dis. , 314082 (2011).
- Kovac, S., et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase. Biochim Biophys Acta. 1850 (4), 794-801 (2015).
- Lee, J. M., Shih, A. Y., Murphy, T. H., Johnson, J. A. NF-E2-related factor-2 mediates neuroprotection against mitochondrial complex I inhibitors and increased concentrations of intracellular calcium in primary cortical neurons. J Biol Chem. 278 (39), 37948-37956 (2003).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236 (2), 313-322 (1997).
- Li, L., et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling. Chem Biol Interact. , 56-67 (2014).
- Cannon, J. R., et al. A highly reproducible rotenone model of Parkinson's disease. Neurobiol Dis. 34 (2), 279-290 (2009).
- Sherer, T. B., Kim, J. H., Betarbet, R., Greenamyre, J. T. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation. Exp Neurol. 179 (1), 9-16 (2003).
- Testa, C. M., Sherer, T. B., Greenamyre, J. T. Rotenone induces oxidative stress and dopaminergic neuron damage in organotypic substantia nigra cultures. Brain Res Mol Brain Res. 134 (1), 109-118 (2005).
- Zhou, J., et al. High-efficiency induction of neural conversion in human ESCs and human induced pluripotent stem cells with a single chemical inhibitor of transforming growth factor beta superfamily receptors. Stem Cells. 28 (10), 1741-1750 (2010).
- Topol, A., Tran, N. N., Brennand, K. J. A Guide to Generating and Using hiPSC Derived NPCs for the Study of Neurological Diseases. J Vis Exp. (96), e52495 (2015).
- Jiang, Y., Zhang, M. J., Hu, B. Y. Specification of functional neurons and glia from human pluripotent stem cells. Protein Cell. 3 (11), 818-825 (2012).
- Parsons, X. H., et al. Efficient derivation of human neuronal progenitors and neurons from pluripotent human embryonic stem cells with small molecule induction. J Vis Exp. (56), e3273 (2011).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7 (10), 1836-1846 (2012).
- Zeng, H., et al. Specification of region-specific neurons including forebrain glutamatergic neurons from human induced pluripotent stem cells. PLoS One. 5 (7), e11853 (2010).
- Zeng, X., et al. An in vitro model of human dopaminergic neurons derived from embryonic stem cells: MPP+ toxicity and GDNF neuroprotection. Neuropsychopharmacology. 31 (12), 2708-2715 (2006).
- Paşca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12 (7), 671-678 (2015).
- Almeida, S., et al. Modeling key pathological features of frontotemporal dementia with C9ORF72 repeat expansion in iPSC-derived human neurons. Acta Neuropathol. 126 (3), 385-399 (2013).
- Urbán, N., Guillemot, F. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front Cell Neurosci. 8, 396 (2014).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. J., Zhang, S. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nat Biotechnol. 29 (6), 528-534 (2011).
- Krencik, R., Zhang, S. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nat Protoc. 6 (11), 1710-1717 (2011).
- Nguyen, T., Nioi, P., Pickett, C. B. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress. J Biol Chem. 284 (20), 13291-13295 (2009).
- Bal-Price, A., et al. Putative adverse outcome pathways relevant to neurotoxicity. Crit Rev Toxicol. 45 (1), 83-91 (2015).
- Cabezas, R., El-Bacha, R. S., Gonzalez, J., Barreto, G. E. Mitochondrial functions in astrocytes: neuroprotective implications from oxidative damage by rotenone. Neurosci Res. 74 (2), 80-90 (2012).
- Swarnkar, S., et al. Astrocyte activation: a key step in rotenone induced cytotoxicity and DNA damage. Neurochem Res. 37 (10), 2178-2189 (2012).
- Canovas-Jorda, D., Louisse, J., Pistollato, F., Zagoura, D., Bremer, S. Regenerative toxicology: the role of stem cells in the development of chronic toxicities. Expert Opin Drug Metab Toxicol. 10 (1), 39-55 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır