Method Article
神経毒性試験のための、ヒト誘導多能性幹細胞のニューロンとグリアの混合培養物への分化のためのプロトコール
要約
ヒトが誘導する多能性幹細胞(hiPSC)は、薬物および化学物質のスクリーニングならびに神経毒性を含む毒性試験のための新しいインビトロモデルの開発のための強力なツールと考えられている。ここでは、hiPSCをニューロンおよびグリアに分化させるための詳細なプロトコールが記載されている。
要約
ヒト多能性幹細胞は、ヒトベースのインビトロ毒性アッセイに適用することができる様々な細胞型に分化することができる。 1つの大きな利点は、体細胞がヒト誘導性多能性幹細胞(hiPSC)を産生するように再プログラムすることにより、ヒト胚性幹細胞(hESC)の使用に関する倫理的および立法上の問題が回避されることである。 HiPSCは、毒性試験のための試験システムとして、特に神経毒性に関与する異なる経路の評価のために役立ち、異なるタイプのニューロンおよびグリア細胞に拡大し、効率的に分化させることができる。この研究は、ニューロンおよびグリア細胞の混合培養物へのhiPSCの分化のためのプロトコールを記載する。ニューロン分化によって調節および/または活性化されるシグナル伝達経路が規定される。この情報は、新しい毒性試験のパラダイムへの細胞モデルの適用に重要であり、化学物質はその能力に基づいて評価されるrturb生物学的経路。概念の証明として、ミトコンドリア呼吸複合体Iの阻害剤であるロテノンを、酸化ストレスに対する抗酸化応答要素(ARE)駆動の細胞防御機構の重要な制御因子であるNrf2シグナル伝達経路の活性化を評価するために使用した。
概要
米国国立研究評議会の報告書1は、ヒトでの細胞を用いた機構的インビトロアッセイに焦点を当てたアプローチに、動物で観察された表現型変化に基づくアプローチから規制毒性試験に移行する新しい毒性試験のパラダイムを構想しました 。取得された細胞がヒト組織の生理学的条件にさらに近似し、化学的に誘発された有害作用を研究するためのより適切なツールを提供し得るため、多能性幹細胞(PSC)誘導体は、癌細胞モデルの代替物を表し得る。毒性試験の最も有望なPSC培養物の2つの主要なタイプは、現在、基礎研究および再生医療の分野で広く使用されているヒト胚性幹細胞(hESC)およびヒト誘導性多能性幹細胞(hiPSC)である2,3 。この専門知識は、新しいクラスのtoxicoloの開発のために利用できるようになりましたin vivoでの悪影響の発症に関与する摂動した生理学的経路を同定することを目的とした生体外試験である。しかし、hESCに基づく規制安全評価の試験方法は、倫理的懸念や胚由来細胞の使用を規制する様々な国内法制のために、EU加盟国および世界各国で受け入れられる可能性は低い。
hiPSCは、hESC4,5と同様の特徴を有し、治療標的の同定および安全性評価の両方のためのインビトロ方法の大きな可能性を保持する。さらに、hiPSC技術は、限られたドナープールの制約および胚由来細胞に関連する倫理的懸念を緩和する。 hiPSCsの主な課題は、これらの細胞が、毒性学的に関連する細胞誘導体の有意な範囲を再現可能に生成することができ、人間の組織に典型的な特徴および応答を有する。選択されたマーカーの所定のレベルは、一般に、分化プロセス後の細胞集団を特徴づけるため、および分化プロセスの安定性に関する洞察を提供するために使用される。
以前の研究では、ニューロンおよびグリア細胞の混合培養物を生成し、ミトコンドリア呼吸複合体Iの阻害剤であるロテノンの抗酸化物質防御機構の重要な制御因子であるNrf2経路の活性化に対するhiPSCの適合性を評価した多くの細胞型6,7 。
この研究は、ニューロン/グリア分化の際に活性化されるシグナル伝達経路(遺伝子およびタンパク質レベル)に関する詳細を提供する、混合ニューロンおよびグリア培養へのhiPSCの分化に使用されるプロトコールを記載する。さらに、この作品は代表的な結果を示しています。hiPSC由来のニューロンおよびグリア細胞モデルを使用して、ロテノンによる急性(24時間)処置によって誘導されるNrf2シグナル伝達活性化を評価し、酸化ストレス誘導の評価を可能にする。
IMR90線維芽細胞をpMIGベクターを用いて2つの転写因子(Oct4およびSox2)のウイルス形質導入によりI-Stem(フランス)でhiPSCに再プログラムした6 。類似のhiPSCモデルも適用することができる。以下に記載するプロトコールは、hiPSCの神経幹細胞(NSC)への分化のすべての段階、さらに分裂後ニューロンおよびグリア細胞の混合培養物へのまとめである(ステップ1および2、詳細については、EURL ECVAM DBALMウェブサイトも参照のこと)。プロトコル) 8 。
混合ニューロンおよびグリア細胞へのNSCの単離、拡大、凍結保存、およびさらなる分化のためのさらなるプロトコルは、ステップ3および4で詳述される(EURL ECVAM DBALMこのプロトコルの詳細な説明については、bsiteを参照してください)。ステップ5は、コミットメントおよび分化のいくつかの段階の間に細胞の表現型の同一性を評価するために行うことができる分析を記載する。
プロトコル
1.ヒト誘導多能性幹細胞(hiPSC)の拡大
注:hiPSCsは、mTeSR1 5xサプリメント(製造業者の説明書に従って調製;プレート〜100コロニーフラグメント/ 60mmペトリ皿)を含むmTeSR1培地の存在下で、適切なタンパク質混合基質上で培養することができる。 hiPSCコロニーが適切な大きさに達したら( 図2Aのコロニーの例を参照)、下記のように細胞を通過させる(1週間に1回)。
- hESC認定の基底膜マトリックス(以下、「修飾マトリックス」と呼ぶ)または他の適切なタンパク質基質を含むコートディッシュ。
- 冷たい1.5 mLチューブと冷たい5または10 mLピペットで、-80°Cで200μLのアリコートで資化マトリックス(材料表を参照 ) を保管します。
- 継代する前に、氷上で修飾されたマトリックス200μLを解凍する。
- 20mで修飾されたマトリックス200μLを希釈するLのDMEM / F12培地(1:100希釈)。
- この溶液(5mL /ディッシュ)で60mmペトリ皿をコートする。
- コーティングした皿を37℃で少なくとも1時間インキュベートする。
- HiPSCコロニー断片の凍結保存および融解
- hiPSCコロニーを切断した後(hiPSCコロニー切断手順についてはステップ1.3を参照)、幹細胞凍結培地中のhiPSCコロニー断片を〜100断片/250μL(表の表を参照)に静かにゆっくりと再懸濁する。
- 凍結保存(250μL/バイアル)のための適切なバイアル中のコロニー断片をアリコート。
- バイアルを2-プロパノールで満たした容器に入れ、最低2時間、最大2週間、容器を-80°Cに置きます。
- バイアルを液体窒素タンクの気相に移す。
- 培養を再開するために、1凍結バイアルを37℃の水浴中で解凍する。
- 7mlの予熱した完全なhiPSC中のhiPSCコロニーフラグメントを静かに収集する培地( 表の表を参照 )を1 mL、2 mL、5 mLのピペットを使用して15 mLチューブに入れます。
- hiPSCコロニー断片を130xgで3分間遠心分離する。
- 上清を除去し、1,2または5 mLのピペットを使用して、完全なhiPSC培地1 mLでhiPSCコロニーの断片を静かに再懸濁します。
- 3または4mLの完全なhiPSC培地中で細胞懸濁液をさらに希釈する。
- hiPSCコロニーの断片を、資格を与えられたマトリックスコートされた60mmペトリ皿(約100断片/皿;ステップ1.1に記載されているように皿にコートする)にプレーティングする。
- 37℃および5%CO 2で hiPSCをインキュベートする。
- 毎日全面的に中程度の変更を行います。
- hiPSCコロニーの継代
注:分化していないhiPSCは、大きな核小体および豊富な細胞質を伴わずに、円形でなければならない。未分化のコロニーは、フラットでしっかりとした形態で特徴づけられるべきである。未分化のコロニー(約1mm in直径)をさらに継代するために切断しなければならない。- 30G針またはその他の市販ツールを使用した1 mLシリンジを使用して、約200μmx 200μmの四角で幹細胞コロニーを切断します(表の表を参照)。室温で層流キャビネットで倍率4倍の立体顕微鏡を使用する。
- 皿表面からコロニーの断片を200μLのピペットを用いてゆっくりとピペットで培地をピペットで取り出し、ピースを持ち上げます。
- コロニーフラグメント(〜100個)を完全なhiPSC培地(表1.1参照)の4 mLを満たした資格を与えられたマトリックス-DMEM / F12被覆プレートに移す(ステップ1.1に記載のように皿をコートする)。
- 新しいプレートを37°Cおよび5%CO 2でインキュベートする。
- 毎日全培地の交換を行い、4倍および10倍の倍率で位相差顕微鏡を用いてコロニーの形態を検査する。
2. HiPSC Differe混合ニューロンとグリアへのネイティエーション
注記:この手順には、 図1 (上段)に概説されている主要な手順を実行するのに約28日かかります。
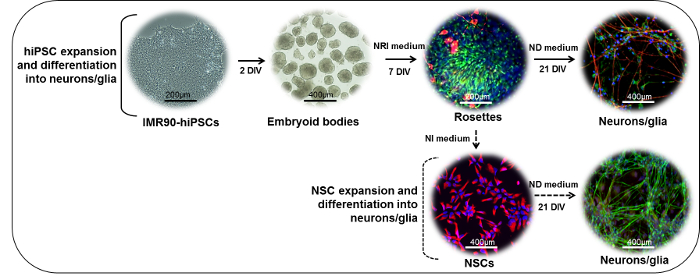
図1:ニューロン分化プロトコルの概略図。 (上部)IMR90-hiPSCコロニーを断片に切断して胚様体(EB)を形成することができる。 インビトロで 2日後(DIV)、EBをラミニンまたは標準マトリックス被覆ディッシュ上にプレーティングし、神経上皮誘導(NRI)培地の存在下で培養して、神経外胚葉誘導体(ロゼット、ここではネスチン(緑色)およびβ -III-チューブリン(赤色))。ロゼットは、解離し、収集し、ラミニンまたは標準マトリックス被覆ディッシュ上に再プレーティングし、さらに成熟ニューロン(NF200、赤)およびグリアニューロン分化(ND)培地の存在下で、細胞(GFAP、緑色)細胞に導入した。 (下部)ローゼット由来NSC(ネスチン、レッド)は、神経誘導(NI)培地の存在下で増殖させ、凍結保存し、またはND培地の存在下でさらに分化させて混合ニューロン(NF200、緑色)およびグリアGFAP、赤色)培養物。 この図の拡大版を見るには、ここをクリックしてください。
- 胚様体(EB)の生成(0日目→1日目)
注:この手順では、手作業のスキルと精度が必要です。 HiPSCコロニー断片は、次の段階で同種の胚様体(EB)を得るために同じ大きさでなければならない。形態学的に分化したコロニー(大きな細胞質画分および小さな核小体を有する)は廃棄すべきである。- 未分化hiPSCコロニーを切断する前に、hiPSC培地(3mL / 60mmペトリ皿)をリフレッシュする(直径約1mmeter、 図2A参照)を用いて(ステップ1に記載されているように)滅菌した。
- 30Gの針を備えた1mLシリンジを用いて未分化のコロニーを( 図2Aおよび図2Bに示すように )約200μm×200μmの断片に切断する。室温で層流キャビネットで4倍の倍率で立体顕微鏡を使用する。
- 皿表面からコロニーの断片を200μLのピペットを用いてゆっくりとピペットで培地をピペットで取り出し、ピースを持ち上げます。
- 1、2、または5 mLのピペットを使用して、すべての分離フラグメントと培地を15 mLチューブに移す。
- 全ての断片を回収するために、2mLの完全なhiPSC培地で皿をすすぐ。
- 112xgで1分間遠心分離する。
- 上清を吸引し、完全なhiPSC EB培地( 表の表を参照 )5 mLに断片を静かに再懸濁する。
- 共同でプレーする60mmの超低付着性ペトリ皿(5mL / 60mmペトリ皿)中に入れた。
- ペトリ皿を37℃、5%CO 2で一晩インキュベートする。
- 翌日(1日目)に、1,2または5 mLのピペットを使用して15 mLチューブにEBとその培地を集める。
- EBを1分間112xgで遠心分離する。
- 慎重に上清を吸引し、1 mL、2 mL、5 mLのピペットを用いて5 mLの完全なhiPSC EB培地にEBを静かに再懸濁する。
- EBを新しい60 mm超低付着ペトリ皿(5 mL / 60 mmペトリ皿)に交換します。
- ペトリ皿を37℃、5%CO 2で一晩インキュベートする。
- 1日目に、基底膜マトリックス( 例えば、 「標準マトリックス」と称するマトリゲル)または他の適切なタンパク質基質( 例えば 、ラミニン)で皿を覆う。
- -80℃で標準マトリックス(材料表を参照 )を冷たい1.5mLチューブおよび冷たい5または10mLピペットを使用して200μLのアリコートを添加する。
- 氷上で200μLの標準マトリックスを解凍する。
- 20mLのDMEM / F12培地(1:100希釈)に200μLの標準マトリックスを希釈する。
- この溶液(5mL /ディッシュ)で60mmペトリ皿をコートする。
- コーティングした皿を37℃で一晩インキュベートする。
注:これらの料理は、EB(約50 EBs /料理)をプレートし、神経上皮骨材(ロゼット)を生成するために使用されます。ステップ2.3を参照してください。
- 神経上皮凝集体(ロゼット)の発生(2→7日目)
- 2日目に、60-mmペトリ皿から標準マトリックスコーティング溶液を除去し(プレートをすすぐ必要はない)、5mL /ディッシュの完全神経上皮誘導培地(NRI)で満たす。材料の表を参照してください。
- ステレオスコピックmiの下で200μLのピペットを使用して、フローティングEB(ステップ2.1.14から)をコーティングされたディッシュ(〜50 EB /ディッシュ)に移す。4倍に拡大し、層流キャビネットに入れた。
注:均質で中程度のEB(直径200〜300μm)を選択することが重要です。小さすぎるEBは神経外胚葉分化の間にうまく生き残ることができず、大きすぎるEBは中核壊死を起こす傾向がある。 - 37℃および5%CO 2で皿をインキュベートする。
- 翌日(3日目)に、10倍の倍率で顕微鏡下の皿をチェックし、EBが全て付着していることを確認する。
- 完全なNRI培地で全培地交換を静かに行う。
- 神経上皮凝集塊(ロゼット)が目に見えるようになる日まで、NRI培地を1日おきに交換する。
- 7日目に、ステップ2.2に記載されているように、96ウェルプレート(100μL/ウェル)、24ウェルプレート(250μL/ウェル)、12ウェルプレートウェルプレート(500μL/ウェル)、MEAチップ(電気活性用、1mL /シングルウェルチップ)、または60mmペトリディッシュs(4mL /ディッシュ)。
- 37℃および5%CO 2で少なくとも2時間、コーティングされたプレート/ディッシュをインキュベートする。
- ロゼットの解離とニューロンの分化(8日目→28日目)
注:この手順では、手作業のスキルと精度が必要です。中胚葉および内胚葉細胞の収集を回避するために、外胚葉ロゼット様構造のみを解離させて収集する必要がある。- 8日目に、滅菌条件下で10倍の倍率で立体顕微鏡下でロゼット様構造を断片に切断する。 30Gの針を備えた1mLシリンジを使用します。ロゼットは、針で触れたときに皿から容易に外れる傾向があることに留意されたい。
- 200μLピペットを用いてロゼット断片の分離を完了する。
- 皿を層流フードの下に移し、1,2または5mLピペットを用いてロゼット断片およびその培地を15mLコニカルチューブに集める。 2mLのNRI培地で皿をすすいで回収するすべての断片。
- ロゼット断片を112 xgで2分間回転させます。
- 上清を吸引する。
- 1x DPBS(カルシウムおよびマグネシウムを含まない)の1mLにペレットを静かに再懸濁し、ローゼット断片を上下に1,000μLのピペットで上下にピペットで静かにピペットで分ける。
- 4 mLの完全NRI培地を加え、トリパンブルーと自動細胞カウンターを用いて細胞数を数えます( 表の表を参照 )
注:20μLの細胞懸濁液を20μLのトリパンブルーで希釈します。細胞を単一細胞懸濁液にすることができない場合、この工程は省略してもよい。ロゼット断片が完全に解離していないと思われる場合、約50個のEB / 60-mmディッシュに由来するロゼット断片を、50mlの完全NRI培地に再懸濁し、 表1に示すようにプレーティングすることができる。 - ペトリ皿、プレート、および/またはMEAチップから標準マトリックス(またはラミニン)コーティング溶液を吸引します(ステップ2.3。7)。彼らは乾かさないでください。
- 試験計画に従って細胞を完全NRI培地にプレーティングする(約15,000細胞/ cm 2 ;メッキ量指示については表1を参照)。
- 37℃および5%CO 2で一晩プレートをインキュベートする。
- 10日目に、完全ニューロン分化培地(ND)を用いて全培地交換を行う。材料の表を参照してください。
- 完全ND培地を週に2回、28日目までリフレッシュする。
- ステップ5(一般的な受容基準については表2を参照)に記載されているように、ニューロン/グリア細胞誘導体を特徴づける。
3. HiPSC由来の神経幹細胞(NSC)の拡大と混合ニューロンとグリアへの分化
注:ロゼット断片由来のNSCは、以下に説明する手順( 図1 、下部)に従って、拡大して維持することができる。これにより、分化および化学試験のための細胞数。
- 標準マトリックスDMEM / F12コーティング溶液5 mLを含む60 mmペトリ皿(またはT-25フラスコ)をコートし、37℃および5%CO 2で少なくとも2時間インキュベートする(2.2項に記載)。
- ステップ1-2(ステップ2.4を参照)から得られたロゼットフラグメントを、円錐形の15mL管内で112xgで2分間スピンダウンする。
- 静かに5mLの神経誘導培地(NI)にペレットを再懸濁する。材料の表を参照してください。
- 細胞を標準的なマトリックス被覆60 mmペトリ皿(またはT-25フラスコ)に移す。
- 培養ロゼット由来NSCをNI培地の存在下で培養し、細胞がコンフルエンスに達するまで一日おきに培地をリフレッシュする。
- コンフルエントになったら、以下の手順にしたがってNSCを継代する。
注:NSCを一週間に1回通過する。研究計画に応じて、新しくコートした皿、フラスコ、またはプレートを使用することを検討してください。 - 完全なNIメディアとgentlを削除するDPBS(カルシウムとマグネシウムを含まない)でNSCをすすぐ。
- 細胞が入っている60-mmのペトリ皿(またはT-25フラスコ)に37℃に予熱した0.05%トリプシン-EDTA 1.5 mLを添加し、インキュベーターに1分間入れる。
- 皿(またはフラスコ)を静かにタップして細胞を剥がす。
- 37℃に予熱した1.5mLのトリプシンインヒビターを添加し、細胞を15mLチューブに移す。
- 同じ容量のNI培地(1.5mL)でペトリ皿(またはT-25フラスコ)をすすぎ、同じ15mLチューブに容量を集める。
- 細胞を130xgで3分間遠心分離する。
- 上清を除去し、1000μLピペットを使用して完全なNI培地1mLに細胞を静かに再懸濁する。
- さらに、3または4mLの完全NI培地で細胞懸濁液を希釈し、トリパンブルーおよび自動細胞計数器を用いて細胞を計数する。
- NSCをステップ3.1の60mmペトリ皿(またはT-25フラスコ)上に約50,000細胞/ cm 2の密度でプレートする。
- 1日おきに完全なNI媒体を使用して完全に媒体を交換します。
- ステップ5で説明したように、ニューロン/グリア細胞誘導体の存在について細胞を特徴づける。
注:完全なND培地(ステップ2.4.11-2.4.13に記載)でNSCをニューロンとグリアの混合培養に分化させ、完全なND培地を週に2回、21日間爽やかにすることができる。
4. HiPSC由来のNSC凍結保存および融解
注:継代に際して、NSCはこの手順に従って凍結して再解凍することができる。
- 130xgで3分間継代した継代したNSC(ステップ3.12から)。
注:セルは、ステップ3.14でカウントする必要があります。 - 静かにゆっくりと3×10 6 / mLの凍結培地でNSCを再懸濁する( 表の表を参照 )。
- 凍結保存のために適切なバイアルに細胞を分注する(約0.5mL = 1.5×10 6 /バイアル)。
- バイアルを容器に入れる。fi2-プロパノールで洗浄し、最低2時間、最高2週間、容器を-80℃に置く。
- バイアルを液体窒素タンクの気相に移す。
- 細胞培養を再開するには、1凍結バイアルを37℃の水浴で解凍します。
- 1000μLのピペットを使用して、15mLチューブ中の予め温めた完全NI培地7mL中に細胞を静かに集める。
- 細胞を130xgで3分間遠心分離する。
- 上清を除去し、1,000μLピペットを使用して完全なNI培地1mLに細胞を静かに再懸濁する。
- さらに3または4mLの完全NI培地で細胞懸濁液を希釈し、トリパンブルーおよび自動細胞計数器を用いて細胞を計数する(注:トリパンブルー20μL中の細胞懸濁液20μLを希釈する;解凍後の生存率は80以上であるべきである) %)。
- コーティングされた60mmペトリ皿(またはT25フラスコ)に、約50,000細胞/ cm 2の密度でNSCをプレートする。
5.キャラhiPSC由来ニューロンおよびグリア細胞の核形成
注:分化の際に、ニューロンおよびグリア誘導体は、以下のセクションで説明するような異なる技術を用いて特徴付けることができる。
- 定量的リアルタイムPCR(qPCR)は、 10
- hiPSCコロニーフラグメント、EB、および/またはNSCを130xgで3分間スピンダウンする。
- RNA抽出に適したキットに入っている冷RNA溶解バッファー100μLに細胞ペレットを再懸濁します。
- あるいは、培地を吸引し、ウェルに低温RNA溶解緩衝液を加えて細胞を収集することにより、プレートから神経細胞/グリア誘導体を直接収集する。
- 製造者の指示に従ってRNAを単離する。
- RNAからcDNAへの逆転写に適したキットを用いて500ngの全RNAを逆転写する。
- 適切なマスターミックスおよびプライマーを使用して、qPCR反応を二重に実行する。セット(材料表を参照 )。
- 蛍光発光をリアルタイムで記録する:60℃でアニーリングするプライマーを用いて45サイクル。
- 相対RNA量を参照遺伝子としてGAPDHおよびβ-アクチンに標準化し、較正条件(ΔΔCt法)のために未分化hiPSCまたは未処理細胞を使用する。あるいは、別の適切な方法を使用してください。
- 免疫細胞化学および高含有イメージング(HCI)6,11
- 冷たい4%パラホルムアルデヒドでhiPSCコロニー、NSCおよび/またはニューロン/グリア誘導体を室温で15分間固定する。
- 1X PBSで細胞を静かに洗浄し、4℃でプレートを1ヶ月間保存する。
- 染色の準備ができたら、室温で15分間透過性緩衝液(0.1%トリトン-X-100および3%BSAを含有する1×DPBS)中で細胞を透過処理する。
- 透過処理を取り除く細胞をブロッキング緩衝液(3%BSA / 1×DPBS)中で室温で15分間インキュベートして、抗体の非特異的結合を防止する。
- ブロッキングバッファーを除去し、細胞を一晩4℃でインキュベートする。適切な一次抗体を含むブロッキングバッファー( 表の表を参照 )。
- 1×PBSで細胞を3回洗浄する。
- 蛍光色素結合二次抗体( 表の表を参照 )を含むブロッキングバッファー中で室温で45分間細胞をインキュベートし、核をDAPI色素で対比染色する。
- 利用可能であれば、適切なハイコンテントイメージングプラットフォームを使用して、平均蛍光強度および細胞タイプの相対百分率を定量する( 表の表を参照 )。
注意:蛍光バックグラウンドの強度レベルを決定するために、いくつかの細胞/ウェルを二次抗体単独でインキュベートする。ライブ(固定されていない)およびフローサイトメトリー分析SSC4のようなPSC特異的マーカーの発現を評価するために、過剰のhiPSCを実施することができる( 表の表を参照 )。市販のBCIP / NBTキットを使用して、製造業者の指示に従って、未分化hiPSCコロニーをアルカリホスファターゼ活性について分析することができる( 表の表を参照 )。さらに、文献12(試験された抗体の一覧については、 表の表を参照 )に記載されているように、逆相タンパク質アレイ(RPPA)アッセイおよび分析を行うことができる。
- 電気生理学的測定13
- 完全なND培地(約1×10 5個の細胞/単一ウェルMEAチップ)中の解離したロゼット断片(7 DIV後)またはコーティングした多電極アレイ(MEA; 表の表を参照 )上のロゼットに由来するNSC をプレートする 。
- 完全なND培地で3週間細胞を分化させ、1週間に2回、
- 分化の最後に、層流フードの下で半透膜でMEAチップを密封し、繰り返し測定するために培養液を無菌状態に保つ。
- 電極の1つを1つのグランド基準に置き換え、残りの電極からの記録を可能にする。
- 37℃と5%CO 2に調整された温度プロセス制御を内蔵したMEAアンプを使用して、平均発火率(MFR;スパイク数/分)を記録する。
- -4.7σ(σは基底ノイズの標準偏差を表す)の限界値を使用して、MEA生データからピークを検出します。
- 適切なソフトウェアでポストレコーディングデータを処理する。
結果
未分化hiPSCの特徴付け
hiPSCの表現型を評価するために、コロニー/細胞形態の分析、PSC特異的マーカーの決定、および遺伝子発現およびアルカリ性リン酸活性の検査を行うべきである。分化していないhiPSCsは、大きな核小体および豊富な細胞質を伴わずに丸くなければならない。大部分のコロニーは、未分化の表現型を示す平滑で密集した形態で特徴づけられるべきである( 図2Aおよび図2B )。さらに、コロニーの80%以上がアルカリホスファターゼ活性染色のために陽性でなければならない( 図2C )。
細胞の約80%は、古典的多能性関連マーカー、例えばOct4、SNestin +およびβ-III-Tubulin +細胞のパーセンテージは有意に低いはずである(それぞれ約8%および3%である)が、免疫細胞化学およびフローサイトメトリーによって示されるように、SEA3、SSEA4およびTra1-60( 図 2D〜 図2H参照)。これらの結果は継代を通して再現可能でなければならない。
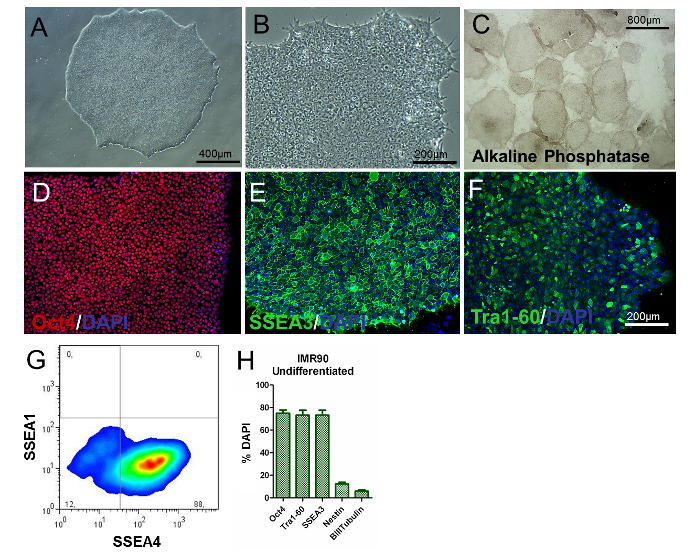
図2.未分化IMR90-hiPSCの特徴付け。 (AおよびB)未分化IMR90-hiPSCコロニーの代表的な位相差画像(10倍および20倍の倍率)。 (C)アルカリホスファターゼ染色コロニーの代表的な画像(倍率4倍)。 (DF) (D) Oct4(赤)、 (E) SSEA3(緑)、および(F) Trの代表的な免疫細胞化学的画像a1-60(緑色)。 (G)フローサイトメトリーにより分析したSSEA1(CD15)およびSSEA4染色の代表的ドットプロット。 (H)バーグラフはOct4 + (〜75-80%)、Tra1-60 + (〜75-80%)、SSEA3 + (〜75-80%)、ネスチン+ (〜10-15% DAPIで対比染色し、HClで定量化した3〜5回の生物学的反復±SEM(参考文献6から改変したグラフ)のβ-III-チューブリン+ (約3-7%)細胞。 この図の拡大版を見るには、ここをクリックしてください。
EB形成による多能性の評価
HiPSCは多能性であり、適切な条件下で3つの胚葉関連遺伝子を発現することを意味する。 hiPSCの多能性を評価するために、3つの胚葉14の形成を誘導する自発的なEB形成に基づくアプローチである。胚葉特異的遺伝子の解析は、内胚葉(α-フェトプロテイン(AFP)およびサイトケラチン18(KRT18))、外胚葉(Nestin、SRY-box1(Sox1)および対ボックス6(Pax6) )、および中胚葉(ナトリウム利尿ペプチドA(NPPA)およびブラキュリ-T)関連遺伝子発現( 図3Aおよび図3B )。材料の表を参照してください。
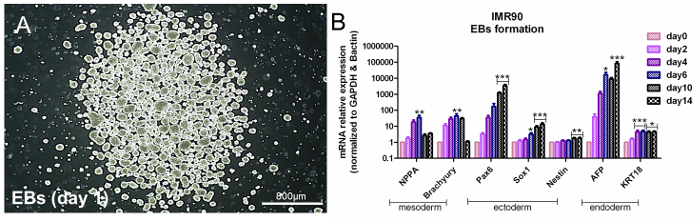
図3. EB形成による多能性の評価。 ( B)棒グラフは、中胚葉(NPPAおよび短尾)、外胚葉(Pax6、Sox1およびネスチン)および内胚葉(AFPおよびKRT18)のqPCR分析を示しており、 )遺伝子を参照遺伝子、β-アクチンおよびGAPDHに対して標準化し、未分化細胞に較正した(0日目)。これはΔΔCt法であり、5つの独立した分析の平均±SEM * p <0.05、** p <0.01、*** p <0.001;グラフを参照番号6から変更しました。この図の拡大版を表示するには、ここをクリックしてください。
ニューロンおよびグリア分化の誘導
IMR90-iPSCは、 図1およびプロトコルセクションに要約されたステップに従って、有糸分裂後ニューロンおよびグリア細胞の混合培養物に分化され得る。完全なNRI培地の存在下で標準的なマトリックスまたはラミニンコーティングされたディッシュ上にEBをプレーティングしてから5〜8日後、ロゼット様構造が可視になるはずである(= "xfig">図4A)。ロゼットは、ネスチン+細胞(ニューロン前駆体、約90%)、いくつかのβ-III-チューブリン+細胞(コミットされた神経細胞、約5-10%)の存在を特徴とし、後者は主にロゼット( 図4B 、12日目のロゼット)。
完全なND培地の存在下でロゼット解離およびラミニンまたは標準的なマトリックス被覆ディッシュまたはプレート上に再プレーティングすると、細胞はニューロンおよびグリアの混合培養物への分化を開始し、徐々に神経突起束によって連結されたニューロン細胞体のクラスターを形成する。図4Cおよび図4D )。ロゼット由来NSCを拡大し、それらをニューロンおよびグリアに分化させることによって得られるニューロン集団を分析する場合、同様の結果が得られるはずである。ロゼットから拡張されたNSCはnエステイン+ ( 図4E 、ネスチン+細胞を示す挿入図)。
21日の分化後、細胞はβ-III-チューブリンに対して陽性でなければならない。 NF200;タウ;グリア原繊維酸性タンパク質(GFAP)、星状膠細胞マーカー( 図4Gおよび図4H)に対して陽性の細胞の少なくとも10〜15%を有する樹状突起の後期マーカーであるMAP2( 図4D 、4Fおよび図4H) 。さらに、細胞の約20〜30%が分化後にネスチンの発現を保持するはずである( 図4H )。各細胞型( すなわち、ニューロン、星状細胞、ネスチン+細胞)のパーセンテージが継代にわたって変化し、ユーザー依存の変動性が観察されることを考慮することが重要である。
特定のニューロン亜集団を分析することにより、GABA作動性ニューロンは、ガンマアミノ酪酸(GABA)、チロシンヒドロキシラーゼ(TH)、および水疱性グルタミン酸(VES)の免疫染色で示されるように、全細胞の15〜20%、ドーパミン作動性ニューロン〜13-20%、およびグルタミン酸作動性ニューロン〜35〜42%トランスポーター1(VGlut1)である( 図4Hの代表的な定量を参照のこと)。分化の誘導は、未分化hiPSCと比較して分化細胞において有意に下方制御されるべき多能性関連マーカー( 例えば、 Oct4、Tra1-60、およびSSEA3)の分析によって評価することもできる(非特許文献6参照)。これは、Oct4およびNanogの減少およびニューロン細胞接着分子1(NCAM1)および微小管関連タンパク質2(MAP2)などのニューロン遺伝子のアップレギュレーションを示すはずのqPCRによる遺伝子発現の分析によっても確認することができる。シナプス前遺伝子、シナプトフィジン(SYP);およびシナプス後の遺伝子である微小管関連タンパク質タウ(MAPT) strong class = "xfig">図4Iを参照してください。さらに、ドーパミン作動性(THおよびNR4A1)、ノルアドレナリン作動性(PHOX2AおよびPHOX2B)、グルタミン酸作動性(NARG2、GRIA1およびGAP43)、GABA作動性(GABRA1およびGABRA3)、運動ニューロン(ISL1およびLHX3)およびコリン作動性(SLC5A7およびSLC18A13)未分化細胞と比較してアップレギュレートされたニューロン細胞を生じる( 図4J )。
MEAによる自発的な電気活動の分析は、分化したhiPSCにおけるニューロンネットワークの機能性を評価するための貴重な情報である。分化期間の終わりに、ニューロン誘導体は、一般に、少なくとも60スパイク/分の平均発火率(MFR)によって特徴付けられる( 図4Kの代表的なラスタプロットを参照のこと )。しかしながら、バーストは観察されない。
55702fig4.jpg "/>
【図4】IMR90-hiPSCのニューロンとグリアの混合培養物への分化。 (AおよびB)ネスチン(緑色)およびβ-III-チューブリン(赤色)について染色された7DIV (A)および12DIV (B)の後のロゼットの代表的画像。 (CおよびD) β-III-チューブリン(赤色)およびNF200(緑色)について染色した22DIV (C)および28DIV (D)後の分化細胞の代表的画像。 (E)ロゼットの解離および拡張に由来するNSCの代表的な画像(挿入図はネスチン+細胞、赤を示す)。 (FおよびG)神経細胞( F 、NF200(赤色)およびTau(緑色)で染色)およびグリア細胞( G 、GFAP(赤色)で染色)の代表的画像はNSCから分化した(H)ネスチン、MAP2、GFAP、γ-アミノ酪酸(GABA)、小胞性グルタミン酸トランスポーター1(VGlutIMR90-hiPSC由来のNSCから分化した細胞(参考文献7から改変されたグラフ)と比較して、HCIによるチロシンヒドロキシラーゼ(TH) - 陽性細胞と比較した。 ( Oct4およびNanog)およびニューロン遺伝子(NCAM1、MAP2、SYPおよびMAPT) (I)およびドーパミン作動性(THおよびNR4A1)、ノルアドレナリン作動性(PHOX2AおよびPHOX2B)のqPCR分析を示す棒グラフ。 (NARG2、GRIA1およびGAP43)、GABA作動性(GABRA1およびGABRA3)、運動ニューロン(ISL1およびLHX3)およびコリン作動性(SLC5A7およびSLC18A13)関連遺伝子(J)すべての分析は、参照遺伝子、β-アクチンおよびGAPDHに対して標準化され、未分化細胞(緑色の棒)に対して較正された。これはΔΔCt法であり、5つの独立した分析の平均±SEM * p <0.05、** p <0.01、*** p <0.001である。 IおよびJのグラフを参考文献6から修正した。 (K) IMR90-NSC由来神経の代表ラスタプロット(記録は最低600秒間行った;垂直バーは単一のスパイクを表す)。 この図の拡大版を見るには、ここをクリックしてください。
ニューロンマーカーの特異的シグネチャーは、分化したIMR90-hiPSCにおいてアップレギュレートされる
新しい毒性試験のパラダイムでは、特定の毒物への曝露後に細胞内で起こる分子事象および細胞事象を定義することが不可欠である。したがって、調査中の細胞モデル内でどのシグナル伝達経路が活性化されているか、および/または上方制御されているかを特徴付けることが重要である。
タンパク質キナーゼ遺伝子発現の分析のための商業的に入手可能なアレイを用いて、未分化hiPSC対分化細胞を比較することができる。 Differen(GDNF)レセプター、骨形成タンパク質(BMP)/ TGF-β経路、および血小板由来の神経栄養因子受容体の制御に関与する遺伝子の上方制御を受ける、 (PDGF)受容体に結合する( 図5Aおよび図5B )。
RPPAの分析は、分化したIMR90-hiPSCにおける特定のニューロンのシグネチャーのアップレギュレーションを示す。特に、Erk / CREB、Akt / PDK1 / mTOR、およびNotch1シグナル伝達経路は、分化の際に活性化される( 図5C )。
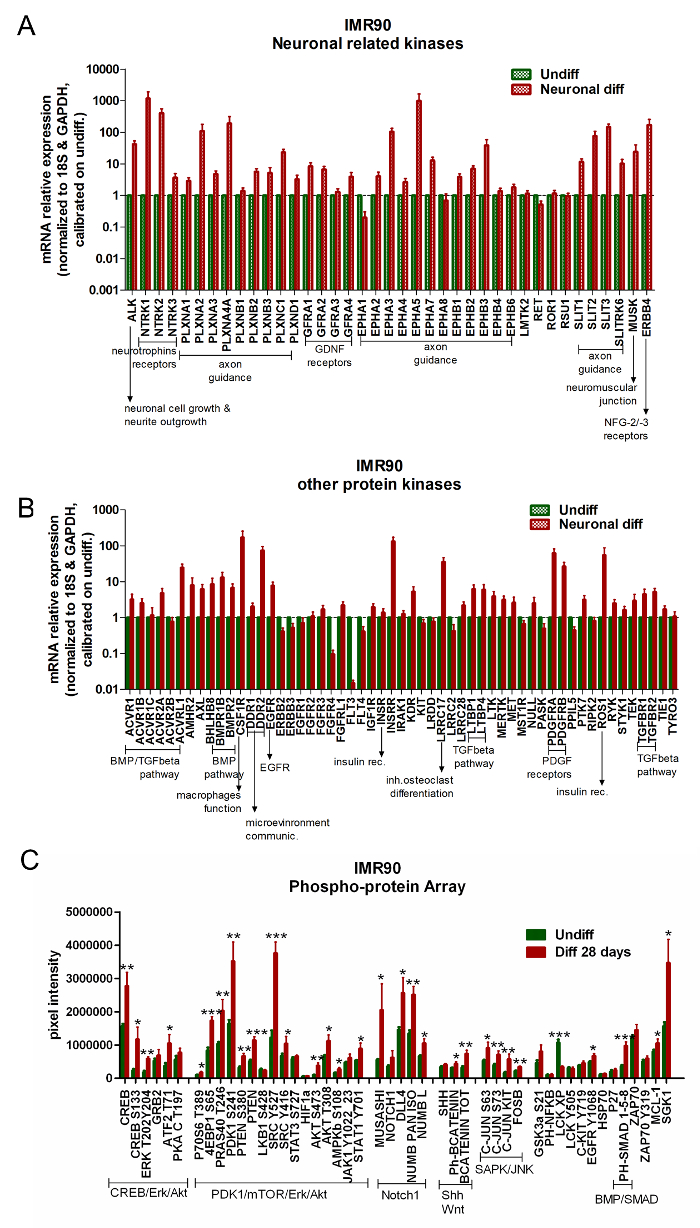
図5.分化したニューロンおよびグリア細胞は、ニューロン関連経路の活性化を示す。 (AB)棒グラフは、ニューロン関連キナーゼ(A)および他のキナーゼ関連遺伝子(B)の qPCR分析を報告する。遺伝子発現データを参照遺伝子18SおよびGAPDH(アレイ中に提供)に対して正規化し、未分化細胞に対して較正した。これらの分析のために、その遺伝子の発現が未分化細胞(2- ΔΔCt ≧2)よりも少なくとも2倍高い場合、遺伝子は有意にアップレギュレートされたとみなされた。 3回の独立した分析の平均±SEM)。 (C)棒グラフは、分化した(赤色の棒)および未分化の細胞(緑色の棒)を比較する、RPPA分析による絶対タンパク質定量を示す。同じシグナル伝達経路カスケードに属するタンパク質は、CREB / Erk / Akt、PDK1 / mTOR / Erk / Akt、Notch1、ShhおよびWnt、SAPK / JNK、およびBMP / SMADとして一緒にクラスター化される。 4つの独立した分析の平均±SEM。 * p <0.05、** p <0.01、*** p <0.001;グラフを修正したfROM参照6. この図の拡大版を見るには、ここをクリックしてください。
IMR90-hiPSC由来のニューロン/グリア培養物を使用して、ロテノンの効果を評価することができる
ミトコンドリア呼吸鎖の複合体Iの阻害剤であるロテノンは、Nrf2経路の活性化を誘発することによって酸化ストレスを引き起こすことが知られている。休止状態では、Nrf2ユビキチン化およびタンパク質分解を促進するNrf2リプレッサーであるKeap1(Kelch様ECH関連タンパク質1)によって、Nrf2が細胞質に固定されている15 。酸化的ストレスが誘導されると、Nrf2は核に移行し、Nrf2-ARE標的遺伝子の発現を活性化する16 。
IMR90-hiPSC由来ニューロンおよびdグリア細胞を使用して、異なる濃度のロテノン( 例えば、 1,10、および100nM)に24時間曝露することにより、Nrf2活性化に対するロテノンの効果を評価することができる。これらの濃度は、以前の研究17,18に従って確立された。
これらの濃度および暴露時間では、生DAPI +細胞核の定量によって示されるように、ロテノンは細胞毒性をもたらさなかった( 図6A )。ロテノンは、特に100nMのロテノンに細胞を暴露した後、Nrf2核移行を誘導した( 図6Bおよび図6E )。同じ濃度で、NAD(P)Hキノンオキシドレダクターゼ1(NQO1)とスルフェレドキシン1(SRXN1)の2つのNrf2-標的酵素の増加とともに、細胞質Keap1の有意な減少が観察された( 図6C )zymes 19,20 ( 図6D )。
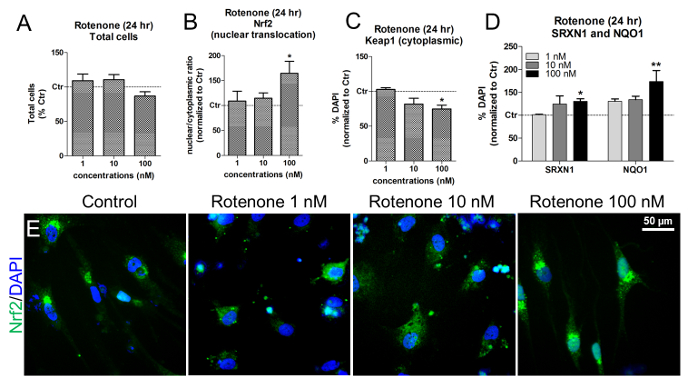
【図6】Nrf2核移行、Keap1、SRXN1、およびNQO1タンパク質レベルに対するロテノンの効果。 (A) 1,10,100nMのロテノンで24時間処理し、未処理の細胞に対して標準化した対照(Ctr)での生DAPI +細胞( すなわち、非核形成核)の定量。 (B)ロテノンへの24時間の曝露後のNrf2タンパク質核移行( すなわち、核/細胞質比)を、HCI分析を用いて蛍光強度の測定によって評価した。 (C)ロテノン処理時の細胞質Keap1タンパク質レベルの定量.HCl分析により評価される。 (D) NAD(P)Hキノンオキシドレダクターゼ1(NQO1)およびスルフィドロテノンで24時間処理した後、免疫蛍光法およびHClを用いてレドキシン1(SRXN1)を検出した。 (E) Nrf2タンパク質局在(緑色)の代表的な画像。全ての値は、3回の生物学的複製の平均±SEMとして示されている。 * p <0.05、** p <0.01;参照番号7から変更された図。この図の拡大版を見るには、ここをクリックしてください。
これらの濃度および治療時間で、ロテノンは、NSC(ネスチン+ )およびニューロン(MAP2 + )の比率に影響を与えずに、アストログリア(GFAP + )細胞パーセンテージの濃度依存性増加を誘発した( 図7Aおよび図7B ) 7B )。特定のニューロンサブタイプの割合を調べることにより、ロテノン処理(10nMおよび100nM)GABA作動性(GABA + )およびグルタミン酸作動性(VGlut1 + )ニューロンの割合は変化しなかったが( 図7D )、ドーパミン作動性ニューロン(TH + )( 図7CおよびD )の数を有意に減少させた。同様に、以前のインビボおよびインビトロ研究では、ロテノン依存性および選択的ドーパミン作動性ニューロン細胞死21,22,23が記載されている 。
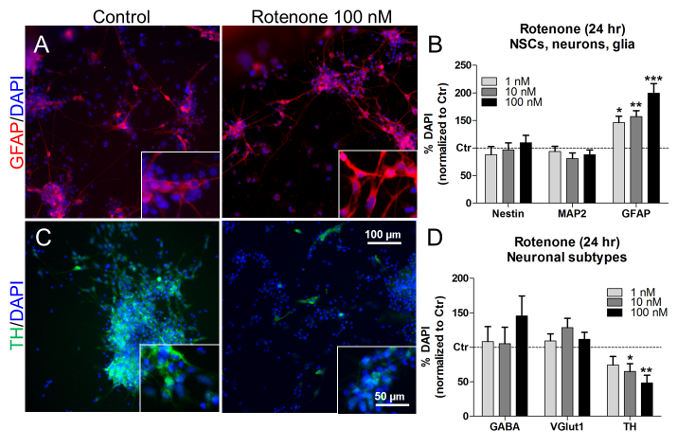
図7.グリア細胞およびドーパミン作動性ニューロンに対するロテノンの効果。 (A)インセットで40倍の倍率で、未処理または100nMのロテノンで24時間処理したGFAP +細胞(赤色)の代表的な写真。 (B)定量未処理細胞(対照、Ctr)に対して標準化したネスチン+ 、MAP2 + 、およびGFAP +細胞の濃度を示す。 (C)インサート中の40倍の倍率で、未処理または100nMのロテノンで24時間処理したドーパミン作動性TH +ニューロン(緑色)の代表的な写真。 (D)未処理細胞(Ctr)に対して正規化したGABA + 、VGlut1 +およびTH +神経細胞の定量。全ての値は、3回の生物学的複製の平均±SEMとして示されている。 * p <0.05、** p <0.01、*** p <0.001;参照番号7から変更された図。この図の拡大版を見るには、ここをクリックしてください。
統計的有意性は、DunnettのMultiple Comparison Testを用いた一元配置ANOVAにより、試験後(全てのカラム対対照カラムを比較する)全てのデータは、少なくとも3回の生物学的反復の平均±平均の標準誤差(SEM)を表す。バー上のアスタリスクは、対照群との有意差* p <0.05、** p <0.01、*** p <0.001。
表1。
解離したロゼットの播種密度に関する注記:ロゼット断片が完全に解離していないと見ても、約15.000細胞/ cm 2の細胞播種密度に達するために、約50 EB / 1×60mm皿に由来する解離したロゼット断片は、 50mLの完全NRI培地に入れ、以下のようにプレートした(プレートのフォーマットに依存する):
| マルチウェルプレート/ MEA | 成長面積(cm 2 /まあ) | 1ウェルあたりの細胞懸濁液の容量(またはMEAチップ) | (細胞懸濁液50mlで)プレートできる最大プレート数 |
| 96ウェル | 0.3 | 100 ul | 5 |
| 48ウェル | 0.7 | 220 ul | 4 |
| 24ウェル | 2 | 625 ul | 3 |
| 12ウェル | 4 | 1.25 ml | 3 |
| 6ウェル | 10 | 3.125ml | 2 |
| シングルウェルMEAチップ | 3.5 | 1.1 ml | 45 |
表2:受け入れ基準
| マーカー /抗体 | 28 DIV後のパーセンテージ(DAPI +(生存)細胞上) |
| B-III-チューブリン(Tuj1) | 35-45% |
| MAP2 | 50-60% |
| NF200 | 45-55% |
| GFAP | 10-25% |
| ネスチン | 15-25% |
ディスカッション
この研究は、IMR90-hiPSCを分裂後ニューロンおよびグリア細胞に分化させるための、堅牢で比較的迅速なプロトコールを記載する。以前に公開されたhESCおよびhiPSCに基づくニューロン分化プロトコールは、通常、高い割合の神経前駆体25,26およびかなりの数の神経標的細胞27,28,29,30,31,32,33を産生する。同様に、本明細書に記載の分化プロトコルは、グリアおよび恒常的な割合のネスチン+細胞と共に、GABA作動性、グルタミン酸作動性およびドーパミン作動性ニューロン細胞の異種培養物を作製するのに適している。グルタミン酸作動性(〜35-42%)およびGABA作動性(〜15-20%)神経細胞の存在は、この培養は前脳、皮質様の特徴を有し、ドーパミン作動性ニューロン(〜13〜20%)の不連続数の存在も中脳特異性を示し得る。さらに、ネスチン+細胞の適度な割合の永続性は、神経新生の研究、および主として前脳34の海馬および脳室下領域(SVZ)の両方に限定されるNSCに対する化学物質の考えられる効果に適していると考えられる。さらなる免疫細胞化学および遺伝子発現分析は、分化した細胞誘導体の領域特異性をより明確にするのに役立つであろう。
この文書に記載されている分化プロトコルの2つの最も重要なステップは、(i)均質な断片へのhiPSCコロニーの切断(均質な大きさのEBの生成に重要である)、および(ii)神経外胚葉構造)、NSC分化のためにはかなりの手作業スキルが必要分化時に得られるニューロンおよびグリア細胞の割合を減少させる可能性のある中胚葉および内胚葉細胞の収集を避けるために、
増殖中(未分化コロニーまたはNSCとして)およびすべての分化段階中に細胞の表現型を特徴付けることは重要である。特に、ニューロン/グリア細胞誘導体の遺伝子およびタンパク質発現プロファイルは、ニューロン関連シグナル伝達経路のアップレギュレーションおよび活性化を示すが、多能性マーカーの発現は減少しなければならない。
EBおよび神経外胚葉誘導体(ロゼット)の生成は、手作業で挑戦的であり、変動する傾向があり得る。この理由から、我々は、ロゼット由来NSCの拡大およびニューロン/グリア細胞へのそれらのさらなる分化のためのプロトコールを開発した。
この分化プロトコルの可能な限界は、主に(i)d(ii)成熟したニューロンネットワーク機能の欠如(バーストの欠如によって示されるように)のいずれかである。さらに、星状細胞の特定の亜集団は、初代前駆細胞またはNSCとして機能し得る35 。この分化した細胞培養物においてネスチン/ GFAP二重陽性細胞は観察されなかったが(データ示さず)、これらの混合培養物中のGFAP +細胞は星状細胞前駆体および星状細胞であると仮定される。分化の時間を伸ばすことによって、星群の数は増加し、その形態は、Zhangのグループ36,37の以前の研究によってすでに示されているように、より成熟する可能性がある。
新しい毒性試験のパラダイムでは、生物学的経路の化学誘起摂動に関する知識は、化学的逆行を評価する際に最も重要である。したがって、 インビトロ試験システムは、有害な結果経路(AOP)の概念に従って、シグナル伝達経路の障害に悪影響を関連付ける。概念の証明として、ロテノンは、酸化ストレスまたは求電子ストレスに対する細胞防御に関与するNrf2経路の活性化を評価するために使用することができ、酸化ストレスは、関連する様々なAOPにおける重要かつ共通の主要事象である発生および成人神経毒性39 。
ロテノンは、Nrf2タンパク質の核移行およびNQO1およびSRXN1を含むNrf2標的酵素の発現の増加によって示され得るNrf2経路の活性化を誘発すべきである。ロテノンは、星状細胞の活性化を示すGFAPタンパク質レベルの用量依存的増加を誘導することが見出されている( 40,41) 。ロテノンはまた、ドーパミン作動性(TH + )細胞の数を減少させ、これは、previこのタイプのニューロンは酸化ストレスに特に敏感であるため、ロテノン依存性ドーパミン作動性細胞死を示すインビトロおよびインビボ研究21,22,23 。
結論として、このhiPSC由来のニューロンおよびグリア細胞培養モデルは、Nrf2経路活性化をもたらす酸化ストレスを誘発する化学物質の神経毒性効果を評価するための貴重なツールである。この分化プロトコルは、神経細胞(GABA作動性、ドーパミン作動性およびグルタミン酸作動性ニューロン)および星状細胞の混合培養物の生成を可能にするので、神経変性疾患などの生理学的および病理学的状態におけるニューロンとグリアとの間のクロストークを研究するのに適している例えば、パーキンソン病)。さらに、有意な割合のNSCの存在は、神経前駆体に対する化学物質の考えられる影響を評価するのに役立つかもしれない化学的に誘発された突然変異またはウィルス感染の主な標的であることが知られている42 。
開示事項
著者は何も開示することはない。
謝辞
著者は、IMR90-hiPSCを提供してくれたMarc Peschanski博士(I-Stem、フランス、エヴリー)に感謝したい。 Giovanna Lazzari博士とSilvia Colleoni博士(Avantea srl、Cremona、Italy); Dr. Simone Haupt(ボン大学、ドイツ); Tiziana Santini博士(イタリア工科大学ローマ)は、免疫蛍光染色の評価に関するアドバイスを提供してくれました。 RPPA分析と抗体の検証に貢献したBenedetta Accordi博士、Elena Rampazzo博士、Luca Persano博士(パドヴァ大学、イタリア)資金調達:このプロジェクトは、EUが資金を提供するプロジェクト「SCR&Tox」(無償資金協力協定第266753号)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Complete hiPSC medium: | |||
| mTeSR1 Basal Medium | Stem Cell Technologies | 05851 | (Step 1.2.6). Complete mTeSR1 is stable when stored at 2 - 8°C for up to 2 weeks. 5X Supplements can be dispensed into working aliquots and stored at -20°C. Use frozen aliquots within 3 months. |
| mTeSR1 5X Supplements | Stem Cell Technologies | 05852 | |
| Matrigel hESC-qualified Matrix | Corning | 354277 | 1:100 (Step 1.1). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200ul aliquot in 20 ml of DMEM/F12 medium. |
| CryoStem Freezing Medium | Stemgent | 01-0013-50 | Freeze ~ 100 fragments/250 ul/vial (Step 1.2.1) |
| Name | Company | Catalog Number | Comments |
| hiPSC EB medium: | |||
| Knockout DMEM | Thermo-Fisher | 10829-018 | (Step 2.1.7) |
| Knockout Serum Replacement (KOSR) | Thermo-Fisher | 10828-028 | 20% final concentration (Step 2.1.7) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.1.7) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.1.7) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 2.1.7) |
| β-Mercaptoethanol | Thermo-Fisher | 31350-010 | 50 µM final concentration (Step 2.1.7) |
| Name | Company | Catalog Number | Comments |
| Complete neuroepithelial induction medium (NRI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 2.3.1) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.3.1) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.3.1) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.3.1) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 2.3.1) |
| bFGF | Thermo-Fisher | 13256-029 | 20 ng/ml final concentration added before use (Step 2.3.1) |
| Matrigel Basement Membrane Matrix | Corning | 354234 | 1:100 (Step 2.2). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200 ul aliquot in 20 ml of cold DMEM/F12 medium. |
| Laminin | Sigma-Aldrich | L2020 | 1:100 (Step 2.2). Dilute in PBS 1X. |
| Name | Company | Catalog Number | Comments |
| Complete Neuronal Differentiation medium (ND): | |||
| Neurobasal Medium | Thermo-Fisher | 21103049 | (Step 2.4.11) |
| B-27 Supplements (50x) | Thermo-Fisher | 17504044 | (Step 2.4.11) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.4.11) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.4.11) |
| GDNF | Thermo-Fisher | PHC7045 | 1 ng/ml final concentration. Added before use. (Step 2.4.11) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use. (Step 2.4.11) |
| Name | Company | Catalog Number | Comments |
| Neural induction medium (NI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 3.3) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 3.3) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 3.3) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 3.3) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 3.3) |
| B-27 Supplement (50X), minus vitamin A | Thermo-Fisher | 12587010 | (Step 3.3) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 3.3) |
| bFGF | Thermo-Fisher | 13256-029 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| EGF | Thermo-Fisher | PHG6045 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use (Step 3.3) |
| Defined Trypsin Inhibitor (DTI) | Thermo-Fisher | R007-100 | Pre-warm at 37°C. Add an equal amount of DTI to Trypsin-EDTA (Step 3.10) |
| Trypsin-EDTA (0.5%), no phenol red | Thermo-Fisher | 15400054 | 1:10. Dilute Trypsin-EDTA in PBS 1x (without calcium and magnesium), pre-warm the solution at 37°C (Step 3.8) |
| CryoStor cell cryopreservation medium | Sigma-Aldrich | C2874-100ML | (Step 4.2) |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| Name | Company | Catalog Number | Comments |
| TaqMan Probesets and reagents for gene expression analysis: | |||
| RNAqueous-Micro kit | Thermo-Fisher | AM1931 | (Step 5.1.6) |
| High Capacity cDNA Reverse Transcription Kits | Thermo-Fisher | 4368814 | |
| TaqMan Gene Expression Master Mix | Thermo-Fisher | 4369016 | |
| GFAP | Thermo-Fisher | Hs00909233_m1 | |
| MAP2 | Thermo-Fisher | Hs00258900_m1 | |
| NQO1 | Thermo-Fisher | Hs02512143_s1 | |
| SRXN1 | Thermo-Fisher | Hs00607800_m1 | |
| HMOX1 | Thermo-Fisher | Hs01110250_m1 | |
| GSR | Thermo-Fisher | Hs00167317_m1 | |
| PAX6 | Thermo-Fisher | Hs01088112_m1 | |
| NES | Thermo-Fisher | Hs00707120_s1 | |
| GRIA1 | Thermo-Fisher | Hs00181348_m1 | |
| GAP43 | Thermo-Fisher | Hs00967138_m1 | |
| GABRA3 | Thermo-Fisher | Hs00968132_m1 | |
| GABRA1 | Thermo-Fisher | Hs00168058_m1 | |
| NR4A2 | Thermo-Fisher | Hs00428691_m1 | |
| TH | Thermo-Fisher | Hs00165941_m1 | |
| GAPDH | Thermo-Fisher | Hs02758991_g1 | |
| ACTB | Thermo-Fisher | Hs99999903_m1 | |
| MAPT | Thermo-Fisher | Hs00902194_m1 | |
| SYP | Thermo-Fisher | Hs00300531_m1 | |
| NANOG | Thermo-Fisher | Hs04260366_g1 | |
| POU5F1 (OCT4) | Thermo-Fisher | Hs04195369_s1 | |
| SOX1 | Thermo-Fisher | Hs01057642_s1 | |
| AFP | Thermo-Fisher | Hs00173490_m1 | |
| KRT18 | Thermo-Fisher | Hs01941416_g1 | |
| NPPA | Thermo-Fisher | Hs00383230_g1 | |
| T | Thermo-Fisher | Hs00610080_m1 | |
| NCAM1 | Thermo-Fisher | Hs00941821_m1 | |
| NR4A1 | Thermo-Fisher | Hs00374226_m1 | |
| PHOX2A | Thermo-Fisher | Hs00605931_mH | |
| PHOX2B | Thermo-Fisher | Hs00243679_m1 | |
| NARG2 | Thermo-Fisher | Hs00973298_g1 | |
| SLC18A3 | Thermo-Fisher | Hs00268179_s1 | |
| SLC5A7 | Thermo-Fisher | Hs00222367_m1 | |
| ISL1 | Thermo-Fisher | Hs00158126_m1 | |
| LHX3 | Thermo-Fisher | Hs01033412_m1 | |
| TaqMan Human Protein Kinase Array | Thermo-Fisher | 4418721 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and reagents for immunostaining: | |||
| B-III-tubulin (Tuj1) | Covance | MMS-435P | 1:500 (Step 5.2.5). Other antibodies may also be used. |
| MAP2 | Sigma Aldrich | M4403 | 1:500 |
| NF200 | Sigma Aldrich | N4142 | 1:1000 |
| GFAP | Acris Antibodies GmbH | AP02002SU-N | 1:500 |
| Nestin | Sigma-Aldrich | N5413 | 1:200 |
| synaptophysin (SYN) | Abcam | AB14692 | 1:200 |
| Tau | Thermo-Fisher | MA5-12808 | 1:100 |
| Nrf2 | Abcam | AB62352 | 1:200 |
| Keap1 | Abcam | AB66620 | 1:200 |
| sulfiredoxin1 (SRXN1) | Abcam | AB92298 | 1:200 |
| NAD(P)H quinone oxidoreductase 1 (NQO1) | Abcam | AB2346 | 1:200 |
| OCT4 | Millipore | MAB4401 | 1:100 |
| SSEA3 | Millipore | MAB4303 | 1:100 |
| Tra1-60 | Millipore | MAB4360 | 1:250 |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | 1:200 |
| Gamma-aminobutyric acid (GABA) | Sigma-Aldrich | A0310 | 1:100 |
| Vesicular glutamate transporter 1 (VGlut1) | Abcam | AB72311 | 1:500 |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | 4% (4% formaldehyde can also be used) |
| DPBS, no calcium, no magnesium | Thermo-Fisher | 14190144 | |
| Triton-X-100 Solution | Sigma-Aldrich | 93443-100ML | 0.1% |
| BSA 35% | Sigma-Aldrich | A7979-50ML | 3.5% |
| Donkey anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 594 conjugate | Thermo-Fisher | SA5-10040 | 1:500. (Step 5.2.7) Other fluorochrome-conjugated secondary antibodies may also be used. In this case, appropriate dilutions should be tested by the enduser. |
| Donkey anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10166 | 1:500 |
| Donkey anti-Goat IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10086 | 1:500 |
| DAPI Solution (1 mg/ml) | Thermo-Fisher | 62248 | 1:1000 (Step 5.2.7) |
| Name | Company | Catalog Number | Comments |
| Antibodies for Reverse Phase Protein Array (RPPA): | |||
| 4E-BP1 (S65) | Abcam | AB81297 | 1:250 (Note after step 5.2.8) |
| Akt (T308) | Cell Signaling | 9275 | 1:100 |
| Akt (S473) | Cell Signaling | 9271 | 1:100 |
| AMPKalpha (T172) | Cell Signaling | 2531 | 1:100 |
| AMPKbeta1 (S108) | Cell Signaling | 4181 | 1:100 |
| ATF-2 (T71) | Cell Signaling | 9221 | 1:100 |
| c-Jun (S63) | Cell Signaling | 9261 | 1:200 |
| c-Jun (S73) | Cell Signaling | 9164 | 1:200 |
| c-Kit (Y719) | Cell Signaling | 3391 | 1:250 |
| CREB (S133) | Cell Signaling | 9191 | 1:100 |
| EGFR (Y1068) | Cell Signaling | 2234 | 1:50 |
| ErbB2/HER2 (Y1248) | Cell Signaling | 2247 | 1:100 |
| ERK 1/2, p44/42 (T202/Y204) | Cell Signaling | 9101 | 1:2000 |
| GSK-3alpha (S21) | Cell Signaling | 9337 | 1:50 |
| Jak1 (Y1022/1023) | Cell Signaling | 3331 | 1:100 |
| Lck (Y505) | Cell Signaling | 2751 | 1:500 |
| LKB1 (S428) | Cell Signaling | 3051 | 1:100 |
| mTOR (S2448) | Cell Signaling | 5536 | 1:100 |
| NFkB p65 (S536) | Cell Signaling | 3031 | 1:50 |
| p70 S6 Kinase (T389) | Cell Signaling | 9205 | 1:200 |
| PDK1 (S241) | Cell Signaling | 3061 | 1:100 |
| PKA C (T197) | Cell Signaling | 4781 | 1:250 |
| PRAS40 (T246) | BioSource | 44-1100 | 1:2000 |
| PTEN (S380) | Cell Signaling | 9551 | 1:500 |
| Smad1 (S463/465), Smad5 (S463/465), Smad8 (S426/428) | Cell Signaling | 9511 | 1:500 |
| Src (Y527) | Cell Signaling | 2105 | 1:500 |
| Src Family (Y416) | Cell Signaling | 2101 | 1:200 |
| Stat1 (Y701) | Cell Signaling | 9171 | 1:200 |
| Stat3 (S727) | Cell Signaling | 9134 | 1:200 |
| Zap-70 (Y319) | Enogene | E011159 | 1:100 |
| βCatenin (S33/37/T41) | Cell Signaling | 9561 | 1:250 |
| CREB | Upstate Biotechnologies | 06-863 | 1:100 |
| Fos B | Cell Signaling | 2251 | 1:200 |
| GRB2 | Cell Signaling | 3972 | 1:2000 |
| HSP70 | Stressgen | SPA-810 | 1:100 |
| c-Jun | Cell Signaling | 9165 | 1:100 |
| Kip1/p27 | BD | 610241 | 1:100 |
| Lck | Cell Signaling | 2984 | 1:250 |
| Mcl-1 | Cell Signaling | 4572 | 1:80 |
| Musashi | Cell Signaling | 2154 | 1:100 |
| NOTCH1 | Cell Signaling | 3439 | 1:100 |
| PTEN | Cell Signaling | 9552 | 1:500 |
| SGK1 | Abnova | PAB4590 | 1:250 |
| Zap-70 | Cell Signaling | 2705 | 1:250 |
| β-Catenin | Abcam | AB32572 | 1:1000 |
| Dll4 | Abcam | AB7280 | 1:500 |
| Shh | Abcam | AB53281 | 1:250 |
| HIF-1α | BD | 610958 | 1:50 |
| NUMB PAN-ISO | Upstate Biotechnologies | 07-207 | 1:400 |
| NUMB-L | Chemicon | AB15145 | 1:750 |
| Cyclin B | BD | 610220 | 1:75 |
| c-Myc | Calbiochem | OP-10 | 1:100 |
| BCIP/NBT Kit | Thermo-Fisher | 002209 | (Note after step 5.2.8). Kit used to measure alkaline phosphatase activity, similar kits can be used. |
| Name | Company | Catalog Number | Comments |
| Antibodies for Flow Cytometry: | |||
| SSEA1 Antibody, Pacific Blue conjugate | Thermo-Fisher | MHCD1528 | 1:100 (Note after step 5.2.8) |
| SSEA4 Antibody (MC813-70), Alexa Fluor 647 | Thermo-Fisher | SSEA421 | 1:100 |
| Name | Company | Catalog number | Comments |
| Specific instruments, tools and softwares: | |||
| Countess Automated Cell Counter | Thermo-Fisher | C10227 | Neubauer chamber or other suitable glass hemocytometer can be used. |
| MEA1060-Inv-BC | Multichannel Systems | MEA1060-Inv-BC | (Step 5.3) |
| MEA1060-BC control software | Multichannel Systems | MEA1060-BC | (Step 5.3) |
| NeuroExplorer | Multichannel Systems | NeuroExplorer (NE) | (Step 5.3) For post-processing of MEA data |
| Multielectrode arrays (MEA) | Multichannel Systems | 60MEA100/10iR-Ti-gr | (Step 5.3) Single-well MEA chip |
| ArrayScan XTI High Content Platform | Thermo-Fisher | ASN00002P | (Step 5.2.8) Mean fluorescence can be quantified by using specific ArrayScan algorithms (e.g., Cytotoxicity V.4 and NucTrans V.4 bioapplications). It is recommended to take minimum 20 pictures/well, and have 7-8 internal replicates per condition |
| 7900HT Fast Real-Time PCR System | Thermo-Fisher | 4351405 | (Step 5.1.6) |
| BD ULTRA-FINE Needle Insulin Syringe (with 30G needle) | BD | 328280 | (Steps 1.3.1, 2.1.2, and 2.4.1) |
| StemPro EZPassage Disposable Stem Cell Passaging Tool | ThermoFisher | 23181010 | This colony cutting tool can be used as an alternative to the use of 30G needle 1 mL syringes (Step 1.3.1) |
| Ultra-Low attachment Petri dish (60 mm) | Corning | 10010582 | (Step 2.1.8) Also other brands can be used. |
| Mr. Frosty Freezing container | Sigma-Aldrich | C1562-1EA | |
参考文献
- NRC. . Toxicity Testing in the 21st Century: A Vision and a Strategy. , (2007).
- Drews, K., Jozefczuk, J., Prigione, A., Adjaye, J. Human induced pluripotent stem cells--from mechanisms to clinical applications. J Mol Med (Berl). 90 (7), 735-745 (2012).
- Ho, P. J., Yen, M. L., Yet, S. F., Yen, B. L. Current applications of human pluripotent stem cells: possibilities and challenges. Cell Transplant. 21 (5), 801-814 (2012).
- Krueger, W. H., Swanson, L. C., Tanasijevic, B., Rasmussen, T. P. Natural and artificial routes to pluripotency. Int J Dev Biol. 54 (11-12), 1545-1564 (2010).
- Pistollato, F., Bremer-Hoffmann, S., Healy, L., Young, L., Stacey, G. Standardization of pluripotent stem cell cultures for toxicity testing. Expert Opin Drug Metab Toxicol. 8 (2), 239-257 (2012).
- Pistollato, F., et al. Development of a pluripotent stem cell derived neuronal model to identify chemically induced pathway perturbations in relation to neurotoxicity: effects of CREB pathway inhibition. Toxicol Appl Pharmacol. 280 (2), 378-388 (2014).
- Zagoura, D., Canovas-Jorda, D., Pistollato, F., Bremer-Hoffmann, S., Bal-Price, A. Evaluation of the rotenone-induced activation of the Nrf2 pathway in a neuronal model derived from human induced pluripotent stem cells. Neurochem Int. , (2016).
- Standard operating procedure for differentiation of human induced pluripotent stem cells into post-mitotic neurons and glial cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-differentiation-of-human-induced-pluripotent-stem-cells-into-post-mitotic-neurons-and-glial-cells-%28mixed-culture%29-protocol-no.-165/key/p_1570 (2016)
- Standard operating procedure for expansion of rosette-derived neural stem cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-expansion-of-rosette-derived-neural-stem-cells-protocol-no.-166/key/p_1571 (2016)
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Brien, P. J., et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening. Arch Toxicol. 80 (9), 580-604 (2006).
- Accordi, B., et al. Functional protein network activation mapping reveals new potential molecular drug targets for poor prognosis pediatric BCP-ALL. PLoS One. 5 (10), e13552 (2010).
- Vassallo, A., et al. A multi-laboratory evaluation of microelectrode array-based measurements of neural network activity for acute neurotoxicity testing. Neurotoxicology. , (2016).
- Shamblott, M. J., et al. Human embryonic germ cell derivatives express a broad range of developmentally distinct markers and proliferate extensively in vitro. Proc Natl Acad Sci U S A. 98 (1), 113-118 (2001).
- Bryan, H. K., Olayanju, A., Goldring, C. E., Park, B. K. The Nrf2 cell defence pathway: Keap1-dependent and -independent mechanisms of regulation. Biochem Pharmacol. 85 (6), 705-717 (2013).
- Tufekci, K. U., Civi Bayin, E., Genc, S., Genc, K. The Nrf2/ARE Pathway: A Promising Target to Counteract Mitochondrial Dysfunction in Parkinson's Disease. Parkinsons Dis. , 314082 (2011).
- Kovac, S., et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase. Biochim Biophys Acta. 1850 (4), 794-801 (2015).
- Lee, J. M., Shih, A. Y., Murphy, T. H., Johnson, J. A. NF-E2-related factor-2 mediates neuroprotection against mitochondrial complex I inhibitors and increased concentrations of intracellular calcium in primary cortical neurons. J Biol Chem. 278 (39), 37948-37956 (2003).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236 (2), 313-322 (1997).
- Li, L., et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling. Chem Biol Interact. , 56-67 (2014).
- Cannon, J. R., et al. A highly reproducible rotenone model of Parkinson's disease. Neurobiol Dis. 34 (2), 279-290 (2009).
- Sherer, T. B., Kim, J. H., Betarbet, R., Greenamyre, J. T. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation. Exp Neurol. 179 (1), 9-16 (2003).
- Testa, C. M., Sherer, T. B., Greenamyre, J. T. Rotenone induces oxidative stress and dopaminergic neuron damage in organotypic substantia nigra cultures. Brain Res Mol Brain Res. 134 (1), 109-118 (2005).
- Zhou, J., et al. High-efficiency induction of neural conversion in human ESCs and human induced pluripotent stem cells with a single chemical inhibitor of transforming growth factor beta superfamily receptors. Stem Cells. 28 (10), 1741-1750 (2010).
- Topol, A., Tran, N. N., Brennand, K. J. A Guide to Generating and Using hiPSC Derived NPCs for the Study of Neurological Diseases. J Vis Exp. (96), e52495 (2015).
- Jiang, Y., Zhang, M. J., Hu, B. Y. Specification of functional neurons and glia from human pluripotent stem cells. Protein Cell. 3 (11), 818-825 (2012).
- Parsons, X. H., et al. Efficient derivation of human neuronal progenitors and neurons from pluripotent human embryonic stem cells with small molecule induction. J Vis Exp. (56), e3273 (2011).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7 (10), 1836-1846 (2012).
- Zeng, H., et al. Specification of region-specific neurons including forebrain glutamatergic neurons from human induced pluripotent stem cells. PLoS One. 5 (7), e11853 (2010).
- Zeng, X., et al. An in vitro model of human dopaminergic neurons derived from embryonic stem cells: MPP+ toxicity and GDNF neuroprotection. Neuropsychopharmacology. 31 (12), 2708-2715 (2006).
- Paşca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12 (7), 671-678 (2015).
- Almeida, S., et al. Modeling key pathological features of frontotemporal dementia with C9ORF72 repeat expansion in iPSC-derived human neurons. Acta Neuropathol. 126 (3), 385-399 (2013).
- Urbán, N., Guillemot, F. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front Cell Neurosci. 8, 396 (2014).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. J., Zhang, S. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nat Biotechnol. 29 (6), 528-534 (2011).
- Krencik, R., Zhang, S. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nat Protoc. 6 (11), 1710-1717 (2011).
- Nguyen, T., Nioi, P., Pickett, C. B. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress. J Biol Chem. 284 (20), 13291-13295 (2009).
- Bal-Price, A., et al. Putative adverse outcome pathways relevant to neurotoxicity. Crit Rev Toxicol. 45 (1), 83-91 (2015).
- Cabezas, R., El-Bacha, R. S., Gonzalez, J., Barreto, G. E. Mitochondrial functions in astrocytes: neuroprotective implications from oxidative damage by rotenone. Neurosci Res. 74 (2), 80-90 (2012).
- Swarnkar, S., et al. Astrocyte activation: a key step in rotenone induced cytotoxicity and DNA damage. Neurochem Res. 37 (10), 2178-2189 (2012).
- Canovas-Jorda, D., Louisse, J., Pistollato, F., Zagoura, D., Bremer, S. Regenerative toxicology: the role of stem cells in the development of chronic toxicities. Expert Opin Drug Metab Toxicol. 10 (1), 39-55 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved