Method Article
인간 독성 Pluripotent 줄기 세포의 신경 독성 테스트를위한 뉴런과 Glia의 혼합 문화로의 분화를위한 프로토콜
요약
인간 유도 다 능성 줄기 세포 (hiPSCs)는 약물 및 화학 스크리닝 및 신경 독성을 포함한 독성 시험을위한 새로운 시험 관내 모델 개발을위한 강력한 도구로 간주됩니다. 여기, hiPSCs의 뉴런과 glia 로의 차별화에 대한 자세한 프로토콜이 설명되어 있습니다.
초록
인간의 다 능성 줄기 세포는 인체 시험관 독성 시험 에 적용 할 수있는 다양한 세포 유형으로 분화 할 수 있습니다. 인간의 배아 줄기 세포 (hESCs)의 사용과 관련된 윤리적 및 입법상의 문제를 피하기 위해 인간 유도 다 능성 줄기 세포 (hiPSCs)를 생산하기위한 체세포의 재 프로그램화가 가장 큰 장점이다. HiPSCs는 확대 될 수 있으며 독성 테스트를위한 테스트 시스템으로, 특히 신경 독성과 관련된 다양한 경로의 평가를 위해 여러 유형의 신경 및 신경 교세포로 효율적으로 분화 될 수 있습니다. 이 작품은 연결 및 glial 세포의 혼합 문화에 hiPSCs의 차별을위한 프로토콜을 설명합니다. 신경 세포 분화 (neuronal differentiation)에 의해 조절 및 / 또는 활성화되는 신호 전달 경로가 정의된다. 이 정보는 새로운 독성 테스트 패러다임에 대한 세포 모델의 적용에 중요합니다.이 패러다임에서는 화학 물질이 자신의 능력에 따라 평가됩니다rturb 생물학적 경로. 개념 증명으로 미토콘드리아 호흡 복합체 I의 억제제 인 로테 논 (rotenone)을 사용하여 산화 스트레스에 대한 항산화 - 반응 요소 - (ARE) - 유도 세포 방어 기작의 핵심 조절자인 Nrf2 신호 전달 경로의 활성화를 평가했다 .
서문
미국 국립 연구위원회 보고서 1 은 규제 독성 시험이 동물에서 관찰 된 표현형 변화에 의존하는 접근법 에서 인간 세포를 이용한 역학 시험 법에 초점을 맞춘 접근법으로 바뀌는 새로운 독성 시험 패러다임을 구상했습니다. 다 능성 줄기 세포 (PSC) 유도체는 얻은 세포가 인간 조직의 생리 조건과 더 유사 할 수 있고 화학 유발 유해 영향을 연구하기 위해보다 관련성이 높은 도구를 제공하기 때문에 암 세포 모델의 대안이 될 수 있습니다. 독성 시험에 가장 유망한 두 가지 유형의 PSC 배양은 인간 배아 줄기 세포 (human embryonic stem cell, hESCs)와 인간 유도 다 능성 줄기 세포 (human induced pluripotent stem cell, hiPSCs)로 현재 기초 연구 및 재생 의학 분야에서 널리 사용되고있다. 이 전문 지식은 이제 새로운 종류의 toxicolo 개발에 활용 될 수 있습니다.생체 내 부작용의 발병과 관련된 섭동 한 생리 학적 경로를 확인하기위한 생체 외 시험. 그러나 hESC에 기초한 규제 안전성 평가 시험 방법은 가능한 모든 윤리적 문제와 배아 유래 세포의 사용을 규제하는 다양한 국가 입법 정책으로 인해 모든 EU 회원국과 전 세계 국가에서 받아 들여지지 않을 것입니다.
hiPSCs는 hESCs 4 , 5 와 유사한 특성을 공유하며, 안전성 평가뿐만 아니라 치료 표적 을 확인 하기위한 시험관 내 방법에 대한 큰 가능성을 가지고 있습니다. 또한, hiPSC 기술은 제한된 기증자 집단의 제약과 배아 유래 세포와 관련된 윤리적 우려를 완화합니다. hiPSC에 대한 주요 도전 과제는 이러한 세포가 독성 학적으로 관련된 세포 유도체의 상당 부분을 재현 가능하게 만들 수 있다는 데모이다.인간의 조직에 전형적으로 나타나는 특성과 반응을 보입니다. 선택된 마커의 미리 정의 된 수준은 일반적으로 차별화 프로세스 이후 세포 집단을 특성화하고 차별화 프로세스의 안정성에 대한 통찰력을 제공하는 데 사용됩니다.
이전의 연구는 hiPSC가 신경 및 신경 교세포의 혼합 배양 물을 생성하고 미토콘드리아 호흡 복합체 I의 억제제 인 로테 논이 항산화 제 방어 기전의 핵심 조절 인자 인 Nrf2 경로의 활성화에 미치는 영향을 평가했다. 많은 세포 유형 6 , 7 .
이 작품은 연결 / glial 차별화시 활성화 신호 경로 (유전자 및 단백질 수준)에 대한 자세한 내용을 제공, 혼합 신경 및 glial 문화로 hiPSCs의 차별을 위해 사용되는 프로토콜을 설명합니다. 또한,이 작업을 통해hiPSC에서 유래 한 신경 세포 및 신경 교세포 모델은 로테 논으로 급성 (24 시간) 치료에 의해 유발 된 Nrf2 신호 전달 활성화를 평가하는 데 사용할 수있어 산화 스트레스 유도 평가가 가능합니다.
IMR90 섬유 아세포는 pMIG 벡터를 사용하여 2 개의 전사 인자 (Oct4 및 Sox2)의 바이러스 성 전달에 의해 I-Stem (프랑스)에서 hiPSCs로 재 프로그램되었다. 유사한 hiPSC 모델도 적용 할 수 있습니다. 아래에 설명 된 프로토콜은 신경 줄기 세포 (NSCs)로 hiPSCs의 차별화의 모든 단계를 요약하고 사후 mitotic 뉴런과 glial 세포의 혼합 문화 (단계 1과 2, 또한 자세한 내용은 EURL ECVAM DBALM 웹 사이트를 참조하십시오 프로토콜) 8 .
NSC의 혼합 뉴런 및 신경 교세포로의 분리, 확장, 저온 보존 및 추가 분화에 대한 추가 프로토콜은 단계 3 및 4에서 상세히 설명된다 (EURL ECVAM DBALM이 프로토콜에 대한 자세한 설명은 bsite를 참조 하십시오.) 9 . 5 단계는 헌신과 분화의 여러 단계 동안 세포의 표현형 정체성을 평가하기 위해 수행 할 수있는 분석을 설명합니다.
프로토콜
1. 인간 유도 된 다 능성 줄기 세포 (hiPSC) 확장
참고 : hiPSCs는 mTeSR1 5x 보충제 (제조사의 지침에 따라 준비, 플레이트 ~ 100 식민지 조각 / 60mm 페트리 접시)가 포함 된 mTeSR1 매체의 존재하에 적절한 단백질 혼합 기판에서 배양 할 수 있습니다. hiPSC 콜로니가 적절한 크기에 도달하면 ( 그림 2A 의 식민지 예 참조), 아래에 설명 된대로 (일주일에 한 번) 세포를 통과시킵니다.
- hESC 인증 된 기저막 매트릭스 (이하 "적격 매트릭스") 또는 기타 적합한 단백질 기질이 들어있는 코트 요리.
- 차가운 1.5 ML 튜브와 차가운 5 또는 10 ML pipettes에 200 μL aliquots에서 -80 ° C에서 자격 매트릭스 (재료의 테이블을 참조 ) 저장하십시오.
- 계대 배양하기 전에 얼음에 적정 매트릭스 200 μL를 녹입니다.
- 20 m에서 적정 매트릭스 200 μL 희석L의 DMEM / F12 배지 (1 : 100 희석).
- 이 용액 (5 mL / dish)으로 60 mm 페트리 접시를 코팅하십시오.
- 적어도 1 시간 37 ° C에서 코팅 접시를 품어.
- HiPSC 식민지 조각 냉동 및 해동
- hiPSC 식민지를 절단 후 (hiPSC 식민지 절단 절차에 대해 단계 1.3 참조), 줄기 세포 동결 매체, ~ 100 조각 / 250 μL (재료 표 참조)에 hiPSC 식민지 조각을 부드럽게 천천히 다시 부순다.
- 분주 보존 (250 μL / 유리 병)에 적합한 유리 병에서 식민지 파편.
- 바이알을 2- 프로판올로 채워진 용기에 넣고 최소 2 시간 및 최대 2 주 동안 용기를 -80 ° C에 놓습니다.
- 바이알을 액체 질소 탱크의 기상으로 옮긴다.
- 배양을 다시 시작하려면 37 ° C의 수 욕조에서 1 개의 고정 바이알을 녹입니다.
- 부드럽게 pre-warmed 완전한 hiPSC의 7 ML에 hiPSC 식민지 조각을 수집1 mL, 2 mL 또는 5 mL 피펫을 사용하여 15 mL 튜브 에 넣습니다 (재료 표 참조).
- 3 분 동안 130 XG에서 hiPSC 식민지 조각을 원심 분리기.
- 뜨는을 제거하고 부드럽게 1, 2, 또는 5 ML 피펫을 사용하여 완전한 hiPSC 매체의 1 ML에 hiPSC 식민지 조각을 resuspend.
- 3 또는 4 mL의 완전한 hiPSC 배지에서 세포 현탁액을 추가 희석한다.
- 자격이 매트릭스 코팅 60mm 페트리 접시 (~ 100 조각 / 접시에 hiPSC의 식민지 조각을 접시, 단계 1.1에서 설명한대로 요리 코트).
- hiPSCs를 37 ° C 및 5 % CO 2 에서 배양하십시오.
- 매일 매체 전체를 변경하십시오.
- hiPSC 콜로니의 계대 배양
참고 : 미분화 된 hiPSCs는 큰 nucleoli과 풍부한 세포질없이 둥근 모양이어야합니다. 미분화 된 콜로니는 평평하고 단단히 채워진 형태로 특징 지어 져야한다. 오직 미분화 된 콜로니 (약 1mm in 직경)은 더 이상의 passaging을 위해 절단되어야한다.- 줄기 세포 식민지를 약 200 μm x 200 μm의 사각형으로 30G 바늘 또는 다른 상업적으로 이용 가능한 도구가있는 1 mL 주사기를 사용하여 잘라냅니다 (재료 표 참조). 상온에서 층류 캐비닛의 배율 4 배의 입체 현미경을 사용하십시오.
- 조각을 들어 올리려면 아래에 매체를 부드럽게 pipetting하여 200 - μL 피펫을 사용하여 접시 표면에서 식민지 조각을 분리합니다.
- 식민지 조각 (~ 100 조각)을 완전한 HiPSC 배지 4 ML (표 1.1 참조)로 채워진 자격 매트릭스 -DMEM / F12 코팅 플레이트에 옮기십시오 (1.1 절에서 설명한대로 접시를 칠하십시오).
- 37 ° C와 5 % CO 2 에서 새 플레이트를 품어.
- 매일 매체 전체를 변경하고 4X 및 10X 배율의 위상 - 대조 현미경을 사용하여 콜로니의 형태를 검사합니다.
2. HiPSC Differe혼합 뉴런과 글 리아로의 통합
참고 : 절차는 그림 1 (상단)에 요약 된 주요 단계를 완료하는 데 약 28 일이 소요됩니다.
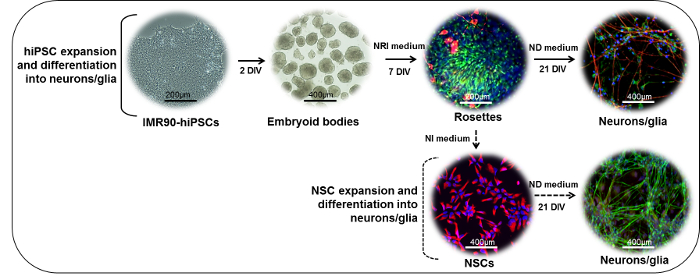
그림 1 : 연결의 분화 프로토콜의 도식 표현. (상단 부분) IMR90-hiPSC 콜로니는 조각으로 절단되어 배아 체 (EB)를 형성 할 수 있습니다. 시험관 내 (DIV) 에서 2 일 후, EBs는 laminin 또는 표준 매트릭스 코팅 요리에 도금 수 neurepectial 유도 (NRI) 매체의 존재에서 neuroectodermal 유도체 (rosettes, 여기에 nestin (녹색) 및 β -III- 튜 불린 (적색)). 로제트는 분리되거나 수집되어 라미네이트 또는 표준 매트릭스 코팅 접시에 재현 될 수 있으며 성숙한 신경 세포 (NF200, 적색) 및 신경아 교세포(GFAP, 녹색) 뉴런 분화 (ND) 매체의 면전에서 세포. (Nestin, red)은 신경 유도 (Neural induction, NI) 배지의 존재하에 확장되거나, 동결 보존되거나, 또는 ND 배지의 존재 하에서 추가로 분화되어 혼합 된 신경 세포 (NF200, 녹색) 및 신경교 (glial)를 형성 할 수있다 GFAP, red) 문화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 배아 체 (EB) 생성 (0 일 → 1 일)
참고 :이 절차를 수행하려면 올바른 수동 기술과 정밀도가 필요합니다. HiPSC 식민지 조각은 다음 단계에서 균일 한 배아 체 (EB)를 얻기 위해 동일한 크기 여야합니다. Morphologically 분화 식민지 (큰 세포질 분수와 작은 nucleoli) 폐기해야합니다.- undifferentiated hiPSC 식민지 (diam에서 약 1mm)를 절단하기 전에 hiPSC 매체 (3 ML / 60 - mm 페트리 접시)를 새로 고침eter, 도 2A 참조 )를 사용하여 배양 하였다 (단계 1에서 기술 된 바와 같다).
- 30G 바늘과 1 ML 주사기를 사용하여 약 200 μm의 X 200 μm의 조각으로 undifferentiated 식민지를 잘라내십시오 ( 그림 2A 및 그림 2B 와 같이 ). 상온에서 층류 캐비닛의 배율 4 배의 입체 현미경을 사용하십시오.
- 조각을 들어 올리려면 아래에 매체를 부드럽게 pipetting하여 200 - μL 피펫을 사용하여 접시 표면에서 식민지 조각을 분리합니다.
- 1, 2 또는 5 mL 피펫을 사용하여 분리 된 모든 단편과 배지를 15 mL 튜브에 옮긴다.
- 모든 조각을 복구하는 완전한 HiPSC 매체 2 ML로 접시를 씻어.
- 1 분 112 XG에서 원심 분리기.
- 뜨는을 대기음하고 부드럽게 완전한 hiPSC EB 매체 5 ML (재료의 테이블을 참조 ) 에 조각을 resuspend .
- 공동 판60 mm 초저 애착 배양 접시 (5 mL / 60 mm 배양 접시)에 lony 파편을 넣습니다.
- 37 ° C와 5 % CO 2 에서 밤새 배양 접시를 품어.
- 다음 날 (1 일)에 1, 2 또는 5 mL 피펫을 사용하여 15 mL 튜브에 EB 및 그 배지를 수집합니다.
- 1 분 동안 112xg에서 EB를 원심 분리하십시오.
- 조심스럽게 뜨는을 기음과 부드럽게 1, 2, 또는 5 ML 피펫을 사용하여 완전한 hiPSC EB 매체의 5 ML에 EBs를 resuspend.
- 새 60mm 초저 부착 페트리 접시 (5mL / 60mm 페트리 접시)에 EB를 보급하십시오.
- 37 ° C와 5 % CO 2 에서 밤새 배양 접시를 품어.
- 1 일째, 기저막 매트릭스 ( 예 : matrigel, 이하 "표준 매트릭스"라고 함) 또는 기타 적합한 단백질 기질 ( 예 : 라미닌)으로 접시를 코팅하십시오.
- -80 ° C에서 표준 매트릭스를 보관하십시오 ( 재료 표 참조).차가운 1.5 mL 튜브 및 차가운 5 또는 10 mL 피펫을 사용하여 200 μL 분액.
- 얼음 위에서 표준 매트릭스 200 μL를 녹입니다.
- 20 ML의 DMEM / F12 배지 (1 : 100 희석)에 표준 매트릭스 200 μL를 희석.
- 이 용액 (5 mL / dish)으로 60 mm 페트리 접시를 코팅하십시오.
- 37 ° C에서 코팅 접시를 품어.
참고 :이 접시는 EBs (약 50 EBs / dish)을 판과 neuroepithelial 집계 (rosettes)를 생성하는 데 사용됩니다; 2.3 단계를 참조하십시오.
- neuroepithelial aggregates (rosettes)의 생성 (2 일 → 7 일)
- 2 일째, 60-mm 배양 접시에서 표준 매트릭스 코팅 용액을 제거하고 (플레이트를 헹굴 필요가 없음) 완전한 신경 상피 유도 배지 (NRI) 5 mL / dish로 채 웁니다. 재료 표를 참조하십시오.
- 입체 음하에 200 μL 피펫을 사용하여 부동 EB (단계 2.1.14에서)을 코팅 접시 (~ 50 EB / dish)로 옮긴다.4 배 배율의 croscope로 층류 캐비닛에 놓습니다.
참고 : 균일 한 중간 크기의 EB (~ 200-300 μm 직경)을 선택하는 것이 중요합니다. 너무 작은 EB는 신경 외배엽 분화 동안 잘 살아남지 못하는 반면, 너무 큰 EB는 중추 괴사를 겪는 경향이있다. - 37 ° C와 5 % CO 2 에서 접시를 품어.
- 다음날 (3 일)에 EB가 모두 부착되었는지 확인하기 위해 현미경으로 접시를 10 배 확대하여 검사합니다.
- 완전한 NRI 매체를 사용하여 부드럽게 전체 매체 변화를 수행하십시오.
- neurepithelial aggregates (rosettes)가 보여야하는 날 7까지 매일 NRI 배지를 교체하십시오.
- 7 일째, 2.2 단계에서 설명한대로 표준 플레이트 (또는 라미닌)를 96- 플레이트 (100 μL / 웰), 24- 웰 플레이트 (250 μL / 웰), 12- 웰 플레이트 (500μL / 웰), MEA 칩 (전기 활성을위한, 1mL / 단일 웰 칩), 또는 60mm 페트리 디쉬s (4 mL / dish).
- 37 ° C와 5 % CO 2 에서 최소 2 시간 동안 코팅 된 접시 / 접시를 품어 라.
- 로제트 해리 및 신경 세포 분화 (8 일 → 28 일)
참고 :이 절차를 수행하려면 올바른 수동 기술과 정밀도가 필요합니다. 중배엽 및 내배엽 세포의 수집을 피하기 위해, 외배엽 로제 같은 조직 만 해리하고 수집해야합니다.- 8 일째, 멸균 상태에서 배율 10 배의 입체 현미경으로 장미 모양의 구조물을 조각으로 자른다. 30G 바늘과 1 ML 주사기를 사용하십시오. 장미는 바늘로 만졌을 때 접시에서 쉽게 분리되는 경향이 있습니다.
- 200 μL 피펫을 사용하여 로제트 파편의 분리를 완료하십시오.
- 층류 후드 아래 접시를 전송하고 1, 2, 또는 5 ML 피펫을 사용하여 15 ML 원추형 튜브에 로제트 조각과 그들의 매체를 수집합니다. 접시를 NRI 매체 2 ML로 씻어 복구모든 조각.
- 2 분 동안 112xg로 로제트 조각을 스핀 다운하십시오.
- 뜨는을 대기음.
- 부드럽게 1x DPBS (칼슘과 마그네슘없이) 1 ML에 펠렛을 부드럽게 resuspend하고 부드럽게 그들을 분열시키기 위해 1,000 - μL 피펫을 사용하여 로제트 파편을 위아래로 피펫.
- 완전한 NRI 매체 4 ML을 추가하고 세포를 트리 판 블루와 자동 셀 카운터를 사용하여 계산합니다 ( 재료 표 참조)
참고 : Trypan 블루 20 μL에 세포 현탁액 20 μL를 희석. 세포가 단일 세포 현탁액으로 될 수없는 경우이 단계는 생략 될 수있다. 로제트 조각이 완전히 해부되지 않은 것처럼 보이면 약 50 EB / 60 mm 접시에서 추출한 로제트 조각을 표 1 에 표시된대로 50 mL의 완전한 NRI 배지에 재용 해하고 도금 할 수 있습니다. - 배양 접시, 플레이트 및 / 또는 MEA 칩 (2.3 단계.)에서 표준 매트릭스 (또는 라미닌) 코팅 솔루션을 기음.7). 그들이 말리 지 않도록하십시오.
- 연구 계획 (약 15,000 세포 / cm 2 , 도금 볼륨 표시에 대한 표 1 참조)에 따라 완전한 NRI 매체에 세포를 플레이트하십시오.
- 37 ° C 및 5 % CO 2 에서 하룻밤 동안 플레이트를 품어.
- 10 일째, 완전한 신경 분화 매체 (ND)를 사용하여 전체 매체 변화를 수행; 재료 표를 참조하십시오.
- 일주일에 두 번 Day 28까지 ND 미디어를 새로 고칩니다.
- 5 단계 (일반적인 수용 기준에 대해서는 표 2 참조)에 설명 된대로 신경 세포 / 신경교 세포 유도체를 특성화합니다.
3. HiPSC 유래 신경 줄기 세포 (NSC) 혼합 뉴런과 Glia 로의 분화
참고 : 로제트 조각에서 추출한 NSC는 아래에 설명 된 절차 ( 그림 1 , 하단 부분)에 따라 확장 및 유지 관리 할 수 있습니다. 이렇게하면 th를 증가시킬 수 있습니다.분화 및 화학 시험을위한 세포 수.
- 표준 매트릭스 DMEM / F12 코팅 솔루션의 5 ML와 60mm 페트리 접시 (또는 T - 25 플라스크)를 코팅하고 ( 2 단계에서 설명한대로) 37 ° C와 5 % CO 2 에서 적어도 2 시간 품어.
- 원뿔형 15 ML 튜브에서 112xg로 2 분 (단계 2.4 참조)에서 추출한 로제트 조각을 스핀 다운하십시오.
- 부드럽게 신경 유도 매체 (NI)의 5 ML에 펠렛을 resuspend; 재료 표를 참조하십시오.
- 표준 매트릭스 코팅 60mm 배양 접시 (또는 T - 25 플라스크)에 세포를 전송합니다.
- 세포 배양액이 합류점에 도달 할 때까지 매일 매체를 새로 고침하여 NI 배지의 존재하에 로제트 유래 NSC를 배양합니다.
- 합류 할 때, 다음 단계에서 기술 된대로 NSC를 통과시킨다.
참고 : NSC를 일주일에 한 번 통과하십시오. 연구 계획에 따라 갓 코팅 한 접시, 플라스크 또는 접시 사용을 고려하십시오. - 완전한 NI 매체와 gentl 제거NBS를 DPBS (칼슘과 마그네슘없이)로 씻어 낸다.
- 세포가 들어있는 60 - mm 페트리 접시 (또는 T - 25 플라스크) 37 ° C 미리 예열 0.05 % 트립신 - EDTA 1.5 ML을 추가하고 1 분 인큐베이터에 놓으십시오.
- 부드럽게 세포 (또는 플라스크)를 탭 세포를 분리합니다.
- 37 ° C로 예열 된 트립신 저해제 1.5 mL를 넣고 세포를 15 mL 튜브에 옮긴다.
- 페트리 접시 (또는 T - 25 플라스크)를 NI 매체 (1.5 ML)의 동일한 볼륨으로 씻어 동일한 15 ML 튜브에 볼륨을 수집합니다.
- 3 분 130 XG에서 세포를 원심 분리기.
- 뜨는을 제거하고 천천히 μl 피펫을 사용하여 완전한 NI 매체 1 ML에있는 세포를 resuspend.
- 추가로 3 또는 4 ML 완전한 NI 매체의 세포 현탁액을 희석하고 세포를 트리 판 블루와 자동 셀 카운터를 사용하여 계산합니다.
- 단계 3.1에서 NSCs를 약 50,000 세포 / cm 2 의 밀도로 60mm 페트리 접시 (또는 T - 25 플라스크)에 놓으십시오.
- 매일 NI 완전한 매체로 전체 매체 변경을 수행하십시오.
- 5 단계에서 설명한대로의 연결 / glial 세포 유도체의 존재에 대한 세포를 특성화합니다.
참고 : NSCs는 완전한 ND 매체 (단계 2.4.11-2.4.13에서 설명)에서 뉴런과 glia의 혼합 문화로 구분할 수 있으며, 완전한 ND 매체를 일주일에 두 번 21 일 동안 새로 고칠 수 있습니다.
4. HiPSC 유래 NSC 저온 보존 및 해동
참고 : passaging, NSCs는 동결 수 있으며이 절차를 다시 해동.
- 130xg에서 3 분 동안 계대 배양 한 NSCs (단계 3.12)를 원심 분리한다.
참고 : 셀은 3.14 단계에서 계산해야합니다. - 천천히 부드럽게 천천히 NSCs 3 X 10 6 / ML 얼어 매체 ( 테이블의 자료를 참조) 에 resuspend .
- cryopreservation (약 0.5 ML = 1.5 X 10 6 / 유리 병)에 적합한 유리 병에 세포를 나누어주십시오.
- 바이알을 용기에 넣는다.2- 프로판올로 채운 다음 최소 2 시간 및 최대 2 주간 -80 ° C에 용기를 놓습니다.
- 바이알을 액체 질소 탱크의 증기 상으로 옮긴다.
- 세포 배양을 다시 시작하려면 37 ℃의 수조에서 1 개의 고정 바이알을 녹입니다.
- 부드럽게 1,000 μL 피펫을 사용하여 15 ML 튜브에 미리 예열 완전한 NI 매체 7 ML에서 세포를 수집합니다.
- 3 분 130 XG에서 세포를 원심 분리기.
- 뜨는을 제거하고 천천히 μl 피펫을 사용하여 완전한 NI 매체 1 ML에 세포를 resuspend.
- 추가로 완전한 NI 배지 3 또는 4 ML에 세포 현탁액을 희석하고 trypan 블루 및 자동 셀 카운터를 사용하여 세포를 계산합니다 (참고 : trypan 블루 20 μL에 세포 현탁액을 희석 20 μL, 해동 후 생존 능력은 ≥ 80이어야합니다 %).
- 코팅 된 60 - mm 페트리 접시 (또는 T25 플라스크)에 NSCs를 약 50,000 세포 / cm 2 의 밀도로 플레이트하십시오.
5. 채라hiPSC 유래 신경 세포 및 신경 교세포의 체화
참고 : 차별화, 신경 및 glial 파생 상품은 다음 섹션에서 설명하는 것과 같은 다른 기술을 사용하여 특성 수 있습니다.
- 정량 실시간 PCR (qPCR) 분석 10
- 3 분 동안 130xg에서 hiPSC 콜로니 단편, EBs 및 / 또는 NSCs를 스핀 다운하십시오.
- RNA 추출을위한 적절한 키트에 제공된 차가운 RNA 용해 버퍼 100 μL에 세포 펠렛을 Resuspend.
- 또는 매체를 흡인하고 세포를 수집하는 우물에 차가운 RNA 용해 버퍼를 추가하여 플레이트에서 직접 연결 / glial 유도체를 수집합니다.
- 제조자의 지시에 따라 RNA를 분리한다.
- RNA 역전사를위한 적절한 키트를 사용하여 500 ng의 total RNA를 역전사하십시오.
- 적절한 마스터 믹스 및 프라이머를 사용하여 qPCR 반응을 이중으로 실시하십시오.세트 ( 재료 표 참조).
- 실시간으로 형광 방출을 기록하십시오 : 60 ° C에서 어닐링하는 프라이머로 45 사이클.
- 상대적 RNA 양을 표준 유전자로서 GAPDH와 β-actin으로 표준화하고 보정 조건 (ΔΔCt 방법)을 위해 미분화 hiPSCs 또는 미처리 세포를 사용하십시오. 또는 다른 적절한 방법을 사용하십시오.
- Immunocytochemistry and high-content imaging (HCI) 6 , 11
- 차가운 4 % 파라 포름 알데히드로 hiPSC 콜로니, NSC 및 / 또는 신경 / glial 유도체를 실온에서 15 분 동안 고정시켰다.
- 부드럽게 1X PBS에서 세포를 씻어 최대 1 개월 동안 4 ° C에서 번호판을 저장하십시오.
- 얼룩이 준비가되면, permeabilization 버퍼 (0.1 % 트리톤 X - 100 및 3 % BSA를 포함하는 1x DPBS)에 실온에서 15 분 동안 세포 permeabilize.
- permeabilization bu 제거항체의 비특이적 결합을 방지하기 위해 상온에서 15 분 동안 블로킹 완충액 (3 % BSA / 1X DPBS)에서 세포를 배양하고 배양한다.
- 차단 버퍼를 제거하고 4 일 밤새 세포를 품어 ° C 적절한 원 항체를 포함하는 버퍼를 차단 (C의 표를 참조 ).
- 1X PBS로 세포를 3 번 씻으십시오.
- DAPI 염료로 핵을 counterstaining, fluorochrome - 접합 보조 항체 ( 표 재료 참조)를 포함하는 버퍼를 차단에서 실온에서 45 분 동안 세포를 품어.
- 사용 가능한 경우 적합한 고감도 이미징 플랫폼을 사용하여 평균 형광 강도와 세포 유형의 상대 백분율을 정량화하십시오 ( 재료 표 참조).
주 : 형광 배경의 강도 수준을 결정하려면, 일부 세포 / 우물을 보조 항체와 함께 배양하십시오. 살아있는 (고정되지 않은), und의 유동 세포 계측 분석SSEA4와 같은 PSC 특이 마커의 발현을 평가하기 위해 ifipliated hiPSC를 수행 할 수 있습니다 ( 표 참조). 상업적으로 이용 가능한 BCIP / NBT 키트를 사용하여 제조 업체의 지침 ( 표 참조)에 따라 미분화 hiPSC 콜로니를 알칼라인 포스 파타 아제 활성에 대해 분석 할 수 있습니다. 또한, 참조 12 (시험 된 항체의 목록은 표를 참조)에서 설명한대로 역상 단백질 배열 (RPPA) 분석 및 분석을 수행 할 수 있습니다.
- 전기 생리 학적 측정 13
- 완전한 ND 배지 (~ 1 x 10 5 세포 / 단일 우물 MEA 칩)에서 코팅 된 다중 전극 배열 (MEAs : 표표 참조)의 로제트에서 유래 한 분리 된 로제트 조각 (7 DIV 이후) 또는 NSCs 를 플레이트 합니다.
- 완전한 ND 배지에서 3 주 동안 세포를 분화시키고,전자 매체를 일주일에 두 번.
- 분화가 끝나면 층류 후드 아래에서 반투막으로 MEA 칩을 밀봉하여 반복 측정을 위해 배양 물을 무균 상태로 유지합니다.
- 전극 중 하나를 접지 기준으로 바꾸고 나머지 전극의 기록을 허용하십시오.
- 37 ° C와 5 % CO2로 조정 된 통합 온도 공정 제어 기능이있는 MEA 증폭기를 사용하여 평균 발화 속도 (MFR, 스파이크 / 분 수)를 기록하십시오.
- 임계 한계 인 -4.7σ (σ는 기본 노이즈의 표준 편차를 나타냄)를 사용하여 MEA 원시 데이터의 피크를 감지합니다.
- 적합한 소프트웨어로 사후 기록 데이터를 처리하십시오.
결과
미분화 hiPSCs의 특성
hiPSCs의 표현형을 평가하기 위해 식민지 / 세포 형태의 분석, PSC- 특이 적 마커의 결정, 유전자 발현 및 알칼리성 인산염 활성의 검사가 수행되어야한다. 미분화 된 hiPSC는 둥글고 커다란 핵 리성과 풍부한 세포질이 없어야한다. 대부분의 콜로니는 미분화 된 표현형을 나타내는 평평하고 단단히 채워진 형태로 특징 지어 져야한다 ( 그림 2A 와 그림 2B ). 또한 콜로니의 80 % 이상이 alkaline phosphatase 활성 염색에 양성이어야한다 ( 그림 2C ).
세포의 약 80 %가 Oct4, S와 같은 고전 다 분화능 관련 마커에 양성이어야한다.SEA3, SSEA4, 및 Tra1-60 ( 도 2D-H )은 면역 세포 화학 및 유동 세포 계측법에 의해 나타내지 만, nestin + 및 β-III-Tubulin + 세포의 백분율은 상당히 낮아야한다 (각각 약 8 % 및 3 % 그림 2H 참조). 이러한 결과는 구절을 통해 재현 가능해야합니다.
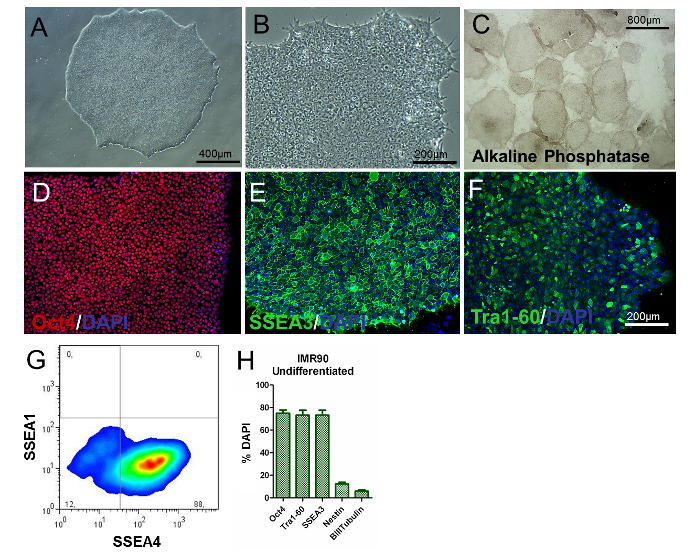
그림 2. 미분화 IMR90 - hiPSCs의 특성. (A 및 B) 미분화 된 IMR90-hiPSC 콜로니의 대표적인 위상 - 대조 이미지 (10X 및 20X 배율). (C) 알칼라인 포스파타제로 염색 된 콜로니 (4X 배율)의 대표 이미지. (DF) (D) Oct4 (적색), (E) SSEA3 (녹색) 및 (F) Tr의 대표적인 면역 세포 화학 이미지a1-60 (녹색). (G) 유동 세포 계측법으로 분석 한 SSEA1 (CD15) 및 SSEA4 염색의 대표적인 도트 플롯. (H) 막대 그래프는 Oct4 + (~ 75-80 %), Tra1-60 + (~ 75-80 %), SSEA3 + (~ 75-80 %), nestin + (~ 10-15 % ), DAPI로 대조 염색하고 HCI로 정량화 한 β-III- 튜 불린 + (~ 3 - 7 %) 세포를 SEM (참조 6에서 수정 된 그래프)으로 3 ~ 5 회의 생물학적으로 복제 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
EB 형성을 통한 pluripotency의 평가
HiPSCs는 다 능성이며 적절한 조건에서 3 개의 세균층 관련 유전자를 발현한다는 의미입니다. hiPSC의 다 분화능을 평가하기 위해 공통점접근은 자발적인 EB 형성에 기반을 두어 3 개의 세균층 형성을 유도한다. 세 포층 특이적인 유전자의 분석은 내배엽 (α-fetoprotein (AFP) 및 Cytokeratin 18 (KRT18)), 외배엽 (Nestin, SRY- 상자 1 (Sox1) 및 쌍 상자 6 (Pax6) ) 및 중배엽 (나트륨 이뇨 펩타이드 A (NPPA) 및 브라 키유리 -T) - 관련 유전자 발현 ( 도 3A 및 도 3B ); 재료 표를 참조하십시오 .
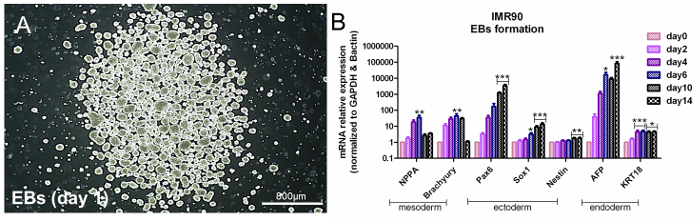
그림 3. EB 형성에 의한 다 능성의 평가. ( B) 막대 그래프는 중배엽 (NPPA 및 brachyury), 외배엽 (Pax6, Sox1 및 nestin) 및 내배엽 (AFP 및 KRT18)의 qPCR 분석을 보여줍니다. ) 유전자를 참조 유전자, β- 액틴 및 GAPDH로 정규화하고, 미분화 세포로 보정 하였다 (0 일째). 이것은 ΔΔCt 방법이며 평균 5 개의 독립적 인 분석 ± SEM * p <0.05, ** p <0.01, *** p <0.001; 그래프는 참고 자료 6에서 수정되었습니다 .이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
신경 및 신경 교세포 분화의 유도
IMR90-iPSCs는 그림 1 과 프로토콜 섹션에 요약 된 단계에 따라 사후 유사 분열 뉴런과 신경 교세포의 혼합 배양으로 분화 될 수 있습니다. 완전한 NRI 배지의 존재하에 표준 매트릭스 또는 라미닌 코팅 된 접시 위에 EB를 도금 한 후 5-8 일 후에, 로제 같은 형태의 구조물이 가시화되기 시작해야한다 (= "xfig"> 그림 4A). Rosettes은 거의 β-III- 튜 불린 + 세포 (신경 세포가 약 5 ~ 10 %)가 거의없는 nestin + 세포 (신경 전구체, ~ 90 %)의 존재를 특징으로하며, 후자는 일반적으로 주로 rosettes ( 그림 4B , 12 일째 장미).
로제리 해리 및 완전한 ND 배지의 존재하에 라미닌 - 또는 표준 매트릭스 - 코팅 된 접시 또는 플레이트 상에 재현시, 세포는 뉴런 및 번리아의 혼합 배양으로 분화를 시작하여 신경 돌기의 번들에 의해 연결된 신경 세포 몸체의 클러스터를 점차적으로 형성한다 ( 도 4C 및 4D ). 유사한 결과는 로제트 유래 NSC를 확대하여 뉴런과 신경아 교세포로 분화하여 얻은 연결 인구를 분석 할 때 얻어야한다. 로제트에서 확장 된 NSC는 n이어야합니다.estin + ( 도 4e , 네 스틴 + 세포를 나타낸 삽화).
분화 21 일 후에 세포는 β-III-tubulin에 양성이어야한다. NF200; 타우; (GFAP), 성상 세포 마커 ( 도 4G 및도 4H)에 대해 양성인 세포의 적어도 10-15 %를 갖는 수상 돌기의 후기 마커 인 MAP2 ( 도 4D , 4F 및도 4H) . 더욱이, 세포의 ~ 20-30 %는 분화 후에 네 스틴의 발현을 유지해야한다 ( 그림 4H ). 각 세포 유형 ( 즉, 뉴런, 성상 세포, 네 스틴 + 세포)의 비율이 계대를 통해 달라질 수 있으며 사용자에 따라 가변성이 관찰 될 수 있다는 점을 고려하는 것이 중요합니다.
특정 신경 subpopulations을 분석하여, GABAergic 뉴런 repre감마 - 아미노 부티르산 (GABA), 티로신 히드 록 실라 제 (TH), 및 소포 성 글루타메이트에 대한 면역 염색으로 볼 때 총 세포의 15-20 %, 도파민 성 뉴론 13-20 %, 글루탐산 작용 성 뉴런 35-42 % 트랜스포터 1 (VGlut1)을 각각 검출 하였다 ( 도 4H 의 대표적인 정량화 참조). 분화 유도는 미 분화 hiPSC 대 미 분화 세포에서 유의하게 하향 조절되어야하는 다 분화능 관련 마커 ( 예 : Oct4, Tra1-60 및 SSEA3)의 분석으로 평가할 수 있습니다 (참고 자료 6 참조). 이것은 OctPC와 Nanog의 감소와 신경 세포 접착 분자 1 (NCAM1)과 미세 소관 연합 단백질 2 (MAP2)와 같은 신경 유전자의 상향 조절을 나타내는 qPCR에 의한 유전자 발현의 분석을 통해서도 확인 될 수있다. presynaptic 유전자, synaptophysin (SYP); 및 시냅스 후 (post-synaptic) 유전자 인 미세 소관 연합 단백질 타우 (microtubule-associated protein tau, MAPT) strong class = "xfig"> 그림 4I. 또한, 도파민 성 (TH 및 NR4A1), 노르 아드레날린 성 (PHOX2A 및 PHOX2B), 글루탐산 작용 성 (NARG2, GRIA1 및 GAP43), GABA 성 (GABRA1 및 GABRA3), 모터 뉴런 (ISL1 및 LHX3) 및 콜린성 (SLC5A7 및 SLC18A13) 미분화 세포와 비교하여 상향 조절 된 신경 세포를 생성한다 ( 도 4J ).
MEA를 통한 자발적인 전기 활동 분석은 분화 된 hiPSC에서 신경 네트워크의 기능을 평가하는 데 중요한 가치가 있습니다. 분화 기간의 끝에서, 신경 유래 물은 일반적으로 최소 발화 속도 (MFR)가 적어도 60 스파이크 / 분인 것을 특징으로합니다 ( 그림 4K 의 대표 래스터 도표 참조). 그러나 파열은 관찰되지 않습니다.
55702fig4.jpg "/>
그림 4. 뉴런과 Glia의 혼합 문화로 IMR90 - hiPSCs의 분화. (A 및 B) 네 스틴 (녹색) 및 β-III- 튜 불린 (적색)에 대해 염색 된 7 DIV (A) 및 12 DIV (B) 후 로제트의 대표 이미지. (C 및 D) β-III- 튜 불린 (적색) 및 NF200 (녹색)에 대해 염색 된 22 DIV (C) 및 28 DIV (D) 후 분화 된 세포의 대표적인 이미지. (E) 로제트 해리 및 팽창으로부터 유래 된 NSC의 대표적인 이미지 (삽관은 네 스틴 + 세포, 적색을 나타낸다). (F 및 G) 신경 세포 ( F , NF200 (적색) 및 타우 (녹색)에 대해 염색) 및 신경교 세포 ( G , GFAP (적색)에 대해 염색 됨)의 대표적인 이미지는 NSC로부터 분화되었다 (21 DIV 이후). (H) Nestin, MAP2, GFAP, 감마 - 아미노 부티르산 (GABA), 소포 글루타메이트 운반체 1 (VGlutIMR90-hiPSC 유도체와 IMR90-hiPSC 유래 NSC로부터 분화 된 세포를 비교하여 HCl에 의한 티로신 히드 록 실기 (TH) - 양성 세포 (참조 7로부터 변형 된 그래프)를 얻었다. ( Oct4 및 Nanog) 및 신경 세포 (NCAM1, MAP2, SYP 및 MAPT) (I) 및 도파민 성 물질 (TH 및 NR4A1), 노르 아드레날린 성 물질 (PHOX2A 및 PHOX2B)의 qPCR 분석을 보여주는 막대 그래프. (NARG2, GRIA1 및 GAP43), GABA (GABRA1 및 GABRA3), 운동 신경 세포 (ISL1 및 LHX3) 및 콜린성 (SLC5A7 및 SLC18A13) 관련 유전자 (J) 모든 분석은 참조 유전자, β-actin 및 GAPDH에 대해 표준화되었고 미분화 세포 (녹색 막대)로 보정되었습니다. 이것은 ΔΔCt 방법이며 평균 5 개의 독립적 인 분석 ± SEM * p <0.05, ** p <0.01, *** p <0.001이다. I 및 J의 그래프는 참고 문헌 6에서 수정되었다. (K) IMR90-NSC 유래 신경의 대표 래스터 플롯(녹음은 최소 600 초 동안 수행되었으며, 수직 막대는 단일 스파이크를 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
신경 마커의 특이 적 시그니처는 분화 된 IMR90-hiPSCs에서 상향 조절됩니다
새로운 독성 시험 패러다임에서 주어진 독성 물질에 노출 된 후 세포 내에서 일어나는 분자 및 세포 사건을 정의하는 것이 필수적이다. 따라서 연구중인 세포 모델 내에서 어떤 신호 전달 경로가 활성화 및 / 또는 상향 조절되는지를 특성화하는 것이 적절하다.
단백질 키나아제 유전자 발현 분석을 위해 상업적으로 이용 가능한 어레이는 분화되지 않은 세포에 비해 미분화 된 hiPSCs를 비교하는데 사용될 수있다. 차이(GDNF) 수용체, 골 형성 단백질 (BMP) / TGF-β 경로 및 혈소판 응집 조절 인자와 같은 신경 모세포 수용체의 조절에 관여하는 유전자의 상향 조절을 받는다. 파생 성장 인자 (PDGF) 수용체 ( 그림 5A 및 그림 5B ).
RPPA의 분석은 분화 된 IMR90-hiPSCs에서 특정 신경 신호의 상향 조절을 보여줍니다. 특히, Erk / CREB, Akt / PDK1 / mTOR 및 Notch1 신호 경로는 분화시 활성화됩니다 ( 그림 5C ).
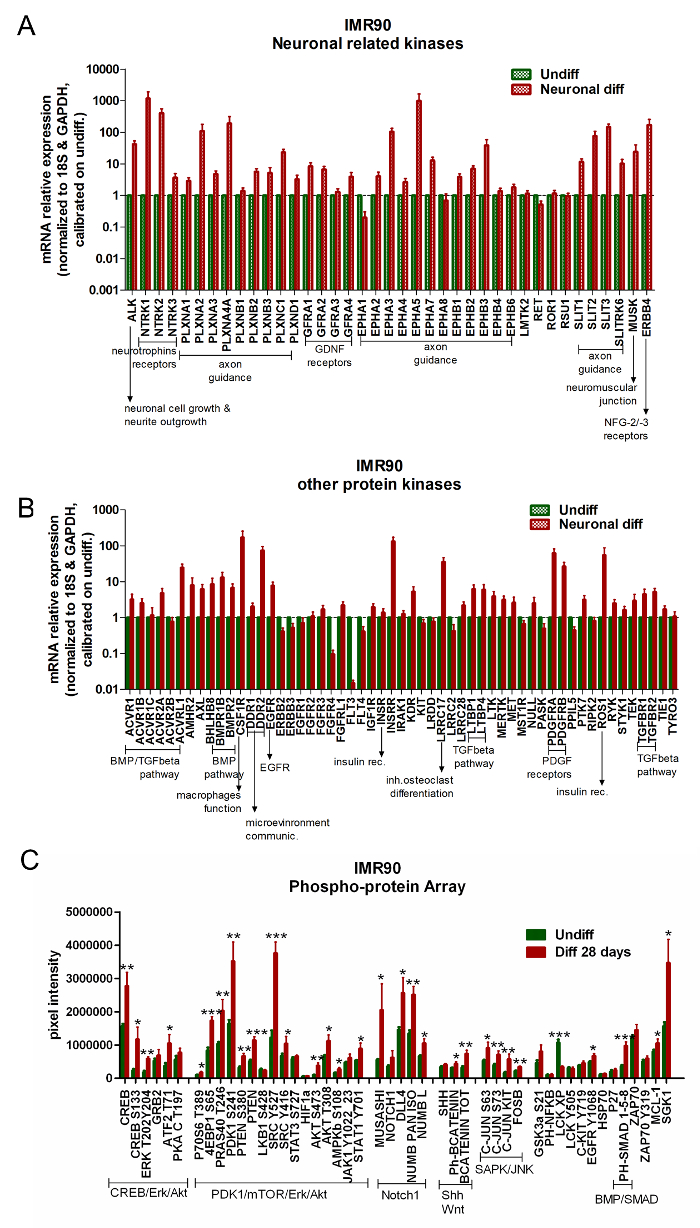
그림 5. 분화 된 신경 및 신경 세포는 뉴런 관련 경로의 활성화를 보여줍니다. (에이B) 막대 그래프는 뉴런 관련 키나아제 (A) 및 기타 키나아제 관련 유전자 (B) 의 qPCR 분석을보고합니다. 유전자 발현 데이터를 참조 유전자 18S 및 GAPDH (어레이에 제공)로 정규화하고 미분화 세포로 보정 하였다. 이러한 분석에서 유전자는 발현이 미분화 세포 (2- ΔΔCt ≥ 2)보다 적어도 2 배 이상 높았을 때 유의하게 상향 조절 된 것으로 간주되었다. 평균 3 개의 독립적 인 분석 ± SEM). (C) 막대 그래프는 RPPA 분석을 통해 분화 된 (빨간색 막대) 및 미분화 세포 (녹색 막대)를 비교하여 절대 단백질 양을 표시합니다. CREB / Erk / Akt, PDK1 / mTOR / Erk / Akt, Notch1, Shh 및 Wnt, SAPK / JNK, 및 BMP / SMAD와 같은 신호 경로 캐스케이드에 속하는 단백질은 함께 클러스터링된다. 4 개의 독립적 인 분석의 평균 ± SEM. * p <0.05, ** p <0.01, *** p <0.001; 그래프 수정 된 from 참고 자료 6. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
IMR90-hiPSC 유래 신경 세포 / 신경 교세포는로 테톤의 효과를 평가하는 데 사용할 수 있습니다
미토콘드리아 호흡 쇄의 복합체 I 억제제 인 로테 논 (Rotenone)은 Nrf2 경로의 활성화를 촉발시켜 산화 스트레스를 일으키는 것으로 알려져있다. 정지 상태에서, Nrf2는 Nrf2 유비퀴틴 화 및 단백질 분해 15를 촉진하는 Keap1 (Kelch-like ECH 관련 단백질 1)에 의해 세포질에 고정되어있다. 산화 스트레스의 유도시, Nrf2는 핵으로 전위되어 Nrf2-ARE 표적 유전자의 발현을 활성화시킨다.
IMR90-hiPSC 유래 뉴런d glial 세포는 24 시간 동안 여러 농도의 rotenone ( 예 : 1, 10 및 100 nM)에 세포를 노출시킴으로써 Nrf2 활성화에 대한 rotenone의 효과를 평가하는 데 사용할 수 있습니다. 이러한 농도는 이전의 연구 17 , 18 에 따라 확립되었다.
이러한 농도와 시간의 노출에서, 로테 논은 생 DAPI + 세포 핵의 정량화에 의해 보여지는 것처럼 세포 독성을 나타내지 않았다 ( 그림 6A ). Rotenone은 Nrf2 nuclear translocation을 유도하였으며, 특히 100nM의 rotenone에 세포를 노출시킨 후 ( 그림 6B 및 그림 6E ). 동일한 농도에서 NAD (P) H 퀴논 산화 환원 효소 1 (NQO1)과 Sulfiredoxin 1 (SRXN1)의 두 가지 Nrf2- 표적 en과 함께 세포질 Keap1의 유의 한 감소가 관찰되었다 ( 도 6C )zymes 19 , 20 ( 도 6D ).
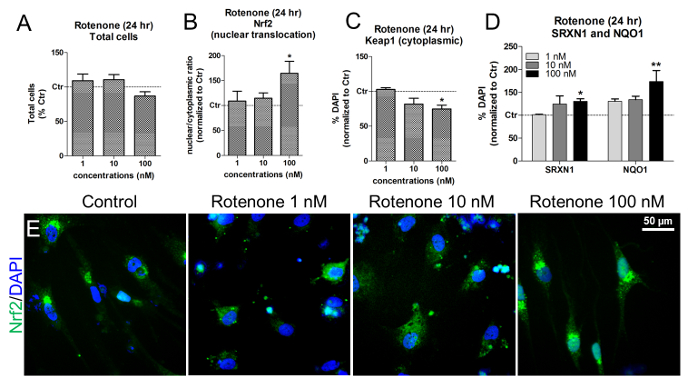
그림 6. Nrf2 핵 이식, Keap1, SRXN1 및 NQO1 단백질 수준에 대한 Rotenone의 효과. (A) 1, 10, 100 nM 로테 논으로 24 시간 처리 한 후 생존 한 DAPI + 세포 (비핵 핵)를 정량화하고 미처리 된 세포로 정상화 (대조군, Ctr). (B) 로테 논 노출 24 시간 후 Nrf2 단백질 핵 전좌 ( 즉, 핵 / 세포질 비율)를 HCI 분석을 사용하여 형광 강도를 측정하여 평가. (C) HCI 분석에 의해 평가 된 로테 논 처리시의 세포질 Keap1 단백질 수준의 정량화. (D) NAD (P) H 퀴논 산화 환원 효소 1 (NQO1)과 Sulfi(redoxin) 1 (SRXN1)을 면역 형광 및 HCI를 이용하여 24 시간 동안 투여 하였다. (E) Nrf2 단백질 지방화 (녹색)의 대표 이미지. 모든 값은 3 번의 생물학적 복제의 평균 ± SEM으로 표시됩니다. * p <0.05, ** p <0.01; 참조 번호 7에서 수정 된 그림입니다.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이러한 농도와 치료 시간에서,로 넥은 또한 NSCs (nestin + )와 뉴런 (MAP2 + )의 비율에 영향을 미치지 않고 농도 의존적으로 성상 세포 (GFAP + ) 세포 백분율을 증가시켰다 ( 그림 7A 및 그림 7B ) 7B ). 특정 신경 아형의 비율을 살펴보면, 로테 논 치료 (10 nM 및 100 nM)GABA (GABA + ) 및 글루탐산 작용 (VGlut1 + ) 뉴런의 비율은 변화하지 않는 반면 ( 도 7C 및 D ) 도파민 성 뉴런 (TH + )의 수를 현저히 감소시켰다 ( 도 7C 및 D ). 유사하게, 이전 의 생체 내 및 시험 관내 연구는 로테 논 의존성 및 선택적 도파민 성 신경 세포 죽음 21 , 22 , 23을 기술 하였다.
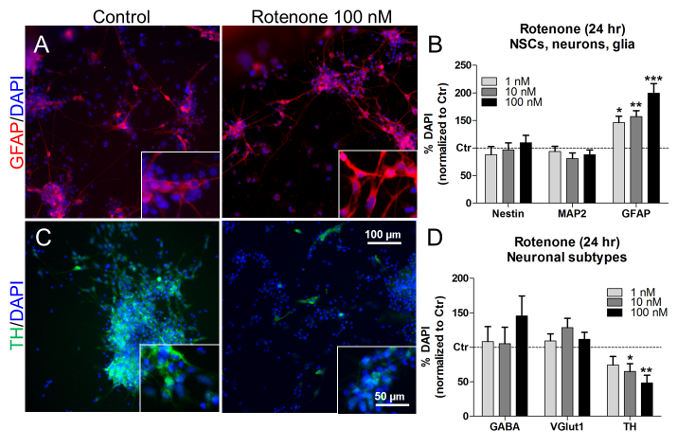
그림 7. Glial 세포와 Dopaminergic 뉴런에 대한 Rotenone의 효과. (A) 인 세트에서 40X 배율의 GFAP + 세포 (적색)의 대표 사진, 치료되지 않거나 24 시간 동안 100nM의 로톤 처리. (B) 정량화 처리되지 않은 세포로 정상화 된 nestin + , MAP2 + 및 GFAP + 세포 (대조군, Ctr) (C) 인 세트에서 40X 배율의 도파민 성 TH + 뉴런 (녹색)의 대표 사진, 치료되지 않거나 24 시간 동안 100nM의로 테톤으로 치료됨. (D) GABA + , VGlut1 + 및 TH + 신경 세포의 정량, 치료받지 않은 세포 (Ctr)로 표준화. 모든 값은 3 번의 생물학적 복제의 평균 ± SEM으로 표시됩니다. * p <0.05, ** p <0.01, *** p <0.001; 참조 번호 7에서 수정 된 그림입니다.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
통계적 유의성은 Dunnett의 Multiple Comparison Test를 사용하여 일원 분산 분석 (one-way ANOVA)으로 사후 테스트로 평가되었습니다 (모든 컬럼과 대조 컬럼 비교)xref "> 24 또는 분석 유형에 따라 양측의 쌍을 이룰 수없는 쌍 또는 쌍으로 된 t- 검정으로 나타낼 수 있습니다. 모든 데이터는 적어도 세 번의 생물학적 복제의 평균 ± 표준 오차 (SEM)를 나타냅니다. 막대 위에 별표가 표시되어 있으면 * p <0.05, ** p <0.01, *** p <0.001.
1 번 테이블.
해리 된 로제트 도금 밀도에 대한 참고 사항 : 로제트 단편이 완전히 해리 된 것처럼 보이지 않는 경우, 약 15.000 세포 / cm2의 세포 도금 밀도에 도달하기 위해, 약 50 EB / 1 x 60mm- 접시에서 유래하는 분리 된 로제트 단편을 50 mL의 완전한 NRI 배지에 넣고 다음과 같이 도금한다 (플레이트 형식에 따라 다름).
| 멀티 웰 플레이트 / MEA | 성장 면적 (cm2 / 우물) | 웰당 플레이트 현탁액의 부피 (또는 MEA 칩) | 도금 할 수있는 최대 플레이트 수 (세포 현탁액 50 ml 포함) |
| 96 개 우물 | 0.3 | 100 ul | 5 |
| 48 개의 우물 | 0.7 | 220 ul | 4 |
| 24 개 우물 | 2 | 625 ul | 삼 |
| 12 개 우물 | 4 | 1.25 ml | 삼 |
| 6 개의 우물 | 10 | 3.125 ml | 2 |
| 싱글 웰 MEA 칩 | 3.5 | 1.1 ml | 45 |
도표 2 : 합격 기준
| 마커 /항독소 | 28 DIV 후 백분율 (DAPI + (live) 세포에서) |
| B-III- 튜 불린 (Tuj1) | 35-45 % |
| MAP2 | 50-60 % |
| NF200 | 45-55 % |
| GFAP | 10-25 % |
| 네스틴 | 15-25 % |
토론
이 연구는 IMR90-hiPSC를 사후 유사 분열 뉴런 및 신경 교세포로 분화시키기위한 견고하고 비교적 빠른 프로토콜을 기술한다. hESCs와 hiPSCs를 기반으로 이전에 발표 된 신경 세포 분화 프로토콜은 일반적으로 높은 비율의 신경 전구체 25 , 26 과 상당한 숫자의 연결 대상 세포 27 , 28 , 29 , 30 , 31 , 32 , 33을 생산 합니다. 유사하게, 여기에 설명 된 분화 프로토콜은 glia와 nestin + 세포의 이산 비율과 함께 GABA 성, glutamatergic 및 dopaminergic 신경 세포의 이종 배양을 생성하는 데 적합합니다. glutamatergic (~ 35-42 %) 및 GABA (~ 15-20 %) 신경 세포의 존재는이 문화는 forebrain, 피질과 같은 기능을 보유하고 dopaminergic 뉴런 (~ 13-20 %)의 이산 번호의 존재는 또한 midbrain 특이성을 나타낼 수 있습니다. 또한, neestrogen + 세포의 겸손한 비율의 영속성은 neurogenesis의 연구와 NSC에 대한 화학 물질의 가능한 영향을 입증 할 수 있으며, NSC는 주로 해마와 뇌의 뇌실 영역 (SVZ) 모두에 국한되어있다. 추가 면역 세포 화학 및 유전자 발현 분석은 분화 된 세포 유도체의 지역 특이성을보다 잘 정의하는 데 도움이됩니다.
이 문서에서 설명하는 분화 프로토콜의 가장 중요한 두 단계는 다음과 같습니다 : (i) 균질 한 조각으로 hiPSC 콜로니를 절단하는 것 (균일 한 크기의 EB 생성에 중요합니다) 및 (ii) 신경 외배엽 구조 절단 ) NSC 차별화에는 상당한 수작업 기술이 필요합니다.분화시 얻은 뉴런 및 신경 교세포의 비율을 감소시킬 수있는 중배엽 및 내배엽 세포를 수집하는 것을 피하기위한 정밀성을 제공한다.
팽창하는 동안 (미분화 된 식민지 또는 NSCs와 같은) 모든 분화 단계에서 세포의 표현형을 특성화하는 것이 중요합니다. 특히, 신경 세포 / 신경 교세포 유도체의 유전자 및 단백질 발현 프로파일은 뉴런 관련 신호 경로의 상향 조절 및 활성화를 보여야하지만, 다 능성 마커의 발현은 감소되어야한다.
EBs와 neuroectodermal 유도체 (rosettes)의 생성은 수동으로 도전하고 가변성이 있습니다. 이러한 이유로 우리는 로제트 유도 NSC의 확장 및 신경 세포 / 신경 교세포로의 추가 분화를위한 프로토콜을 개발했습니다.
이 분화 프로토콜의 가능한 한계는 주로 (i) 상대적으로 낮은 비율의 d(ii) 성숙한 신경 네트워크 기능의 결핍 (파열의 부족으로 나타남)과 관련이있다. 또한, 성상 세포의 특정 subpopulations은 기본 progenitors 또는 NSCs 35 로 기능 할 수 있습니다. 이 분화 된 세포 배양에서 nestin / GFAP 이중 양성 세포가 관찰되지 않았지만 (데이터는 표시되지 않음), 이러한 혼합 배양 물에서 GFAP + 세포는 성상 세포 전구 세포 및 성상 세포 인 것으로 가정합니다. 분화 시간을 연장함으로써 성 장군의 숫자가 증가하고 그 형태가보다 성숙해질 가능성이있다 (Zhang의 36 , 37) .
새로운 독성 시험 패러다임에서는 화학적 역경을 평가할 때 생물학적 경로의 화학적 섭동에 대한 지식이 가장 중요합니다. 따라서 체외 시험 시스템은불리한 결과 경로 (AOP)의 개념에 따라 신호 경로의 교란에 부작용을 연관시킨다. 개념 증명으로 로테 논은 Nrf2 경로의 활성화를 평가하는 데 사용할 수 있습니다.이 경로는 산화성 또는 친 전자 성 스트레스에 대한 세포 방어에 관여합니다. 38 산화 스트레스는 다음과 관련된 다양한 AOP에서 중요하고 공통적 인 핵심 이벤트입니다. 발달 및 성충 신경 독성 39 .
로 테논은 Nrf2 단백질의 핵 전좌와 NQO1과 SRXN1을 포함한 Nrf2 표적 효소의 발현 증가에 의해 증명 될 수있는 Nrf2 경로의 활성화를 이끌어 내야한다. 로테 논은 성상 세포 활성화 40 , 41 을 나타내는 GFAP 단백질 수준의 용량 의존적 인 증가를 유도한다는 것이 밝혀졌습니다. Rotenone은 또한 dopaminergic (TH + ) 세포의 수를 감소 시키며, 이는 previ와 일치한다이 유형의 뉴런은 특히 산화 적 스트레스에 민감하기 때문에, 로테 논 의존성 도파민 성 세포 사멸을 보여주는 시험관 내 및 생체 내 연구 21 , 22 , 23 .
결론적으로이 hiPSC 유래 신경 세포 및 신경교 세포 배양 모델은 Nrf2 경로 활성화를 초래하는 산화 스트레스를 유발하는 화학 물질의 신경 독성 효과를 평가하는 데 유용한 도구입니다. 이 분화 프로토콜은 신경 세포 (GABA 성, 도파민 성 및 글루탐산 작용 성 뉴런) 및 성상 교세포의 혼합 배양 물의 생성을 허용하기 때문에 신경 퇴행성 질환과 같은 생리적 및 병리학 적 조건에서 뉴런과 글 리아 사이의 크로스 토크를 연구하는 데 적합 할 수 있습니다 예 : 파킨슨 병). 또한 상당량의 NSC가 존재하면 신경계에 화학 물질이 미치는 영향을 평가하는 데 도움이 될 수 있습니다화학적으로 유도 된 돌연변이 또는 바이러스 감염의 주요 표적이 될 수있는 것으로 알려져있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 IMR90-hiPSC를 제공 한 Dr. Marc Peschanski (I-Stem, 프랑스, 에리)에게 감사 드리고 싶습니다. Dr. Giovanna Lazzari와 Dr. Silvia Colleoni (Avantea srl, Cremona, Italy); Dr. Simone Haupt (독일 본 (Bonn) 대학교); Tiziana Santini 박사 (이탈리아 기술 연구소, 로마), 면역 형광 염색 평가에 대한 조언 제공. RPPA 분석 및 항체 검증에 대한 공헌으로 Benedetta Accordi 박사, Elena Rampazzo 박사 및 Luca Persano 박사 (University of Padua, 이탈리아) 자금 조달 :이 작업은 EU가 지원하는 "SCR & Tox"프로젝트 (보조금 협약 N ° 266753)에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Complete hiPSC medium: | |||
| mTeSR1 Basal Medium | Stem Cell Technologies | 05851 | (Step 1.2.6). Complete mTeSR1 is stable when stored at 2 - 8°C for up to 2 weeks. 5X Supplements can be dispensed into working aliquots and stored at -20°C. Use frozen aliquots within 3 months. |
| mTeSR1 5X Supplements | Stem Cell Technologies | 05852 | |
| Matrigel hESC-qualified Matrix | Corning | 354277 | 1:100 (Step 1.1). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200ul aliquot in 20 ml of DMEM/F12 medium. |
| CryoStem Freezing Medium | Stemgent | 01-0013-50 | Freeze ~ 100 fragments/250 ul/vial (Step 1.2.1) |
| Name | Company | Catalog Number | Comments |
| hiPSC EB medium: | |||
| Knockout DMEM | Thermo-Fisher | 10829-018 | (Step 2.1.7) |
| Knockout Serum Replacement (KOSR) | Thermo-Fisher | 10828-028 | 20% final concentration (Step 2.1.7) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.1.7) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.1.7) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 2.1.7) |
| β-Mercaptoethanol | Thermo-Fisher | 31350-010 | 50 µM final concentration (Step 2.1.7) |
| Name | Company | Catalog Number | Comments |
| Complete neuroepithelial induction medium (NRI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 2.3.1) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.3.1) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.3.1) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.3.1) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 2.3.1) |
| bFGF | Thermo-Fisher | 13256-029 | 20 ng/ml final concentration added before use (Step 2.3.1) |
| Matrigel Basement Membrane Matrix | Corning | 354234 | 1:100 (Step 2.2). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200 ul aliquot in 20 ml of cold DMEM/F12 medium. |
| Laminin | Sigma-Aldrich | L2020 | 1:100 (Step 2.2). Dilute in PBS 1X. |
| Name | Company | Catalog Number | Comments |
| Complete Neuronal Differentiation medium (ND): | |||
| Neurobasal Medium | Thermo-Fisher | 21103049 | (Step 2.4.11) |
| B-27 Supplements (50x) | Thermo-Fisher | 17504044 | (Step 2.4.11) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.4.11) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.4.11) |
| GDNF | Thermo-Fisher | PHC7045 | 1 ng/ml final concentration. Added before use. (Step 2.4.11) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use. (Step 2.4.11) |
| Name | Company | Catalog Number | Comments |
| Neural induction medium (NI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 3.3) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 3.3) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 3.3) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 3.3) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 3.3) |
| B-27 Supplement (50X), minus vitamin A | Thermo-Fisher | 12587010 | (Step 3.3) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 3.3) |
| bFGF | Thermo-Fisher | 13256-029 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| EGF | Thermo-Fisher | PHG6045 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use (Step 3.3) |
| Defined Trypsin Inhibitor (DTI) | Thermo-Fisher | R007-100 | Pre-warm at 37°C. Add an equal amount of DTI to Trypsin-EDTA (Step 3.10) |
| Trypsin-EDTA (0.5%), no phenol red | Thermo-Fisher | 15400054 | 1:10. Dilute Trypsin-EDTA in PBS 1x (without calcium and magnesium), pre-warm the solution at 37°C (Step 3.8) |
| CryoStor cell cryopreservation medium | Sigma-Aldrich | C2874-100ML | (Step 4.2) |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| Name | Company | Catalog Number | Comments |
| TaqMan Probesets and reagents for gene expression analysis: | |||
| RNAqueous-Micro kit | Thermo-Fisher | AM1931 | (Step 5.1.6) |
| High Capacity cDNA Reverse Transcription Kits | Thermo-Fisher | 4368814 | |
| TaqMan Gene Expression Master Mix | Thermo-Fisher | 4369016 | |
| GFAP | Thermo-Fisher | Hs00909233_m1 | |
| MAP2 | Thermo-Fisher | Hs00258900_m1 | |
| NQO1 | Thermo-Fisher | Hs02512143_s1 | |
| SRXN1 | Thermo-Fisher | Hs00607800_m1 | |
| HMOX1 | Thermo-Fisher | Hs01110250_m1 | |
| GSR | Thermo-Fisher | Hs00167317_m1 | |
| PAX6 | Thermo-Fisher | Hs01088112_m1 | |
| NES | Thermo-Fisher | Hs00707120_s1 | |
| GRIA1 | Thermo-Fisher | Hs00181348_m1 | |
| GAP43 | Thermo-Fisher | Hs00967138_m1 | |
| GABRA3 | Thermo-Fisher | Hs00968132_m1 | |
| GABRA1 | Thermo-Fisher | Hs00168058_m1 | |
| NR4A2 | Thermo-Fisher | Hs00428691_m1 | |
| TH | Thermo-Fisher | Hs00165941_m1 | |
| GAPDH | Thermo-Fisher | Hs02758991_g1 | |
| ACTB | Thermo-Fisher | Hs99999903_m1 | |
| MAPT | Thermo-Fisher | Hs00902194_m1 | |
| SYP | Thermo-Fisher | Hs00300531_m1 | |
| NANOG | Thermo-Fisher | Hs04260366_g1 | |
| POU5F1 (OCT4) | Thermo-Fisher | Hs04195369_s1 | |
| SOX1 | Thermo-Fisher | Hs01057642_s1 | |
| AFP | Thermo-Fisher | Hs00173490_m1 | |
| KRT18 | Thermo-Fisher | Hs01941416_g1 | |
| NPPA | Thermo-Fisher | Hs00383230_g1 | |
| T | Thermo-Fisher | Hs00610080_m1 | |
| NCAM1 | Thermo-Fisher | Hs00941821_m1 | |
| NR4A1 | Thermo-Fisher | Hs00374226_m1 | |
| PHOX2A | Thermo-Fisher | Hs00605931_mH | |
| PHOX2B | Thermo-Fisher | Hs00243679_m1 | |
| NARG2 | Thermo-Fisher | Hs00973298_g1 | |
| SLC18A3 | Thermo-Fisher | Hs00268179_s1 | |
| SLC5A7 | Thermo-Fisher | Hs00222367_m1 | |
| ISL1 | Thermo-Fisher | Hs00158126_m1 | |
| LHX3 | Thermo-Fisher | Hs01033412_m1 | |
| TaqMan Human Protein Kinase Array | Thermo-Fisher | 4418721 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and reagents for immunostaining: | |||
| B-III-tubulin (Tuj1) | Covance | MMS-435P | 1:500 (Step 5.2.5). Other antibodies may also be used. |
| MAP2 | Sigma Aldrich | M4403 | 1:500 |
| NF200 | Sigma Aldrich | N4142 | 1:1000 |
| GFAP | Acris Antibodies GmbH | AP02002SU-N | 1:500 |
| Nestin | Sigma-Aldrich | N5413 | 1:200 |
| synaptophysin (SYN) | Abcam | AB14692 | 1:200 |
| Tau | Thermo-Fisher | MA5-12808 | 1:100 |
| Nrf2 | Abcam | AB62352 | 1:200 |
| Keap1 | Abcam | AB66620 | 1:200 |
| sulfiredoxin1 (SRXN1) | Abcam | AB92298 | 1:200 |
| NAD(P)H quinone oxidoreductase 1 (NQO1) | Abcam | AB2346 | 1:200 |
| OCT4 | Millipore | MAB4401 | 1:100 |
| SSEA3 | Millipore | MAB4303 | 1:100 |
| Tra1-60 | Millipore | MAB4360 | 1:250 |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | 1:200 |
| Gamma-aminobutyric acid (GABA) | Sigma-Aldrich | A0310 | 1:100 |
| Vesicular glutamate transporter 1 (VGlut1) | Abcam | AB72311 | 1:500 |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | 4% (4% formaldehyde can also be used) |
| DPBS, no calcium, no magnesium | Thermo-Fisher | 14190144 | |
| Triton-X-100 Solution | Sigma-Aldrich | 93443-100ML | 0.1% |
| BSA 35% | Sigma-Aldrich | A7979-50ML | 3.5% |
| Donkey anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 594 conjugate | Thermo-Fisher | SA5-10040 | 1:500. (Step 5.2.7) Other fluorochrome-conjugated secondary antibodies may also be used. In this case, appropriate dilutions should be tested by the enduser. |
| Donkey anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10166 | 1:500 |
| Donkey anti-Goat IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10086 | 1:500 |
| DAPI Solution (1 mg/ml) | Thermo-Fisher | 62248 | 1:1000 (Step 5.2.7) |
| Name | Company | Catalog Number | Comments |
| Antibodies for Reverse Phase Protein Array (RPPA): | |||
| 4E-BP1 (S65) | Abcam | AB81297 | 1:250 (Note after step 5.2.8) |
| Akt (T308) | Cell Signaling | 9275 | 1:100 |
| Akt (S473) | Cell Signaling | 9271 | 1:100 |
| AMPKalpha (T172) | Cell Signaling | 2531 | 1:100 |
| AMPKbeta1 (S108) | Cell Signaling | 4181 | 1:100 |
| ATF-2 (T71) | Cell Signaling | 9221 | 1:100 |
| c-Jun (S63) | Cell Signaling | 9261 | 1:200 |
| c-Jun (S73) | Cell Signaling | 9164 | 1:200 |
| c-Kit (Y719) | Cell Signaling | 3391 | 1:250 |
| CREB (S133) | Cell Signaling | 9191 | 1:100 |
| EGFR (Y1068) | Cell Signaling | 2234 | 1:50 |
| ErbB2/HER2 (Y1248) | Cell Signaling | 2247 | 1:100 |
| ERK 1/2, p44/42 (T202/Y204) | Cell Signaling | 9101 | 1:2000 |
| GSK-3alpha (S21) | Cell Signaling | 9337 | 1:50 |
| Jak1 (Y1022/1023) | Cell Signaling | 3331 | 1:100 |
| Lck (Y505) | Cell Signaling | 2751 | 1:500 |
| LKB1 (S428) | Cell Signaling | 3051 | 1:100 |
| mTOR (S2448) | Cell Signaling | 5536 | 1:100 |
| NFkB p65 (S536) | Cell Signaling | 3031 | 1:50 |
| p70 S6 Kinase (T389) | Cell Signaling | 9205 | 1:200 |
| PDK1 (S241) | Cell Signaling | 3061 | 1:100 |
| PKA C (T197) | Cell Signaling | 4781 | 1:250 |
| PRAS40 (T246) | BioSource | 44-1100 | 1:2000 |
| PTEN (S380) | Cell Signaling | 9551 | 1:500 |
| Smad1 (S463/465), Smad5 (S463/465), Smad8 (S426/428) | Cell Signaling | 9511 | 1:500 |
| Src (Y527) | Cell Signaling | 2105 | 1:500 |
| Src Family (Y416) | Cell Signaling | 2101 | 1:200 |
| Stat1 (Y701) | Cell Signaling | 9171 | 1:200 |
| Stat3 (S727) | Cell Signaling | 9134 | 1:200 |
| Zap-70 (Y319) | Enogene | E011159 | 1:100 |
| βCatenin (S33/37/T41) | Cell Signaling | 9561 | 1:250 |
| CREB | Upstate Biotechnologies | 06-863 | 1:100 |
| Fos B | Cell Signaling | 2251 | 1:200 |
| GRB2 | Cell Signaling | 3972 | 1:2000 |
| HSP70 | Stressgen | SPA-810 | 1:100 |
| c-Jun | Cell Signaling | 9165 | 1:100 |
| Kip1/p27 | BD | 610241 | 1:100 |
| Lck | Cell Signaling | 2984 | 1:250 |
| Mcl-1 | Cell Signaling | 4572 | 1:80 |
| Musashi | Cell Signaling | 2154 | 1:100 |
| NOTCH1 | Cell Signaling | 3439 | 1:100 |
| PTEN | Cell Signaling | 9552 | 1:500 |
| SGK1 | Abnova | PAB4590 | 1:250 |
| Zap-70 | Cell Signaling | 2705 | 1:250 |
| β-Catenin | Abcam | AB32572 | 1:1000 |
| Dll4 | Abcam | AB7280 | 1:500 |
| Shh | Abcam | AB53281 | 1:250 |
| HIF-1α | BD | 610958 | 1:50 |
| NUMB PAN-ISO | Upstate Biotechnologies | 07-207 | 1:400 |
| NUMB-L | Chemicon | AB15145 | 1:750 |
| Cyclin B | BD | 610220 | 1:75 |
| c-Myc | Calbiochem | OP-10 | 1:100 |
| BCIP/NBT Kit | Thermo-Fisher | 002209 | (Note after step 5.2.8). Kit used to measure alkaline phosphatase activity, similar kits can be used. |
| Name | Company | Catalog Number | Comments |
| Antibodies for Flow Cytometry: | |||
| SSEA1 Antibody, Pacific Blue conjugate | Thermo-Fisher | MHCD1528 | 1:100 (Note after step 5.2.8) |
| SSEA4 Antibody (MC813-70), Alexa Fluor 647 | Thermo-Fisher | SSEA421 | 1:100 |
| Name | Company | Catalog number | Comments |
| Specific instruments, tools and softwares: | |||
| Countess Automated Cell Counter | Thermo-Fisher | C10227 | Neubauer chamber or other suitable glass hemocytometer can be used. |
| MEA1060-Inv-BC | Multichannel Systems | MEA1060-Inv-BC | (Step 5.3) |
| MEA1060-BC control software | Multichannel Systems | MEA1060-BC | (Step 5.3) |
| NeuroExplorer | Multichannel Systems | NeuroExplorer (NE) | (Step 5.3) For post-processing of MEA data |
| Multielectrode arrays (MEA) | Multichannel Systems | 60MEA100/10iR-Ti-gr | (Step 5.3) Single-well MEA chip |
| ArrayScan XTI High Content Platform | Thermo-Fisher | ASN00002P | (Step 5.2.8) Mean fluorescence can be quantified by using specific ArrayScan algorithms (e.g., Cytotoxicity V.4 and NucTrans V.4 bioapplications). It is recommended to take minimum 20 pictures/well, and have 7-8 internal replicates per condition |
| 7900HT Fast Real-Time PCR System | Thermo-Fisher | 4351405 | (Step 5.1.6) |
| BD ULTRA-FINE Needle Insulin Syringe (with 30G needle) | BD | 328280 | (Steps 1.3.1, 2.1.2, and 2.4.1) |
| StemPro EZPassage Disposable Stem Cell Passaging Tool | ThermoFisher | 23181010 | This colony cutting tool can be used as an alternative to the use of 30G needle 1 mL syringes (Step 1.3.1) |
| Ultra-Low attachment Petri dish (60 mm) | Corning | 10010582 | (Step 2.1.8) Also other brands can be used. |
| Mr. Frosty Freezing container | Sigma-Aldrich | C1562-1EA | |
참고문헌
- NRC. . Toxicity Testing in the 21st Century: A Vision and a Strategy. , (2007).
- Drews, K., Jozefczuk, J., Prigione, A., Adjaye, J. Human induced pluripotent stem cells--from mechanisms to clinical applications. J Mol Med (Berl). 90 (7), 735-745 (2012).
- Ho, P. J., Yen, M. L., Yet, S. F., Yen, B. L. Current applications of human pluripotent stem cells: possibilities and challenges. Cell Transplant. 21 (5), 801-814 (2012).
- Krueger, W. H., Swanson, L. C., Tanasijevic, B., Rasmussen, T. P. Natural and artificial routes to pluripotency. Int J Dev Biol. 54 (11-12), 1545-1564 (2010).
- Pistollato, F., Bremer-Hoffmann, S., Healy, L., Young, L., Stacey, G. Standardization of pluripotent stem cell cultures for toxicity testing. Expert Opin Drug Metab Toxicol. 8 (2), 239-257 (2012).
- Pistollato, F., et al. Development of a pluripotent stem cell derived neuronal model to identify chemically induced pathway perturbations in relation to neurotoxicity: effects of CREB pathway inhibition. Toxicol Appl Pharmacol. 280 (2), 378-388 (2014).
- Zagoura, D., Canovas-Jorda, D., Pistollato, F., Bremer-Hoffmann, S., Bal-Price, A. Evaluation of the rotenone-induced activation of the Nrf2 pathway in a neuronal model derived from human induced pluripotent stem cells. Neurochem Int. , (2016).
- Standard operating procedure for differentiation of human induced pluripotent stem cells into post-mitotic neurons and glial cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-differentiation-of-human-induced-pluripotent-stem-cells-into-post-mitotic-neurons-and-glial-cells-%28mixed-culture%29-protocol-no.-165/key/p_1570 (2016)
- Standard operating procedure for expansion of rosette-derived neural stem cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-expansion-of-rosette-derived-neural-stem-cells-protocol-no.-166/key/p_1571 (2016)
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Brien, P. J., et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening. Arch Toxicol. 80 (9), 580-604 (2006).
- Accordi, B., et al. Functional protein network activation mapping reveals new potential molecular drug targets for poor prognosis pediatric BCP-ALL. PLoS One. 5 (10), e13552 (2010).
- Vassallo, A., et al. A multi-laboratory evaluation of microelectrode array-based measurements of neural network activity for acute neurotoxicity testing. Neurotoxicology. , (2016).
- Shamblott, M. J., et al. Human embryonic germ cell derivatives express a broad range of developmentally distinct markers and proliferate extensively in vitro. Proc Natl Acad Sci U S A. 98 (1), 113-118 (2001).
- Bryan, H. K., Olayanju, A., Goldring, C. E., Park, B. K. The Nrf2 cell defence pathway: Keap1-dependent and -independent mechanisms of regulation. Biochem Pharmacol. 85 (6), 705-717 (2013).
- Tufekci, K. U., Civi Bayin, E., Genc, S., Genc, K. The Nrf2/ARE Pathway: A Promising Target to Counteract Mitochondrial Dysfunction in Parkinson's Disease. Parkinsons Dis. , 314082 (2011).
- Kovac, S., et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase. Biochim Biophys Acta. 1850 (4), 794-801 (2015).
- Lee, J. M., Shih, A. Y., Murphy, T. H., Johnson, J. A. NF-E2-related factor-2 mediates neuroprotection against mitochondrial complex I inhibitors and increased concentrations of intracellular calcium in primary cortical neurons. J Biol Chem. 278 (39), 37948-37956 (2003).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236 (2), 313-322 (1997).
- Li, L., et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling. Chem Biol Interact. , 56-67 (2014).
- Cannon, J. R., et al. A highly reproducible rotenone model of Parkinson's disease. Neurobiol Dis. 34 (2), 279-290 (2009).
- Sherer, T. B., Kim, J. H., Betarbet, R., Greenamyre, J. T. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation. Exp Neurol. 179 (1), 9-16 (2003).
- Testa, C. M., Sherer, T. B., Greenamyre, J. T. Rotenone induces oxidative stress and dopaminergic neuron damage in organotypic substantia nigra cultures. Brain Res Mol Brain Res. 134 (1), 109-118 (2005).
- Zhou, J., et al. High-efficiency induction of neural conversion in human ESCs and human induced pluripotent stem cells with a single chemical inhibitor of transforming growth factor beta superfamily receptors. Stem Cells. 28 (10), 1741-1750 (2010).
- Topol, A., Tran, N. N., Brennand, K. J. A Guide to Generating and Using hiPSC Derived NPCs for the Study of Neurological Diseases. J Vis Exp. (96), e52495 (2015).
- Jiang, Y., Zhang, M. J., Hu, B. Y. Specification of functional neurons and glia from human pluripotent stem cells. Protein Cell. 3 (11), 818-825 (2012).
- Parsons, X. H., et al. Efficient derivation of human neuronal progenitors and neurons from pluripotent human embryonic stem cells with small molecule induction. J Vis Exp. (56), e3273 (2011).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7 (10), 1836-1846 (2012).
- Zeng, H., et al. Specification of region-specific neurons including forebrain glutamatergic neurons from human induced pluripotent stem cells. PLoS One. 5 (7), e11853 (2010).
- Zeng, X., et al. An in vitro model of human dopaminergic neurons derived from embryonic stem cells: MPP+ toxicity and GDNF neuroprotection. Neuropsychopharmacology. 31 (12), 2708-2715 (2006).
- Paşca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12 (7), 671-678 (2015).
- Almeida, S., et al. Modeling key pathological features of frontotemporal dementia with C9ORF72 repeat expansion in iPSC-derived human neurons. Acta Neuropathol. 126 (3), 385-399 (2013).
- Urbán, N., Guillemot, F. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front Cell Neurosci. 8, 396 (2014).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. J., Zhang, S. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nat Biotechnol. 29 (6), 528-534 (2011).
- Krencik, R., Zhang, S. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nat Protoc. 6 (11), 1710-1717 (2011).
- Nguyen, T., Nioi, P., Pickett, C. B. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress. J Biol Chem. 284 (20), 13291-13295 (2009).
- Bal-Price, A., et al. Putative adverse outcome pathways relevant to neurotoxicity. Crit Rev Toxicol. 45 (1), 83-91 (2015).
- Cabezas, R., El-Bacha, R. S., Gonzalez, J., Barreto, G. E. Mitochondrial functions in astrocytes: neuroprotective implications from oxidative damage by rotenone. Neurosci Res. 74 (2), 80-90 (2012).
- Swarnkar, S., et al. Astrocyte activation: a key step in rotenone induced cytotoxicity and DNA damage. Neurochem Res. 37 (10), 2178-2189 (2012).
- Canovas-Jorda, D., Louisse, J., Pistollato, F., Zagoura, D., Bremer, S. Regenerative toxicology: the role of stem cells in the development of chronic toxicities. Expert Opin Drug Metab Toxicol. 10 (1), 39-55 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유