Method Article
Protocol עבור הבחנה של תאים גזעיים Pluripotent Indoced האדם לתוך תרבויות מעורבות של נוירונים וגליה עבור בדיקה נוירוטוקסיות
In This Article
Summary
האדם המושרה בתאי גזע pluripotent (hiPSCs) נחשבים כלי רב עוצמה עבור סריקה וכימיים ההקרנה ופיתוח של מודלים חדשים במבחנה לבדיקת רעילות, כולל נוירוטוקסיטי. הנה, פרוטוקול מפורט עבור ההבחנה של hiPSCs לתוך נוירונים וגליה מתואר.
Abstract
האדם בתאי גזע pluripotent יכול להבדיל סוגים שונים של תאים שניתן ליישם את האדם מבוסס מבחני רעילות מבחנה . אחד היתרונות העיקריים הוא שתכנות מחדש של תאים סומטיים לייצר תאי גזע פלוריפוטנטיים המושרשים על ידי האדם (hiPSCs) נמנעים מהנושאים האתיים והחקיקתיים הנוגעים לשימוש בתאי גזע עובריים אנושיים (hESC). HiPSCs ניתן להרחיב ו הבדיל ביעילות לסוגים שונים של תאים עצביים ותאי גלייה, המשמשים מערכות בדיקה לבדיקת רעילות, בפרט, לצורך הערכת מסלולים שונים המעורבים neurotoxicity. עבודה זו מתארת פרוטוקול ההבחנה של hiPSCs לתוך תרבויות מעורבות של תאים עצביים ותאי גלייה. מסלולי האיתות המווסתים ו / או מופעלים על ידי הבחנה נוירונים מוגדרים. מידע זה הוא קריטי ליישום המודל התא כדי פרדיגמה חדשה בדיקת רעילות, שבו כימיקלים מוערכים על בסיס יכולתם peRturb מסלולים ביולוגיים. כהוכחה לקונספט, rotenone, מעכב של מיטוכונדריה מורכבת I, שימש כדי להעריך את ההפעלה של נתיב איתות Nrf2, רגולטור מפתח של מנגנון נוגד חמצון תגובה אלמנט - (ARE) מונע מנגנון הגנה הסלולר נגד מתח חמצוני .
Introduction
המועצה הלאומית למחקר של ארה"ב דו"ח 1 חזה חדש בדיקת רעילות פרדיגמה שבה בדיקות רעילות רגולטורית יועברו מתוך גישה להסתמך על שינויים פנוטיפי שנצפה בבעלי חיים לגישה המתמקדת מבחני מבחנה מכניסטית באמצעות תאים אנושיים. נגזרות של תאי גזע Pluripotent (PSC) עשויות לייצג חלופות למודלי תאים סרטניים, שכן התאים המתקבלים עשויים להיות דומים יותר לתנאים הפיזיולוגיים של רקמות האדם ולספק כלים רלוונטיים יותר לחקר השפעות שליליות הנגרמות על ידי כימי. שני סוגים עיקריים של תרבויות PSC כי הם המבטיחים ביותר לבדיקת רעילות הם תאי גזע עובריים אנושיים (hESCs) ו האדם המושרה בתאי גזע pluripotent (hiPSCs), אשר נמצאים בשימוש נרחב בתחומי מחקר בסיסי רפואה משובי 2 , 3 . מומחיות זו יכולה כעת להיות רתום לפיתוח של סוג חדש של toxicoloGical במבחנה בדיקות שמטרתן לזהות את המסלולים הפיזיולוגיים מוטרד מעורב עם התפתחות של תופעות לוואי in vivo . עם זאת, שיטות בדיקה עבור הערכות בטיחות רגולטורית המבוססת על hESCs יהיה סביר להתקבל על ידי כל המדינות החברות באיחוד האירופי ועל ידי מדינות ברחבי העולם בשל חששות אתיים אפשריים ומדיניות החקיקה הלאומית מגוונים המסדיר את השימוש בתאים הנגזרים העובר.
HiPSCs לשתף מאפיינים דומים hESCs 4 , 5 ו להחזיק פוטנציאל גדול לשיטות חוץ גופית , הן לזיהוי מטרות טיפוליות, כמו גם עבור הערכות בטיחות. בנוסף, הטכנולוגיה hiPSC מפחית את האילוצים של מאגר התורם מוגבל ואת החששות האתיים הקשורים תאים הנגזרות העובר. האתגר העיקרי עבור hiPSCs היא ההוכחה כי תאים אלה יכולים reproducibly ליצור מגוון משמעותי של נגזרות תאים הרלוונטיים מבחינה רעילה,עם מאפיינים ותגובות אופייניות לרקמות אנושיות. רמות מוגדרות מראש של סמנים נבחרים משמשים בדרך כלל לאפיון אוכלוסיות תאים לאחר תהליך ההבחנה ולספק תובנות לגבי היציבות של תהליך ההבחנה.
עבודות קודמות העריכו התאמה של hiPSCs ליצירת תרבויות מעורבות של תאים עצביים ותאי גלייה, ולהעריך את ההשפעות של רוטנון, מעכב של המורכבות הנשימתיות המיטוכונדריאליות I, בהפעלת נתיב Nrf2, וסת רגולציה של מנגנוני הגנה נוגדי חמצון סוגי תאים רבים 6 , 7 .
עבודה זו מתארת פרוטוקול המשמש להבחנה של hiPSCs לתוך תרבויות מעורבות נוירונים וגליאלי, מתן פרטים על מסלולי איתות (רמת גן וחלבון) המופעלים על בידול נוירוני / גליאלי. בנוסף, העבודה מראה נציג תוצאות המדגים כיצד זהHiPSC הנגזרות תאים תאיים נוירונים ותאי גלייה ניתן להשתמש כדי להעריך Nrf2 הפעלת איתות המושרה על ידי טיפול אקוטי (24 שעות) עם rotenone, המאפשר הערכה של אינדוקציה מתח חמצוני.
IMR90 fibroblasts היו מתוכנתים לתוך hiPSCs ב I-Stem (צרפת) על ידי התמרה ויראלי של 2 גורמי שעתוק (Oct4 ו Sox2) באמצעות וקטורים pMIG 6 . מודלים hiPSC אנלוגי יכול להיות מיושם גם. הפרוטוקולים המתוארים להלן מסכמים את כל השלבים של ההבחנה בין hiPSCs לתאי גזע עצביים (NSCs) ובין תרבויות מעורבות של נוירונים פוסט-מיטוטיים ותאי גלייה (שלבים 1 ו -2, ראו גם את האתר של EURL ECVAM DBALM לתיאור מפורט של הפרוטוקול) 8 .
פרוטוקול נוסף לבידוד, הרחבה, cryopreservation, והבחנה נוספת של NSCs לתוך נוירונים מעורבים ותאי גלייה מפורטת בשלבים 3 ו 4 (גם מתייחסים EURL ECVAM DBALM אנחנוBsite לתיאור מפורט של פרוטוקול זה) 9 . שלב 5 מתאר את הניתוחים שניתן לעשות כדי להעריך את הזהות פנוטיפי של התאים במהלך שלבים שונים של מחויבות בידול.
Protocol
1. הרחבת תאי גזע פלוריפוטנטיים (hiPSC)
הערה: hiPSCs יכול להיות מתורבת על מצע תערובת חלבון מתאים בנוכחות mTeSR1 בינוני המכיל mTeSR1 5x ספקים (מוכן בעקבות הוראות היצרן, צלחת ~ 100 שברי מושבה / צלחת פטרי 60 מ"מ). כאשר מושבות hiPSC להגיע לגודל המתאים (ראה דוגמה המושבה באיור 2A ), להעביר את התאים כמתואר להלן (פעם בשבוע).
- כלי מעיל עם מטריצת קרום במיקרון מרתק hESC (להלן "מטריקס מוסמך") או כל מצע חלבונים מתאים אחר.
- חנות מטריקס מוסמך (ראה טבלה של חומרים ) ב -80 מעלות צלזיוס ב 200-μL aliquots בקור צינורות 1.5 מ"ל וקרים 5 או 10 מ"ל.
- לפני passaging, להפשיר 200 μL של מטריקס מוסמך על הקרח.
- לדלל 200 μL של מטריקס מוסמך 20 מ 'L של DMEM / F12 בינוני (דילול 1: 100).
- מעיל 60 מ"מ צלחות פטרי עם פתרון זה (5 מ"ל / צלחת).
- דגירה מצופה צלחות על 37 מעלות צלזיוס במשך לפחות 1 שעות.
- שימור היקפס בקטע שימור והקפאה
- לאחר חיתוך מושבות hiPSC (ראה שלב 1.3 עבור הליך חיתוך המושבה hiPSC), בעדינות ובאיטיות resuspend שברי המושבה hiPSC בתא גזע הקפאת בינוני, ~ 100 שברי / 250 μL (ראה טבלה של חומרים).
- Aliquot את שברי המושבה בבקבוקים מתאימים עבור cryopreservation (250 μL / בקבוקון).
- מניחים את צלוחיות במיכל מלא 2-propanol ומכניסים את המיכל ב -80 מעלות צלזיוס למשך מינימום של 2 שעות ועד 2 שבועות.
- מעבירים את הבקבוקים לשלב אדי של מיכל חנקן נוזלי.
- כדי להפעיל מחדש את התרבות, להפשיר 1 בקבוקון קפוא באמבט מים ב 37 מעלות צלזיוס.
- בעדינות לאסוף את שברי המושבה hiPSC ב 7 מ"ל של hiPSC מלאה מראש מחומםבינוני (ראה טבלה של חומרים ) בצינור 15 מ"ל באמצעות פיפטה 1, 2, או 5 מ"ל.
- צנטריפוגה שברי המושבה hiPSC ב 130 xg במשך 3 דקות.
- הסר את supernatant ו resuspend בעדינות את שברי המושבה hiPSC ב 1 מ"ל של המדיום hiPSC מלאה באמצעות פיפטה 1, 2, או 5 מ"ל.
- עוד לדלל את ההשעיה התא 3 או 4 מ"ל של המדיום hiPSC מלאה.
- פלייט את שברי המושבה hiPSC ב מטריקס מצופה צלחת פטרי 60 מ"מ (~ 100 שברי / צלחת, מעיל את המאכלים כמתואר בשלב 1.1).
- דגירה hiPSCs ב 37 מעלות צלזיוס 5% CO 2 .
- בצע שינוי בינוני כולל בכל יום.
- מעבר של מושבות hiPSC
הערה: hiPSCs לא מובחנים צריכים להיות עגולים בצורתם, עם גרעין גדול וללא ציטופלסמה בשפע. מושבות לא מתוארות צריכות להיות מאופיינות במורפולוגיה שטוחה וגדולה. רק מושבות לא מובחנות (בערך 1 מ"מקוטר n) יש לחתוך עבור מעבר נוסף.- חותכים את מושבות תאי גזע בריבועים של כ 200 מיקרומטר x 200 מיקרומטר באמצעות מזרק 1 מ"ל עם מחט 30G או כל כלי מסחר אחרים זמינים (ראה טבלה של חומרים). השתמש במיקרוסקופ סטריאוסקופית בהגדלה 4x בארון זרימה למינרית בטמפרטורת החדר.
- לנתק את שברי המושבה מן משטח צלחת באמצעות פיפטה 200-μL ידי pipetting בעדינות את המדיום מתחת להרים את החלקים.
- מעבירים את שברי המושבה (~ 100 חתיכות) כדי מטריקס מוסמך - DMEM / F12 מצופה צלחת מלאה 4 מ"ל של המדיום hiPSC מלא (ראה טבלה של חומרים, מעיל את המאכלים כמתואר בשלב 1.1).
- לדגור את הצלחת החדשה (ים) ב 37 ° C ו 5% CO 2 .
- לבצע שינוי בינוני הכולל כל יום ולבדוק את המורפולוגיה של המושבות באמצעות ניגודיות שלב ניגוד בהגדלה 4X ו 10X.
2. HiPSC DiffereNtiation לתוך נוירונים מעורב וגליה
הערה: ההליך אורך כ -28 יום, עם השלבים העיקריים המתוארים באיור 1 (החלק העליון).
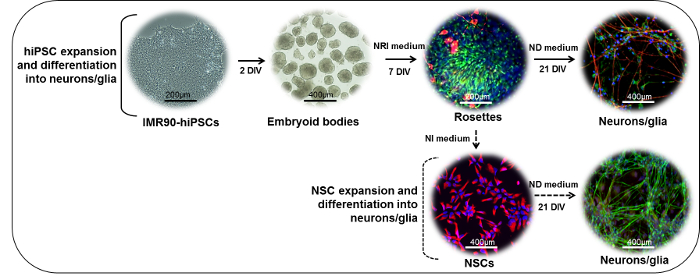
איור 1: ייצוג סכמטי של פרוטוקול ההפרדה העצבית. (החלק העליון) IMR90-hiPSC מושבות ניתן לחתוך לשברים כדי ליצור גופים עובריים (EBS). לאחר 2 ימים במבחנה (DIV), EBS יכול להיות מצופה על laminin או סטנדרטי מטריצה מצופה מנות ותרבותית בנוכחות בינוני אינדוקציה neuroepithelial (NRI) כדי לייצר נגזרות neuroectodermal (רוזטות, כאן מוכתם עבור nestin (ירוק) ו β -אני טובולין (אדום)). Rosettes ניתן לנתק, שנאספו, הוחזרו על laminin או סטנדרטי מצופה מטריצה כלים, ועוד הבדיל לתוך נוירונים בוגרת (NF200, אדום) ו glial(GFAP, ירוק) תאים בנוכחות של דיפרנציאציה נוירונים (ND) בינוני. (חלק תחתון) NSCs רוזטה נגזרות (nestin, אדום) ניתן להרחיב בנוכחות אינדוקציה עצבית (NI) בינוני, cryopreserved, או עוד הבדיל בנוכחות בינוני ND לעצב מעורב נוירונים (NF200, ירוק) ו גליה ( GFAP, אדום) תרבויות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
- הדור של גופים עובריים (EBs) (ימים 0 → 1)
הערה: הליך זה דורש מיומנויות ידניות טובות ודיוק. שברי המושבה HiPSC צריך להיות בגודל שווה להשיג גופים עובריים הומוגני (EBs) בשלבים הבאים. מושבות מובחנות מורפולוגית (עם שברים cytoplasmic גדול נוקלאולי קטן) צריך להיות מושלך.- לרענן את המדיום hiPSC (3 מ"ל / 60 מ"מ צלחת פטרי) לפני חיתוך מושבות hiPSC לא מובחנות (כ 1 מ"מ קוטראטר, ראה איור 2 א ) בתנאים סטריליים (כמתואר בשלב 1).
- חותכים את המושבות לא מתוארים (כפי שמוצג באיור 2 א ו איור 2 ב ) לתוך שברי של כ 200 מיקרומטר x 200 מיקרומטר באמצעות מזרק 1 מ"ל עם מחט 30G. השתמש במיקרוסקופ סטריאוסקופית בהגדלה 4X בארון זרימה למינרית בטמפרטורת החדר.
- לנתק את שברי המושבה מן משטח צלחת באמצעות פיפטה 200-μL ידי pipetting בעדינות בינוני מתחת להרים את החלקים.
- מעבירים את כל שברי מנותקת בינוני עד צינור 15 מ"ל באמצעות 1, 2, או 5 מ"ל פיפטה.
- שוטפים את המנה עם 2 מ"ל של המדיום hiPSC מלאה כדי לשחזר את כל השברים.
- צנטריפוגה ב 112 xg במשך 1 דקות.
- לשאוב supernatant ו resuspend בעדינות את השברים 5 מ"ל של המדיום מלא hiPSC EB (ראה טבלה של חומרים ).
- פלייט שיתוףשברים לוני 60 מ"מ מצורף נמוך במיוחד צלחת פטרי (5 מ"ל / 60 מ"מ צלחת פטרי).
- דגירה צלחת פטרי לילה ב 37 מעלות צלזיוס 5% CO 2 .
- ביום הבא (יום 1), לאסוף את EBS ואת המדיום שלהם צינור 15 מ"ל באמצעות פיפטה 1, 2, או 5 מ"ל.
- צנטריפוגה EBS ב 112 xg במשך 1 דקות.
- בזהירות לשאוב supernatant ו resuspend בעדינות את EBS ב 5 מ"ל של המדיום להשלים hiPSC EB באמצעות 1, 2, או 5 מ"ל פיפטה.
- Replate את EBS על חדש 60 מ"מ נמוך במיוחד מצורף צלחת פטרי (5 מ"ל / 60 מ"מ צלחת פטרי).
- דגירה צלחת פטרי לילה ב 37 מעלות צלזיוס 5% CO 2 .
- ביום הראשון, מעילים את הכלים עם מטריצת קרום במרתף ( למשל, matrigel, המכונה להלן "מטריצה רגילה") או כל מצע חלבון מתאים אחרים ( למשל , laminin).
- חנות המטריצה הסטנדרטית (ראה טבלה של חומרים ) ב -80 מעלות צלזיוס ב200-μL aliquots באמצעות צינורות קרים 1.5 מ"ל ו 5 או 10 מ"ל טמפרטורות קר.
- להפשיר 200 μL של מטריצה רגילה על הקרח.
- מדולל 200 μL של מטריצה רגילה 20 מ"ל של מדיום DMEM / F12 (דילול 1: 100).
- מעיל 60 מ"מ צלחות פטרי עם פתרון זה (5 מ"ל / צלחת).
- דגירה את הכלים מצופים ב 37 מעלות צלזיוס למשך הלילה.
הערה: מנות אלה ישמשו צלחת EBS (כ 50 EBS / צלחת) וליצור אגרגטים neuroepithelial (רוזטות); ראה שלב 2.3.
- הדור של אגרגטים neuroepithelial (רוזטות) (ימים 2 → 7)
- ביום 2, להסיר את פתרון ציפוי מטריצה תקן מן 60 מ"מ צלחות פטרי (אין צורך לשטוף את הצלחות) ולמלא אותם עם 5 מ"ל / צלחת של המדידה אינדוקציה neuroepithelial מלאה (NRI); ראה טבלה של חומרים .
- מעבירים את EBS צף (משלב 2.1.14) כדי מצופים מאכלים (~ 50 EBS / צלחת) באמצעות פיפטה 200 μL תחת stereoscopic miCroscope בהגדלה 4x והניח בארון זרימה למינרית.
הערה: זה קריטי כדי לבחור הומוגנית, בגודל בינוני EBS (~ 200-300 מיקרומטר קוטר). EBS קטן מדי לא יכול לשרוד היטב במהלך בידול neuroectodermal, בעוד EBS גדול מדי נוטים לעבור נמק הליבה. - דגירה את הכלים ב 37 מעלות צלזיוס 5% CO 2 .
- יום לאחר (יום 3), לבדוק את הכלים מתחת למיקרוסקופ בהגדלה 10x על מנת להבטיח כי כל ה- EBs מחוברים.
- בעדינות לבצע שינוי בינוני הכולל עם בינוני NRI מלא.
- לשנות את המדיום NRI כל יום אחר עד יום 7, כאשר אגרגטים neuroepithelial (רוזטות) צריך להיות גלוי.
- ביום 7, מטריצה סטנדרטי המעיל (או laminin), כמתואר בשלב 2.2, על כל צלחת נדרש או פורמט צלחת: 96-גם צלחות (100 μL / טוב), 24 גם צלחות (250 μL / טוב), 12- גם צלחות (500 μL / טוב), שבבים MEA (עבור פעילות חשמל, 1 מ"ל / שבב יחיד היטב), או 60 מ"מ Petri dishe(4 מ"ל / צלחת).
- דגירה צלחות מצופה / צלחות לפחות 2 שעות ב 37 ° C ו 5% CO 2 .
- רוזט דיסוציאציה והתמיינות נוירונים (ימים 8 → 28)
הערה: הליך זה דורש מיומנויות ידניות טובות ודיוק. כדי למנוע איסוף mesodermal ו endodermal תאים, רק ectoderm שושנה דמויי מבנים צריך להיות ניתק ולאסוף.- ביום 8, לחתוך את מבנים דמויי רוזטה לתוך שברי תחת מיקרוסקופ סטריאוסקופית בהגדלה 10X בתנאים סטריליים. השתמש מזרק 1 מ"ל עם מחט 30G. שים לב כי שושנות נוטים בקלות לנתק מן המנה כאשר נגע עם המחט.
- השלם את הניתוק של שברי רוזטה באמצעות פיפטה 200 μL.
- מעבירים את המנה מתחת למכסה המנוע זרימה למינרית לאסוף את שברי רוזטה ואת המדיום שלהם לתוך צינור חרוטי 15 מ"ל באמצעות פיפטה 1, 2, או 5 מ"ל. שוטפים את המנה עם 2 מ"ל של המדיום NRI להתאוששכל השברים.
- ספין למטה שברי רוזטה ב 112 xg במשך 2 דקות.
- לשאוב את supernatant.
- בעדינות resuspend גלולה ב 1 מ"ל של 1x DPBS (ללא סידן ומגנזיום) ו בעדינות פיפטה שברי רוזטה למעלה ולמטה באמצעות פיפטה 1000 μL כדי לנתק אותם חלקית.
- הוסף 4 מ"ל של המדיום NRI להשלים לספור את התאים באמצעות כחול trypan ו מונה תא אוטומטי (ראה טבלה של חומרים )
הערה: לדלל 20 μL ההשעיה התא μL 20 של כחול Trypan. צעד זה עשוי להיות מושמט אם התאים לא יכול להיות מובא לתוך ההשעיה תא בודד. אם שברי רוזטה לא נראים מנותקים לחלוטין, rosettes שברי נגזר כ 50 EBS / 60 מ"מ צלחת ניתן resuspended ב 50 מ"ל של המדיום NRI מלא מצופה, כפי שצוין בטבלה 1 . - לשאוב את תקן מטריקס (או laminin) פתרון ציפוי מן צלחות פטרי, צלחות, ו / או שבבי MEA (משלב 2.3.7). אל תיתן להם להתייבש.
- צפיפות התאים במדיום NRI מלא על פי תוכנית המחקר (כ -15,000 תאים / ס"מ 2 , ראה טבלה 1 להנחות נפח ציפוי).
- דגירה צלחות לילה ב 37 מעלות צלזיוס 5% CO 2 .
- ביום 10, לבצע שינוי בינוני הכולל באמצעות בינוני דיפרנציאציה נוירונים מלאה (ND); ראה טבלה של חומרים.
- רענן את המדיום ND מלא פעמיים בשבוע עד יום 28.
- לאפיין את נגזרות תא עצבי / גליה, כמתואר בשלב 5 (ראה טבלה 2 עבור קריטריונים קבלה כללית).
3. HiPSC הנגזרות גזע גזע עצביים (NSC) הרחבת בידול לתוך נוירונים מעורב גליה
הערה: NSCs נגזר שברי רוזטה ניתן להרחיב ומתוחזק בעקבות הנוהל המתואר להלן ( איור 1 , חלק התחתון). זה מאפשר תוספת thמספר תאים לבדיקות ובדיקות כימיות.
- מעיל צלחת פטרי 60 מ"מ (או בקבוק T-25) עם 5 מ"ל של תקן מטריקס DMEM / F12 ציפוי פתרון דגירה זה לפחות 2 שעות ב 37 ° C ו 5% CO 2 (כמתואר בשלב 2.2).
- ספין למטה שברי רוזטה נגזר צעדים 1-2 (ראה שלב 2.4) בצינור חרוטי 15 מ"ל ב 112 xg במשך 2 דקות.
- בעדינות resuspend גלולה ב 5 מ"ל של המדידה אינדוקציה עצביים (NI); ראה טבלה של חומרים.
- מעבירים את התאים על צלחת פטרי 60 מ"מ מצופה סטנדרטי (או T-25).
- תרבות רוזטה הנגזרות NSC בנוכחות בינוני NI, מרענן את המדיום כל יום אחר עד התאים להגיע המפגש.
- כאשר confluent, מעבר NSCs כמתואר בשלבים הבאים.
הערה: מעבר NSCs בערך פעם בשבוע; שקול להשתמש בציפוי מצופה טריים, צלוחיות או צלחות, בהתאם לתוכנית הלימודים. - הסר את המדיום NI מלא ועדיןY לשטוף את NSCs עם DPBS (ללא סידן ומגנזיום).
- הוסף 1.5 מ"ל של 0.05% טריפסין-EDTA מראש חימם ל 37 מעלות צלזיוס צלחת פטרי 60 מ"מ (או בקבוק T-25) המכיל את התאים במקום זה באינקובטור במשך 1 דקות.
- בעדינות הקש את צלחת (או בקבוק) כדי לנתק את התאים.
- הוסף 1.5 מ"ל של מעכב טריפסין מראש מחומם ל 37 מעלות צלזיוס ולהעביר את התאים צינור 15 מ"ל.
- שוטפים את צלחת פטרי (או בקבוק T-25) עם נפח שווה של המדיום NI (1.5 מ"ל) ולאסוף את עוצמת הקול של צינור 15 מ"ל זהה.
- צנטריפוגה התאים ב 130 xg במשך 3 דקות.
- הסר supernatant ו resuspend בעדינות התאים 1 מ"ל של המדיום NI להשלים באמצעות פיפטה 1000-μL.
- עוד לדלל את ההשעיה התא 3 או 4 מ"ל של המדיום NI להשלים לספור את התאים באמצעות כחול trypan ו מונה תא אוטומטי.
- פלייט NSCs על צלחת פטרי 60 מ"מ (או בקבוק T-25) משלב 3.1 בצפיפות של כ 50,000 תאים / ס"מ 2 .
- בצע שינוי בינוני הכולל עם בינוני NI מלא כל יום אחר.
- לאפיין את התאים לנוכחות של נגזרות תא עצבי / גליה, כמתואר בשלב 5.
הערה: NSCs יכול להיות מובחן לתוך תרבויות מעורבות של נוירונים גליה במדיום ND מלאה (כמתואר צעדים 2.4.11-2.4.13), מרענן את המדיום ND מלא פעמיים בשבוע במשך 21 ימים.
4. HiPSC הנגזרות NSC Cryopreservation והפשרה
הערה: על passaging, NSCs ניתן להקפיא מחדש מופשר בעקבות הליך זה.
- צנטריפוגה מעברי NSCs (משלב 3.12) ב 130 xg במשך 3 דקות.
הערה: יש למנות את התאים בשלב 3.14. - בעדינות לאט resuspend NSCs ב 3 x 10 6 / mL של המדיום מקפיא (ראה טבלה של חומרים ).
- Aliquot התאים בקבוקונים מתאימים עבור cryopreservation (כ 0.5 מ"ל = 1.5 x 10 6 / בקבוקון).
- מניחים את הבקבוקים במיכלLled עם 2-propanol ומכניסים את מיכל ב -80 מעלות צלזיוס למשך מינימום של 2 שעות ועד 2 שבועות.
- מעבירים את הבקבוקים לשלב אדי של מיכל חנקן נוזלי.
- כדי להפעיל מחדש את תרבות התא, להפשיר 1 בקבוקון קפוא באמבט מים ב 37 מעלות צלזיוס.
- בעדינות לאסוף את התאים 7 מ"ל של מראש חימם להשלים NI בינוני בצינור 15-מ"ל באמצעות פיפטה 1000-μL.
- צנטריפוגה התאים ב 130 xg במשך 3 דקות.
- הסר את supernatant בעדינות resuspend התאים 1 מ"ל של המדיום NI להשלים באמצעות פיפטה 1000-μL.
- עוד לדלל את ההשעיה התא 3 או 4 מ"ל של המדיום NI להשלים לספור את התאים באמצעות טריפאן כחול מונה תא אוטומטי (הערה: לדלל 20 μL ההשעיה התא μL 20 של כחול trypan, הכדאיות לאחר הפשרה צריך להיות 80 ≥ %).
- פלייט NSCs צלחת 60 מ"מ מצופה פטרי (או בקבוק T25) בצפיפות של כ 50,000 תאים / ס"מ 2 .
5. צ'ארהCterization של hiPSC הנגזרות תאים עצביים וגליאל
הערה: עם הבחנה, נגזרות עצביות וגליאל ניתן לאפיין באמצעות טכניקות שונות, כגון אלה המתוארים בסעיפים הבאים.
- כמותי בזמן אמת PCR (qPCR) מנתח 10
- ספין למטה שברי מושבות hiPSC, EBs, ו / או NSCs ב 130 xg במשך 3 דקות.
- Resuspend תא גלולה μL 100 של חיץ קר RNA תמוגה בתנאי בערכה מתאימה עבור מיצוי רנ"א.
- לחלופין, לאסוף נגזרים נוירונים / גליה ישירות מן הצלחות על ידי aspirating המדיום והוספת חיץ קר RNA תמוגה לבארות כדי לאסוף את התאים.
- לבודד את RNA בעקבות ההוראה של היצרן.
- הפוך להעתיק 500 ng של RNA הכולל באמצעות ערכת מתאים RNA כדי retrotranscription cDNA.
- הפעל תגובות qPCR כפולות באמצעות תערובת הורים מתאימים פריימרסטים (ראה טבלה של חומרים ).
- שיא את פליטת פלורסנט בזמן אמת: 45 מחזורים עם חישול primers ב 60 מעלות צלזיוס.
- לנרמל את כמויות RNA יחסית ל- GAPDH ו- β- אקטין כמו גנים התייחסות ולהשתמש hiPSCs לא מובחן או תאים מטופלים לתנאי כיול (שיטה ΔΔCt). לחלופין, השתמש בשיטה מתאימה אחרת.
- Immunocytochemistry והדימות תוכן גבוהה (HCI) 6 , 11
- תקן את המושבות hiPSC, NSCs, ו / או נוירונים / נגזרים גליה עם paraformaldehyde קר 4% במשך 15 דקות בטמפרטורת החדר.
- בעדינות לשטוף את התאים 1X PBS ולאחסן את הצלחות על 4 מעלות צלזיוס למשך עד 1 חודש.
- כאשר מוכן מכתים, permeabilize התאים במאגר permeabilization (1x DPBS המכיל 0.1% triton-X-100 ו 3% BSA) במשך 15 דקות בטמפרטורת החדר.
- הסר את bum permeabilizationFfer ו דגירה התאים חוסם חיץ (3% BSA / 1X DPBS) במשך 15 דקות בטמפרטורת החדר, כדי למנוע מחייב ספציפי של נוגדנים.
- הסר את המאגר חסימה דגירה התאים לילה ב 4 ° C חסימת המאגר המכיל נוגדנים ראשוניים מתאימים (ראה טבלה של חומרים ).
- לשטוף את התאים 3 פעמים עם 1x PBS.
- דגירה התאים למשך 45 דקות בטמפרטורת החדר לחסום חיץ המכיל נוגדנים משני fluorochrome מצומדות משני (ראה טבלה של חומרים ), counterstaining את הגרעינים עם צבע DAPI.
- לכמת את עוצמת הקרינה הממוצעת ואת האחוזים היחסיים של סוגי תאים באמצעות פלטפורמה מתאימה הדמיה תוכן גבוהה, אם זמין (ראה טבלה של חומרים ).
הערות: כדי לקבוע את עוצמת עוצמת הרקע פלורסנט, דגירה כמה תאים / בארות עם נוגדנים משניים לבד. ניתוח cytometric הזרימה של לחיות (לא קבוע), undHiPSCs if differentiated יכול להתבצע כדי להעריך את הביטוי של סמנים ספציפיים PSC, כגון SSEA4 (ראה טבלה של חומרים ). Unifferentiated hiPSC מושבות ניתן לנתח עבור פעילות phosphatase אלקליין באמצעות ערכות BCIP / NBT זמין מסחרית, בעקבות הוראות היצרנים (ראה טבלה של חומרים ). בנוסף, בשלב מבחני חלבון שלב הפוכה (RPPA) מבחני יכול להתבצע, כמתואר בסעיף 12 (עבור רשימה של נוגדנים נבדק, ראה טבלה של חומרים ).
- מדידות אלקטרו-פיזיולוגיות 13
- צלחת שברי רוזטה ניתק (לאחר 7 DIV) או NSCs נגזר שושנות על מערכים multielectrode מצופה (MEAs, ראה טבלה של חומרים ) ב בינוני ND מלא (~ 1 x 10 5 תאים / יחיד גם שבב MEA).
- להבדיל את התאים במשך 3 שבועות להשלים בינוני ND, מרענן המדיום פעמיים בשבוע.
- בסוף בידול, חותם את הצ 'יפס MEA עם קרום חדיר למחצה תחת מכסה המנוע זרימה למינרית כדי לשמור על תרבויות סטריליות עבור מדידות חוזרות.
- החלף אחת האלקטרודות עם הפניה אחת הקרקע, המאפשר הקלטות מן האלקטרודות שנותרו.
- הקלט את קצב הירי הממוצע (MFR, מספר הקוצים / דקות) באמצעות מגבר MEA עם בקרת טמפרטורה משולבת תהליך מותאם 37 ° C ו 5% CO 2 .
- זיהוי פסגות מנתונים גולמיים MEA באמצעות מגבלת סף של -4.7σ (σ מייצג את סטיית התקן של הרעש הבסיסי).
- לעבד את הנתונים לאחר ההקלטה עם תוכנה מתאימה.
תוצאות
אפיון של hiPSCs לא מובחנים
כדי להעריך את הפנוטיפ של hiPSCs, ניתוח מורפולוגיה המושבה / התא, קביעת סמנים ספציפיים PSC, ובדיקה של ביטוי גנים ופעילות פוספט אלקליין צריך להתבצע. Uniferentiated hiPSCs צריך להיות עגול, עם גרעין גדול וללא ציטופלסמה בשפע. רוב המושבות צריך להיות מאופיין שטוח המורחב במורפולוגיה, המעיד על פנוטיפ בלתי מובחנת ( איור 2 א ו איור 2 ב ). בנוסף, יותר מ 80% של המושבות צריך להיות חיובי עבור פעילות phosphatase אלקליין פעילות ( איור 2 ג ).
כ 80% מהתאים צריך להיות חיובי עבור סמנים הקשורים קלאסי pluripotency, כגון Oct4, SSEA3, SSEA4 ו Tra1-60 ( איור 2D-H ), כפי שמוצג על ידי immunocytochemistry ו cytometry זרימה, בעוד אחוזי nestin + ו β-III-Tubulin + תאים צריך להיות נמוך באופן משמעותי (כ 8% ו -3%, בהתאמה, כפי שמוצג בתרשים 2H ). תוצאות אלה יש לשעתק על מעברים.
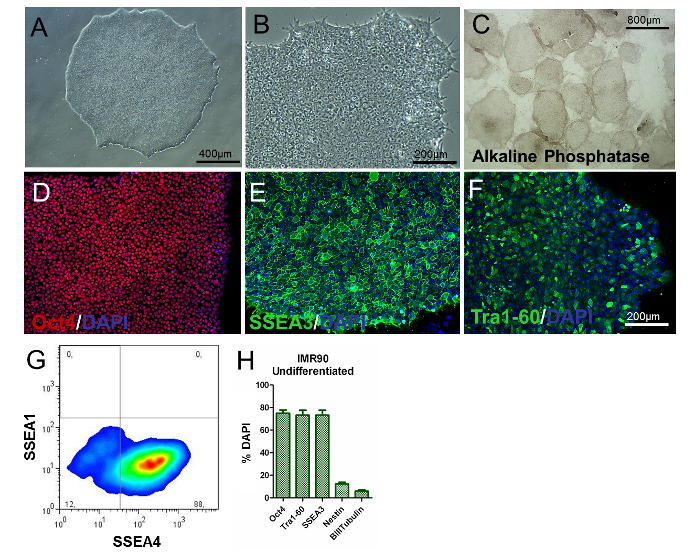
איור 2. אפיון של IMR90-hiPSCs לא מתוארים. (A ו- B) נציג שלב תמונות בניגוד (10X ו 20x הגדלות) של מושבות IMR90-hiPSC לא מובחנים. (ג) תמונות נציג של מושבות מוכות phosphatase אלקליין (הגדלה 4X). (DF) נציג תמונות immunocytochemical של (D) Oct4 (אדום), (E) SSEA3 (ירוק), ו (F) TrA1-60 (ירוק). (G) נציג נקודה של SSEA1 (CD15) ו SSEA4 מכתים, ניתח על ידי cytometry הזרימה. ( + ) ~ ~ 75% - 80%, + + + ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ~ ), ו β-III-tubulin + (~ 3 - 7%) תאים, counterstained עם DAPI ו לכמת ידי HCI, עם ממוצע של 3 עד 5 משכפל ביולוגי ± SEM (גרף שונה מ הפניה 6). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
הערכה של pluripotency באמצעות היווצרות EB
HiPSCs הם pluripotent, כלומר הם מבטאים שלושה גנים הקשורים גידולים הקשורים בתנאים המתאימים. כדי להעריך hiPSC pluripotency, ניתן להחיל משותףגישה המבוססת על היווצרות EB ספונטנית, אשר גורם להיווצרות של שלוש שכבות נבט 14 . ניתוחי גנים ספציפיים של שכבת גידולים חייבים להצביע על עלייה תלויית זמן באאודודרם (α-fetoprotein (AFP) ו- Cytokeratin 18 (KRT18)), ectoderm (Nestin, SRY-box 1 (Sox1) ו 6 קופסה 6 (Pax6) ), ו mesoderm (nptriuretic פפטיד (NPPA) ו Brachyury-T) ביטוי גנטי הקשורות ( איור 3 א ו איור 3 ב ); ראה טבלה של חומרים.
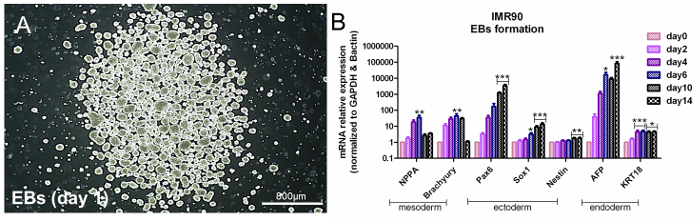
איור 3. הערכה של pluripotency על ידי היווצרות EB. (A) נציג שלב שלב התמונה של EBS ביום 1. (ב) תרשים הבר מציג ניתוח QPCR של מזודרמל (NPPA ו brachyury), ectodermal (Pax6, Sox1, ו nestin), ואת האאודודרמה (AFP ו KRT18 ) גנים, מנורמל לגנים הפניה, אקטין β ו- GAPDH, וכיול לתאים לא מובחנים (יום 0). זוהי שיטת ΔΔCt, עם ממוצע של 5 ניתוחים עצמאיים ± S
אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
אינדוקציה של בידול נוירוני וגליאלי
IMR90-iPSCs ניתן להבדיל תרבויות מעורבות של נוירונים פוסט מיטוטי ותאי גלייה בעקבות הצעדים המסוכמים באיור 1 ובקטעים פרוטוקול. 5-8 ימים לאחר ציפוי EBS על סטנדרטי מטריקס או laminin מצופים מנות בנוכחות של NRI בינוני, מבנים דמויי רוזטה צריך להתחיל להיות גלוי (= "Xfig"> איור 4 א). רוזטות מאופיינות בנוכחות תאי nestin + (מבשרי עצבים, ~ 90%), עם מעט תאים β-III-tubulin + (תאים נוירונים מחויב, ~ 5-10%), האחרון בדרך כלל מקומי בעיקר בפריפריה של ורדים ( איור 4 ב , שושנות ביום 12).
על דיסוציאציה עם רוזטה ולהחזיר על גבי laminin או סטנדרטי מצופה מטריצה צלחות או צלחות בנוכחות המדיום ND מלא, תאים מתחילים עוברים differiation לתוך תרבויות מעורבות של נוירונים וגליה, בהדרגה יוצרים אשכולות של גופים תא עצבי מחובר על ידי צרורות של neurites ( איור 4C ותרשים 4 ד ). תוצאות דומות יש להשיג בעת ניתוח אוכלוסיות נוירונים המתקבל על ידי הרחבת NSCs נגזר רוזטה ומבדיל אותם נוירונים וגליה. NSCs מורחבת משושלות צריך להיות nEstin + ( איור 4E , הבלעה מראה nestin + תאים).
לאחר 21 ימים של הבחנה, התאים צריכים להיות חיוביים ל- β-III-tubulin; NF200; טאו; ו MAP2, סמן מאוחר של הדנדריטים ( איור 4D , 4F, ואת איור 4H), עם לפחות 10-15% של תאים חיוביים עבור חלבון חומצה fibriillary fibriillary (GFAP), סמן astroglial ( איור 4 איור 4H) . יתר על כן, ~ 20 - 30% של התאים צריך לשמור על הביטוי של nestin לאחר בידול ( איור 4H ). חשוב לזכור כי אחוז של כל סוג תא ( כלומר, נוירון, astrocyte, nestin + תאים) עשויים להשתנות על פני מעברים, ואת השתנות תלויי המשתמש ניתן לצפות.
על ידי ניתוח subpopulations נוירונים ספציפיים, נוירונים GABAergic repreשנשלחו ~ 15 - 20% מכלל התאים, נוירונים דופאמינרגיים ~ 13 - 20%, נוירונים גלוטמטריים ~ 35 - 42%, כפי שמוצג על ידי immunostaining עבור gamma-aminobutyric חומצה (GABA), tyrosine hydroxylase (TH), גלוטמט שלפוחית טרנספורטר 1 (VGlut1), בהתאמה (ראה כימות נציג בתרשים 4H ). האינדיקציה של הבחנה יכולה גם להיות מוערכת על ידי ניתוח של סמנים הקשורים pluripotency ( למשל, Oct4, Tra1-60, ו SSEA3), אשר צריך להיות downregulated משמעותי בתאים מובחנים לעומת hiPSCs לא מובחנים (לא מוצג, ראה התייחסות 6). זה גם יכול להיות מאושר על ידי ניתוח של ביטוי גנים על ידי qPCR, אשר אמור להצביע על ירידה של Oct4 ו Nanog ו upregulation של גנים עצביים, כגון מולקולה הידבקות תא עצביים 1 (NCAM1) ו microtubule הקשורים חלבון 2 (MAP2); הגן presynaptic, synaptophysin (SYP); ואת הגן שלאחר הסינפטי, microtubule הקשורים חלבון טאו (MAPT), כפי שמוצג ב < Strong class = "xfig"> איור 4I. יתר על כן, דופאמינרגים (TH ו- NR4A1), נוירונרגים (PHOX2A ו- PHOX2B), גלוטמטרגים (NARG2, GRIA1 ו- GAP43), GABRAEGIC (GABRA1 ו- GABRA3), נוירונים מוטוריים (ISL1 ו- LHX3) וגנים הקשורים ב- cholinergic (SLC5A7 ו- SLC18A13) וכתוצאה מכך תאים עצביים upregulated לעומת תאים בלתי מובחנים ( איור 4J ).
ניתוח הפעילות החשמלית הספונטנית, באמצעות MEA, הוא readout יקר כדי להעריך את הפונקציונליות של הרשת העצבית hiPSCs מובחן. בתום תקופת ההבחנה, נגזרים נוירונים מאופיינים בדרך כלל בשיעור ירי ממוצע (MFR) של לפחות 60 קוצים / דקות (ראה את העלילה הסופית המייצגת בתרשים 4K ). עם זאת, התפרצויות לא נצפו.
55702fig4.jpg "/>
איור 4. דיפרנציאציה של IMR90-hiPSCs לתוך תרבויות מעורבות של נוירונים וגליה. (A ו- B) תמונות נציג של שושנות לאחר 7 DIV (A) ואחרי 12 DIV (B) , מוכתם עבור nestin (ירוק) ו- β III- טובולין (אדום)). (C ו- D) נציג תמונות של תאים מובחנים לאחר 22 DIV (C) ו 28 DIV (D) , מוכתמים β-III-tubulin (אדום) ו NF200 (ירוק)). (ה) תמונה נציג של NSCs הנגזרות דיסוציאציה ורדיאטיה (מראה הבלעדי nestin + תאים, אדום). (F ו- G) תמונות נציג של תאים עצביים ( F , מוכתם עבור NF200 (אדום) ו טאו (ירוק)) ותאי גלייה ( G , מוכתם עבור GFAP (אדום) נבדלים מ NSCs (לאחר 21 DIV). (H) כימות של nestin, MAP2, GFAP, gamma-aminobutyric חומצה (GABA), transulator גלוטמט vesicular 1 (VGlut1), ו tyrosine hydroxylase (TH) תאים חיוניים על ידי HCI, השוואת IMR90-hiPSC נגזרות תאים מובחנים IMR90-hiPSC הנגזרות NSCs (גרף שונה מ הפניה 7). (I ו - J) בר גרפים המראים ניתוחי QPCR של גנים מסוג pluripotency (Oct4 ו Nanog) וגנים נוירונים (NCAM1, MAP2, SYP ו- MAPT) (I) ושל דופאמינרגי (TH ו- NR4A1), נואדרנרגי (PHOX2A ו- PHOX2B) Glutamatergic (NARG2, GRIA1, ו- GAP43), GABAergic (GABRA1 ו GABRA3), נוירון המוטורי (ISL1 ו LHX3), ו cholinergic (SLC5A7 ו SLC18A13) גנים הקשורים (J) . כל הניתוחים מנורמל לגנים הפניה, אקטין β ו- GAPDH, וכיול לתאים לא מובחנים (מוטות ירוקים). זוהי שיטת ΔΔCt, עם ממוצע של 5 ניתוחים עצמאיים ± S
(K) נציג סריקה העלילה של IMR90-NSC נגזר neur(ההקלטות בוצעו עבור מינימום של 600 s, ברים אנכיים מייצגים קוצים יחיד). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
חתימה ספציפית של סמנים עצביים הוא upregulated ב IMR90-hiPSCs מובחן
בפרדיגמת בדיקת הרעילות החדשה, חיוני להגדיר את האירועים המולקולריים והסלולריים המתרחשים בתוך תא בעקבות החשיפה לרעיל נתון. לכן, חשוב לאפיין אילו מסלולי איתות מופעלים ו / או מבודדים בתוך המודל הסלולרי הנחקר.
מערכים זמינים מסחרית עבור ניתוחים של ביטוי חלבון קינאז חלבון ניתן להשתמש כדי להשוות hiPSCs לא מובחן לעומת תאים מובחנים. דיפרנס(IMPR), גידולים של נוירוטרופים (GDNF), חלבון מורפוגנטי (BMP) / TGF-Beta, מקדם גדילה נגזר (PDGF) קולטנים ( איור 5 א ו איור 5 ב ).
הניתוח של RPPA מראה את upregulation של חתימה עצבית ספציפית IMR90-hiPSCs מובחן. בפרט, ארק / CREB, Akt / PDK1 / mTOR, ואת נתיבי איתות Notch1 מופעלים על בידול ( איור 5 ג ).
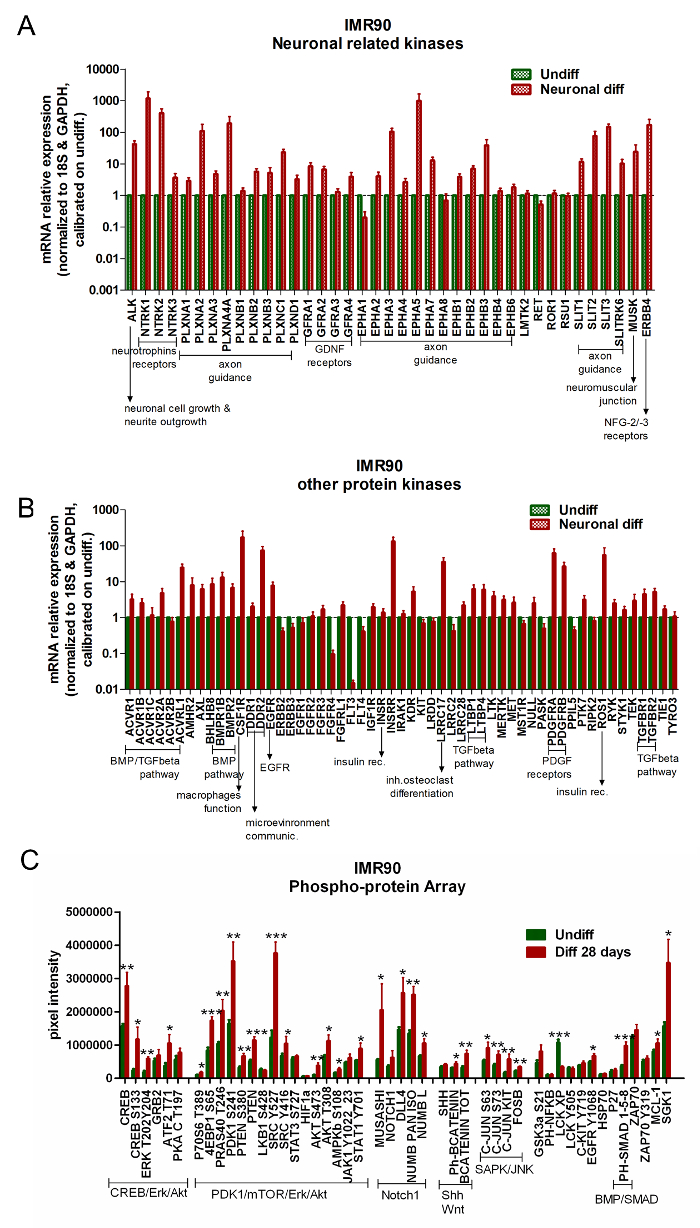
איור 5. מובחנים תאים עצביים ו Glial הצג את הפעלת נתיבים הקשורים נוירון. (או B) גרפים בר לדווח על ניתוח qPCR של קינאזות נוירון הקשורים (א) וגנים אחרים הקשורים קינאז (B) . נתוני ביטוי גנים מנורמל הגנים התייחסות 18S ו GAPDH (מסופק במערך) מכויל לתאים מובחנים. עבור ניתוחים אלה, גן נחשב upregulated באופן משמעותי כאשר הביטוי שלה היה לפחות 2x גבוה יותר מאשר תאים מובחנים (2 -ΔΔCt ≥ 2); ממוצע של 3 ניתוחים עצמאיים ± SEM). (ג) תרשים הבר מציג את quantifications חלבון מוחלט באמצעות ניתוח RPPA, השוואת הבדיל (ברים אדומים) ותאים מובחנים (ברים ירוקים). החלבונים השייכים לאותם מסלולים של נתיבי איתות, מקובצים יחדיו כדלקמן: CREB / Erk / Akt, PDK1 / mTOR / Erk / Akt, Notch1, Shh ו- Wnt, SAPK / JNK ו- BMP / SMAD. ממוצע ± SEM של 4 ניתוחים עצמאיים. * P <0,05, ** p <0.01, *** p <0.001; גרף שונהRom Reference 6. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
IMR90-hiPSC הנגזרות נוירונים / גליה תרבויות ניתן להשתמש כדי להעריך את ההשפעות של rotenone
Rotenone, מעכב של I מורכב של שרשרת הנשימה המיטוכונדריאלית, ידוע כגורם ללחץ חמצוני על ידי הפעלת ההפעלה של נתיב Nrf2. בתנאים של שקט, Nrf2 מעוגן בציטופלזמה על ידי Keap1 (Kelch כמו ECH הקשורים חלבון 1), מדכא Nrf2, אשר מקל על Nvf2 ubiquitination ו proteolysis 15 . עם אינדוקציה של מתח חמצוני, Nrf2 translocates לתוך הגרעין ומפעיל את הביטוי של Nrf2-ARE גנים היעד 16 .
IMR90-hiPSC הנגזרות נוירונים אD תאים גליה ניתן להשתמש כדי להעריך את ההשפעות של rotenone על הפעלת Nrf2 על ידי חשיפת התאים לריכוזים שונים של rotenone ( למשל, 1, 10, 100 ננומטר) במשך 24 שעות. ריכוזים אלה נקבעו על פי מחקרים קודמים 17 , 18 .
בריכוזים אלה וזמני החשיפה, rotenone לא לגרום cytotoxicity, כפי שמוצג על ידי כימות של גרעין DAPI + תא גרעין ( איור 6 א ). Rotenone המושרה Nrf2 טרנסלוקציה גרעינית, במיוחד לאחר חשיפת התאים 100 romone ננומטר ( איור 6 ב ו איור 6E ). בריכוז זהה, ירידה משמעותית ב- Keap1 הציטוטלסמה נצפתה ( איור 6 ג ' ), יחד עם עלייה של שני NAD (P) H quidone oxidoreductase 1 (NQO1) ו Sulfiredoxin 1 (SRXN1), שני Nrf2 היעדZymes 19 , 20 ( איור 6D ).
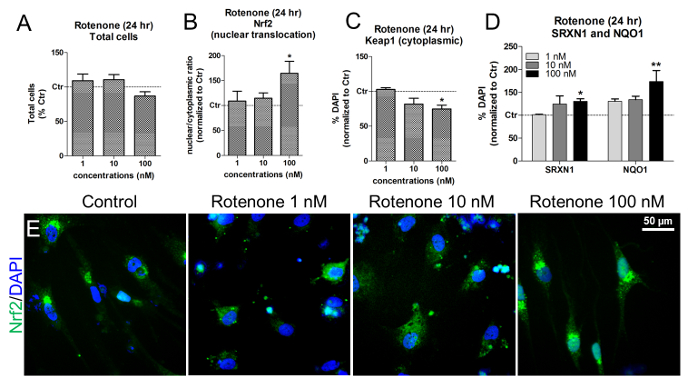
איור 6. ההשפעות של Rotenone על Nrf2 גרעיני טרנסלוקציה, Keap1, SRXN1, ו NQO1 רמות החלבון. (א) כימות של תאים DAPI חיים ( כלומר, גרעינים שאינם pyknotic) על טיפול 24 שעות עם 1, 10, 100 רוטנון ננומטר ו מנורמל לתאים מטופלים (Control, Ctr). (B) Nrf2 חלבון גרעיני טרנסלוקציה ( כלומר, יחסי גרעינית / cytoplasmic) לאחר 24 שעות של חשיפה rotenone, מוערך על ידי מדידות של עוצמת הקרינה באמצעות ניתוח HCI. (ג) כימות של רמות חלבון cytoplasmic Keap1 על הטיפול rotenone, להעריך על ידי ניתוח HCI. (D) כימות של NAD (P) H quidone oxidoreductase 1 (NQO1) ו SulfiRedoxin 1 (SRXN1) באמצעות immunofluorescence ו- HCI לאחר 24 שעות של טיפול עם rotenone. (ה) נציג תמונות של לוקליזציה חלבון Nrf2 (ירוק). כל הערכים מוצגים כמו הממוצע ± SEM של 3 משכפל ביולוגי. * P <0,05, ** p <0.01; דמות שונה מ הפניה 7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
בריכוז זה ובשעות הטיפול, הרוטנון העלה גם גידול תלויי ריכוז של אחוז התא באסטרוגליום ( איור 7 א ' ואיור 7 ב' ), מבלי להשפיע על הפרופורציות של NSC (nestin + ) ונוירונים (MAP2 + ) ( איור). 7 ב ). על ידי בחינת הפרופורציות של תת סוגי נוירונים ספציפיים, טיפול rotenone (10 ננומטר 100 ננומטר)הפחית משמעותית את מספר הנוירונים הדופאמינרגיים (TH + ) ( איור 7 ג ' ו- ד' ), בעוד שאחוזים של נוירונים GABAergic (GABA + ) ו glutamatergic (VGlut1 + ) לא השתנה ( איור 7 ד ). באופן אנלוגי, הקודם in vivo ובמחקרים חוץ גופית תיארו רוטנון תלוי סלקטיבי דופאמינרגי תא עצבי דופאמינרגי 21 , 22 , 23 .
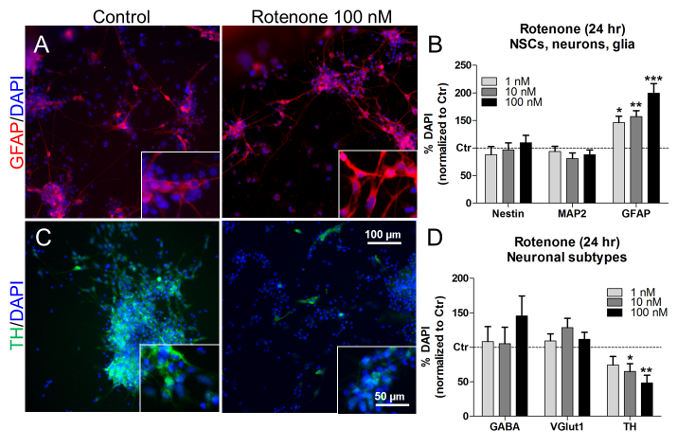
איור 7. השפעות של רוטנון על תאים גליה ו נוירונים דופאמינרגיים. (א) תמונות נציג של GFAP + תאים (אדום), עם הגדלה 40X ב insets, מטופל או מטופל עם rotenone 100 ננומטר במשך 24 שעות. (ב) כימות של + nestin + , MAP2 + , ו GFAP + תאים, מנורמל לתאים מטופלים (שליטה, Ctr). (C) נציג תמונות של נוירונים דופאמין + דופאמין (ירוק), עם הגדלה 40X ב insets, מטופל או מטופל עם rotenone 100 ננומטר במשך 24 שעות. (D) כימות של GABA + , VGlut1 + , ו + תאים נוירונים, מנורמל תאים מטופלים (Ctr). כל הערכים מוצגים כמו הממוצע ± SEM של 3 משכפל ביולוגי. * P <0,05, ** p <0.01, *** p <0.001; דמות שונה מ הפניה 7. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
משמעות סטטיסטית הוערכה על ידי ANOVA חד-כיווני עם מבחן השוואתי מרובה של דנט כבחנת פוסט (השוואת כל העמודות לעומת עמודת הבקרה)Xref "> 24 או על ידי מבחן זנב לא מזווג או מזווג דו-זנבי לפי סוג הניתוח כל הנתונים מייצגים את הממוצע של לפחות שלושה משכפלים ביולוגיים ± השגיאה הסטנדרטית של הממוצע (SEM). הבדל משמעותי עם קבוצת הביקורת. * P <0.05, p <0.01, p <0.001.
שולחן 1.
הערה על צפיפות ציפוי רוזטה ניתק: אם שברי רוזטה לא נראים מנותקים לחלוטין, כדי להגיע צפיפות ציפוי של כ 15.000 תאים / ס"מ 2 , ניתוק שושנות ניתוק הנובע כ 50 EBS / 1 x 60 מ"מ צלחת ניתן resuspended ב 50 מ"ל של המדיום NRI מלא מצופה כדלקמן (בהתאם לתבנית הצלחת):
| לוחיות רב-תכליתי / MEA | אזור הגידול (ס"מ 2) / טוב) | נפח ההשעיה התא לצלחת לכל טוב (או שבב MEA) | המספר המרבי של צלחות שניתן מצופה (עם 50 מ"ל של השעיה תא) |
| 96 בארות | 0.3 | 100 ul | 5 |
| 48 בארות | 0.7 | 220 | 4 |
| 24 בארות | 2 | 625 ul | 3 |
| 12 בארות | 4 | 1.25 מ"ל | 3 |
| 6 בארות | 10 | 3.125 מ"ל | 2 |
| שבב MEA יחיד | 3.5 | 1.1 מ"ל | 45 |
טבלה 2: קריטריונים לקבלה
| סמן /נוֹגְדָן | אחוז (על DAPI + (תאים) תאים) לאחר 28 DIV |
| B-III-tubulin (Tuj1) | 35-45% |
| MAP2 | 50-60% |
| NF200 | 45-55% |
| GFAP | 10-25% |
| Nestin | 15-25% |
Discussion
עבודה זו מתארת פרוטוקול חזק ומהיר יחסית עבור בידול של IMR90-hiPSCs לתוך נוירונים פוסט מיטוטי ותאי גלייה. פורסמו בעבר פרוטוקולים בידול נוירונים המבוססים על hESCs ו hiPSCs בדרך כלל תשואה אחוזים גבוהים של מבשרי עצבים 25 , 26 ו מספר משמעותי של תאים היעד העצבית 27 , 28 , 29 , 30 , 31 , 32 , 33 . באופן אנלוגי, פרוטוקול ההבחנה המתואר כאן מתאים ליצירת תרבויות הטרוגניות של תאים עצביים של GABAergic, glutamatergic ו- dopaminergic, יחד עם גליה ושיעור דיסקרטי של תאי Nestin + . נוכחות של תאים עצביים גלוטמטריים (~ 35-42%) ו GABAergic (~ 15-20%) עצביים עולה כילתרבות זו יש תכונות של המוח הקדמי, כמו קליפת המוח, ונוכחות של מספר דיסקרטי של נוירונים דופאמינרגיים (~ 13-20%) עשויה גם להצביע על סגוליות של המוח התיכון. בנוסף, הקביעות של אחוז קטן של תאים + nestin עשוי להוכיח מתאים לחקר neurogenesis ואת ההשפעות האפשריות של כימיקלים על NSCs, אשר מוגבלים בעיקר הן את ההיפוקמפוס ואת אזור subventricular (SVZ) של forebrain 34 . ניתוח נוסף immunocytochemical ו ביטוי גנים יעזור להגדיר טוב יותר את הספציפיות האזורית של נגזרות תא מובחן.
שני הצעדים הקריטיים ביותר בפרוטוקול ההבחנה המתואר במסמך זה הם: (i) חיתוך מושבות hiPSC לשברים הומוגניים (קריטיים לדור EBS עם גודל הומוגני) ו- (ii) חיתוך מבנים נוירו-אוקטרומלים (שושנות) ) עבור בידול NSC, הדורש מיומנות ידנית משמעותיתואת דיוק כדי למנוע איסוף mesodermal ו תאים endodermal שעלולים להפחית את הפרופורציות של נוירונים ותאי גלייה שהושגו על בידול.
זה חיוני כדי לאפיין את פנוטיפים של התאים במהלך ההתרחבות (כמו מושבות לא מובחנות או NSCs) ובמהלך כל הצעדים בידול. בפרט, הגן פרופילים ביטוי חלבון של נגזרות תא עצבי / גליה צריך להראות upregulation והפעלה של מסלולי איתות נוירון הקשורים, ואילו הביטוי של סמנים pluripotency צריך להיות מופחת.
הדור של EBS ונגיפים neuroectodermal (רוזטות) יכול להיות מאתגר באופן ידני נוטה השתנות. מסיבה זו, פיתחנו פרוטוקול להרחבת NSCs נגזר רוזטה והבחנה נוספת שלהם לתוך תאים עצביים / גליה.
המגבלות האפשריות של פרוטוקול זה בידול הם בעיקר (i) אחוז נמוך יחסית של דנגזרים גליליים שונים ו - (ii) היעדר פונקציות רשת נוירונים בוגרים (כפי שמוצג על ידי חוסר התפרצויות). יתר על כן, subpopulations ספציפיים של astrocytes יכול לתפקד כמו אבות ראשוניים או NSCs 35 . בעוד Nestin / GFAP תאים חיוביים פעמיים לא נצפו בתרבות תאים מובחנת זו (נתונים לא מוצג), הוא שיערו כי GFAP + תאים אלה תרבויות מעורבות הם אבות astrocytic ו astrocytes. סביר כי על ידי הארכת הזמן של בידול, מספר האסטרוציטים עשוי להגדיל, המורפולוגיה שלהם עשוי להיות יותר בוגרת, כפי שכבר צוין על ידי עבודות קודמות של הקבוצה של ג 'אנג 36 , 37 .
בפרדיגמת בדיקת הרעילות החדשה, הידע על הפרעות ביולוגיות של נתיבים ביולוגיים הוא בעל חשיבות עליונה בהערכת מצוקות כימיות. לכן, במבחנה מערכות הבדיקה צריכה להיות מסוגלתמתייחסים לתופעות שליליות להפרעות של מסלולי איתות, בהתאם למושג של מסלול התוצאה השלילית (AOP). כמו הוכחה של קונספט, rotenone ניתן להשתמש כדי להעריך את ההפעלה של נתיב Nrf2, אשר מעורב בהגנה הסלולרית נגד מתח חמצוני או electrophilic 38 , ואת הלחץ החמצוני הוא אירוע מפתח חשוב משותף ב- AOPs שונים הרלוונטיים נוירוטוקסיות התפתחותית ומבוגרת 39 .
Rotenone צריך לעורר את ההפעלה של נתיב Nrf2, אשר ניתן להוכיח על ידי Nrf2 חלבון טרנסלוקציה גרעינית ביטוי מוגבר של אנזימים היעד Nrf2, כולל NQO1 ו SRXN1. נמצא כי rotenone גורם לגידול תלוי מינון של רמות חלבון GFAP, המעיד על הפעלת אסטרוציטים 40 , 41 . Rotenone גם מקטין את מספר תאים dopaminergic (TH + ), אשר עולה בקנה אחד עם previOus במבחנה ובבדיקות vivo המציגות רוטנון תלוי במוות דופאמינרגי, שכן סוג זה של נוירון רגיש במיוחד למתח חמצוני 21 , 22 , 23 .
לסיכום, זה hiPSC הנגזרות נוירונים ותאי גלייה התרבות מודל הוא כלי רב ערך כדי להעריך את ההשפעות הנוירוטוקסיות של כימיקלים המעוררים מתח חמצוני וכתוצאה מכך הפעלה נתיב Nrf2. כמו פרוטוקול הבחנה זה מאפשר את הדור של תרבויות מעורבות של תאים עצביים (GABAergic, dopaminergic, ו נוירונים glutamatergic) ו astrocytes, זה עשוי להוכיח מתאים ללמוד את crosstalk בין נוירונים וגליה בתנאים פיזיולוגיים ופתולוגיים, כגון מחלות נוירודגנרטיבית ( למשל, מחלת פרקינסון). יתר על כן, הנוכחות של חלק משמעותי של NSCs עשוי לעזור להעריך את ההשפעות האפשריות של כימיקלים על פרווה עצביתEnitors, אשר ידוע להיות היעד העיקרי של מוטציות הנגרמות כימית או זיהומים ויראליים 42 .
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות לד"ר מארק Peschanski (I-Stem, Évry, צרפת), על מתן IMR90-hiPSCs; ד"ר ג'ובאנה לזארי וד"ר סילביה קולוני (Avantea srl, קרמונה, איטליה); ד"ר סימון האפט (אוניברסיטת בון, גרמניה); ד"ר Tiziana Santini (המכון האיטלקי לטכנולוגיה, רומא), למתן ייעוץ על הערכת מכתים immunofluorescence; ד"ר בנדטה אקורדי, ד"ר אלנה רמפאצו וד"ר לוקה פרסאנו (אוניברסיטת פאדובה, איטליה), על תרומתם לניתוח ה- RPPA ולאימות הנוגדן. מימון: עבודה זו נתמכה על ידי האיחוד האירופי במימון פרויקט "SCR & Tox" (הסכם מענק מס '266753).
Materials
| Name | Company | Catalog Number | Comments |
| Complete hiPSC medium: | |||
| mTeSR1 Basal Medium | Stem Cell Technologies | 05851 | (Step 1.2.6). Complete mTeSR1 is stable when stored at 2 - 8°C for up to 2 weeks. 5X Supplements can be dispensed into working aliquots and stored at -20°C. Use frozen aliquots within 3 months. |
| mTeSR1 5X Supplements | Stem Cell Technologies | 05852 | |
| Matrigel hESC-qualified Matrix | Corning | 354277 | 1:100 (Step 1.1). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200ul aliquot in 20 ml of DMEM/F12 medium. |
| CryoStem Freezing Medium | Stemgent | 01-0013-50 | Freeze ~ 100 fragments/250 ul/vial (Step 1.2.1) |
| Name | Company | Catalog Number | Comments |
| hiPSC EB medium: | |||
| Knockout DMEM | Thermo-Fisher | 10829-018 | (Step 2.1.7) |
| Knockout Serum Replacement (KOSR) | Thermo-Fisher | 10828-028 | 20% final concentration (Step 2.1.7) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.1.7) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.1.7) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 2.1.7) |
| β-Mercaptoethanol | Thermo-Fisher | 31350-010 | 50 µM final concentration (Step 2.1.7) |
| Name | Company | Catalog Number | Comments |
| Complete neuroepithelial induction medium (NRI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 2.3.1) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 2.3.1) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.3.1) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.3.1) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 2.3.1) |
| bFGF | Thermo-Fisher | 13256-029 | 20 ng/ml final concentration added before use (Step 2.3.1) |
| Matrigel Basement Membrane Matrix | Corning | 354234 | 1:100 (Step 2.2). Thaw Matrigel on ice, prepare 200 ul aliquots and store them in -80°C. For coating, dilute 200 ul aliquot in 20 ml of cold DMEM/F12 medium. |
| Laminin | Sigma-Aldrich | L2020 | 1:100 (Step 2.2). Dilute in PBS 1X. |
| Name | Company | Catalog Number | Comments |
| Complete Neuronal Differentiation medium (ND): | |||
| Neurobasal Medium | Thermo-Fisher | 21103049 | (Step 2.4.11) |
| B-27 Supplements (50x) | Thermo-Fisher | 17504044 | (Step 2.4.11) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 2.4.11) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 2.4.11) |
| GDNF | Thermo-Fisher | PHC7045 | 1 ng/ml final concentration. Added before use. (Step 2.4.11) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use. (Step 2.4.11) |
| Name | Company | Catalog Number | Comments |
| Neural induction medium (NI): | |||
| DMEM/F12 | Thermo-Fisher | 3133-038 | (Step 3.3) |
| Non-Essential Amino Acids | Thermo-Fisher | 11140-035 | (Step 3.3) |
| N2 Supplement | Thermo-Fisher | 17502-048 | (Step 3.3) |
| Penicillin/Streptomycin | Thermo-Fisher | 15140-122 | 50 U/mL final concentration (Step 3.3) |
| Heparin Grade I-A, ≥180 USP units/mg | Sigma-Aldrich | H3149-100KU | 2 µg/ml final concentration (Step 3.3) |
| B-27 Supplement (50X), minus vitamin A | Thermo-Fisher | 12587010 | (Step 3.3) |
| L-Glutamine 200 mM Solution | Thermo-Fisher | 25030-081 | 2 mM final concentration (Step 3.3) |
| bFGF | Thermo-Fisher | 13256-029 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| EGF | Thermo-Fisher | PHG6045 | 10 ng/ml final concentration. Added before use (Step 3.3) |
| BDNF | Thermo-Fisher | PHC7074 | 2.5 ng/ml final concentration. Added before use (Step 3.3) |
| Defined Trypsin Inhibitor (DTI) | Thermo-Fisher | R007-100 | Pre-warm at 37°C. Add an equal amount of DTI to Trypsin-EDTA (Step 3.10) |
| Trypsin-EDTA (0.5%), no phenol red | Thermo-Fisher | 15400054 | 1:10. Dilute Trypsin-EDTA in PBS 1x (without calcium and magnesium), pre-warm the solution at 37°C (Step 3.8) |
| CryoStor cell cryopreservation medium | Sigma-Aldrich | C2874-100ML | (Step 4.2) |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| Name | Company | Catalog Number | Comments |
| TaqMan Probesets and reagents for gene expression analysis: | |||
| RNAqueous-Micro kit | Thermo-Fisher | AM1931 | (Step 5.1.6) |
| High Capacity cDNA Reverse Transcription Kits | Thermo-Fisher | 4368814 | |
| TaqMan Gene Expression Master Mix | Thermo-Fisher | 4369016 | |
| GFAP | Thermo-Fisher | Hs00909233_m1 | |
| MAP2 | Thermo-Fisher | Hs00258900_m1 | |
| NQO1 | Thermo-Fisher | Hs02512143_s1 | |
| SRXN1 | Thermo-Fisher | Hs00607800_m1 | |
| HMOX1 | Thermo-Fisher | Hs01110250_m1 | |
| GSR | Thermo-Fisher | Hs00167317_m1 | |
| PAX6 | Thermo-Fisher | Hs01088112_m1 | |
| NES | Thermo-Fisher | Hs00707120_s1 | |
| GRIA1 | Thermo-Fisher | Hs00181348_m1 | |
| GAP43 | Thermo-Fisher | Hs00967138_m1 | |
| GABRA3 | Thermo-Fisher | Hs00968132_m1 | |
| GABRA1 | Thermo-Fisher | Hs00168058_m1 | |
| NR4A2 | Thermo-Fisher | Hs00428691_m1 | |
| TH | Thermo-Fisher | Hs00165941_m1 | |
| GAPDH | Thermo-Fisher | Hs02758991_g1 | |
| ACTB | Thermo-Fisher | Hs99999903_m1 | |
| MAPT | Thermo-Fisher | Hs00902194_m1 | |
| SYP | Thermo-Fisher | Hs00300531_m1 | |
| NANOG | Thermo-Fisher | Hs04260366_g1 | |
| POU5F1 (OCT4) | Thermo-Fisher | Hs04195369_s1 | |
| SOX1 | Thermo-Fisher | Hs01057642_s1 | |
| AFP | Thermo-Fisher | Hs00173490_m1 | |
| KRT18 | Thermo-Fisher | Hs01941416_g1 | |
| NPPA | Thermo-Fisher | Hs00383230_g1 | |
| T | Thermo-Fisher | Hs00610080_m1 | |
| NCAM1 | Thermo-Fisher | Hs00941821_m1 | |
| NR4A1 | Thermo-Fisher | Hs00374226_m1 | |
| PHOX2A | Thermo-Fisher | Hs00605931_mH | |
| PHOX2B | Thermo-Fisher | Hs00243679_m1 | |
| NARG2 | Thermo-Fisher | Hs00973298_g1 | |
| SLC18A3 | Thermo-Fisher | Hs00268179_s1 | |
| SLC5A7 | Thermo-Fisher | Hs00222367_m1 | |
| ISL1 | Thermo-Fisher | Hs00158126_m1 | |
| LHX3 | Thermo-Fisher | Hs01033412_m1 | |
| TaqMan Human Protein Kinase Array | Thermo-Fisher | 4418721 | |
| Name | Company | Catalog Number | Comments |
| Antibodies and reagents for immunostaining: | |||
| B-III-tubulin (Tuj1) | Covance | MMS-435P | 1:500 (Step 5.2.5). Other antibodies may also be used. |
| MAP2 | Sigma Aldrich | M4403 | 1:500 |
| NF200 | Sigma Aldrich | N4142 | 1:1000 |
| GFAP | Acris Antibodies GmbH | AP02002SU-N | 1:500 |
| Nestin | Sigma-Aldrich | N5413 | 1:200 |
| synaptophysin (SYN) | Abcam | AB14692 | 1:200 |
| Tau | Thermo-Fisher | MA5-12808 | 1:100 |
| Nrf2 | Abcam | AB62352 | 1:200 |
| Keap1 | Abcam | AB66620 | 1:200 |
| sulfiredoxin1 (SRXN1) | Abcam | AB92298 | 1:200 |
| NAD(P)H quinone oxidoreductase 1 (NQO1) | Abcam | AB2346 | 1:200 |
| OCT4 | Millipore | MAB4401 | 1:100 |
| SSEA3 | Millipore | MAB4303 | 1:100 |
| Tra1-60 | Millipore | MAB4360 | 1:250 |
| Tyrosine hydroxylase (TH) | Millipore | AB152 | 1:200 |
| Gamma-aminobutyric acid (GABA) | Sigma-Aldrich | A0310 | 1:100 |
| Vesicular glutamate transporter 1 (VGlut1) | Abcam | AB72311 | 1:500 |
| Paraformaldehyde | Sigma-Aldrich | P6148-500G | 4% (4% formaldehyde can also be used) |
| DPBS, no calcium, no magnesium | Thermo-Fisher | 14190144 | |
| Triton-X-100 Solution | Sigma-Aldrich | 93443-100ML | 0.1% |
| BSA 35% | Sigma-Aldrich | A7979-50ML | 3.5% |
| Donkey anti-Rabbit IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 594 conjugate | Thermo-Fisher | SA5-10040 | 1:500. (Step 5.2.7) Other fluorochrome-conjugated secondary antibodies may also be used. In this case, appropriate dilutions should be tested by the enduser. |
| Donkey anti-Mouse IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10166 | 1:500 |
| Donkey anti-Goat IgG (H+L) Cross Adsorbed Secondary Antibody, DyLight 488 conjugate | Thermo-Fisher | SA5-10086 | 1:500 |
| DAPI Solution (1 mg/ml) | Thermo-Fisher | 62248 | 1:1000 (Step 5.2.7) |
| Name | Company | Catalog Number | Comments |
| Antibodies for Reverse Phase Protein Array (RPPA): | |||
| 4E-BP1 (S65) | Abcam | AB81297 | 1:250 (Note after step 5.2.8) |
| Akt (T308) | Cell Signaling | 9275 | 1:100 |
| Akt (S473) | Cell Signaling | 9271 | 1:100 |
| AMPKalpha (T172) | Cell Signaling | 2531 | 1:100 |
| AMPKbeta1 (S108) | Cell Signaling | 4181 | 1:100 |
| ATF-2 (T71) | Cell Signaling | 9221 | 1:100 |
| c-Jun (S63) | Cell Signaling | 9261 | 1:200 |
| c-Jun (S73) | Cell Signaling | 9164 | 1:200 |
| c-Kit (Y719) | Cell Signaling | 3391 | 1:250 |
| CREB (S133) | Cell Signaling | 9191 | 1:100 |
| EGFR (Y1068) | Cell Signaling | 2234 | 1:50 |
| ErbB2/HER2 (Y1248) | Cell Signaling | 2247 | 1:100 |
| ERK 1/2, p44/42 (T202/Y204) | Cell Signaling | 9101 | 1:2000 |
| GSK-3alpha (S21) | Cell Signaling | 9337 | 1:50 |
| Jak1 (Y1022/1023) | Cell Signaling | 3331 | 1:100 |
| Lck (Y505) | Cell Signaling | 2751 | 1:500 |
| LKB1 (S428) | Cell Signaling | 3051 | 1:100 |
| mTOR (S2448) | Cell Signaling | 5536 | 1:100 |
| NFkB p65 (S536) | Cell Signaling | 3031 | 1:50 |
| p70 S6 Kinase (T389) | Cell Signaling | 9205 | 1:200 |
| PDK1 (S241) | Cell Signaling | 3061 | 1:100 |
| PKA C (T197) | Cell Signaling | 4781 | 1:250 |
| PRAS40 (T246) | BioSource | 44-1100 | 1:2000 |
| PTEN (S380) | Cell Signaling | 9551 | 1:500 |
| Smad1 (S463/465), Smad5 (S463/465), Smad8 (S426/428) | Cell Signaling | 9511 | 1:500 |
| Src (Y527) | Cell Signaling | 2105 | 1:500 |
| Src Family (Y416) | Cell Signaling | 2101 | 1:200 |
| Stat1 (Y701) | Cell Signaling | 9171 | 1:200 |
| Stat3 (S727) | Cell Signaling | 9134 | 1:200 |
| Zap-70 (Y319) | Enogene | E011159 | 1:100 |
| βCatenin (S33/37/T41) | Cell Signaling | 9561 | 1:250 |
| CREB | Upstate Biotechnologies | 06-863 | 1:100 |
| Fos B | Cell Signaling | 2251 | 1:200 |
| GRB2 | Cell Signaling | 3972 | 1:2000 |
| HSP70 | Stressgen | SPA-810 | 1:100 |
| c-Jun | Cell Signaling | 9165 | 1:100 |
| Kip1/p27 | BD | 610241 | 1:100 |
| Lck | Cell Signaling | 2984 | 1:250 |
| Mcl-1 | Cell Signaling | 4572 | 1:80 |
| Musashi | Cell Signaling | 2154 | 1:100 |
| NOTCH1 | Cell Signaling | 3439 | 1:100 |
| PTEN | Cell Signaling | 9552 | 1:500 |
| SGK1 | Abnova | PAB4590 | 1:250 |
| Zap-70 | Cell Signaling | 2705 | 1:250 |
| β-Catenin | Abcam | AB32572 | 1:1000 |
| Dll4 | Abcam | AB7280 | 1:500 |
| Shh | Abcam | AB53281 | 1:250 |
| HIF-1α | BD | 610958 | 1:50 |
| NUMB PAN-ISO | Upstate Biotechnologies | 07-207 | 1:400 |
| NUMB-L | Chemicon | AB15145 | 1:750 |
| Cyclin B | BD | 610220 | 1:75 |
| c-Myc | Calbiochem | OP-10 | 1:100 |
| BCIP/NBT Kit | Thermo-Fisher | 002209 | (Note after step 5.2.8). Kit used to measure alkaline phosphatase activity, similar kits can be used. |
| Name | Company | Catalog Number | Comments |
| Antibodies for Flow Cytometry: | |||
| SSEA1 Antibody, Pacific Blue conjugate | Thermo-Fisher | MHCD1528 | 1:100 (Note after step 5.2.8) |
| SSEA4 Antibody (MC813-70), Alexa Fluor 647 | Thermo-Fisher | SSEA421 | 1:100 |
| Name | Company | Catalog number | Comments |
| Specific instruments, tools and softwares: | |||
| Countess Automated Cell Counter | Thermo-Fisher | C10227 | Neubauer chamber or other suitable glass hemocytometer can be used. |
| MEA1060-Inv-BC | Multichannel Systems | MEA1060-Inv-BC | (Step 5.3) |
| MEA1060-BC control software | Multichannel Systems | MEA1060-BC | (Step 5.3) |
| NeuroExplorer | Multichannel Systems | NeuroExplorer (NE) | (Step 5.3) For post-processing of MEA data |
| Multielectrode arrays (MEA) | Multichannel Systems | 60MEA100/10iR-Ti-gr | (Step 5.3) Single-well MEA chip |
| ArrayScan XTI High Content Platform | Thermo-Fisher | ASN00002P | (Step 5.2.8) Mean fluorescence can be quantified by using specific ArrayScan algorithms (e.g., Cytotoxicity V.4 and NucTrans V.4 bioapplications). It is recommended to take minimum 20 pictures/well, and have 7-8 internal replicates per condition |
| 7900HT Fast Real-Time PCR System | Thermo-Fisher | 4351405 | (Step 5.1.6) |
| BD ULTRA-FINE Needle Insulin Syringe (with 30G needle) | BD | 328280 | (Steps 1.3.1, 2.1.2, and 2.4.1) |
| StemPro EZPassage Disposable Stem Cell Passaging Tool | ThermoFisher | 23181010 | This colony cutting tool can be used as an alternative to the use of 30G needle 1 mL syringes (Step 1.3.1) |
| Ultra-Low attachment Petri dish (60 mm) | Corning | 10010582 | (Step 2.1.8) Also other brands can be used. |
| Mr. Frosty Freezing container | Sigma-Aldrich | C1562-1EA | |
References
- NRC. . Toxicity Testing in the 21st Century: A Vision and a Strategy. , (2007).
- Drews, K., Jozefczuk, J., Prigione, A., Adjaye, J. Human induced pluripotent stem cells--from mechanisms to clinical applications. J Mol Med (Berl). 90 (7), 735-745 (2012).
- Ho, P. J., Yen, M. L., Yet, S. F., Yen, B. L. Current applications of human pluripotent stem cells: possibilities and challenges. Cell Transplant. 21 (5), 801-814 (2012).
- Krueger, W. H., Swanson, L. C., Tanasijevic, B., Rasmussen, T. P. Natural and artificial routes to pluripotency. Int J Dev Biol. 54 (11-12), 1545-1564 (2010).
- Pistollato, F., Bremer-Hoffmann, S., Healy, L., Young, L., Stacey, G. Standardization of pluripotent stem cell cultures for toxicity testing. Expert Opin Drug Metab Toxicol. 8 (2), 239-257 (2012).
- Pistollato, F., et al. Development of a pluripotent stem cell derived neuronal model to identify chemically induced pathway perturbations in relation to neurotoxicity: effects of CREB pathway inhibition. Toxicol Appl Pharmacol. 280 (2), 378-388 (2014).
- Zagoura, D., Canovas-Jorda, D., Pistollato, F., Bremer-Hoffmann, S., Bal-Price, A. Evaluation of the rotenone-induced activation of the Nrf2 pathway in a neuronal model derived from human induced pluripotent stem cells. Neurochem Int. , (2016).
- Standard operating procedure for differentiation of human induced pluripotent stem cells into post-mitotic neurons and glial cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-differentiation-of-human-induced-pluripotent-stem-cells-into-post-mitotic-neurons-and-glial-cells-%28mixed-culture%29-protocol-no.-165/key/p_1570 (2016)
- Standard operating procedure for expansion of rosette-derived neural stem cells. EURL ECVAM Available from: https://ecvam-dbalm.jrc.ec.europa.eu/methods-and-protocols/protocol/standard-operating-procedure-for-expansion-of-rosette-derived-neural-stem-cells-protocol-no.-166/key/p_1571 (2016)
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc. 3 (6), 1101-1108 (2008).
- Brien, P. J., et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening. Arch Toxicol. 80 (9), 580-604 (2006).
- Accordi, B., et al. Functional protein network activation mapping reveals new potential molecular drug targets for poor prognosis pediatric BCP-ALL. PLoS One. 5 (10), e13552 (2010).
- Vassallo, A., et al. A multi-laboratory evaluation of microelectrode array-based measurements of neural network activity for acute neurotoxicity testing. Neurotoxicology. , (2016).
- Shamblott, M. J., et al. Human embryonic germ cell derivatives express a broad range of developmentally distinct markers and proliferate extensively in vitro. Proc Natl Acad Sci U S A. 98 (1), 113-118 (2001).
- Bryan, H. K., Olayanju, A., Goldring, C. E., Park, B. K. The Nrf2 cell defence pathway: Keap1-dependent and -independent mechanisms of regulation. Biochem Pharmacol. 85 (6), 705-717 (2013).
- Tufekci, K. U., Civi Bayin, E., Genc, S., Genc, K. The Nrf2/ARE Pathway: A Promising Target to Counteract Mitochondrial Dysfunction in Parkinson's Disease. Parkinsons Dis. , 314082 (2011).
- Kovac, S., et al. Nrf2 regulates ROS production by mitochondria and NADPH oxidase. Biochim Biophys Acta. 1850 (4), 794-801 (2015).
- Lee, J. M., Shih, A. Y., Murphy, T. H., Johnson, J. A. NF-E2-related factor-2 mediates neuroprotection against mitochondrial complex I inhibitors and increased concentrations of intracellular calcium in primary cortical neurons. J Biol Chem. 278 (39), 37948-37956 (2003).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236 (2), 313-322 (1997).
- Li, L., et al. Nrf2/ARE pathway activation, HO-1 and NQO1 induction by polychlorinated biphenyl quinone is associated with reactive oxygen species and PI3K/AKT signaling. Chem Biol Interact. , 56-67 (2014).
- Cannon, J. R., et al. A highly reproducible rotenone model of Parkinson's disease. Neurobiol Dis. 34 (2), 279-290 (2009).
- Sherer, T. B., Kim, J. H., Betarbet, R., Greenamyre, J. T. Subcutaneous rotenone exposure causes highly selective dopaminergic degeneration and alpha-synuclein aggregation. Exp Neurol. 179 (1), 9-16 (2003).
- Testa, C. M., Sherer, T. B., Greenamyre, J. T. Rotenone induces oxidative stress and dopaminergic neuron damage in organotypic substantia nigra cultures. Brain Res Mol Brain Res. 134 (1), 109-118 (2005).
- Zhou, J., et al. High-efficiency induction of neural conversion in human ESCs and human induced pluripotent stem cells with a single chemical inhibitor of transforming growth factor beta superfamily receptors. Stem Cells. 28 (10), 1741-1750 (2010).
- Topol, A., Tran, N. N., Brennand, K. J. A Guide to Generating and Using hiPSC Derived NPCs for the Study of Neurological Diseases. J Vis Exp. (96), e52495 (2015).
- Jiang, Y., Zhang, M. J., Hu, B. Y. Specification of functional neurons and glia from human pluripotent stem cells. Protein Cell. 3 (11), 818-825 (2012).
- Parsons, X. H., et al. Efficient derivation of human neuronal progenitors and neurons from pluripotent human embryonic stem cells with small molecule induction. J Vis Exp. (56), e3273 (2011).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7 (10), 1836-1846 (2012).
- Zeng, H., et al. Specification of region-specific neurons including forebrain glutamatergic neurons from human induced pluripotent stem cells. PLoS One. 5 (7), e11853 (2010).
- Zeng, X., et al. An in vitro model of human dopaminergic neurons derived from embryonic stem cells: MPP+ toxicity and GDNF neuroprotection. Neuropsychopharmacology. 31 (12), 2708-2715 (2006).
- Paşca, A. M., et al. Functional cortical neurons and astrocytes from human pluripotent stem cells in 3D culture. Nat Methods. 12 (7), 671-678 (2015).
- Almeida, S., et al. Modeling key pathological features of frontotemporal dementia with C9ORF72 repeat expansion in iPSC-derived human neurons. Acta Neuropathol. 126 (3), 385-399 (2013).
- Urbán, N., Guillemot, F. Neurogenesis in the embryonic and adult brain: same regulators, different roles. Front Cell Neurosci. 8, 396 (2014).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annu Rev Neurosci. 32, 149-184 (2009).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. J., Zhang, S. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nat Biotechnol. 29 (6), 528-534 (2011).
- Krencik, R., Zhang, S. C. Directed differentiation of functional astroglial subtypes from human pluripotent stem cells. Nat Protoc. 6 (11), 1710-1717 (2011).
- Nguyen, T., Nioi, P., Pickett, C. B. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress. J Biol Chem. 284 (20), 13291-13295 (2009).
- Bal-Price, A., et al. Putative adverse outcome pathways relevant to neurotoxicity. Crit Rev Toxicol. 45 (1), 83-91 (2015).
- Cabezas, R., El-Bacha, R. S., Gonzalez, J., Barreto, G. E. Mitochondrial functions in astrocytes: neuroprotective implications from oxidative damage by rotenone. Neurosci Res. 74 (2), 80-90 (2012).
- Swarnkar, S., et al. Astrocyte activation: a key step in rotenone induced cytotoxicity and DNA damage. Neurochem Res. 37 (10), 2178-2189 (2012).
- Canovas-Jorda, D., Louisse, J., Pistollato, F., Zagoura, D., Bremer, S. Regenerative toxicology: the role of stem cells in the development of chronic toxicities. Expert Opin Drug Metab Toxicol. 10 (1), 39-55 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved