A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام هيستوتشيميستري الزنك متشابك للكشف عن مختلف المناطق وعن في الدماغ النامي والكبار
In This Article
Summary
يصف لنا إجراء histochemical الذي يكشف عن الزنك الصفحي ومساحية مميزة تلطيخ أنماط في مناطق مختلفة من الدماغ. قد تستخدم نمط تلوين الزنك بالاقتران مع علامات تشريحية أخرى موثوق بها التمييز بين الطبقات والمناطق في الدماغ النامي والكبار.
Abstract
وصف المنظمة الدماغ التشريحية والوظيفية والتنمية يتطلب التحديد الدقيق للدوائر العصبية متميزة ومناطق في الدماغ غير ناضجة والكبار. هنا يصف لنا إجراء زنك المصبوغة histochemical الذي يكشف عن الاختلافات في أنماط المصبوغة بين طبقات مختلفة ومناطق الدماغ. الآخرين قد تستخدم هذا الإجراء ليس فقط لتكشف عن توزيع الدوائر في الدماغ والخلايا العصبية المحتوية على الزنك، ولكن أيضا لترسيم الحدود المساحية وطبقية في الدماغ النامي والكبار في العديد من الأنواع بنجاح. هنا يمكننا توضيح هذا تلطيخ الإجراء مع الصور من البلدان النامية والعقول النمس الكبار. ونحن تكشف عن نمط تلوين الزنك بمثابة علامة تشريحية للمناطق والطبقات، ويمكن استخدامها للتمييز بين المناطق القشرية البصرية في القشرة البصرية النامية والكبار موثوق بها. والهدف الرئيسي من هذا البروتوكول هو تقديم أسلوب histochemical التي تسمح تحديد دقيق للطبقات والمناطق في الدماغ النامي والكبار حيث تفشل الطرق الأخرى للقيام بذلك. ثانوي، بالاقتران مع تحليل الصورة دينسيتوميتريك، هذا الأسلوب يسمح أحد لتقييم توزيع الزنك متشابك للكشف عن التغيرات المحتملة في جميع أنحاء التنمية. ويصف هذا البروتوكول بالتفصيل الكواشف، والأدوات والخطوات اللازمة تباعا وصمة عار أقسام الدماغ المجمدة. على الرغم من أن يتم وصف هذا البروتوكول باستخدام أنسجة المخ النمس، بسهولة يمكن تكييفها للاستخدام في القوارض أو القطط أو القرود، وكذلك كما هو الحال في مناطق أخرى من الدماغ.
Introduction
وقد استخدمت تقليديا البقع النسيجي للمساعدة في تحديد المناطق القشرية في الأنواع المختلفة عن طريق الكشف عن الاختلافات في ملامح معمارية. الجمع بين استخدام تقنيات histochemical مثل لمادة نسل أو مفاعليه السيتوكروم أوكسيديز (CO)، أو المايلين يمكن أن يكون مثمرا كما أنها تكشف عن الحدود المساحية مشابهة في الدماغ الكبار. ومع ذلك، لا تكشف هذه البقع histochemical دائماً على نحو كاف حدود واضحة بين المناطق القشرية والطبقات في الدماغ غير ناضجة.
في الجهاز العصبي المركزي، الزنك لديه العديد من الوظائف الحيوية التي تشمل استقرار بنية الحمض النووي، بوصفها مساعد إنزيم، المشاركة في العديد من المهام التنظيمية، ووصفها نيورومودولاتور من خلال وجودها في حويصلات متشابك 1-الزنك متشابك فريدة من نوعها، فإنه يمكن تصور استخدام أساليب غذائها، بينما الزنك البروتين زمنياً لا يمكن تصور2. وقد استغلت هذه الميزة لتكشف عن نمط متشابك الزنك في مختلف المناطق القشرية، والزنك متشابك هيستوتشيميستري وقد استخدمت في عدد من الدراسات. مجموعة فرعية من جلوتاماتيرجيك الخلايا العصبية في قشرة الدماغ تحتوي على الزنك في الحويصلات presynaptic داخل تلك المحطات إكسون3،4. وقد كشفت الدراسات histochemical توزيع غير متجانس من الزنك متشابك في قشرة الدماغ5،،من67. يبدو أن هناك توزيعاً مساحية وطبقية مختلفة من الزنك هيستوتشيميكالي رد الفعل في مختلف المناطق القشرية (مثلاً، البصرية مقابل قشرة somatosensory)، أو طبقات (مثلاً، مستويات الزنك في سوبراجرانولار و إينفراجرانولار طبقات من القشرة البصرية الأولية أعلى بكثير من طبقة الإدخال الرابع ثالاموكورتيكال مع مستويات منخفضة نسبيا من الزنك متشابك)5،،من89. عدم تجانس في تلوين الزنك متشابك في القشرة مفيد خاصة حيث أنها تسهل تحديد مساحية وطبقية.
وهنا يقدم وصفاً مفصلاً لإجراء histochemical الزنك متشابك، ونسخة معدلة من دانشير في عام 1982 الأسلوب10. ويستخدم هذا الأسلوب سيلينيت حقن إينترابيريتونيلي (IP) إلى الحيوانات كعامل شيلاتينغ. سيلينيت يسافر إلى الدماغ لتتفاعل مع تجمعات الزنك الحرة الموجودة في حويصلات من مجموعة فرعية من جلوتاماتيرجيك نقاط الاشتباك العصبي في الدماغ. رد الفعل هذا غلة متسرعا التي يمكن تعزيزها بعد ذلك بوضع الفضة2،،من1011.
ويكشف هذا الإجراء الأنماط الصفحي والمساحية لتلوين الزنك متشابك؛ يمكن استخدام تحليل دينسيتوميتريك لتقييم هذه الأنماط كمياً ونوعيا في الدماغ الكبار وغير ناضجة لدراسة تأثيرات التدخلات الأخرى، مثل التلاعب الحسية والبيئية والدوائية، أو الوراثية. وعلاوة على ذلك، واحد قد تحتاج أيضا لتقييم التغيرات الإنمائية المحتملة في توزيع الزنك متشابك في الهياكل القشرية أو سوبكورتيكال الأخرى في نظم نموذجية أخرى. المعلومات الكمية التي يوفر تحليل دينسيتوميتريك في هذا الأسلوب يمكن أن تكون مفيدة لنمو الدماغ التالية مع مرور الوقت. يوفر هذا البروتوكول مصاحب لغيرها المناعية-وعلامات histochemical للكشف عن حدود الصفحي والمساحية.
Protocol
البروتوكول التالي المبادئ التوجيهية رعاية الحيوان أنشأ "مؤسسات الرعاية الحيوانية" واستخدام اللجنة (إياكوك) في "مدينة كلية نيويورك"، التي تتوافق مع كل دولة مناسبة والمبادئ التوجيهية الاتحادية. التخدير المناسب لفرت، وينبغي تعديلها وفقا للأنواع التي شملتها الدراسة.
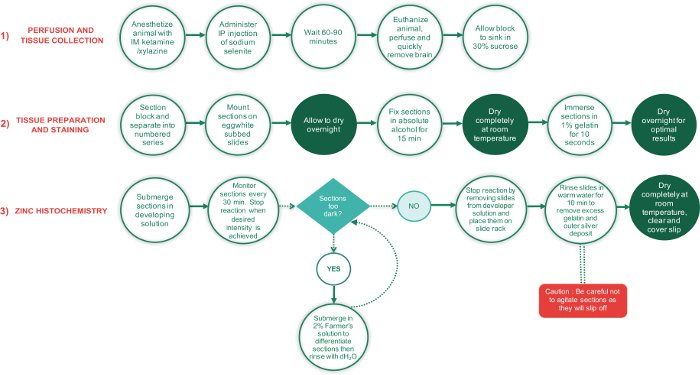
رقم 1: مخطط انسيابي يبين الخطوات الرئيسية التي تنطوي عليها في المراحل 3 من هذا البروتوكول والوقت اللازم لإتمام كل خطوة. الفترات التي تتطلب الأقسام لتجف تماما ترد في نص أخضر دوائر، بينما جميع الخطوات الأخرى في دوائر نص أبيض. مربع النص على شكل الماس الأخضر نقطة قرار، بينما المستطيل الأحمر خطوة بالغة الأهمية، وينبغي أن يقوم بمزيد من العناية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
1-"الخطوات التحضيرية" (الشريحة سوبينج ويجعل الحل)
- تغسل شرائح أونسوبيد بمطهر في الماء الساخن ويشطف عدة مرات في المياه الدافئة التي اتبعت مع شطف ماء مقطر دقة إزالة أي أوساخ أو الحطام. السماح للشرائح لتجف في درجة حرارة الغرفة أو في فرن في 37 درجة مئوية.
- بمجرد شرائح جافة تماما، طبقة طبقة حتى رقيقة من البيض الأبيض على كل شريحة باستخدام الأصابع أو الرسام. السماح لتجف في الفرن عند 60 درجة مئوية لمدة 20-30 دقيقة. لتحقيق أفضل النتائج وتجنب الانزلاق خارج أبواب، إضافة طبقة ثانية من البيض الأبيض والسماح لتجف مرة أخرى في الفرن 60 ° C.
- تعد حلاً جيلاتين 1% بإذابة 1 غرام من الجيلاتين في 100 مل ماء الساخن (60 درجة مئوية) والسماح لتبرد بدرجة حرارة الغرفة-
- إعداد 200 مل من محلول المطور كما هو موضح أدناه للاستخدام في الفرع 4-
- تحضير الصمغ العربي الحل بإضافة 40 ز ببطء في زيادات إلى 120 مل ماء الساخن (أنه يذوب بسهولة بهذه الطريقة). تواصل إثارة الحل مع كوب إثارة رود. بمجرد أن الحل قد حلت تماما، إزالته من الحرارة، والسماح لها ببارد لبضع دقائق، ثم تصفيتها من خلال 6-8 طبقات من القماش الشاش في قمع-
- سترات إعداد المخزن المؤقت عن طريق إضافة سترات الصوديوم حمض الستريك بالإضافة إلى 4.7 ز ز 5.04 في 20 مل dH 2 س وتذويب الخليط. التأكد من أن الرقم الهيدروجيني لهذا الحل هو 4.0 في 25 ° جيم ضبط الأس الهيدروجيني إذا لزم الأمر بإضافة هيدروكسيد الصوديوم أو حمض الهيدروكلوريك إلى الحل.
- إعداد حل الهيدروكينون بتدفئة 30 مل dH 2 س وتذويب ز 1.7 من الهيدروكينون-
ملاحظة: تسخين الهيدروكينون الحل ضروري للسماح تذوب بسهولة في الماء كما الهيدروكينون ليس ديسولفابل سهولة في الماء في درجة حرارة الغرفة. كن حذراً الحفاظ على درجة حرارة الماء أقل من 60 درجة مئوية، وإلا قد تكون تتأكسد الهيدروكينون. إذا كان الحل الذي يتحول إلى اللون الأصفر، تجاهل وتعد حلاً جديداً آخر. - لاكتات الفضة تحضير الحل بتذويب ز 0.22 في 30 مل من dH 2 o.
- ميكس الحلول (1.4.1-1-4-4) في النظام التي يرد فيها عندما تكون جاهزاً القيام بردود فعل (أي، بعد تمزيقها والتجفيف، وإصلاح) ( الشكل 2). إضافة حل لاكتات الفضة في النهاية. ضمان أن يتم إكمال هذه الخطوة بسرعة ويتم وضع الحل المطور في الظلام حتى حان الوقت للرد الأقسام كما لاكتات الفضة حساس.
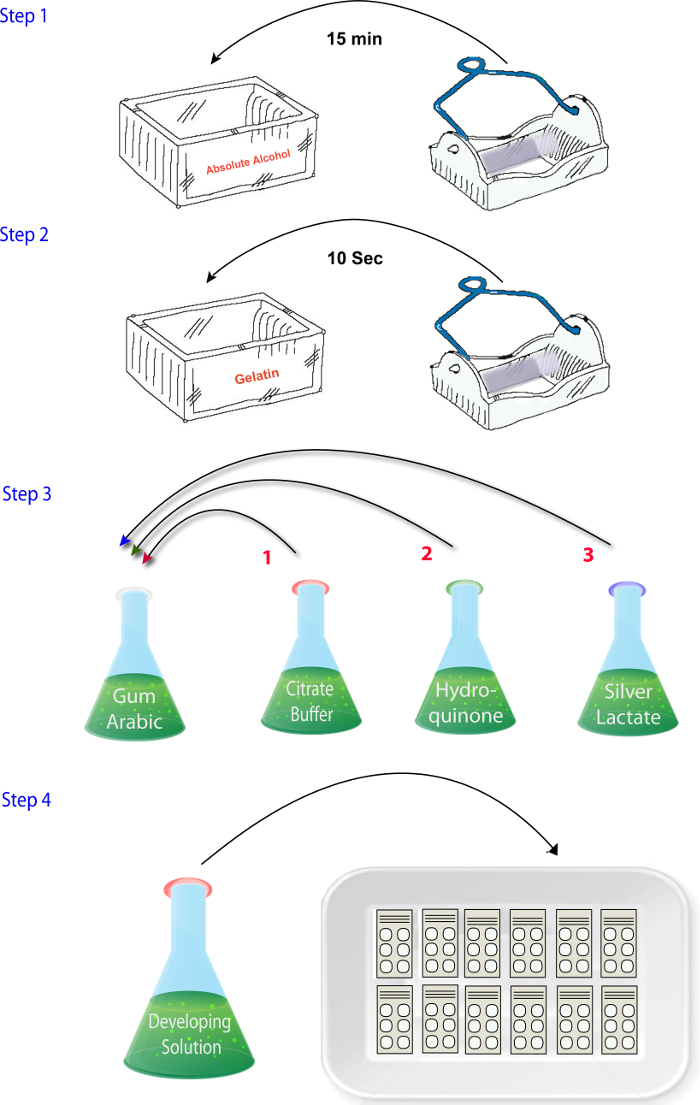
رقم 2: التخطيطي يوضح تسلسل الخطوات التي تنطوي عليها في خلط الكواشف في المرحلة هيستوتشيميستري الزنك البروتوكول. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
2-معاملة الحيوان والتخدير
- قبل المسكنة الحيوان، وتعد حلاً سيلينيت (نا 2 كبار المسئولين الاقتصاديين 3) صوديوم 1% بتذويب 10 مغ سيلينيت الصوديوم في 1 مل dH 2 o.
- تخدير الحيوان مع حقن العضلي من الكيتامين (25 ملغ/كغ) وإكسيلازيني (2 مغ/كغ)-
ملاحظة: ضمان تحقيق مستوى مناسب من التخدير باستخدام استجابة منعكس الدواسة. - إدخال الزنك chelator الحل سيلينيت الصوديوم (15 مغ/كغ) إينترابيريتونيلي (IP)-
ملاحظة: يمكن أن تختلف سمية سيلينيت الصوديوم في إعمار مختلفة أو في الأنواع الأخرى-
السماح - 60 إلى 90 دقيقة سيلينيت الصوديوم للسفر إلى الدماغ. وخلال هذه الفترة، لا بد من التأكد من أن الحيوان هو مخدراً بشكل صحيح، وهو لا يستجيب، حتى تحقق عمق التخدير كل دقيقة 5
- خلال فترة سيلينيت، بينما تم تخديره من الحيوان، ضمان أن يتم إغلاق العينين لمنع جفاف، أو إدارة مرهم العيون لإبقائها رطبة.
3. إعداد الأنسجة وستينينج
- Euthanize الحيوان بالدولة القائمة بجرعة زائدة من الصوديوم بينتوباربيتال (100 مغ/كغ، والملكية الفكرية)-
- إجراء نضح ترانسكارديال مع المحلول الملحي العادي لمدة 1 دقيقة، ومع بارافورمالدهيد 4% عن 20 دقيقة وأخيراً، إدارة حلاً مع السكروز بارافورمالدهيد و 10% 4% (فترة تثبيت الكامل من ح 1)-
- إزالة الرأس باستخدام زوج من مقص كبير.
- جعل شق خط الوسط باستخدام مشرط من الآنف في الرقبة لفضح الجمجمة.
- بعناية إزالة الدماغ وفصل في نصفي الكرة الأرضية مع شفرة-
- بلوك في الجزء الخلفي من الدماغ و postfix في بارافورمالدهيد 4 ٪ في المخزن المؤقت للفوسفات 0.1 M (الجريدة الرسمية) لعدة ساعات-
- وضع الكتل في حل سكروز 30% في الجريدة الرسمية م 0.1 وتسمح للدماغ بالوعة.
ملاحظة: استبدال محلول السكروز بارافورمالدهيد و 30% 4% مع محلول السكروز 30% في الجريدة الرسمية م 0.1 بالوعة الدماغ يحد المخ ' s التعرض إلى بارافورمالدهيد كهذا يمكن أن يؤثر على الأنسجة تلطيخ الجودة.
المصارف - مرة واحدة في الدماغ، قطع شبه عرضية 40 ميكرومتر أبواب سميكة من خلال القشرة البصرية أو المنطقة لمصلحة في تجميد أو انزلاق مبضع أو كريوستات. يمكن تحقيق هذا عن طريق وضع الكتلة مع الآنسي السطحية إلى أسفل والتسوية بلطف مع شريحة زجاجية.
- جمع المقاطع مع الرسام ومخزن في مواجهة صندوق يحتوي على الفوسفات مخزنة المالحة (PBS).
- فصل المقاطع إلى سلسلة رقمية منفصلة. جبل فورا واحدة أو سلسلتين من أقسام الدماغ على الشرائح subbed البيض الأبيض (الجزء 1)، تسمح للمبيت جاف في درجة حرارة الغرفة، وعملية الأقسام هيستوتشيميكالي بالنسبة للزنك متشابك.
ملاحظة: قد يتم معالجة سلسلة أخرى لعلامات أخرى للمقارنة، مثل المايلين 12 أو السيتوكروم أوكسيديز باستخدام بروتوكول تعديل 13: احتضانها ح 2-8 عند 40 درجة مئوية مع السكروز 3%، 0.015% السيتوكروم ج، كاتالاز 0.015%، و 0.02% ديامينوبينزيديني في الجريدة الرسمية م 0.1. قد تستعمل أيضا مادة نسل كعلامة النسيجي لتمييز المناطق القشرية البصرية. لا تتطلب هذه البقع النسيجي الأخرى أن أقسام الدماغ هي التي شنت على الشرائح subbed البيض الأبيض، حيث يمكن استخدام الشرائح التقليدية الجيلاتين المغلفة بدلاً من ذلك.
4. متشابك "الزنك هيستوتشيميستري"
- إصلاح أقسام الشريحة التي شنت في الكحول المطلق لمدة 15 دقيقة، والسماح لتجف تماما في درجة حرارة الغرفة حاء – 1 < lأنا > تزج بإيجاز مقاطع ل 10 ق في محلول جيلاتين 1% (القسم 1) والسماح للمبيت جاف في درجة حرارة الغرفة.
- معا كما هو موضح في الخطوة 1.8 أقرب الفروع على استعداد لأن يكون رد فعل مزيج الحلول.
- الرد الأقسام حسب ترتيب الشرائح جنبا إلى جنب في الزجاج أو علبة بلاستيكية، وصب محلول النامي على الشرائح. تحقق من أن الشرائح مغمورة تماما في الحل ونقل العلبة في الفضاء مظلم، أو تغطية مع مربع ضوء محكم.
ملاحظة: علبة بلاستيكية أن حوالي 12 بوصة يمكن استخدامها منذ فترة طويلة قبل 8 بوصة، مما يناسب الشرائح بالضبط 18. إجمالي حجم 200 مل مطور الحل غير كافية لغمر الشرائح تماما، حتى تضمن أن يستخدم وحدة التخزين الصحيحة لعدد الشرائح ليكون رد فعل وضبط الوصفة تبعاً لذلك. من المستحسن استخدام علبة بلاستيكية أو زجاجية بدلاً من استخدام علبة معدنية كما أن هناك درجة معينة من الصليب تفاعلية بين لاكتات الفضة في الحل المطور والحديد أو المعادن الأخرى الموجودة في علب معدنية.
- الرد الأقسام حسب ترتيب الشرائح جنبا إلى جنب في الزجاج أو علبة بلاستيكية، وصب محلول النامي على الشرائح. تحقق من أن الشرائح مغمورة تماما في الحل ونقل العلبة في الفضاء مظلم، أو تغطية مع مربع ضوء محكم.
- رصد تطور رد الفعل بتفتيش بصريا المقاطع كل 30 دقيقة. الأقسام عموما تتطلب 120-180 دقيقة لاستكمال تطوير.
- إذا أصبحت أوفيرستينيد الأقسام (انظر الشكل 3 ألف)، تفرق في 2% مزارع ' حل s (9 أجزاء ثيوكبريتات الصوديوم 2% في dH 2 س وجزء 1 2% "سيانيد البوتاسيوم" في dH 2 س) لدقيقة 1-2
ملاحظة: يظهر المقطع عينة الذي هو ضعيف الملون في الشكل 3b. - متى تحقق كثافة المرجوة، إنهاء رد فعل عن طريق إزالة الشريحة تحميل المقاطع من الدرج ووضع الشرائح على حامل شرائح.
- وضع على الرف الشرائح في زجاج كبيرة تلطيخ طبق ويغسل الشرائح في الحارة (40-50 درجة مئوية) تشغيل المياه لمدة 10 دقيقة لإزالة طبقة الجيلاتين وإيداع الفضة الخارجي.
ملاحظة: كن حذراً لا تحرض حامل الشرائح للحيلولة دون الانزلاق خارج أبواب. كثافة المرجوة من المقطع ويتحقق عندما يتضح التباين الصفحي كافية والمقاطع الظلام ما يكفي ولكن لا تفرط (انظر الشكل 4a). - السماح للشرائح لتجف في درجة حرارة الغرفة، ويذوي ثم في 100% EtOH (5 دقائق)، واضحة في زيلين نفط (5 دقائق)، وكشف الغطاء مع وسيلة متزايدة. وبدلاً من ذلك، وضع الشرائح في سلسلة تصاعدي من الكحول، ثم يذوي، واضحة، وساترة-
- استخدام أقسام من الحيوانات دون علاج سيلينيت السابقة ليكون بمثابة عنصر تحكم سلبية. فضة التضخيم من هذه الأقسام ينبغي أن تسفر عن لا تلطيخ.
ملاحظة: للحصول على النتائج المثلى تسمح المقاطع إلى الجافة بين عشية وضحاها. السماح بالمقاطع إلى الجافة بين عشية وضحاها غلة تلطيخ الأنسجة أفضل.
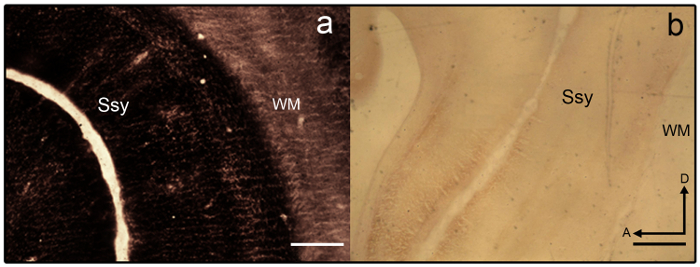
رقم 3: الزنك متشابك تلطيخ في الدماغ النمس الأحداث. Photomicrographs شبه عرضية الأقسام الملطخة بالزنك أ) أوفيرستينيد وب) أونديرستينيد في الدماغ النمس الأحداث. الحدود المساحية من الصعب أن نتبين كما تفتقر إلى تباين الصفحي. هو الملون الأبيض هذه المسألة أيضا بشكل كبير. سوبراسيلفيان Ssy اللحاء، الأبيض WM يهم، الأمامي، د الظهرية. شريط المقياس = 500 ميكرومتر (أ-ب). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
5-التمييز بين الحدود المساحية والحصول على الصور
- استخدام ميزات معمارية لمناطق الدماغ المختلفة لتحديد مساحية وطبقية.
ملاحظة: على سبيل المثال، في وضع الفئران ريتروسبلينيال اللحاء 14، المؤلفين كشف نمطية عابرة تتسم بصبغة ثقيلة بالنسبة للزنك، الذي لم يكن موجوداً في تعليم الكبار ولكن يمكن أن تستخدم لوصف القشرية المنظمة خلال التنمية في هذه الأنواع. في آخر دراسة 15، كشف الكتاب خصوصية في توزيع الزنك متشابك الأنوية المختلفة الموجودة في اللوزة القرد المكاك، مما يسهل تحديد هذه الانقسامات. المناطق القشرية البصرية في الدماغ النمس النامية والكبار قد تم وصفه سابقا 16 ، 17 ، 18، تقسيم معمارية اللحاء الجديد في وكان السنجاب الرمادي وصف 19. وعلاوة على ذلك، هيستوتشيميستري الزنك كان يستخدم للتمييز بين المناطق في القرد الكبار القشرة البصرية 8 ووضع بالغ القط القشرة البصرية 5، وضع قشرة somatosensory الفئران 9 ، 20، والكبار الماوس قشرة سوماتوسينسوري 6 ، 21. إذا كان متوفراً، مقارنة نمط المصبوغة في المايلين الملون، السيتوكروم أوكسيديز (CO) الملون، والزنك متشابك الملون أقسام الدماغ، لتأكيد الحدود المساحية في الكبار. في أقسام شبه عرضية من القشرة البصرية النمس الملون للزنك متشابك، هناك اختلافات بارزة بين المناطق القشرية المرئية التي تسهل تحديد مساحية. على سبيل المثال، والمناطق 17 و 18 من النمس الكبار تكشف أن تلوين الزنك متشابك مرتفع في طبقات من الأول إلى الثالث والسادس طبقة ف البقع أقل مكثف، بينما يفتقر الطبقة الرابعة تقريبا الزنك. وجدت نقص الزنك تلطيخ في الطبقة الرابعة أو المناطق 17 و 18 يتناقض مع الفرقة الملون مظلم واضح في طبقة الرابع في أول أكسيد الكربون الملون المقاطع. ومع ذلك، الطبقة الرابعة منطقة 17 في ثاني الملون المقاطع يحافظ على حدود حادة مع طبقات الثالث والخامس ولكن تتميز بانخفاض خفية في تلطيخ كثافة الطبقة الرابعة في المنطقة 18 وحدودها العليا الموجودة في طبقة الثالث أقل يمكن تمييزها. - دراسة أقسام استخدام الفحص المجهري برايتفيلد مع هدفا طاقة منخفضة (2 X أو 4 X التكبير) وتصوير مجالات الاهتمام.
- تعزيز التباين والسطوع من photomicrographs استخدام برامج معالجة الصورة. الحصول على صور لقياسات الكثافة البصرية لا ينبغي تغيير في أي حال من الأحوال-
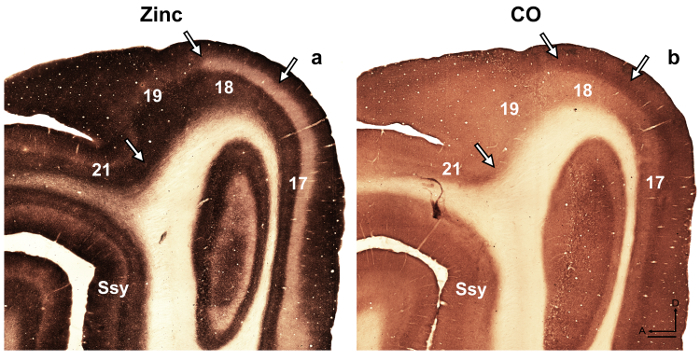
الرقم 4: يميز الزنك متشابك تلطيخ في الدماغ النمس الكبار مختلف المناطق القشرية البصرية- Photomicrographs الأقسام شبه عرضية المتاخمة الملون على () متشابك الزنك أو (ب) السيتوكروم أوكسيديز (CO) في الكبار. سهام علامة الحدود المساحية. سوبراسيلفيان Ssy اللحاء، الأمامي، د الظهرية. شريط المقياس = 500 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
6-قياس كثافة (اختياري)
ملاحظة: دينسيتوميمكن استخدام تحليل اتريك لتقييم توزيع الزنك متشابك في الدماغ بقياس الكثافة البصرية من الزنك الممثل الملون الفروع في المناطق ذات الاهتمام. هذا الأسلوب أيضا مفيدة لتتبع التغيرات المحتملة في مستويات الزنك متشابك في جميع أنحاء التنمية-
- استخدام تحديد المقاطع الملطخة بالزنك، عشوائياً اختر الأعمدة القشرية (photomicrographs عمودي) للعرض المناسب (يمكن استخدام عمود واسعة 450 ميكرون) من photomicrographs المكتسبة من منطقة الاهتمام. عمود القشرية ومنطقة تغطي كل الطبقات القشرية من السطح بيال للمسألة الأبيض.
- اختيار عدد مناسب من أعمدة عينة من عدة أقسام مختلفة من الدماغ في كل منطقة من مناطق الاهتمام.
- نقل الصور عينة تمثيلية الأعمدة في برامج معالجة صور-
- استخدام أداة التحديد المستطيل لكي يشمل العمود بأكمله القشرية.
- استخدام أداة المقلوب لإنشاء صورة تباين عكس مماثلة إلى سلبية فوتوغرافية العمود.
ملاحظة: يتم انعكاس على النقيض من الصور تسفر عن قيم عالية الكثافة البصرية لمستويات عالية من الزنك متشابك وقيم منخفضة الكثافة البصرية لمستويات منخفضة من الزنك متشابك. هذه طريقة أكثر بديهية لتقديم الرسوم البيانية الشخصية مؤامرة مشابهة لتلك التي ينظر إليها في الشكل 5- - إنتاج ملفات تعريف الكثافة البصرية من هذه الصور باستخدام أداة الشخصية مؤامرة لإنشاء رسم بياني ثنائي الأبعاد من كثافة بكسل على طول خط-
- خيارات استخدام الأرض لتحويل الرسم البياني مؤامرة الشخصية إلى تشكيل جانبي عمودي انقر فوق الأرض الشخصية مرة واحدة أكثر.
ملاحظة: المسافة ويمثل المحور السيني على طول الخط، والمحور الصادي يمثل كثافة بكسل. ولذلك، يعكس كل قيمة الشخصية في الأرض قيمة مقياس رمادي متوسط في عمق كل عبر عرض العمود. - الأرض المفتوحة القيم الشخصية كملفات نصية في جدول البيانات، وتطبيع، والأرض كالرسوم البيانية (انظر الشكل 5)-
ملاحظة: من المستحسن استخدام الكثافة النسبية للزنك متشابك لمقارنة القياسات الكمية كما يمكن مرتبك النتائج حسب الاختلاف في كثافة المصبوغة عموما نتيجة لرد فعل أوقات مختلفة، ستينابيليتي من الأنسجة، فضلا عن غيرها المتغيرات- - حساب الكثافة النسبية الزنك عن طريق إجراء أول متوسط النقل القيم الشخصية مؤامرة البيانات على نحو سلس.
ملاحظة: هذا هو إنجاز بالمتوسط، على سبيل المثال، كل بكسل 20 أو 30 المتعاقبة (1 بيكسل = 2.5 ميكرومتر) في العمق، وتطبيع ثم إلى حدة الأقصى لكل عينة. ولذلك، يعكس كل الأرض متوسط قيمة الشخصية القيمة مقياس رمادي متوسط في هذا العمق (تدرج الرمادي قيم تتراوح بين 0 إلى 255). يمكن استخدام أسلوب تطبيع مختلفة بقيم الكثافة البصرية المسألة الأبيض (WM) المقتني الأولى من مناطق العينة تتضمن المسألة الأبيض الكامنة في المجالات التي تهم. ومن الناحية المثالية، اختيار عدة مناطق ملطخة رفق قدر الإمكان للحصول على متوسط قيمة WM. قيم متوسط الكثافة البصرية هي ثم مقسوماً على متوسط القيم وات للحصول على قيم WM تطبيع.
يعني - تحديد قيم الكثافة البصرية في طبقات معينة من المناطق ذات الاهتمام بالنسبة للمقارنات الكمية.
ملاحظة: على سبيل المثال، قيمة متوسط الكثافة البصرية الحد الأدنى في الطبقة الرابعة من المناطق القشرية البصرية للنمس تتحدد يشمل المنطقة الأقل ملطخة بدقة ± 5 بكسل- - حساب متوسط الكثافة البصرية القيم الموجودة في طبقات سوبراجرانولار وإينفراجرانولار من المناطق القشرية البصرية للنمس التي تشمل منطقة أحلك ملطخة بدقة ± 5 بكسل لتحديد الحد الأقصى لقيمة متوسط-
- التأكد من أن يعني قيم الكثافة البصرية يتم الحصول عليها من داخل طبقات معينة.
ملاحظة: من الضروري التحقق من حدود هذه الطبقات في الصور التباين مقلوب بمقارنتها photomicrographs الأصلي، فضلا عن قسم أول أكسيد الكربون المجاور. وهذا يضمن أن المرء لا تتدخل في الطبقات المجاورة.
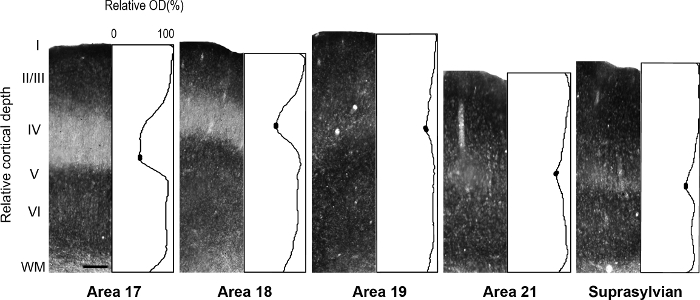
رقم 5: توزيع الصفحي الزنك متشابك في القشرية المختلفة البصرية المناطق في النمس الكبار- الممثل photomicrographs الأعمدة عبر جميع الطبقات القشرية مع ملامح الكثافة البصرية تطبيع المقابلة في الكبار. يشار إلى الزنك متشابك منخفضة الكثافة في الطبقة الرابعة من المناطق البالغين 17 و 18 بالحوض الصغير في المؤامرة الشخصية. في كل ملف تعريف المؤامرة، تشير الأشكال البيضاوية شغلها في الحوض الصغير الطبقة الرابعة إلى القيم المستخدمة لتحديد قيمة بكسل الحد الأدنى متوسط الكثافة. شريط المقياس = 200 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
النتائج
وترد الخطوات الرئيسية التي تنطوي عليها في هذا البروتوكول وصمة عار أقسام الدماغ للزنك متشابك في المخطط انسيابي في الشكل 1. البروتوكول يمكن تقسيمها إلى ثلاث مراحل: 1) نضح وجمع الأنسجة وإعداد 2) الأنسجة وتلطيخ والزنك 3) هيستوتشيميستري. باختصار، خلال المرحلة ال...
Discussion
وتستخدم الدراسة الحالية أسلوب histochemical استناداً إلى نسخة معدلة من دانشير الأسلوب (1982)10، حيث يمكن الكشف عن التعريب الزنك متشابك وتصور في الدماغ. ويعمل هذا الأسلوب أساسا عن طريق حقن الحيوان مع سيلينيت الصوديوم تشيلاتور الزنك (نا2كبار المسئولين الاقتصاديين3) (15 مغ/كغ). ?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا العمل كان يدعمها المنح المقدمة من المركز الوطني "بحوث الموارد" (2G12RR03060-26A1)؛ المعهد الوطني لصحة الأقليات والفوارق الصحية (8G12MD007603-27) من المعاهد الوطنية للصحة؛ الفنية موظفي الكونغرس-مدينة جامعة نيويورك (PSC-جامعة مدينة نيويورك)؛ وكلية البحوث منحة (FRG II) الجامعة الأمريكية في الشارقة. ونشكر سريراموجو النيابي على تقديمه لنا لهذه الأساليب.
Materials
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
References
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved