このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
さまざまな地域と発展途上と大人の脳のラミナを明らかにするシナプス亜鉛化学の使用
要約
パターンの異なる脳の領域を染色特性の層流および面積の亜鉛を明らかに組織化学的手順をについて説明します。レイヤーと領域を開発、大人の脳を確実に区別するためにその他の解剖学的マーカーと亜鉛染色パターンは組み合わせて使用可能性があります。
要約
解剖学的および機能的な脳組織および開発の評価には、異なる神経回路と未熟な大人の脳の領域の正確な同定が必要です。ここで別のレイヤーと脳の間で染色パターンの違いを明らかにする亜鉛の組織化学的染色手順をについて説明します。他の人は亜鉛含有ニューロンと脳の回路の分布を明らかにするだけでなく、正常にいくつかの種の開発と大人の脳の面積と層流境界の線引きにもこのプロシージャを利用しています。ここで我々 は説明これ開発から画像とプロシージャを汚すと大人のフェレット脳。我々 はエリアのレイヤー、解剖学的マーカーとして機能する亜鉛染色パターンを明らかにして開発および成人の視覚野における視覚皮質を区別するために安心して使用できます。このプロトコルの主な目的は、レイヤーと他の方法がように失敗する発展途上と大人の脳の領域の正確な同定を可能にする組織化学的方法を提示することです。第二に、デンシトメトリーの画像解析と併せて、この方法により開発中の潜在的な変化を明らかにするためのシナプスの亜鉛の分布を評価するために 1 つです。このプロトコルは、試薬、ツール、および順次冷凍脳のセクションを染色に必要な手順の詳細について説明します。フェレット脳組織を使用してこのプロトコルを解説していますが、それは簡単に、齧歯動物、猫、または他の頭脳領域のように同様にサルでの使用に適応できます。
概要
組織学的汚れは伝統的建築の機能の違いを明らかにして様々 な種の皮質領野の同定の支援するために使用されています。ニッスル物質、チトクロム酸化酵素 (CO) 反応性ミエリンを組織化学的手法の併用は、成人の脳と同様の面積境界を明らかにする証明実り。しかし、これらの組織化学的汚れは皮質と未熟な脳の層の間の明確な境界を常に十分に明らかに行います。
中枢神経系における亜鉛の多数規制機能に参加してシナプス小胞の存在を通して神経調節物質として作用する酵素の補足因子としての DNA 構造の安定化を含むいくつかの重要な機能1。 それが視覚化できること組織学的手法を用いた蛋白結合亜鉛は可視化2をすることはできません一方、シナプス亜鉛はユニークな。この機能は、異なる皮質のシナプス亜鉛パターンを明らかにするために悪用されているし、組織化学シナプスの亜鉛は、多くの研究で使用されています。大脳皮質のグルタミン酸作動性ニューロンのサブセットには、その軸索ターミナル3,4内シナプス小胞中の亜鉛が含まれています。組織化学的研究は、大脳皮質の5,6,7でのシナプスの亜鉛の不均質分布を明らかにしました。異なる皮質領域 (例えば、体性感覚野と視覚的)、または層中の亜鉛の組織化学的反応性の異なる面積と層流分布をするようです (例えば亜鉛量は、顆粒と一次視覚野のではレイヤーが視床入力層 IV シナプス亜鉛の比較的低レベルでより大幅に高い)5,8,9。シナプスの亜鉛は、大脳皮質にみられる染色の不均一性は、面積と層流の識別を容易に特に有利であります。
Danscher の 1982年法10の修正版は、シナプスの亜鉛の化学プロシージャの詳細な説明をご紹介します。このメソッドは、キレート剤として、動物に亜セレン酸注入腹腔内 (IP) を利用しています。亜セレン酸は、脳内でグルタミン酸作動性シナプスのサブセットの小胞は、亜鉛のプールと反応する脳へ移動します。この反応は銀の開発2,,1011後高めることができる沈殿物を生成します。
この手順は、シナプス亜鉛の汚損; の層流および面積のパターンを明らかにします。デンシトメトリー分析は、感覚や環境、薬理学的、遺伝的操作など、他の介入の効果を研究する大人と未熟な脳で定性的・定量的にこれらのパターンを評価するために使用可能性があります。また、1 つはまた他のモデル系シナプス亜鉛その他の皮質や皮質下構造の分布の潜在的な発達的変化を評価しすることも。デンシトメトリーの分析を提供するこの方法で定量的な情報を時間をかけて次の脳の発達のために有利にすることができます。このプロトコルは、層流と地域の境界を明らかにする他の免疫・組織化学的マーカーにコンパニオンを提供します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
次のプロトコルによってすべての適切な州および連邦政府のガイドラインに準拠している施設動物ケアおよび使用委員会 (IACUC)、都市大学のニューヨークで、動物のケア ガイドラインに従います。麻酔、フェレットに適しており勉強の種に従って修正されるべき
。 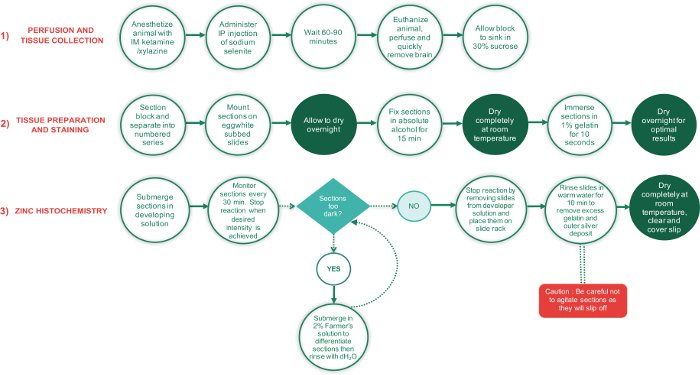
図 1: このプロトコルの 3 フェーズで主要な手順の概要を示すフローチャート各ステップの完了に要する時間。完全に乾燥するにはセクションを必要とする期間は、他のすべての手順は、白いテキスト円中緑のテキスト円で表示されます。緑のダイヤモンド形のテキスト ボックスは意思決定ポイント赤い四角形の重要なステップは、余分な注意を払って実行する必要があります。 この図の拡大版を表示するのにはここをクリックしてください
1 です。 (スライド Subbing とソリューションを作る) の準備手順
- お湯で洗剤とユーチュッブ スライドを洗浄し、ほこりやゴミを徹底的に削除する蒸留水リンス後ぬるま湯で数回をすすぎ。室温または 37 のオーブンで乾かすのスライドを許可する ° C 卵白の薄もコート層の
- スライドが完全に乾燥して指や絵筆を使用して各スライドに。20-30 分の 60 ° C のオーブンで乾燥することができます。最適な結果を得るのため、セクションをオフに滑りを避けるために、卵白の第 2 コートを追加し、60 のオーブンでもう一度乾燥させて ° C
- 1 グラムの 100 mL のお湯 (60 ° C) にゼラチンを溶解することにより 1% ゼラチン液を準備し、部屋の温度に冷やすことができます 。
- セクション 4 で使用するため下記のとおりの開発者溶液 200 mL を準備します。
- (この方法で溶けやすい) お湯 120 ml ずつゆっくりと 40 g を追加することによって準備アラビアゴム ソリューション。ガラス攪拌棒で攪拌ソリューションを続けます。ソリューションを完全に溶かし、一度暑さから削除し、いくつかの分間冷却し、漏斗にガーゼ布の 6-8 層をフィルター処理できるようにします 。
- 準備クエン酸バッファー 20 mL dH 2 O で 5.04 g クエン酸プラス 4.7 g ナトリウム クエン酸を追加し、混合物を溶解します。この溶液の pH が 4.0 で 25 分であることを確認 ° c. 水酸化ナトリウムや塩酸をソリューションに追加することで必要に応じて pH を調整します 。
- が 30 mL dH 2 O を加熱した後にハイドロキノンの 1.7 g 溶解ヒドロキノン溶液を準備します
。 注意: は、ハイドロキノンは常温の水に容易に溶ける水に容易に溶解するように重要ですヒドロキノン溶液を加熱します。ハイドロキノンが酸化するかもしれないがそれ以外の場合、60 ° C 以下の水の温度を保つために注意してください。解決策は黄色する場合、は破棄し、別の新鮮なソリューションを準備します 。
- 準備銀が 0.22 g dH 2 o. の 30 mL の溶解液を乳酸
- ミックス ソリューション (1.4.1 - 1.4.4) (すなわち、区分、乾燥、および修正後) の反応を実行する準備ができたらを記述されている順序で ( 図 2)。最後に銀の乳酸ソリューションを追加します。この手順は、短時間で完了、乳酸銀は感光性のセクションを反応する時間まで、開発者解決が暗闇の中で置かれることを確認します 。
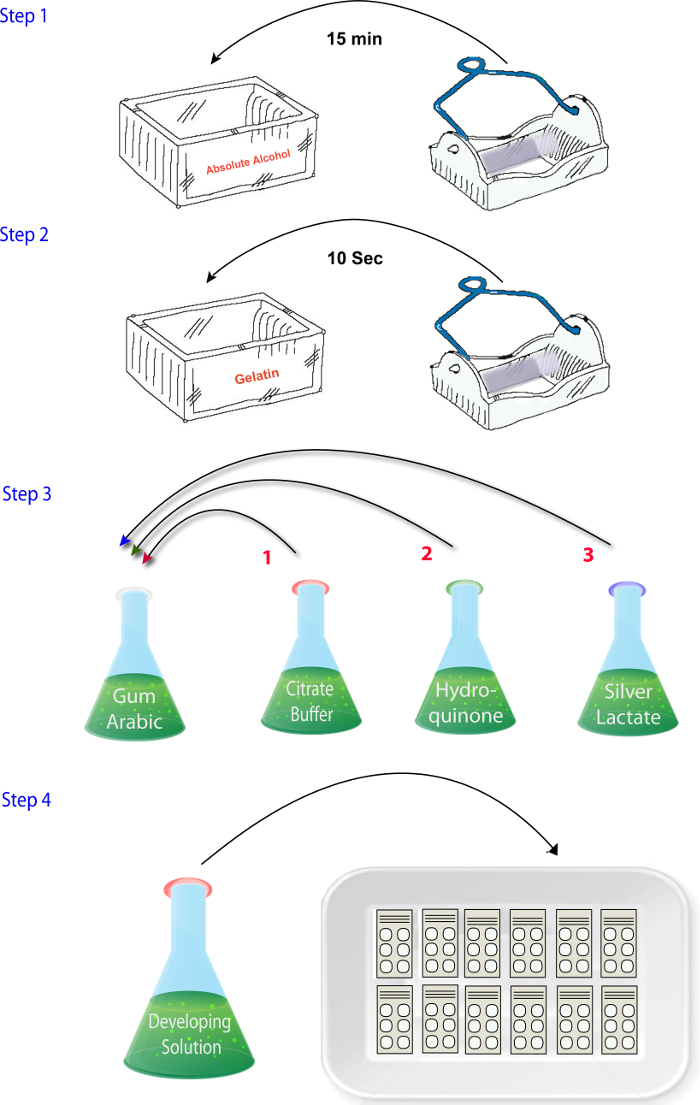
図 2: 手順のシーケンスを示す模式図プロトコルの亜鉛化学段階で試薬を混合します。 この図の拡大版を表示するのにはここをクリックしてください
2 です動物治療と麻酔
- 動物を鎮静前準備 1 mL dH 2 o ・亜セレン酸ナトリウム 10 mg を溶解することにより 1% ナトリウム亜セレン酸 (Na 2 SeO 3) ソリューション 。
- 麻酔のケタミン (25 mg/kg) とキシラジン (2 mg/kg の筋肉内注射を動物
。 メモ: は、ペダル反射応答を使用して麻酔の適切なレベルを達成することを確認します 。
- 注入亜鉛キレート剤ナトリウム亜セレン酸溶液 (15 mg/kg 腹腔内 (IP).
注: 異なる年齢でまたは他の種の亜セレン酸ナトリウムの毒性が変わる可能性があります 。
- は、脳への旅行に亜セレン酸ナトリウム 60 に 90 分を許可します。この期間中に動物が正しく鎮静が応答しないことを確認、だから 5 分ごとに麻酔の深さを確認することが不可欠だ
- 亜セレン酸期間中に動物を麻酔すると中を確認または湿潤を保つために眼軟膏を管理する、乾燥を防ぐために目が閉じられている 。
3。ティッシュの準備と染色
- ペントバルビ タール ナトリウム (100 mg/kg、i.p) の過量投与により、動物を安楽死させる 。
- 生理食塩水 1 分と 20 分の 4% パラホルムアルデヒド実行 transcardial の灌流は、最後に、4% パラホルムアルデヒドと 10% スクロース (1 h の合計固定期間) ソリューションを管理します 。
- 大きなはさみのペアを使用して頭を削除します 。
- 首に鼻からメスを使って頭蓋骨を公開する正中線切開します 。
- 慎重に脳を削除し、ブレードで半球を区切ります 。
- 脳の後部をブロックし、数時間に 0.1 M のリン酸バッファー (PB) で 4% パラホルムアルデヒドで後置します 。
- 0.1 M PB で 30% ショ糖液にブロックを配置でき、シンクに脳
。 注意: 脳をシンクする鉛を 0.1 M で 30% ショ糖液 4% パラホルムアルデヒドと 30% ショ糖液に置き換える脳を制限 ' これとしてパラホルムアルデヒドに s 露出することができます組織染色質に影響します 。
- 脳回シンク カット半接線視覚野や凍結、スライド式ミクロトームやクライオスタットに関心領域を 40 μ m 厚セクションを。これは下面と優しくスライド ガラスの平坦化、内側のブロックを配置することによって実現できます 。
- 絵筆とリン酸緩衝生理食塩水 (PBS) を含むタックル ボックス ストアのセクションを収集します 。
- は、別の番号のシリーズにセクションを区切ります。すぐに 1 つをマウントまたは卵白话スライド (セクション 1) 上の脳のセクションの 2 つのシリーズ、室温で一晩乾燥できるようにし、組織化学的シナプス亜鉛のセクションを処理します
。 注: 他のシリーズは、ミエリン 12 や 13 の修正されたプロトコルを用いたチトクロム酸化酵素などの比較のため他のマーカーの処理可能性があります: 3% スクロース、0.015% シトクロム C、40 ° C で 2 8 時間インキュベート0.015% のカタラーゼと 0.1 M PB で 0.02% ジアミノベンジジン。ニッスル物質は、視覚皮質領域を区別するため組織学的マーカーとして使用する場合があります。伝統的なゼラチン コーティング スライド可能性があります代わりに使用するので、脳が卵白话スライド、マウントされているこれらの他の組織の汚れは必要ありません 。
4。シナプスの亜鉛化学
- 15 分の無水アルコールでマウント スライド セクションを修正し室温 1 時間で完全に乾燥させて < l私 > 10 のセクションを簡単に浸し 1% のゼラチン溶液 (セクション 1) s 室温で一晩乾燥できるようにと
- セクションが反応する準備ができているとすぐに 1.8 の手順で説明するように、一緒に解決策をミックスします。
- セクションをスライド ガラスまたはプラスチック製のトレイ、サイド バイ サイドの配置とスライド上に現像液を注ぐことによって反応します。そのスライド ソリューションに完全に沈んでいると暗い空間にトレイを転送または光タイト ボックスとカバーを確認します
。 注意: プラスチック製のトレイは約 12 インチ 8 インチ ワイドで長期の使用される、まさに 18 スライドに適合。200 mL 開発者ソリューションの総容積はスライドが完全に水没、反応するし、レシピを調整するスライドの数を適切なボリュームがされていることを確認するのに十分です。ある開発者ソリューションで銀の乳酸および鉄の交叉反応の程度やその他金属の金属トレイとは、金属製のトレイを使用してではなくプラスチックまたはガラスのトレイの使用をお勧めします 。
- セクションをスライド ガラスまたはプラスチック製のトレイ、サイド バイ サイドの配置とスライド上に現像液を注ぐことによって反応します。そのスライド ソリューションに完全に沈んでいると暗い空間にトレイを転送または光タイト ボックスとカバーを確認します
- セクション 30 分毎を視覚的に調べることによって、反応の開発を監視します。セクションでは、完全な開発の 120-180 分通常必要があります 。
- セクションは、( 図 3 a を参照)、overstained になる場合は 2% で区別して農民 ' s ソリューション (9 パーツ dH 2 O で 1部 2% チオ硫酸ナトリウム 2% dH 2 O にフェリシアン化カリウム) 1-2 分の
メモ: 不十分なステンド グラス サンプル セクションは 図 3 b に示されています 。
- 一度目的の強度を達成すると、スライドを削除することによって反応を停止させますトレイからスライド ラックにスライドを配置するセクションをマウントします 。
- 皿を汚す大きなガラスのスライド ラックを配置し、ゼラチン コートと外側の銀の預金を削除する 10 分間流水暖かい (40-50 ° C) にスライドを洗うです
。 注: セクションをオフに滑りを防ぐためにスライド ラックを扇動するためにしないように気をつけてください。十分な層流の変化が明らかとセクションが暗い十分過剰反応しない (参照 図 4 a) セクションの目的の強度を実現します 。
- は常温で乾燥させると、100% の脱水のスライドを許可するエタノール (5 分)、キシレン (5 分)、およびメディアをマウントをカバー スリップで明らか。また、アルコールの昇順シリーズのスライドを配置し、脱水、明確にし、coverslip 。
- ネガティブ コントロールとして機能する以前の亜セレン酸治療せず動物からセクションを使用します。染色以下の銀増幅をもたらす必要がありますない 。
。 注: 最適な結果を得るのため、一晩乾燥してセクションを許可します。一晩乾燥してセクションを許可するより良い組織染色が得られます。
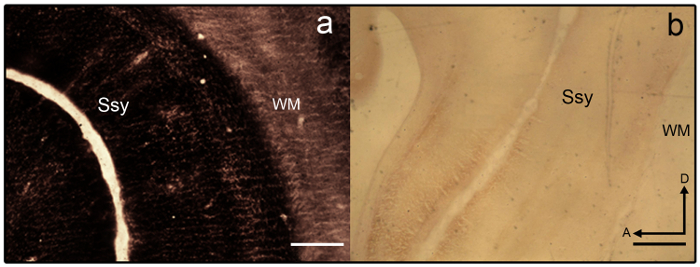
図 3: 染色少年フェレット脳シナプスの亜鉛。) Overstained、b) 少年フェレット脳内 understained 半接線の亜鉛染色切片の顕微鏡写真。地域の境界は、層流のバリエーションが不足するいるとを見分けることは困難です。白質は染色も大きく。Ssy Suprasylvian 皮質、WM ホワイト問題、前方、D 背。スケール バー = 500 μ m (b)。 この図の拡大版を表示するのにはここをクリックしてください
5 地域の境界を区別すると画像取得
- 使用面積と層流の識別のための異なる脳領域の建築機能します。
。 注: たとえば、発展途上ラット後板状皮質の 14、著者明らかに亜鉛が大人に存在しないが、皮質を記述するために利用できる重い染色によって特徴付けられる一時的なモジュール性この種の開発時の組織。別研究 15, 著者らは、これらの部門の識別を容易にするサル扁が見つかりました別の核のシナプス亜鉛分布の特異性を明らかにしました。前述の 16 , 17 , 18, における大脳新皮質のアーキテクチャーの細分化をされている開発および大人のフェレット脳の視覚皮質野灰色リスは記述されていた 19.さらに、亜鉛化学以前に成人サル視覚野 8、開発および大人猫視覚野 5 ラット体性感覚野の開発の区域の間で区別するために使用しました。 9, 20、および成体マウス体性感覚野 6 , 21。利用可能な場合は、ミエリン染色、染色、チトクロム酸化酵素 (CO) とシナプス亜鉛大人の面の境界を確認するための脳のセクションを染色の染色パターンを比較します。フェレット視覚野のシナプス亜鉛のステンド グラスの半接線部に面積の識別を容易にする視覚皮質の間で顕著な違いがあります。たとえば、17 大人のフェレットの 18 の領域を明らかにすることシナプス亜鉛染色レイヤー III の高五層六汚れないより激しく、4 層にほぼ亜鉛が不足している中。亜鉛層 IV または暗く汚されたバンドとエリア 17 と 18 は対照的に染色の顕著な欠乏層 co IV 染色標本が見つかりました。ただし、染色標本領域 co 17 の 4 層保持層 III および V、鋭い境界層地区 18 IV は染色の微妙な減少によって特徴付けられる、その上限は、レイヤー III はボーダレス 。
- 低消費電力目的と明視野顕微鏡を使用してセクションを調べる (2 X または 4 X 倍率) 写真の関心のある分野と 。
- 効果を高めるコントラストと顕微鏡写真の画像処理ソフトウェアを使用しての明るさ。画像取得の光学密度計測を何らかの方法で変更しないようにします 。
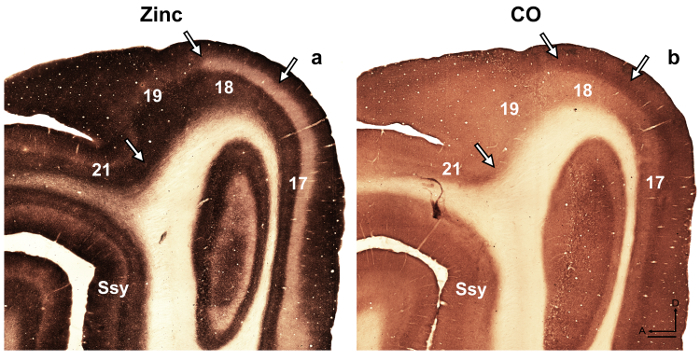
図 4: シナプス亜鉛大人のフェレット脳で染色を区別します。異なる視覚皮質野。隣接する半接線断面の顕微鏡写真は、(、) シナプス亜鉛または (b) チトクロム酸化酵素 (CO) 大人のステンド グラス。矢印は、面の境界をマークします。Ssy Suprasylvian 皮質、前方、D 背。スケール バー = 500 μ m. この図の拡大版を表示するのにはここをクリックしてください
6 (オプション) デンシトメトリー
注: Densitom。研究分析は、関心領域のセクションを染色代表的な亜鉛の光学密度を測定することによって脳のシナプスの亜鉛の分布を評価するために使用可能性があります。この方法は、開発中のシナプスの亜鉛レベルの潜在的な変化を追跡するのに役立ちます
。- 選択使用亜鉛ステンドのセクションでは、ランダムに関心領域の取得顕微鏡写真から適切な幅 (450 μ m 幅の広い列を使用することができます) の皮層のコラム (円柱顕微鏡写真) を選択します。皮質の列は白質軟膜の表面からすべての皮質層にまたがる地域 。
- 興味の各地域でいくつかの異なる脳セクションからサンプルの列の適切な数を選択します 。
- 代表的な列のサンプル画像を画像処理ソフトに転送します 。
- 皮質列全体を包含する長方形選択ツールを使用します 。
- では、反転ツールを使用して、列の写真のネガのようなコントラストの反転イメージを作成します
。 メモ: イメージのコントラスト反転は高いシナプス亜鉛レベルの高い光学濃度値と低シナプス亜鉛レベルの低濃度値を生成するため実行されます。これはプロファイルをプロットしたグラフを 図 5 に示すものと同様にレンダリングするより直感的な方法です 。
- 線に沿ってピクセル強度の二次元グラフを生成するプロットのプロファイル ツールを使用して、これらの画像から光の密度分布を生成します 。
- 鉛直分布をプロット断面図グラフを変換してプロットをクリックしてプロット オプションを使用プロファイル一度以上
。 注: 行と y 軸に沿って x 軸を表す距離ピクセル強度を表します。したがって、各プロットのプロファイル値が列の幅を各水深平均グレースケール値を反映します 。
ワークシートでは、テキスト ファイルとして - オープン プロット プロファイル値正常化し、( 図 5 参照) のグラフとしてプロットします
。 注: 結果は、別の反応時間、他のプロパティと同様に、組織の持続可能性の結果として全体的な染色強度の変化によって混同することができます、定量的測定の比較のためシナプスの亜鉛の相対的な密度を使用することをお勧めです。変数 。
- は、データを滑らかにするプロットのプロファイル値の有蓋車の平均を行い相対亜鉛密度を計算します
。 注: これは、たとえば、連続 20 または 30 ピクセルごとの平均 (1 ピクセル = 2.5 μ m) の深さ、および各サンプルの最大強度に正規化しで。したがって、各平均のプロットのプロファイル値はその深さ (階調値の範囲は 0 から 255 の範囲) で平均グレースケール値を反映します。関心分野の基になる白質を含むサンプルの地域からの最初取得白質 (WM) 光学密度値によって異なる正規化法が使えます。理想的には、WM の値の平均値を取得することが可能として軽く黒ずんでいるいくつかの地域を選択してください。光学密度の平均値が、WM の正規化された値を取得する平均の WM 値で割ります 。
- を決定する定量的な比較のための関心領域の特定の層に光学濃度値の平均です
。 メモ: たとえば、フェレットの視覚皮質の層 IV の平均最小光密度値 ± 5 ピクセルによって少なくとも染色領域を包含によって決まりますがします 。
- 平均の最大値を決定する ± 5 ピクセルで暗い染色領域を包含するフェレットの視覚皮質野の顆粒とでは層で計算平均光密度の値します 。 光学濃度値の平均
- ことを確認特定の層内から取得されます
。 注: 隣接する CO セクションと同様、元の顕微鏡写真を比較することによってコントラスト反転画像にこれらの層の限界を確認することが不可欠です。これは 1 つは隣接するレイヤーを侵害していないことを保証します 。
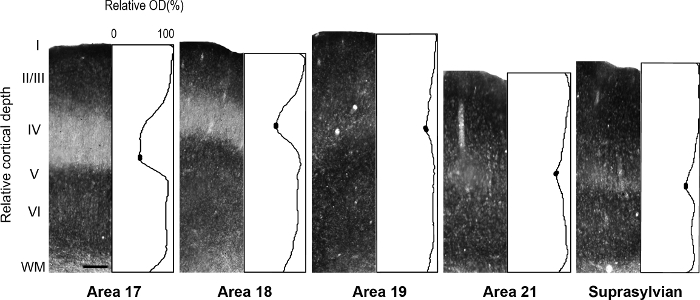
図 5: さまざまな視覚皮質のシナプスの亜鉛の薄層の分布大人のフェレットの領域。大人の対応する正規化された光学濃度プロファイルを持つすべての皮質層の列の代表的な顕微鏡写真。大人の領域 17 と 18 の 4 層で低シナプス亜鉛濃度は、プロファイルのプロットでトラフによって示されます。各プロット プロファイル層 IV のトラフの塗りつぶされた楕円形は平均最小のピクセルの輝度の値を決定する値を示します。スケール バー = 200 μ m. この図の拡大版を表示するのにはここをクリックしてください
Access restricted. Please log in or start a trial to view this content.
結果
図 1のフローチャートのシナプス亜鉛の脳のセクションを染色するこのプロトコルに関連する主要な手順が掲載されています。プロトコルは 3 つのフェーズに分けることができます: 1) 血流や組織の採取、2) ティッシュの準備と染色と 3) 亜鉛化学。簡潔に、プロトコルの最初のフェーズは、動物は麻酔をかけられ、亜セレン酸ナトリウムの適切?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
現在の研究では、Danscher (1982) 法10、シナプス亜鉛の局在が検出され、脳で可視化するという修正版に基づく組織化学的手法を採用しています。このメソッドは本質的に亜鉛キレート剤ナトリウム亜セレン酸 (Na2SeO3) 動物 (15 mg/kg) を注入することによって動作します。注入後、亜セレン酸は脳に移動し、亜鉛亜鉛含有ニューロンのシナプス小胞にローカライズ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者が明らかに何もありません。
謝辞
この作業は、研究資源 (2G12RR03060 26A1); 国立センターからの補助金によって支えられました。少数の健康および健康格差 (8G12MD007603-27) 国立衛生研究所から国立研究所プロフェッショナル スタッフ議会市立大学ニューヨーク (PSC ニューヨーク市立大学);教員の研究グラント (ドイツ連邦共和国 II) アメリカ大学シャルジャ.Vidyasagar Sriramoju は、これらのメソッドにご紹介を感謝いたします。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
参考文献
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved