È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Uso di zinco sinaptica istochimica per rivelare diverse regioni e lamine nel cervello in via di sviluppo ed adulto
In questo articolo
Riepilogo
Descriviamo una procedura istochimica che rivela la caratteristica dello zinco laminare e areal modelli in diverse regioni del cervello di macchiatura. Il modello di macchiatura di zinco può essere utilizzato in combinazione con altri marcatori anatomici per distinguere attendibilmente strati e regioni nel cervello in via di sviluppo e adulto.
Abstract
Caratterizzazione di organizzazione anatomica e funzionale del cervello e sviluppo richiede un'identificazione accurata di circuiti neurali distinti e regioni nel cervello adulto e immaturo. Qui descriviamo una procedura di colorazione istochimica di zinco che rivela differenze nel pattern di colorazione tra diversi strati e regioni del cervello. Altri hanno utilizzato questa procedura non solo per rivelare la distribuzione di zinco-contenendo i neuroni e circuiti nel cervello, ma anche per delineare correttamente areali e laminari confini nel cervello in via di sviluppo e adulto in diverse specie. Qui illustriamo questa procedura con immagini dallo sviluppo di colorazione e furetto adulto cervelli. Abbiamo rivelato un modello di macchiatura di zinco che serve come indicatore anatomico delle aree e livelli e può essere utilizzati in modo affidabile per distinguere le aree corticali visive nella corteccia visiva in via di sviluppo e adulta. L'obiettivo principale del presente protocollo è di presente un metodo istochimico che permette l'identificazione precisa dei livelli e delle regioni nel cervello adulto e in via di sviluppo dove altri metodi non riescono a farlo. Secondariamente, in concomitanza con analisi densitometrica delle immagini, questo metodo permette di valutare la distribuzione di zinco sinaptica per rivelare potenziali modifiche nel corso dello sviluppo. Questo protocollo descrive dettagliatamente i reagenti, strumenti e passaggi necessari per successivamente macchia sezioni di cervello congelato. Anche se questo protocollo è descritto usando il tessuto di cervello di furetto, può essere facilmente adattato per l'uso in roditori, gatti o scimmie così come in altre regioni del cervello.
Introduzione
Le macchie istologiche sono state usate tradizionalmente per aiutare nell'identificazione delle aree corticali in varie specie, rivelando le differenze nelle caratteristiche architettoniche. L'uso combinato di tecniche istochimiche come sostanza di Nissl, reattività del citocromo ossidasi (CO) o mielina può rivelarsi fruttuosa, come rivelano i limiti areali simili nel cervello adulto. Tuttavia, queste macchie istochimiche non rivelano sempre adeguatamente chiari confini tra aree corticali e livelli nel cervello immaturo.
Nel sistema nervoso centrale, lo zinco ha diverse funzioni critiche che includono la struttura del DNA, che agisce come c....
Access restricted. Please log in or start a trial to view this content.
Protocollo
il seguente protocollo segue le linee guida di cura degli animali istituite dall'istituzionale Animal Care e uso Committee (IACUC) presso il City College di New York, che sono conformi a tutti i stato appropriato e le linee guida federali. L'anestesia è appropriato per i furetti e debbono essere modificato secondo le specie studiate.
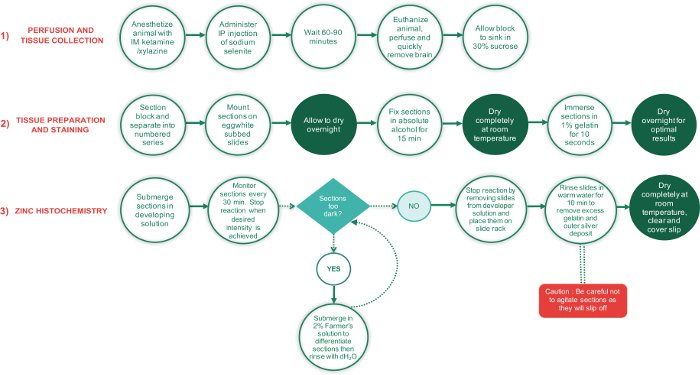
Figura 1: diagramma di flusso che illustra i passaggi principali relativi a 3 fasi del presente protocollo e il tempo necessario per completa....
Access restricted. Please log in or start a trial to view this content.
Risultati
I passaggi principali relativi a questo protocollo per macchiare le sezioni del cervello per zinco sinaptico sono presentati in un diagramma di flusso nella Figura 1. Il protocollo può essere diviso in tre fasi: 1) aspersione e tessuto raccolta, preparazione 2) tessuto e la macchiatura e l'istochimica 3) zinco. Brevemente, durante la prima fase del protocollo, l'animale è anestetizzato e IP iniettato con la dose appropriata di selenito di sodio. Dopo un per.......
Access restricted. Please log in or start a trial to view this content.
Discussione
Lo studio corrente impiega una tecnica istochimica basata su una versione modificata del Danscher (1982) metodo10, per cui zinco sinaptica localizzazione può essere rilevato e visualizzato nel cervello. Questo metodo funziona essenzialmente iniettando l'animale con il selenito di sodio chelante (Na2SeO3) di zinco (15 mg/kg). A seguito di iniezione, la selenite viaggia al cervello e si lega di zinco liberi che è localizzato alle vescicole presinaptiche di zinco contenente ne.......
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dal centro nazionale per le risorse di ricerca (2G12RR03060-26A1); L'Istituto nazionale sulla salute delle minoranze e le disparità di salute (8G12MD007603-27) dal National Institutes of Health; Professional Staff Congress-City University of New York (PSC-CUNY); e facoltà Research Grant (la RFG II) American University of Sharjah. Ringraziamo Vidyasagar Sriramoju per introdurre noi a questi metodi.
....Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Riferimenti
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M.
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon