Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Uso de Zinc sináptica histoquímica para revelar las diferentes regiones y láminas en el cerebro en desarrollo y adulto
En este artículo
Resumen
Describimos un procedimiento histoquímico que revela características zinc laminar y areal manchas patrones en regiones diferentes del cerebro. El patrón de coloración de zinc puede utilizarse en conjunto con otros marcadores anatómicos distinguir confiablemente las capas y regiones en el cerebro en desarrollo y adultos.
Resumen
Caracterización de la organización anatómica y funcional del cerebro y desarrollo requiere la identificación precisa de circuitos neuronales distintos y regiones en el cerebro inmaduro y adulto. Aquí describimos un procedimiento de tinción histoquímica de cinc que revela las diferencias en los patrones de tinción entre los diferentes estratos y regiones del cerebro. Otros han utilizado este procedimiento no sólo para revelar la distribución de las neuronas que contienen cinc y circuitos en el cerebro, sino también para delinear correctamente límites areal y laminares en el cerebro en desarrollo y adultos en varias especies. Aquí ilustramos esto procedimiento con imágenes del desarrollo de la coloración y los cerebros de adultos ferret. Revelan un patrón de coloración de zinc que sirve como un marcador anatómico de las zonas y capas y puede usarse confiablemente para distinguir áreas visuales corticales en la corteza visual en desarrollo y adultos. El objetivo principal de este protocolo es presentar un método histoquímico que permite la identificación exacta de las capas y regiones en el cerebro en desarrollo y adultos donde otros métodos no lo hacen. En segundo lugar, en combinación con el análisis densitométrico de la imagen, este método permite evaluar la distribución de zinc sináptica para revelar posibles cambios a lo largo de desarrollo. Este protocolo describe en detalle los reactivos, herramientas y pasos necesarios para teñir sucesivamente secciones del cerebro congelado. Aunque este protocolo es descrito usando tejido de cerebro de ferret, fácilmente puede ser adaptado para su uso en roedores, gatos o monos, así como en otras regiones del cerebro.
Introducción
Manchas histológicas se han utilizado tradicionalmente para ayudar en la identificación de áreas corticales en varias especies por revelar las diferencias en características arquitectónicas. El uso combinado de técnicas histoquímicas como gránulos de Nissl, citocromo oxidasa (CO) reactividad o mielina puede resultar fructífero como revelan límites áreas similares en el cerebro adulto. Sin embargo, estas manchas histoquímicas no revelan siempre adecuadamente límites claros entre áreas corticales y las capas del cerebro inmaduro.
En el sistema nervioso central, zinc tiene varias funciones esenciales que incluyen estabilización de la estructura del ADN, actuando como un cofactor enzimático, participa en numerosas funciones reguladoras y actúan como un neuromodulador a través de su presencia en vesículas sinápticas 1. zinc sináptica es única ya que puede visualizarse mediante métodos histológicos, mientras que el cinc protein-bound se puede visualizar2. Esta característica ha sido aprovechada para revelar el patrón de cinc sináptica en diferentes regiones corticales, e histoquímica de zinc sináptica se ha utilizado en varios estudios. Un subconjunto de neuronas glutamatérgica en la corteza cerebral contiene zinc en las vesículas presinápticas en su axon terminales3,4. Estudios histoquímicos han revelado una distribución heterogénea de zinc sináptica en la corteza cerebral5,6,7. Parece haber una distribución areal y laminar diferentes de zinc histochemically reactiva en diferentes regiones corticales (p. ej., visual y Corteza somatosensorial), o en capas (por ejemplo, los niveles de zinc en el supragranular y infragranular capas de la corteza visual primaria son substancialmente más altas que en la capa de entrada talamocorticales IV con niveles relativamente bajos de zinc sináptica)5,8,9. La heterogeneidad en zinc sináptica la coloración observada en la corteza es especialmente ventajosa como facilita la identificación areal y laminar.
Aquí presentamos una descripción detallada de un procedimiento histoquímico de zinc sináptica, que es una versión modificada del Danscher 1982 método10. Este método utiliza selenio inyectado por vía intraperitoneal (IP) en los animales como un agente quelante. La selenita viaja al cerebro a reaccionar con piscinas de zinc libre encuentran en las vesículas de un subconjunto de las sinapsis glutamatérgica en el cerebro. Esta reacción produce un precipitado que se puede ampliar posteriormente el desarrollo plata2,10,11.
Este procedimiento revela patrones laminares y areal de tinción sináptica zinc. Análisis densitométricos pueden utilizarse para evaluar estos patrones cualitativa y cuantitativamente en el cerebro adulto y no maduro para estudiar efectos de otras intervenciones, como manipulaciones sensoriales, ambientales, farmacológicas o genéticas. Además, uno también puede desear evaluar potenciales cambios de desarrollo en la distribución de zinc sináptica en otras estructuras corticales o subcorticales en otros sistemas del modelo. La información cuantitativa que proporciona análisis densitométrico en este método puede ser ventajosa para el siguiente desarrollo del cerebro en el tiempo. Este protocolo proporciona un compañero y otras inmuno - marcadores histoquímicos para revelar los límites laminares y areal.
Access restricted. Please log in or start a trial to view this content.
Protocolo
el siguiente protocolo sigue las pautas de cuidado de los animales establecidas por el cuidado Animal institucional y Comité uso (IACUC) en la Universidad de Nueva York, que se ajustan a todos los estado adecuado y las pautas federales. Anestesia es apropiada para hurones y debe modificarse según la especie estudiada.
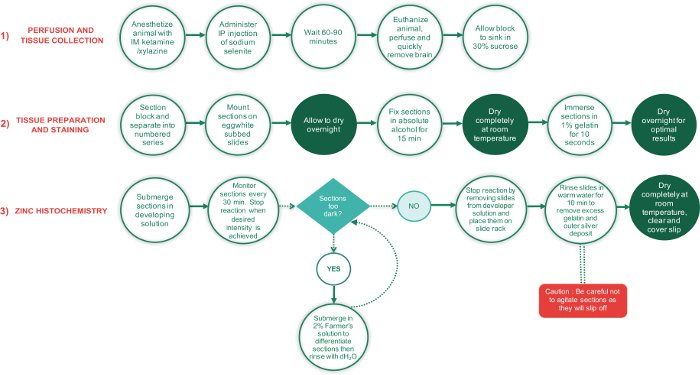
figura 1: esquematización de los pasos más importantes en las 3 fases de este protocolo de diagrama de flujo y el tiempo requerido para completar cada paso. Períodos que requieren secciones se seque por completo se muestran en los círculos de texto verde, mientras que todos los otros pasos son en círculos de texto blanco. El cuadro de texto en forma de diamante verde es un punto de decisión, mientras que el rectángulo rojo es un paso crítico y debe realizarse con mucho cuidado. haga clic aquí para ver una versión más grande de esta figura.
1. pasos preparatorios (Deslice sustituía y solución hacer)
- Lave unsubbed diapositivas con un detergente en agua caliente y enjuague varias veces en agua tibia con un enjuague con agua destilada para eliminar completamente la suciedad o los residuos. Deje que los portaobjetos se seque a temperatura ambiente o en estufa a 37 ° C.
- Una vez que las diapositivas estén completamente secas, capa una capa uniforme de huevo en cada diapositiva usando los dedos o un pincel. Deje que se seque en el horno a 60 ° C durante 20-30 min. Para obtener resultados óptimos y evitar deslizamiento de secciones, añadir una segunda capa de clara de huevo y deje que se seque una vez más en el horno a 60 ° C.
- Preparar una solución de gelatina 1% disolviendo 1 gramo de gelatina en 100 mL de agua caliente (60 ° C) y deje que se enfríe a temperatura ambiente.
- Preparar 200 mL de solución de revelado, como se describe a continuación para el uso en la sección 4.
- Solución de goma arábiga preparar añadiendo lentamente 40 g en incrementos de 120 mL de agua caliente (que se disuelve más fácilmente de esta manera). Seguir a agitar la solución con un vaso, varilla de agitación. Una vez que la solución se ha disuelto completamente, retire del fuego y deje que se enfríe durante unos minutos, luego filtrar a través de 6-8 capas de tela de gasa en un embudo de.
- Preparar citrato buffer agregando 5,04 g ácido cítrico más 4,7 g citrato de sodio en 20 mL dH 2 O y disolución de la mezcla. Asegurar que el pH de esta solución es 4.0 a 25 ° C. ajustar el pH si es necesario mediante la adición de hidróxido de sodio o ácido clorhídrico a la solución.
- Preparar la solución de hidroquinona 30 mL dH 2 O de la calefacción y disolver 1,7 g de hidroquinona.
Nota: Calentar la solución de hidroquinona es esencial para permitir que se disuelva fácilmente en agua como la hidroquinona no es fácilmente soluble en agua a temperatura ambiente. Tenga cuidado de mantener la temperatura del agua inferior a 60 ° C, de lo contrario la hidroquinona puede ser oxidada. Si la solución se vuelve amarilla, descartar y preparar otra solución fresco. - Preparar plata lactato solución disolviendo 0,22 g en 30 mL de dH 2 O.
- Mezclar las soluciones (1.4.1 - 1.4.4) en el orden en el que se describen cuando esté listo para llevar a cabo las reacciones (es decir, después de corte, secado y fijación) ( figura 2). Añadir la solución de lactato de plata en el final. Asegúrese de que este paso se completa rápido y la solución de revelado se coloca en la oscuridad hasta que es hora de reaccionar las secciones como lactato de plata es fotosensible.
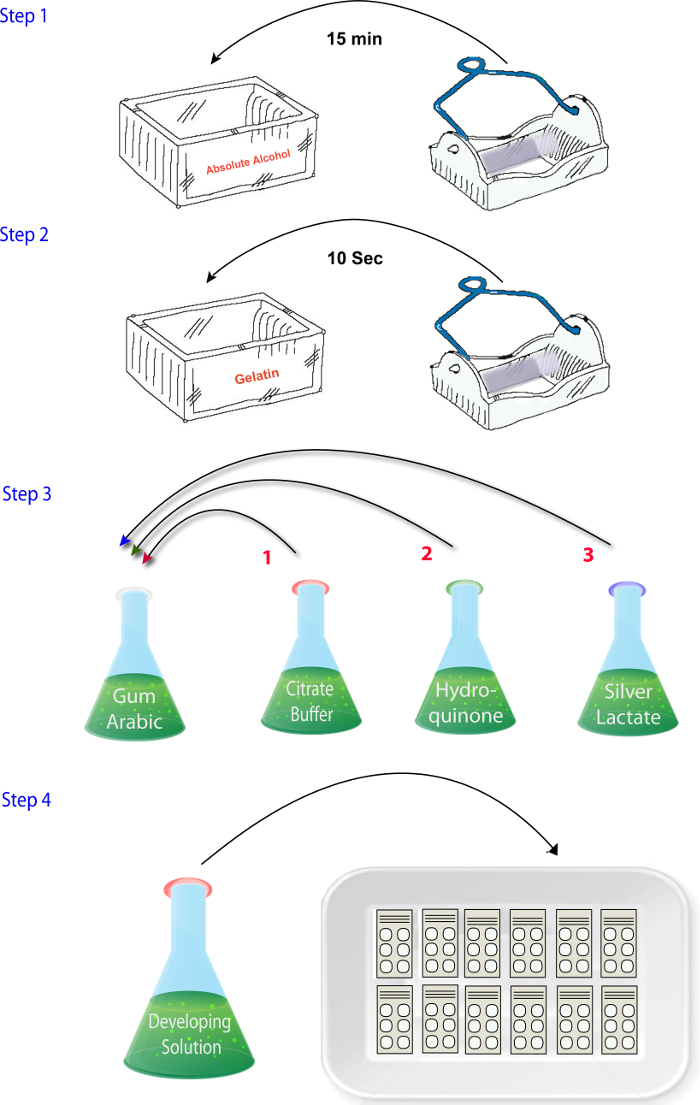
figura 2: esquema que ilustra la secuencia de pasos necesarios para mezclar los reactivos en la fase de histoquímica de zinc del protocolo. haga clic aquí para ver una versión más grande de esta figura.
2. anestesia y tratamiento del animal
- antes de SEDAR al animal, preparar una solución de 1% sodio selenito (Na 2 SeO 3) disolviendo 10 mg de selenito de sodio en 1 mL dH 2 O.
- Anestesiar al animal con una inyección intramuscular de ketamina (25 mg/kg) y xilacina (2 mg/kg).
Nota: Asegúrese de que un nivel adecuado de anestesia se logra mediante el uso de la respuesta refleja pedal. - Inyectar zinc solución de selenito de sodio quelante (15 mg/kg) por vía intraperitoneal (IP).
Nota: Puede variar la toxicidad del selenito de sodio en diferentes edades o en otras especies. - Permiten 60 a 90 min de la selenita de sodio viajar al cerebro. Durante este periodo, es imperativo asegurarse de que el animal está adecuadamente sedado y no responde, así que Compruebe la profundidad de la anestesia cada 5 minutos
- Durante el período de selenio, mientras que el animal está anestesiado, asegúrese de que los ojos se cierran para evitar la sequedad, o administrar pomada oftálmica para mantenerlos húmedos.
3. Preparación de tejido y tinción
- eutanasia a los animales mediante la administración de una sobredosis de pentobarbital sódico (100 mg/kg, i.p).
- Realizar transcardial perfusión con solución salina normal durante 1 minuto y con paraformaldehído al 4% durante 20 minutos por último, administrar una solución de sacarosa al 4% paraformaldehido y 10% (un período de fijación total de 1 h).
- Quitar la cabeza con un par de tijeras grandes.
- Hacer una incisión de línea media con bisturí de la nariz en el cuello para exponer el cráneo.
- Cuidadosamente quitar el cerebro y los hemisferios se separan con una hoja de.
- Bloquear la parte posterior del cerebro y postfix en paraformaldehído al 4% en tampón de fosfato de 0,1 M (PB) durante varias horas.
- Colocar los bloques en una solución de sacarosa de 30% en PB 0.1m y permitir que el cerebro a.
Nota: Sustituir la solución de sacarosa 4% paraformaldehido y 30% con solución de sacarosa al 30% en PB 0.1m para hundir el cerebro limita el cerebro ' s exposición a paraformaldehido como esto puede afectar calidad de tinción del tejido. - Una vez que el cerebro se hunde, corte semi-tangencial secciones de espesor de 40 μm a través de la corteza visual o región de interés en un micrótomo de congelación, resbalando o criostato. Esto puede lograrse colocando el bloque con el medial superficie abajo y suavemente aplana con un portaobjetos de cristal.
- Recoger las secciones con un pincel y un almacén en una caja que contiene solución salina tamponada con fosfato (PBS).
- Separar las secciones en serie numerada separada. Inmediatamente montar una o dos series de secciones del cerebro en portaobjetos subbed huevo (sección 1), permita que seque durante la noche a temperatura ambiente y procesar secciones histochemically para zinc sináptica.
Nota: Otras series pueden procesarse para otros marcadores para la comparación, como mielina 12 o citocromo oxidasa utilizando el protocolo modificado 13: incubar durante 2-8 h a 40 ° C con 3% de sacarosa, 0.015% citocromo C, catalasa de 0.015% y 0.02% diaminobenzidina en 0,1 M de PB. Sustancia de Nissl puede usarse también como un marcador histológico para distinguir áreas corticales visuales. Estas otras manchas histológicas no requieren que secciones del cerebro están montadas en portaobjetos subbed de clara de huevo, así que las diapositivas de la tradicional gelatina recubierto pueden utilizarse en su lugar.
4. Histoquímica de Zinc sináptica
- fijar secciones diapositiva montada en alcohol absoluto durante 15 minutos y déjelo para secar completamente a temperatura ambiente durante 1 h. < lYo > sumerja brevemente las secciones de 10 s en una solución de gelatina 1% (sección 1) y deje que se seque durante la noche a temperatura ambiente.
- Mezclar las soluciones como se describe en paso 1.8 en cuanto secciones están listas para reaccionar.
- Reaccionar las secciones por organizar las diapositivas al lado en un vaso o bandeja de plástico y verter la solución en desarrollo sobre las diapositivas. Verificar que diapositivas estén completamente sumergidas en la solución y transfiera la bandeja en un espacio oscuro o cubren con una caja de luz-apretado.
Nota: Una bandeja de plástico que es de aproximadamente 12 pulgadas de largo por 8 pulgadas de ancho se puede utilizar, que adapta exactamente 18 diapositivas. Un volumen total de solución de revelado de 200 mL es suficiente para sumergir completamente el portaobjetos, así garantizar que el volumen correcto es el número de diapositivas a reaccionar y ajustar en consecuencia la receta. Uso de una bandeja de plástico o vidrio en lugar de utilizar una bandeja de metal es recomendable algún grado de reactividad entre el lactato de plata en la solución de revelado y la plancha cruzada u otros metales encontrados en las bandejas del metal.
- Reaccionar las secciones por organizar las diapositivas al lado en un vaso o bandeja de plástico y verter la solución en desarrollo sobre las diapositivas. Verificar que diapositivas estén completamente sumergidas en la solución y transfiera la bandeja en un espacio oscuro o cubren con una caja de luz-apretado.
- Controlar el desarrollo de la reacción mediante la inspección visual de las secciones cada 30 minutos. Las secciones generalmente requieren 120-180 min de desarrollo completo.
- Si las secciones se convierten en overstained (ver figura 3a), distinguir en el 2% agricultor ' solución de s (9 piezas 2% tiosulfato de sodio en dH 2 O y 1 parte 2% Ferricianuro de potasio en dH 2 O) durante 1-2 minutos
Nota: Sección de la muestra que se tiñe mal se muestra en la figura 3b. - Una vez lograda la intensidad deseada, terminar la reacción quitando la diapositiva montar las secciones de la bandeja y colocar las diapositivas en una parrilla.
- Coloque la parrilla en un vaso grande plato de tinción y lavar los portaobjetos en caliente (40-50 ° C) chorro de agua durante 10 minutos quitar la capa de gelatina y el depósito externo de la plata.
Nota: Tenga cuidado de no agitar la parrilla para evitar que las secciones resbale. La intensidad deseada de la sección se logra cuando la suficiente variación laminar es evidente y las secciones son bastante oscuro pero no overreacted (ver figura 4a). - Deje que los portaobjetos secar a temperatura ambiente y luego deshidratar en un 100% EtOH (5 min), claro en el xileno (5 min) y cubreobjetos con un medio de montaje. Como alternativa, coloque los portaobjetos en una serie ascendente de alcohol y deshidratar, claro y cubreobjetos de.
- Secciones de uso de los animales sin tratamiento previo con selenita para servir como un control negativo. Amplificación de la plata de estas secciones no debe producir ninguna coloración.
Nota: Para obtener resultados óptimos permiten secciones secas durante la noche. Permitiendo que las secciones que seque durante la noche produce tinción de tejido mejor.
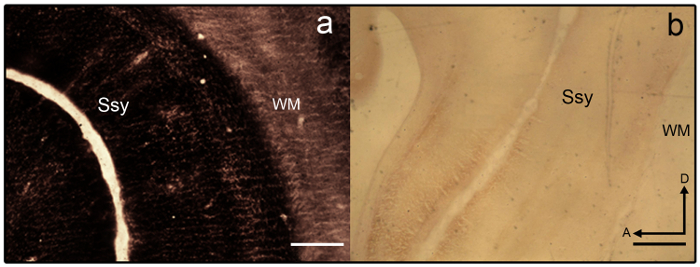
figura 3: zinc sináptica manchas en el cerebro del hurón juveniles. Microfotografías de las secciones manchadas de zinc semi tangenciales a) overstained y b) understained en el cerebro del hurón juvenil. Areal límites son difíciles de discernir como carece de variación laminar. Materia blanca es también pesadamente manchada. Ssy Suprasylvian corteza, blanco WM importa, un anterior, D dorsal. Barra de escala = 500 μm (a-b). haga clic aquí para ver una versión más grande de esta figura.
5. distinguir límites Areal y adquisición de imágenes
- uso arquitectónicos características de regiones diferentes del cerebro para identificación areal y laminar.
Nota: por ejemplo, en el desarrollo rata retrosplenial corteza 14, los autores revelaron una modularidad transitoria caracterizada por la coloración fuerte de zinc, que no está presente en el adulto, pero podría utilizarse para describir cortical Organización durante el desarrollo de esta especie. En otro estudio 15, los autores revelaron la especificidad en la distribución de zinc sináptica de diferentes núcleos en la amígdala de monos macacos, que facilitan la identificación de estas divisiones. Áreas visuales corticales en el cerebro en desarrollo y adulto de hurón han sido previamente descritos 16 , 17 , 18, subdivisión arquitectónica del neocórtex en la ardilla gris fueron descritos 19. Por otra parte, histoquímica de zinc fue utilizada previamente para distinguir entre áreas en el adulto mono corteza visual 8 y desarrollo adulto gato corteza visual 5, desarrollando la corteza somatosensorial de la rata 9 , 20 y ratón adulto Corteza somatosensorial 6 , 21. Si está disponible, comparar el patrón de coloración en la mielina, teñido, citocromo oxidasa (CO) teñido y sináptica zinc manchado secciones del cerebro, para confirmar los límites areal en el adulto. En secciones semi-tangenciales de ferret corteza visual tinción sináptica zinc, hay importantes diferencias entre áreas corticales visuales que facilitan la identificación areal. Por ejemplo, las áreas 17 y 18 de la ferret adultos revelan que tinción sináptica zinc es alta en las capas III y V. capa VI se tiñe menos intensamente, mientras que la capa IV casi carece de zinc. La visible falta de coloración en la capa IV o contrastes de zonas 17 y 18 con la banda oscuro manchada de zinc encontrado en la capa que IV en CO secciones manchadas. Sin embargo, la capa IV de la zona 17 en CO secciones manchada mantiene un borde afilado con capas III y V, pero capa IV en la zona 18 se caracteriza por una sutil disminución de la intensidad de la tinción y su límite superior se encuentra en la capa III es menos distinguible. - Examinar las secciones mediante microscopía brightfield con un objetivo de baja potencia (2 X ó 4 aumentos) y áreas de interés.
- Mejora de contraste y brillo de microfotografías usando software de procesamiento de imagen. Imágenes obtenidas por mediciones de densidad óptica no deben ser alteradas en cualquier forma.
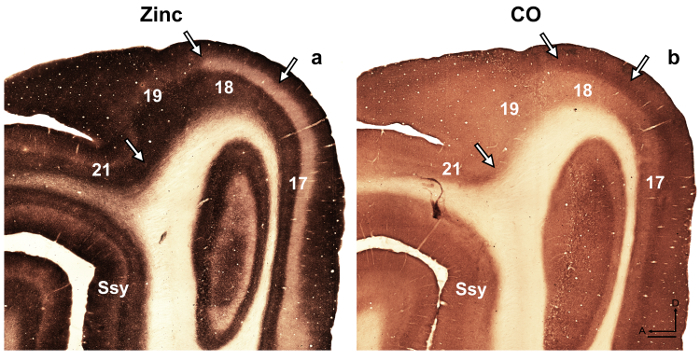
figura 4: zinc sináptica manchas en el cerebro del hurón adulto distingue áreas corticales visuales diferentes. Microfotografías de las secciones adyacentes y tangenciales mancharon para (un) sináptica cinc o (b) citocromo oxidasa (CO en el adulto). Las flechas marcan límites areal. Ssy Suprasylvian corteza, un anterior, D dorsal. Barra de escala = 500 μm. haga clic aquí para ver una versión más grande de esta figura.
6. densitometría (opcional)
Nota: Densitometric análisis pueden utilizarse para evaluar la distribución de zinc sináptica en el cerebro mediante la medición de la densidad óptica de zinc representante manchada las secciones en las regiones de interés. Este método también es útil para el seguimiento de posibles cambios en los niveles de zinc sináptica a lo largo del desarrollo.
- Uso seleccionado zinc-las secciones manchadas, elegir al azar columnas corticales (columnares microfotografías) de la anchura adecuada (puede utilizarse una columna ancho 450 μm) microfotografías adquiridos de la región de interés. Una columna cortical es una región que abarca todas las capas corticales de la superficie pial de la materia blanca.
- Elegir un número apropiado de columnas muestra varias secciones de la cerebral diferente en cada región de interés.
- Transferencia de imágenes de muestra de las columnas representativas en una software de procesamiento de imagen.
- Utilizar la herramienta de selección rectangular para abarcar toda la columna cortical.
- Utilizar la herramienta invertir para crear una imagen invertida similar a un negativo fotográfico de la columna de.
Nota: Inversión de contraste de las imágenes se realiza para obtener alta densidad óptica valores para los niveles de cinc sináptica alta y baja densidad óptica para bajos sináptica niveles de cinc. Esta es una manera más intuitiva para hacer trama perfil gráficos similares a los vistos en la figura 5. - Producir perfiles de densidad óptica de estas imágenes mediante la herramienta de Perfil de terreno para generar un gráfico bidimensional de las intensidades de los píxeles a lo largo de una línea.
- Opciones de parcela de uso para convertir el gráfico de Perfil de trama en un perfil vertical y haga clic en diagrama de perfil una vez más.
Nota: La distancia de eje x representa a lo largo de la línea y el eje y representa la intensidad del pixel. Por lo tanto, cada valor de Perfil de trama refleja el valor promedio de escala de grises en cada profundidad a lo ancho de la columna de. - Valores de Perfil de trama abierta como archivos de texto en la hoja de cálculo, normalizar y trazar como gráficos (ver figura 5).
Nota: Es recomendable usar la densidad relativa de zinc sináptica para comparación de mediciones cuantitativas que resultados pueden confundirse por la variación en la intensidad de la tinción total como resultado de diferentes tiempos de reacción, stainability del tejido, así como otros variables. - Calcular la densidad relativa de zinc realizando primero un promedio de vagón de carga de los valores de Perfil de terreno para suavizar los datos.
Nota: Esto se logra con un promedio de, por ejemplo, cada píxeles de 20 o 30 sucesivas (1 pixel = 2.5 μm) en profundidad y luego normalizar a intensidad máxima para cada muestra. Por lo tanto, cada valor de Perfil de parcela promedio refleja el valor de escala de grises promedio a esa profundidad (escala de grises valores van de 0 a 255). Puede utilizarse un método de normalización diferentes por primera adquisición valores de densidad óptica (WM) de la materia blanca de regiones muestra que la materia blanca subyacente en las áreas de interés. Lo ideal sería elegir varias regiones que se tiñen tan suavemente como sea posible para obtener una media valor WM. Valores de densidad óptica media son entonces divididos por valores para obtener valores normalizado WM WM. - Determine significa valores de densidad óptica en capas específicas de las regiones de interés para comparaciones cuantitativas.
Nota: por ejemplo, el valor de densidad óptica mínima media en la capa IV de áreas corticales visuales del hurón se determinan por la cobertura de la región menos manchada por píxeles de ±5. - Densidad óptica media de calcular los valores en las capas supragranular y infragranular de áreas corticales visuales del hurón por que abarca la región más oscura manchada ±5 píxeles para determinar el valor máximo medio.
- Asegúrese de que los valores de densidad óptica obtenidos de capas particulares.
Nota: Es imprescindible para verificar los límites de estas capas en las imágenes de contraste invertido mediante la comparación de las microfotografías originales así como la sección adyacente de la CO. Esto garantiza que uno no se entrometen en las capas adyacentes.
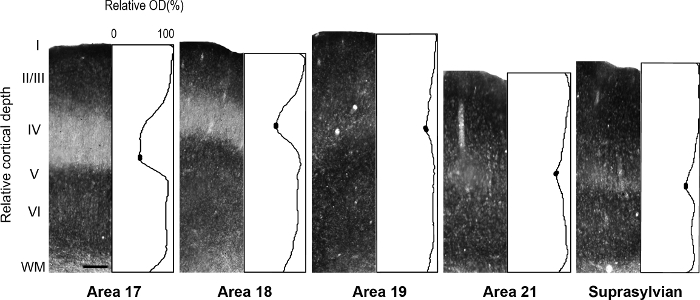
figura 5: distribución Laminar de zinc sináptica en diferentes visual cortical áreas en el hurón adulto. Microfotografías representativas de las columnas a través de todas las capas corticales con perfiles correspondientes de densidad óptica normalizada en un adulto. Densidad bajo zinc sinápticos en la capa IV de adultos áreas 17 y 18 se indica por el canal en la trama de perfil. En el perfil de cada parcela, óvalos rellenos en la depresión de la capa IV indican los valores utilizados para determinar el valor de la intensidad de píxeles mínimo promedio. Barra de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Los pasos principales implicados en este protocolo de tinción de secciones del cerebro para zinc sináptica se presentan en un diagrama de flujo en la figura 1. El protocolo puede dividirse en tres fases: 1) perfusión y colección de tejido, preparación de tejido 2) coloración e histoquímica 3) Zinc. Brevemente, durante la primera fase del Protocolo, el animal está anestesiado e inyectado IP con la dosis apropiada de selenito de sodio. Después de un pe...
Access restricted. Please log in or start a trial to view this content.
Discusión
El presente estudio emplea una técnica histoquímica basada en una versión modificada de la Danscher (1982) método10, por el que localización sináptica cinc puede ser detectado y visualizado en el cerebro. Esencialmente, este método funciona mediante la inyección el animal con el selenito de sodio quelante cinc (Na2SeO3) (15 mg/kg). Después de la inyección, la selenita viaja al cerebro y se une al zinc libre que se localiza en las vesículas presinápticas de zinc qu...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones del centro nacional para recursos de investigación (2G12RR03060-26A1); El Instituto Nacional de salud de minorías y disparidades en la salud (8G12MD007603-27) de los institutos nacionales de salud; Profesional personal Universidad de Congreso-ciudad de Nueva York (PSC-CUNY); y Facultad investigación Grant (RFA II) de la Universidad Americana de Sharjah. Agradecemos a Vidyasagar Sriramoju para introducirnos a estos métodos.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Referencias
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados