Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование синаптических цинка гистохимии выявить различные регионы и пластинки в развивающихся, так и взрослого мозга
В этой статье
Резюме
Мы описываем гистохимические процедуру, которая раскрывает характерные ламинарное и площадных цинка, окрашивания моделей в различных мозга. Цинк окрашивание шаблон может использоваться в сочетании с другими анатомические маркерами надежно различать слои и регионах в развивающихся, так и взрослого мозга.
Аннотация
Характеристика мозга анатомической и функциональной организации и развития требует точной идентификации различных нейронных цепей и регионов в незрелых и взрослого мозга. Здесь мы описываем цинка гистохимические пятная процедуру, которая показывает различия в окрашивания моделей среди различных слоев и мозга. Другие использовали эту процедуру не только выявить распределения цинка содержащих нейронов и цепей в головном мозге, но и успешно очертить границы ареала и ламинарные в развивающихся, так и взрослого мозга в нескольких видов. Здесь мы показываем это пятная процедуру с изображениями из развивающихся и взрослого хорька мозги. Мы раскрыть шаблон окрашивание цинка, который служит в качестве анатомического маркера областей и слои и надежно может использоваться для различения визуальные корковых областях в развивающихся, так и взрослых зрительной коры. Основная цель настоящего Протокола заключается в представлении гистохимический метод, который позволяет точное выявление слоев и регионов в развивающихся, так и взрослого мозга, где другие методы не позволяют сделать это. Во-вторых в сочетании с анализом денситометрических изображений, этот метод позволяет оценить распределение синаптических цинка выявить потенциальные изменения на протяжении развития. Этот протокол описывает подробно реагентов, инструменты и шаги, необходимые для последовательно пятно замороженный мозг секций. Хотя этот Протокол описан с помощью хорька мозговой ткани, она может быть легко адаптирована для использования в грызунов, кошки или обезьян также, как и в других регионах мозга.
Введение
Гистологические пятна традиционно использовались для оказания помощи в идентификации корковых областях в различных видов путем выявления различий в архитектурные особенности. Комбинированное использование гистохимические методы, такие как Ниссль вещество, реактивность цитохрома-оксидазы (CO) или миелина может оказаться плодотворным, как они показывают аналогичные площадной границ в взрослого мозга. Однако эти гистохимические пятна не всегда должным образом выявить четких границ между корковых областях и слоев в незрелых мозга.
В центральной нервной системе цинк имеет несколько важных функций, которые включают стабилизации структуры ДНК, действуя как кофактор фермента, участвуя в многочисленных нормативных функций и действуя в качестве нейромодулятора через свое присутствие в синаптических пузырьков 1. синаптических цинка является уникальной, поскольку она могут быть визуализированы с помощью гистологических методов, в то время как белок прыгните цинка не может быть визуализирован2. Эта возможность была использована раскрыть структуре синаптических цинка в различных регионах корковых и синаптической цинка гистохимии использовалась в ряде исследований. Подмножество глутаматергические нейронов коры головного мозга содержат цинка в пресинаптическом везикулы в пределах их аксона терминалы3,4. Гистохимических исследований показали гетерогенных распределение синаптических цинка в коре5,6,7. Там, как представляется, различные площадной и ламинарные распределения методами реагирования цинка в различных регионах кортикального слоя (например, визуальный против соматосенсорной коры), или слоев (например, уровни цинка в supragranular и infragranular слои первичной зрительной коры значительно выше, чем в thalamocortical входного слоя IV с относительно низкой синаптических цинка уровнями)5,8,9. Гетерогенность в синаптических цинка окрашивание, наблюдается в коре особенно выгодно, как она содействует идентификации площадной и слоистые.
Здесь мы представляем подробное описание синаптических цинка гистохимические процедуры, которая представляет собой модифицированную версию Danscher в 1982 году метод10. Этот метод использует селенит вводили внутрибрюшинно (IP) в животных как комплексон. Селенит едет в мозг реагировать с бассейнами свободной цинка, найденных в везикулы подмножество глутаматергические синапсов в головном мозге. Эта реакция дает осадок, который может впоследствии дополняться Серебряный развития2,10,11.
Эта процедура показывает ламинарное и площадных модели синаптической цинка окрашивания; денситометрических анализ может использоваться для оценки этих моделей как качественно, так и количественно в мозге взрослого и незрелых для изучения воздействия других мероприятий, таких как сенсорные, экологические, фармакологическим или генетических манипуляций. Кроме того один может потребоваться оценить потенциал развития изменения в распределении синаптических цинка в других корковых и подкорковых структур в других системах модель. Количественная информация, предоставляющий денситометрических анализ в этот метод может быть выгодным для развития мозга со временем. Этот протокол обеспечивает компаньон для других иммуно - и гистохимических маркеры раскрыть ламинарное и площадных границ.
Access restricted. Please log in or start a trial to view this content.
протокол
следующий протокол следует животных ухода руководящими принципами, установленными на институциональный уход за животными и использования Комитет (IACUC) в колледже Нью-Йорка, которые соответствуют все соответствующие государственные и федеральные руководящие принципы. Анестезия для хорьков и должен быть изменен согласно изученных видов.
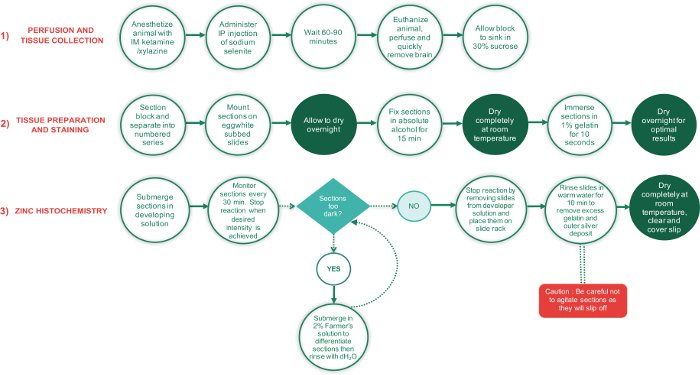
Рисунок 1: схема, указанием основных шагов, участвующих в 3 этапах этого протокола и время, необходимое для выполнения каждого шага. Периоды, требующие секций полностью высохнуть показаны в кругах зеленый текст, в то время как все другие шаги, в кругах белый текст. Зеленый ромбовидной текстовое поле — момента принятия решения, в то время как красный прямоугольник является важным шагом и должны быть выполнены с особой тщательностью. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
1. подготовительные шаги (слайд Subbing и приготовления раствора)
- мыть где слайды с моющим средством в горячей воде и промыть несколько раз в теплой воде, затем с дистиллированной водой промыть, чтобы тщательно удалите грязь или мусор. Разрешить слайды высохнуть при комнатной температуре или в духовке при 37 ° с.
- После того, как слайды полностью сухой, слой тонкий равномерный слой яичного белка на каждом слайде, используя пальцами или кистью. Дайте высохнуть в духовке при 60 ° C для 20-30 мин. Для получения оптимальных результатов и избежать соскальзывания разделы, добавить второй слой яичный белок и еще раз высушите в духовке при температуре 60 ° C.
- Приготовляют раствор 1% желатина, растворяя 1 грамм желатина в 100 мл горячей воды (60 ° C) и дайте ему остыть до комнатной температуры.
- Подготовить 200 мл раствора разработчик, как описано ниже, для использования в разделе 4.
- Подготовить раствор гуммиарабика, медленно добавляя 40 g с шагом 120 мл горячей воды (это более легко растворяется таким образом). Продолжать перемешать раствор с бокалом помешивая стержня. После того, как решение полностью не растворится, удалить от жары и дайте ему остыть в течение нескольких минут, затем процеживают через 6-8 слоев ткани марли в воронку.
- Подготовка цитрат буфер путем добавления 5.04 г лимонной кислоты плюс 4,7 г натрия цитрата в 20 мл dH 2 O и растворения смеси. Убедитесь, что рН этого решения 4.0 в 25 ° C. Регулировка рН в случае необходимости путем добавления раствора гидроксида натрия или соляной кислоты.
- Готовят гидрохинона раствор отопления 30 мл dH 2 O и растворения 1.7 g гидрохинона.
Примечание: Топление вверх гидрохинона раствор необходимо позволить ей легко растворяются в воде, как гидрохинона не легко растворимые в воде при комнатной температуре. Будьте осторожны, чтобы держать температуру воды ниже 60 ° C, иначе может быть окисляется гидрохинон. Если решение желтеет, отменить и подготовить еще один свежий раствор. - Подготовка серебро лактат раствора путем растворения 0,22 g в 30 мл dH 2 O.
- Смесь решения (1.4.1 - 1.4.4) в том порядке, в котором они описаны, когда будете готовы выполнить реакций (то есть, после разрезания, сушки и фиксации) ( Рисунок 2). В конце добавьте Серебряный лактат раствора. Убедитесь, что этот шаг завершен быстро и разработчик решения помещается в темноте, пока не пришло время реагировать в разделах как серебро лактат светочувствительной.
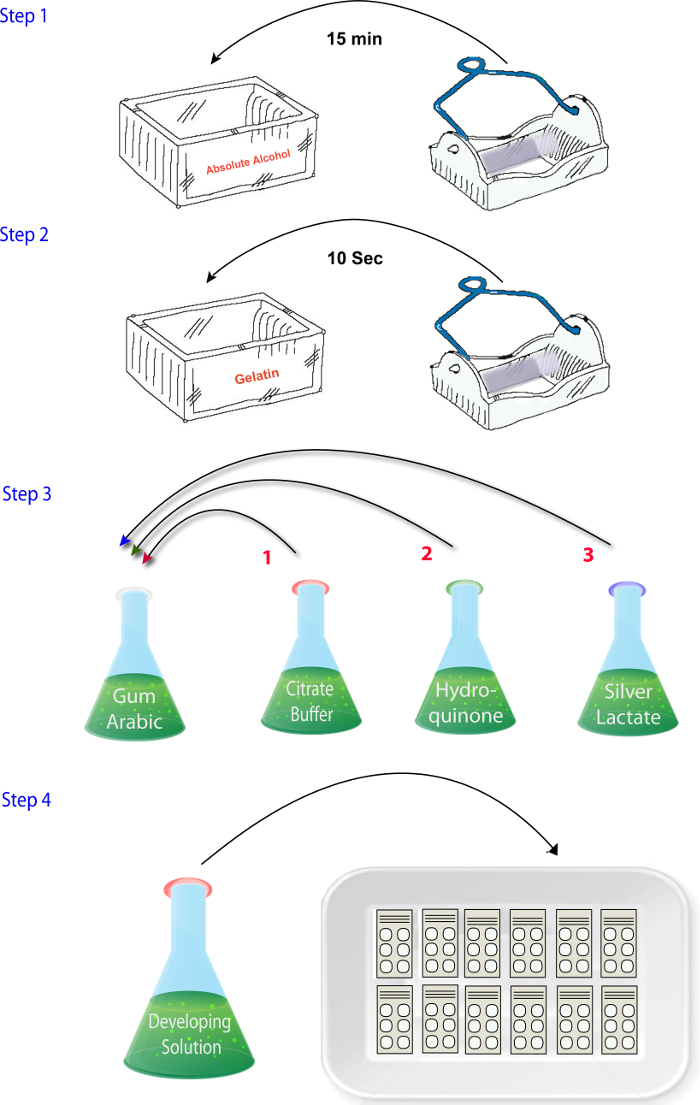
Рисунок 2: схема, иллюстрирующая последовательность шагов, участвующих в перемешивание реагентов в фазе гистохимии цинка протокола. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
2. животных лечения и обезболивания
- до седативным животного, приготовляют раствор 1% Натрия селенит (Na 2 SeO 3), растворяя 10 мг натрия селенит в 1 мл dH 2 O.
- Анестезировать животное с внутримышечной инъекции кетамин (25 мг/кг) и ксилазина (2 мг/кг).
Примечание: Убедитесь, что надлежащий уровень анестезии достигается с помощью педали рефлекторной реакции. - Придать цинка хелатором раствор натрия селенит (15 мг/кг) внутрибрюшинно (IP).
Примечание: Токсичность селенит натрия в разном возрасте или других видов могут варьироваться. - Позволяют 60-90 мин для селенит натрия для поездки в мозг. В этот период важно обеспечить животное правильно седативные и перестает отвечать на запросы, так что проверить глубины анестезии каждые 5 минут
- Период селенит, в то время как наркоз животным, убедитесь, что глаза закрыты для предотвращения сухости, или администрировать глазная мазь, чтобы держать их влажными.
3. Подготовка тканей и окрашивания
- усыпить животных управляющими передозировка Пентобарбитал натрия (100 мг/кг, i.p).
- Выполнять transcardial перфузии с нормальной солевой раствор 1 мин и параформальдегида 4% за 20 мин. Наконец, администрировать раствор с 4% параформальдегида и 10% сахарозы (всего фиксации период 1 h).
- Удалить голову, с помощью пары больших ножницы.
- Сделать срединной линии разреза с помощью скальпеля от носа к шее подвергать черепа.
- Тщательно удалить мозга и отдельных полушарий с лезвием.
- Блок в задней части мозга и postfix в параформальдегида 4% в 0,1 М фосфатного буфера (PB) на несколько часов.
- Место блоков в 30% раствор сахарозы в 0,1 М PB и позволяют мозгу раковина.
Примечание: Замена 4% раствор сахарозы параформальдегида и 30% раствором 30% сахарозы в 0,1 М PB потопить мозга ограничивает мозга ' s подверженности параформальдегида как это может повлиять на качество окрашивания ткани. - Когда-то мозг раковины, стрижки полу тангенциальная 40 мкм толщиной через зрительной коры или региона интерес на замораживание, раздвижные микротома или криостата. Это может быть достигнуто путем размещения блока с медиальной поверхности вниз и осторожно спрямления с на стеклянное скольжение.
- Собирать секции с кистью и хранить в снасти коробки, содержащие фосфат амортизированное saline (PBS).
- Отдельные разделы на отдельные номерные серии. Сразу же установить один или два ряда участков мозга на яичный subbed слайды (раздел 1), позволяют для высыхания на ночь при комнатной температуре и обработки секций методами для синаптических цинк.
Примечание: Другие серии могут быть обработаны для других маркеров для сравнения, например миелина 12 или цитохрома-оксидазы, используя измененный Протокол 13: проинкубируйте 2-8 ч при температуре 40 ° C с 3% сахарозы, 0,015% цитохром С, 0,015% каталазы и 0,02% Диаминобензидин в 0,1 М PB. Ниссль вещество может также использоваться как гистологические маркера для отличительные визуальный корковых областях. Эти гистологические пятна не требуют, что мозг разделы монтируются на яичный subbed слайды, поэтому традиционные желатин покрытием слайды могут использоваться вместо.
4. Синаптических цинка гистохимии
- исправить разделы слайд монтируется в абсолютном спирте 15 мин и дайте высохнуть полностью при комнатной температуре в течение 1 ч. < lя > кратко погружать разделы для 10 s в раствор 1% желатина (раздел 1) и позволяют для высыхания на ночь при комнатной температуре.
- Смешать решения как описано в шаге 1.8, как только разделы готовы быть отреагировали.
- Реагируют разделы путем организации бок о бок в стеклянной или пластиковый лоток слайды и лить развивающихся раствор на слайды. Убедитесь, что слайды полностью погружен в раствор и перевести лотка на темное пространство или покрытия с свет жесткой коробке.
Примечание: Пластиковый лоток, который составляет приблизительно 12 дюймов может использоваться длиной 8 дюймов широкий, который подходит именно 18 слайдов. Суммарный объем 200 мл разработчик решения достаточно, чтобы полностью погрузите слайды, поэтому убедитесь, что правильный том используется для указанного числа слайдов для быть отреагировали и соответственно корректировать рецепт. Рекомендуется использовать пластика или стекла лоток в отличие от использования металлический лоток, как есть некоторые степень реактивности между Серебряный лактата в решении разработчик и железа или другие металлы встречаются в металлических лотков.
- Реагируют разделы путем организации бок о бок в стеклянной или пластиковый лоток слайды и лить развивающихся раствор на слайды. Убедитесь, что слайды полностью погружен в раствор и перевести лотка на темное пространство или покрытия с свет жесткой коробке.
- Следить за развитием реакции путем визуального осмотра в разделах каждые 30 мин. Разделы, как правило, требуют 120-180 мин для полного развития.
- Если разделы становятся overstained (см. рис. 3а), дифференцировать в 2% Фермер ' s решение (9 частей тиосульфата натрия 2% в dH 2 O и 1 часть 2% калия Гексацианоферрат dH 2 O) для 1-2 мин
Примечание: Пример раздела, который плохо окрашенных показано на рисунке 3b. - После достижения желаемой интенсивности, прекратить реакции путем удаления слайд монтируется разделы из лотка и размещения слайдов на коммуникационном слайд.
- Установите решетку слайд в большой стакан, окрашивание блюдо и мыть слайды в теплой (40-50 ° C) воды за 10 мин удалить слой желатина и внешних месторождения серебра.
Примечание: Будьте осторожны, чтобы не агитировать слайд стойку для предотвращения соскальзывания секции. Желаемой интенсивности секции достигается, когда достаточно ламинарные вариация проявляется и разделы являются достаточно темно, но не сожалеете (см. рис. 4a). - Позволяют слайды сохнуть при комнатной температуре, и затем обезвоживает в 100% EtOH (5 мин), ясно в ксилоле (5 мин) и крышка выскальзования с монтажа средних. Кроме того, место слайды в восходящей серии алкоголя, а затем обезвоживает, очистить и coverslip.
- Использование секций от животных без предыдущего лечения селенит в качестве отрицательного контроля. Серебряный усиления этих разделов должна принести без пятнать.
Примечание: Для оптимальных результатов позволяют разделы для высыхания на ночь. Позволяя разделы для высыхания на ночь дает лучше окрашивания тканей.
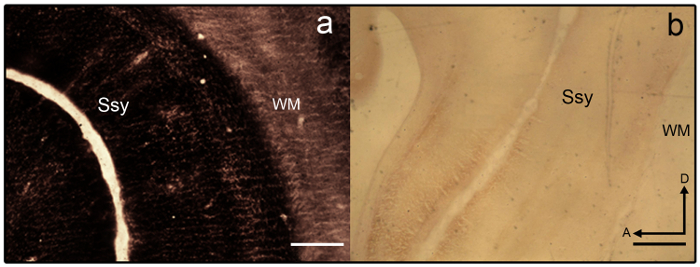
Рисунок 3: синаптических цинка, пятнать в мозге несовершеннолетних хорька. Микрофотографиями полу тангенциальная цинка окрашенных секций, которые) overstained и b) understained в мозге несовершеннолетних хорька. Границы ареала трудно различить, как ламинарная вариации хватает. Белое вещество также сильно запятнана. СМЗ Suprasylvian коры, WM белый вопрос, передний, D спинной. Шкалы бар = 500 мкм (a-b). пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. отличительные площадной границ и захвата изображений
- использования архитектурные особенности различных мозга регионов для идентификации площадной и ламинарные.
Примечание: например, в развивающихся retrosplenial крыса коры 14, авторы выявили переходных модульность, характеризуется тяжелого окрашивания для цинка, который отсутствует у взрослых, но могут быть использованы для описания корковых Организация во время разработки в этот вид. В другом исследовании 15 авторы выявили специфичности в синаптических цинка распределение различных ядер в миндалина обезьяны макаки, способствующих идентификации этих подразделений. Визуальные корковых областях в развивающихся, так и взрослого хорька мозга были ранее описанных 16 , 17 , 18, архитектурное подразделение коры головного мозга в Серая белка были описаны 19. Кроме того цинка гистохимии ранее использовался для различения областей в взрослых обезьян зрительной коры 8, развивающихся и взрослого кота зрительной коры 5, разработка крыса соматосенсорной коры 9 , 20 и взрослые мыши соматосенсорной коры 6 , 21. Если возможно, Сравните окрашивание шаблон в миелина, витражи, цитохром оксидазы (CO) окрашенных и синаптической цинка, окрашенных мозга секций, чтобы подтвердить границы ареала в взрослых. В полу тангенциальная разделах хорька зрительной коры, витражи для синаптических цинка есть известные различия среди визуальных корковых областей, которые облегчают площадной идентификации. Например районах 17 и 18 взрослого хорька показывают, что окрашивание синаптических цинка является высоким в слои-III и VI слой V. пятна менее интенсивно, в то время как слой IV почти не хватает цинка. Бросается в глаза отсутствие цинка, пятнать в слое IV или районах 17 и 18 контрастирует с темно окрашенных группы нашел в слое IV в CO окрашенных секций. Однако, слой IV района 17 в CO окрашенных разделы поддерживает резкое границы с слоями III и V, но слоя IV в районе 18 характеризуется тонким снижением интенсивности окрашивания и его верхняя граница нашли в слое III менее различимыми. - Изучить разделы, с помощью микроскопии brightfield с целью малой мощности (2 X или 4 X увеличение) и сфотографировать области интереса.
- Усилить контраст и яркость микрофотографиями, используя программное обеспечение для обработки изображений. Изображения получены для измерения оптической плотности не должно быть изменено в коей.
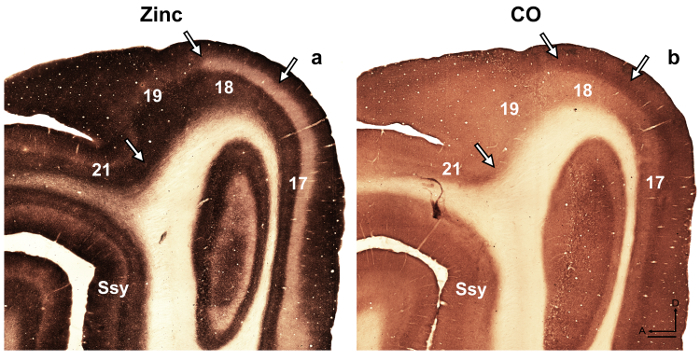
Рисунок 4: отличает синаптических цинка, пятнать в мозге взрослого хорька различные визуальные корковых областях. Микрофотографиями прилегающих полу тангенциальная секций витражи для () синаптических цинка или (b) цитохрома оксидазы (CO) у взрослых. Стрелки Марк площадной границ. СМЗ Suprasylvian коры, передний, D спинной. Шкалы бар = 500 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
6. денситометрия (необязательно)
Примечание: Densitometric анализ может использоваться для оценки распределения синаптических цинка в мозге путем измерения оптической плотности представитель цинка, окрашенных в регионах интересующие разделы. Этот метод также полезен для отслеживания потенциальных изменений в уровнях синаптических цинка на протяжении развития.
- Использование выбранных цинка окрашенных секций, случайным образом выбирать корковые колонки (столбчатых микрофотографиями) соответствующей ширины (450 мкм широкий столбец может использоваться) из приобретенных микрофотографиями региона интерес. Корковых столбец является регионом, охватывающих все корковых слоев от поверхности сетчаточных белого вещества.
- Выбрать соответствующее количество образцов столбцов из нескольких различных мозга секций в каждом регионе интереса.
- Передачи изображения образца представитель столбцов в обработки изображений программное обеспечение.
- Использовать инструмент Прямоугольное выделение охватывает весь столбец корковых. Для создания образа контраст вспять похож на негативе столбце
- использовать средство инвертировать.
Примечание: Инверсии контраст изображения выполняется для получения высокой оптической плотности для уровней высокой синаптических цинка и низкой оптической плотности значения для уровней низкого синаптических цинка. Это более интуитивным способом оказать участок профиль графов, похожие на те, показано на рисунке 5. - Производят оптической плотности профилей из этих изображений, используя средство профиль участка для создания двумерных графа пиксель света вдоль линии.
- Использовать параметры печати для преобразования диаграммы профиля в вертикальный профиль и нажмите на участке профиль раз больше.
Примечание: Ось x представляет расстояние вдоль линии и y представляет интенсивности пикселей. Таким образом, каждый участок профиля значение отражает значение среднего серого на каждой глубине по ширине столбца. - Открыт участок профиля значения в виде текстовых файлов в таблицы, нормализации и печать как графики, (см. Рисунок 5).
Примечание: Рекомендуется использовать относительную плотность синаптических цинка для сравнения количественных измерений, как результаты могут быть confounded вариации интенсивности общего окрашивание вследствие различных время реакции, stainability ткани, а также другие переменные. - Вычислить плотность относительной цинка выполняя первый вагон среднего значения профиля сюжет для сглаживания данных.
Примечание: Это достигается путем усреднения, например, каждые последующие 20 или 30 пикселей (1 пиксель = 2,5 мкм) в глубину и затем нормализации для максимальной интенсивности для каждого образца. Таким образом каждый средний участок профиля значение отражает значение среднего серого на этой глубине (серого диапазон значений от 0 до 255). Различные нормализации метод может использоваться значениями первого приобретения белого вещества (WM) оптической плотности образца регионов, которые включают основные белого вещества в областях, представляющих интерес. В идеале выберите несколько областей, которые легко окрашены как можно получить среднее значение WM. Средняя оптической плотности значений затем делятся на средние значения WM для получения значения WM нормированный. - Определение значения оптической плотности в определенных слоях областей, представляющих интерес для количественных сопоставлениях.
Примечание: К примеру, значение средней минимальной оптической плотности в слое IV визуального корковых областях хорька определяются охватывающих регионе наименее окрашенные пикселей ±5. - Расчет средней оптической плотности значения в supragranular и infragranular слои визуального корковых областях хорька, охватывающих регионе темные витражи на ±5 пикселей, чтобы определить среднее значение максимальной.
- Обеспечить которые оптической плотности значения получаются из в рамках конкретных слоев.
Примечание: Важно, чтобы проверить пределы этих слоев в Перевернутый контраст изображения путем сравнения их с оригинальной микрофотографиями, а также смежные секции CO. Это гарантирует, что один не вторгаться на прилегающих слоях.
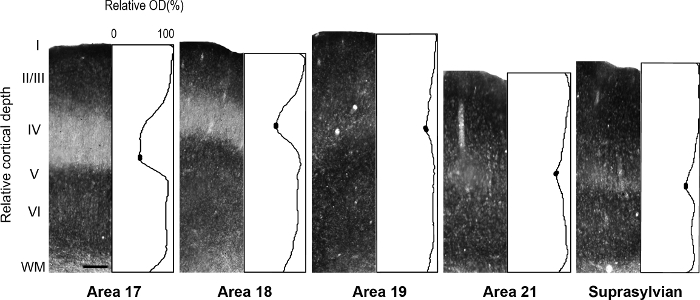
Рисунок 5: ламинарный распределение синаптических цинка в различных visual корковых районы в взрослого хорька. Представитель микрофотографиями колонн через все слои коры с соответствующее нормализованное оптической плотности профилей в взрослых. Плотность низкая синаптических цинка в слое IV взрослых районах 17 и 18 обозначается корыта в участок профиля. В каждом профиле сюжет заполненные овалы в корыте слоя IV указывают значения, используемые для определения значения интенсивности средний минимальный пиксел. Шкалы бар = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
Результаты
В блок-схема на рисунке 1представлены основные шаги, участвующих в настоящем Протоколе пятно мозга разделы для синаптических цинка. Протокол можно разделить на три этапа: 1) перфузии и коллекции тканей, подготовка 2) тканей и окрашивание и гистохимии 3) ц?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Настоящее исследование использует гистохимический метод, основанный на модифицированную версию Danscher (1982) метод10, whereby синаптических цинка локализации могут быть обнаружены и визуализирована в головном мозге. Этот метод по сути работает путем инъекций животное с цинка сел...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана субсидии от национального центра для исследования ресурсов (2G12RR03060-26A1); Национальный институт здоровья меньшинств и неравенства в области здравоохранения (8G12MD007603-27) от национальных институтов здоровья; Профессиональный персонал конгресс Сити университета Нью-Йорка (PSC-CUNY); и факультет исследований Грант (ФРГ II) американский университет в Шардже. Мы благодарим Видьясагар Sriramoju за представление нам этих методов.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Ссылки
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены