Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verwendung von synaptischen Zink Histochemie, verschiedene Regionen und Schichten im Entwicklungs- und Erwachsenen Gehirn zu offenbaren
In diesem Artikel
Zusammenfassung
Wir beschreiben eine histochemische Prozedur, die charakteristische laminar und areal Zink Muster in verschiedenen Gehirnregionen Färbung zeigt. Das Zink-Färbung Muster kann in Verbindung mit anderen anatomischen Markierungen verwendet werden, um Schichten und Regionen im Entwicklungs- und Erwachsenen Gehirn zuverlässig zu unterscheiden.
Zusammenfassung
Charakterisierung der anatomischen und funktionellen Gehirn Organisation und Entwicklung erfordert genaue Identifizierung unterschiedliche neuronale Schaltkreise und Regionen im unreifen und Erwachsenen Gehirn. Hier beschreiben wir eine Zink histochemische Färbeverfahren, die Unterschiede in der Färbung Muster zwischen den verschiedenen Schichten und Hirnregionen offenbart. Andere haben dieses Verfahren nicht nur um die Verteilung von Zink-haltige Neuronen und Schaltkreise im Gehirn zu offenbaren, sondern auch erfolgreich areal und laminare Grenzen im Entwicklungs- und Erwachsenen Gehirn in mehrere Arten abgrenzen genutzt. Hier zeigen wir dies Färbeverfahren mit Bildern aus den Entwicklungsländern und Erwachsene Frettchen Gehirne. Wir offenbaren eine Zink-Färbung Muster, die als eine anatomische Marker von Bereichen und Schichten dient und visuelle kortikale Arealen in der Entwicklungs- und Erwachsenen Sehrinde unterscheiden zuverlässig einsetzbar. Das wichtigste Ziel dieses Protokolls ist es, eine histochemische Methode vorzustellen, die erlaubt die genaue Identifikation von Schichten und Regionen im Entwicklungs- und Erwachsenen Gehirn wo andere Methoden versagen, dies zu tun. Diese Methode ermöglicht in Verbindung mit densitometrische Bildanalyse, sekundär, zu beurteilen, die Verteilung der synaptischen Zink, mögliche Änderungen in der gesamten Entwicklung zu offenbaren. Dieses Protokoll beschreibt im Detail die Reagenzien, Tools und erforderlichen Schritte zum gefrorenen Gehirn Abschnitte nacheinander zu beflecken. Obwohl dieses Protokoll mit Frettchen Hirngewebe beschrieben ist, kann es leicht für Nagetiere, Katzen oder Affen ebenso wie in anderen Hirnregionen angepasst werden.
Einleitung
Histologischen Flecke haben traditionell verwendet, um bei der Identifizierung von kortikalen Areale in der verschiedenen Sorte zu unterstützen, durch die Hervorhebung der Unterschiede in der architektonischen Merkmale. Der kombinierte Einsatz von histochemische Techniken wie z. B. Nissl Substanz, Cytochrom-Oxidase (CO) Reaktivität oder Myelin kann fruchtbare beweisen, wie sie ähnliche areal Grenzen im erwachsenen Gehirn offenbaren. Diese histochemische Flecken zeigen jedoch nicht immer ausreichend klare Grenzen zwischen kortikalen Bereiche und Ebenen im unreifen Gehirn.
In das zentrale Nervensystem hat Zink mehrere wichtige Funktionen, die Stabilisierung der DNA-Struktur, als ein Enzym-Cofaktor, Teilnahme an zahlreichen regulatorischen Funktionen, und als ein Neuromodulator durch seine Präsenz in synaptischen Vesikel enthalten 1. Synaptic Zink ist einzigartig, da es kann mit histologischen Methoden visualisiert werden kann nicht proteingebundene Zink visualisierte2vorzusehen. Diese Funktion wurde um die synaptischen Zink-Muster in verschiedenen kortikalen Regionen offenbaren ausgeschöpft und synaptischen Zink Histochemie wurde in einer Reihe von Studien verwendet. Eine Teilmenge der glutamatergen Neuronen in der Großhirnrinde enthalten Zink in die präsynaptischen Vesikel innerhalb ihrer Axon Klemmen3,4. Histochemische Untersuchungen ergaben eine heterogene Verteilung der synaptischen Zink in der Großhirnrinde5,6,7. Es scheint eine andere areal und flächige Verteilung der histochemically reaktive Zink in unterschiedlichen kortikalen Regionen (z.B., visuellen und somatosensorischen Cortex) oder Schichten (z.B.Zink-Spiegel in den Supragranular und Infragranular Schichten der primären visuellen Cortex sind wesentlich höher als in Thalamocortical Eingabeebene IV mit relativ niedrigen synaptischen Zinkspiegel)5,8,9. Die Heterogenität in der synaptischen Zink Färbung beobachtet im Kortex ist besonders vorteilhaft, da es areal und laminar Identifizierung erleichtert.
Hier präsentieren wir Ihnen eine detaillierte Beschreibung eines synaptischen Zink histochemische Verfahrens eine modifizierte Version des Danschers 1982 Methode10 ist. Diese Methode nutzt Selenit intraperitoneal injiziert (IP) in Tiere als ein Chelatbildner. Der Selenit reist zum Gehirn reagieren mit Pools von freien Zink in Vesikeln mit einer Teilmenge der glutamatergen Synapsen im Gehirn gefunden. Diese Reaktion liefert einen Niederschlag, der anschließend durch Silber Entwicklung2,10,11gesteigert werden kann.
Dieses Verfahren zeigt laminar und räumlichen Muster der synaptischen Zink Färbung; densitometrische Analysen kann verwendet werden, um diese Muster im Erwachsenen- und unreifen Gehirn Studie zu Auswirkungen von anderen Interventionen, wie sensorische, Umwelt, pharmakologische oder genetische Manipulationen sowohl qualitativ als auch quantitativ zu bewerten. Darüber hinaus kann man auch mögliche Entwicklungs Veränderungen in der Verteilung der synaptischen Zink in anderen kortikalen und subkortikalen Strukturen in anderen Modellsystemen bewerten wollen. Die quantitative Angaben, die densitometrische Analysen in dieser Methode bietet kann für folgende Entwicklung des Gehirns im Laufe der Zeit vorteilhaft sein. Dieses Protokoll stellt eine Ergänzung zu anderen Immuno und histochemische Marker um laminar und räumlichen Grenzen hinweg sichtbar zu machen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
das folgende Protokoll folgt den Tierpflege-Richtlinien festgelegten institutionellen Tier Pflege und Verwendung Committee (IACUC) in The City College of New York, die alle entsprechenden Zustand und Bundesrichtlinien entsprechen. Anästhesie für Frettchen geeignet ist und sollte je nach untersuchten Spezies geändert werden.
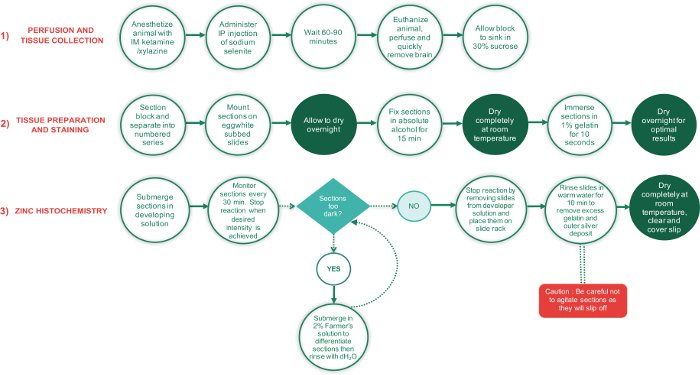
Abbildung 1: Flussdiagramm skizziert die wichtigsten Schritte in den 3 Phasen dieses Protokolls und der Zeitaufwand für jedes Schritts. Perioden erfordern Teile vollständig trocknen werden in grüner Schrift Kreisen angezeigt, während alle anderen Schritte in weißer Schrift Kreisen sind. Das grüne Rauten-Textfeld ist ein Entscheidungspunkt, während das rote Rechteck ein wichtiger Schritt ist und mit besonderer Sorgfalt durchgeführt werden sollte. Bitte klicken Sie hier für eine größere Version dieser Figur.
1. vorbereitende Schritte (Slide eingesprungen und Lösung die)
- unsubbed Objektträger mit einem Reinigungsmittel in heißem Wasser waschen und spülen Sie mehrmals mit warmem Wasser, gefolgt mit destilliertem Wasser spülen, gründlich Schmutz und Ablagerungen zu entfernen. Ermöglichen Folien Trocknen bei Raumtemperatur oder in einem Ofen bei 37 ° c
- Folien sind völlig trocken, Schicht eine dünne gleichmäßige Schicht Eiweiß auf jeder Folie mit Fingern oder einem Pinsel. Im Backofen bei 60 ° C für 20-30 min. trocknen lassen. Für ein optimales Ergebnis und Abschnitte Abrutschen zu vermeiden, fügen Sie eine zweite Schicht von Eiweiß und nochmals im Backofen bei 60 trocknen ° C.
- Bereiten eine 1 % Gelatine-Lösung durch Auflösen von 1 Gramm Gelatine in 100 mL heißem Wasser (60 ° C) und auf Raumtemperatur abkühlen lassen.
- 200 mL Entwicklerlösung vorbereiten, wie unten beschrieben für den Einsatz in Abschnitt 4.
- Prepare Gummiarabikum Lösung indem langsam 40 g in Schritten zu 120 mL heißem Wasser (es löst sich leichter auf diese Weise). Rühren Sie die Lösung mit einem Glas rühren Stab weiter. Wenn die Lösung vollständig aufgelöst hat, vom Herd nehmen und lassen Sie ihn für ein paar Minuten abkühlen lassen, dann filtern durch 6-8 Schichten Gaze Stoff in einen Trichter.
- Vorbereiten Citrat-Puffer von 5,04 g Zitronensäure plus 4,7 g Natriumcitrat in 20 mL dH 2 O hinzufügen und die Mischung auflösen. Sicherzustellen, dass der pH-Wert dieser Lösung 4.0 bei 25 ° c Stellen Sie den pH-Wert ggf. durch Zugabe von Natronlauge oder Salzsäure zur Lösung.
- Bereiten Sie die Hydrochinon-Lösung durch 30 mL dH 2 O erhitzen und Auflösen von 1,7 g von Hydrochinon.
Hinweis: Aufheizen der Hydrochinon-Lösung ist wichtig, lassen Sie es einfach in Wasser auflösen, wie Hydrochinon nicht in Wasser bei Raumtemperatur leicht auflösbar ist. Achten Sie darauf, um die Temperatur des Wassers unter 60 ° C zu halten, sonst Hydrochinon oxidiert werden kann. Wenn die Lösung färbt sich gelb, verwerfen und bereiten Sie eine weitere frische Lösung. - Prepare Silber Laktat-Lösung durch Auflösen von 0,22 g in 30 mL dH 2 O.
- Mischen die Lösungen (1.4.1 - 1.4.4) in der Reihenfolge, in denen sie beschrieben, wenn Sie bereit sind sind, die Reaktionen (d.h., nach dem Schneiden, trocknen und fixieren) durchzuführen ( Abbildung 2). Die Silber-Laktat-Lösung am Ende hinzufügen. Sicherzustellen, dass dieser Schritt schnell abgeschlossen ist und die Entwicklerlösung liegt im Dunkeln, bis es Zeit ist, in den Abschnitten zu reagieren, wie Silber Laktat lichtempfindlich ist.
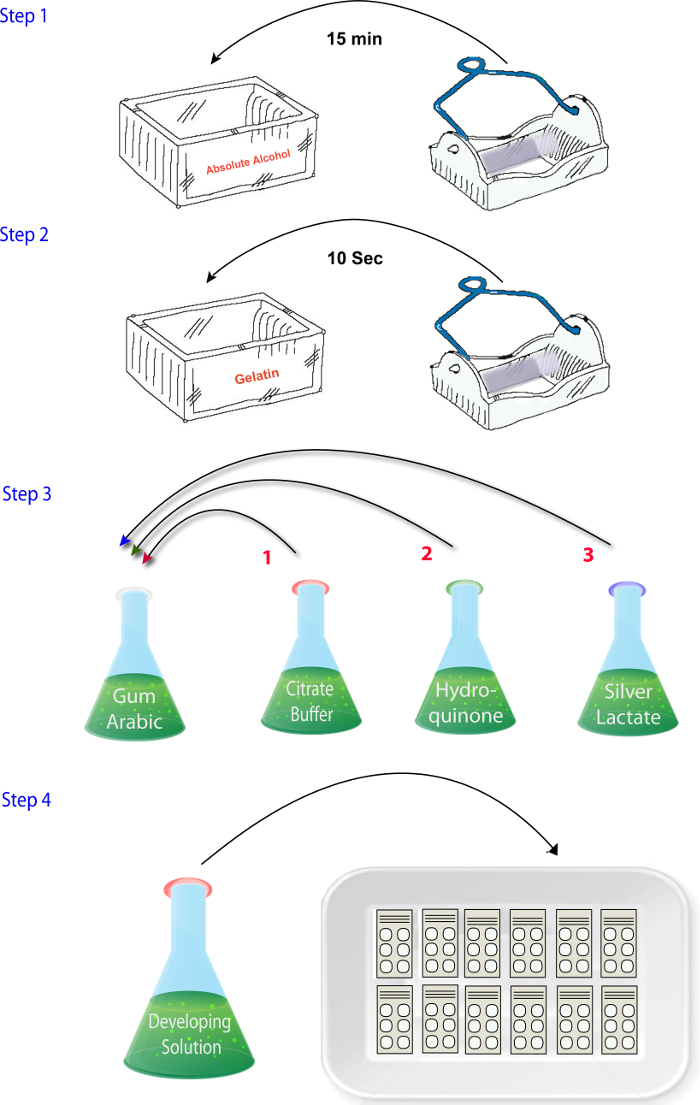
Abbildung 2: Schema veranschaulicht die Abfolge der Schritte Mischen der Reagenzien in der Zink Histochemie Phase des Protokolls. Bitte klicken Sie hier für eine größere Version dieser Figur.
2. Tier Behandlung und Anästhesie
- Betäuben das Tier mit einer intramuskulären Injektion von Ketamin (25 mg/kg) und Xylazin (2 mg/kg).
Hinweis: Sicherstellen, dass eine entsprechende Anästhesie mittels Pedale Reflexe Antwort erreicht ist. - Inject Zink Chelator Natrium Selenit Lösung (15 mg/kg) intraperitoneal (IP).
Hinweis: Die Toxizität von Natriumselenit in verschiedenen Altersstufen oder in anderen Arten variieren könnte. - Erlauben 60 bis 90 min für die Natriumselenit zum Gehirn Reisen. Während dieser Zeit ist es zwingend notwendig, um sicherzustellen, dass das Tier richtig sediert und reagiert nicht, so überprüfen die Tiefe der Narkose alle 5 min.
- Zur Zeit der Selenit während das Tier betäubt ist, sicherzustellen, dass die Augen geschlossen sind, um zu verhindern, dass Trockenheit oder verabreichen ophthalmologischen Salbe um sie feucht zu halten.
3. Gewebe-Vorbereitung und färben
- das Tier durch die Verabreichung einer Überdosis von Natrium-Pentobarbital (100 mg/kg, IP) einschläfern.
- Perform Transcardial Perfusion mit normalen Kochsalzlösung für 1 min und 4 % Paraformaldehyd für 20 min. verwalten schließlich eine Lösung mit 4 % Paraformaldehyd und 10 % Saccharose (totale Fixierung beträgt 1 h).
- Entfernen Sie den Kopf mit einer großen Schere.
- Machen eine Mittellinie Inzision mit einem Skalpell von der Nase bis zum Hals des Schädels aussetzen.
- Sorgfältig entfernen, das Gehirn und trennen der Halbkugeln mit einer Klinge.
- Blockieren den hinteren Teil des Gehirns und postfix für mehrere Stunden in 4 % Paraformaldehyd in 0,1 M Phosphatpuffer (PB).
- Legen Sie die Blöcke in einer 30 % Saccharoselösung in 0,1 M PB und lassen das Gehirn zu sinken.
Hinweis: Ersetzen die 4 % Paraformaldehyd und 30 % Saccharose-Lösung mit 30 % Saccharoselösung in 0,1 M PB, das Gehirn zu versenken das Gehirn begrenzt ' s Belichtung zu Paraformaldehyd als dies kann Gewebe Färbung Qualität beeinflussen. - Einmal das Gehirn senken, schneiden Semi-tangentiale 40 µm dicke Abschnitte durch den visuellen Cortex oder Interessenbereich auf einem Einfrieren, Schiebe Mikrotom oder Kryostat. Dies kann erreicht werden, indem man den Block mit der medialen Oberfläche nach unten und sanft mit einem Objektträger Abflachung.
- Sammeln Abschnitte mit einem Pinsel und Shop in einem Tackle Box mit Phosphat-gepufferte Kochsalzlösung (PBS).
- Trennen die Abschnitte in separate nummerierte Serie. Sofort Montage eine oder zwei Serien von Gehirn Abschnitte auf Eiweiß subbed Folien (Abschnitt 1), über Nacht bei Raumtemperatur trocknen lassen und verarbeiten Abschnitte histochemically für synaptische Zink.
Hinweis: Andere Serien können verarbeitet werden, für andere Marker für den Vergleich, wie Myelin 12 oder Cytochrom-Oxidase anhand der geänderten Protokoll 13: 2-8 h bei 40 ° C mit 3 % Saccharose, 0,015 % Cytochrom C inkubieren 0,015 % Katalase und 0,02 % Diaminobenzidine in 0,1 M PB. Nissl Substanz kann auch als histologische Marker zur Unterscheidung von visueller kortikaler Arealen verwendet werden. Diese histologischen Flecke verlangen nicht, dass Gehirn Abschnitte auf Eiweiß subbed Folien montiert sind, so dass die traditionellen Gelatine beschichtete Folien stattdessen verwendet werden können.
4. Synaptische Zink Histochemie
- Fix Folie montiert Abschnitte in absoluten Alkohol für 15 min und vollständig bei Raumtemperatur für 1 h trocknen lassen < lich > kurz eintauchen Abschnitte für 10 s in einem 1 % Gelatine-Lösung (Abschnitt 1) und über Nacht bei Raumtemperatur trocknen lassen.
- Mischen die Lösungen wie beschrieben im Schritt 1,8 als Abschnitte sind bereit, reagiert werden.
- Reagieren die Abschnitte durch die Anordnung der Dias nebeneinander in einem Glas oder Kunststoff-Tablett, und gießen die entwickelnde Lösung auf die Folien. Stellen Sie sicher, dass Folien sind vollständig in die Lösung getaucht und das Tablett in einen dunklen Raum zu übertragen oder mit einem lichtdichten Kasten abdecken.
Hinweis: Eine Plastikschale, die ca. 12 Zoll lang durch 8 Zoll breit eingesetzt werden, die passt genau 18 Folien. Einem Gesamtvolumen von 200 mL Entwicklerlösung genügt völlig Eintauchen der Folien, so sicher, dass das korrekte Volumen verwendet wird für die Anzahl der Folien reagiert werden und das Rezept entsprechend anpassen. Verwendung von Kunststoff oder Glas Tablett im Gegensatz zur Verwendung von einem Metalltablett ist empfehlenswert, da es ein gewisses Maß an Kreuz Reaktivität zwischen Silber Laktat in der Entwicklerlösung und das Eisen oder andere gefunden in Metall Tabletts Metalle.
- Reagieren die Abschnitte durch die Anordnung der Dias nebeneinander in einem Glas oder Kunststoff-Tablett, und gießen die entwickelnde Lösung auf die Folien. Stellen Sie sicher, dass Folien sind vollständig in die Lösung getaucht und das Tablett in einen dunklen Raum zu übertragen oder mit einem lichtdichten Kasten abdecken.
- Die Entwicklung der Reaktion von visuell inspizieren die Abschnitte alle 30 min. zu verfolgen. Die Abschnitte erfordern in der Regel 120-180 min. für Komplettentwicklung.
- Wenn Abschnitte overstained geworden (siehe Abbildung 3a), unterscheiden sich in 2 % Bauer ' s-Lösung (9 Teile 2 % Natriumthiosulfat in dH 2 O und 1 Teil 2 % Kalium Ferricyanid dH 2 O) für 1 – 2 min.
Hinweis: Probe-Abschnitt, der schlecht gefärbt ist zeigt sich in Abb. 3 b. - Sobald die gewünschte Intensität erreicht ist, kündigen die Reaktion durch das Entfernen der Folie Abschnitte aus dem Fach und platzieren die Folien auf einer Folie Zahnstange montiert.
- Legen Sie die Folie Rack in ein großes Glas Schüssel Färbung und waschen Sie die Folien in warmen (40-50 ° C) fließendes Wasser für 10 min bis zum Entfernen der Gelatine-Mantel und die äußeren Silber Kaution.
Hinweis: Achten Sie darauf, die Folie Rack Abschnitte verhindern Abrutschen zu agitieren. Die gewünschte Intensität des Abschnitts wird erreicht, wenn ausreichend laminar Variation offensichtlich ist und Teile dunkel genug aber nicht überreagiert (siehe Abbildung 4a sind). - Ermöglichen die Folien bei Zimmertemperatur trocknen und dann entwässern in 100 % EtOH (5 min), in Xylol (5 min) und Deckglas mit einem Eindeckmittel deutlich. Alternativ legen Sie die Folien in einer aufsteigenden Reihe von Alkohol, dann entwässern, klar und Deckgläschen.
- Einsatz Abschnitte von Tieren ohne vorherige Selenit Behandlung als eine negative Kontrolle dienen. Silber Verstärkung dieser Abschnitte ergeben sollte kein abfärben.
Hinweis: Um ein optimales Ergebnis lassen Sie Abschnitte über Nacht trocknen. So dass Abschnitte über Nacht trocknen ergibt bessere Gewebe Färbung.
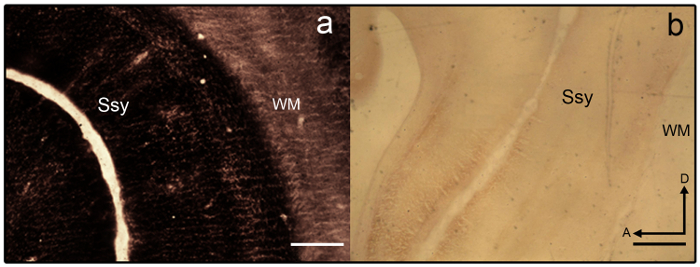
Abbildung 3: Synaptic Zink Färbung im Gehirn juvenile Frettchen. Vergößerung der semi-tangentiale Zink-gefärbten Abschnitte, die (a) overstained und (b) understained im Gehirn juvenile Frettchen. Areal Grenzen sind schwer zu erkennen, wie laminar Variante fehlt. Weißen Substanz ist ebenfalls stark verschmutzt. Ssy Suprasylvian Kortex, WM weiß Rolle, einen vorderen dorsalen D. Maßstabsleiste = 500 µm (a-b). Bitte klicken Sie hier für eine größere Version dieser Figur.
5. Areal Grenzen unterscheiden und Bildaufnahme
- Verwendung architektonischen Merkmale der verschiedenen Gehirnregionen für areal und laminar Identifikation.
Hinweis: zum Beispiel offenbart in den Entwicklungsländern Ratte Retrosplenial Rinde 14, die Autoren eine transiente Modularität gekennzeichnet durch schwere Färbung für Zink, das ist nicht in der Erwachsene aber könnte genutzt werden, um die kortikalen beschreiben Organisation während der Entwicklung in dieser Spezies. In einer anderen Studie 15 offenbart die Autoren Spezifität bei der synaptischen Zinkverteilung der verschiedenen Kerne gefunden in der Amygdala Makaken-Affen, die Identifizierung dieser Abteilungen zu erleichtern. Visuelle kortikale Arealen im Gehirn entwickeln und Erwachsene Frettchen wurden zuvor beschriebenen 16 , 17 , 18, architektonische Unterteilung des Neocortex in Das graue Eichhörnchen waren beschrieben 19. Darüber hinaus wurde Zink Histochemie früher unter Bereiche im Erwachsenen Affen visuellen Cortex 8, Entwicklung und Erwachsenen Katze Sehrinde 5 Ratte somatosensorischen Cortex Entwicklung unterscheiden 9 , 20, und Erwachsenen Maus somatosensorischen Cortex 6 , 21. Falls verfügbar, vergleichen der Färbung Musters in Myelin gebeizt, Cytochrom-Oxidase (CO) gebeizt und synaptischen Zink gebeizt Gehirn Abschnitte, um areal Grenzen beim Erwachsenen zu bestätigen. In semi-tangentiale Abschnitten der Frettchen Sehrinde gebeizt für synaptische Zink gibt es bedeutende Unterschiede zwischen den visuellen kortikalen Arealen, die areal zu erleichtern. Beispielsweise zeigen Bereiche 17 und 18 des Erwachsenen Frettchen, dass synaptische Zink Färbung hoch in Layer I-III ist und V. Schicht VI weniger intensiv, Flecken während Schicht IV fast Zink fehlt. Die auffällige Mangel an Zink Färbung in Schicht IV oder Bereiche 17 und 18 Kontraste mit der dunkel gefärbten Band fand in Schicht IV Co Abschnitte gebeizt. Jedoch Schicht IV Bereich 17 Co gebeizt Abschnitte unterhält eine scharfe Grenze mit Schichten III und V, aber Schicht IV im Bereich 18 zeichnet sich durch eine subtile Abnahme der Intensität Färbung und seine obere Grenze in Schicht III ist weniger unterscheidbar gefunden. - Abschnitte mit Hellfeld Mikroskopieren mit einem low-Power-Ziel zu prüfen (2 X oder 4 X Vergrößerung) und Interessensgebiete zu fotografieren.
- Enhance Kontrast und Helligkeit der Vergößerung mit Bildverarbeitungs-Software. Bilder zu erhalten, für optische Dichtemessungen nicht in irgendeiner Weise geändert werden sollen.
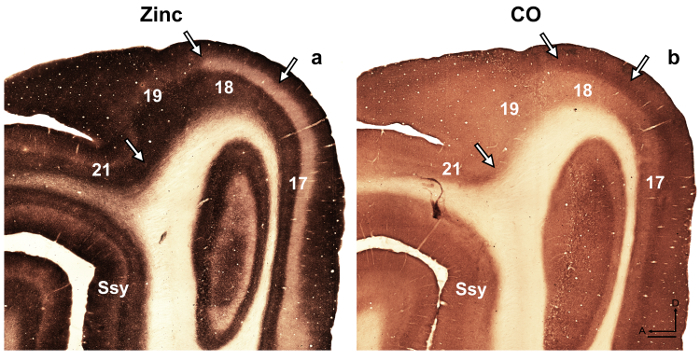
Abbildung 4: Synaptic Zink Färbung in das Gehirn des Erwachsenen Frettchen unterscheidet verschiedenen visuellen kortikalen Arealen. Vergößerung der angrenzenden semi-tangentiale Abschnitte gebeizt für (eine) synaptischen Zink- oder (b) Cytochrom Oxidase (CO) bei Erwachsenen. Pfeile markieren die räumliche Grenzen. Ssy Suprasylvian Cortex, einen vorderen dorsalen D. Maßstabsleiste = 500 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
6. Densitometrie (Optional)
Hinweis: DensitomEtric Analyse kann verwendet werden, um die Verteilung der synaptischen Zink im Gehirn beurteilen durch die Messung der optischen Dichte der repräsentativen Zink gebeizt Abschnitte in den Regionen von Interesse. Diese Methode ist auch nützlich für die Verfolgung von möglicher Änderungen in der synaptischen Zink-Spiegel während der gesamten Entwicklung.
- Mit ausgewählten Zink-gefärbten Sektionen wählen Sie zufällig kortikale Säulen (säulenförmigen Mikroaufnahmen) der entsprechenden Breite (eine 450 µm breite Spalte kann verwendet werden) von erworbenen Vergößerung der Region von Interesse. Kortikale Kolumne ist eine Region, die alle kortikale Schichten von der pial Oberfläche der weißen Substanz.
- Wählen Sie eine entsprechende Anzahl von Probe Spalten aus mehreren verschiedenen Gehirn Sektionen in den einzelnen Regionen von Interesse.
- Beispielbilder der repräsentativen Spalten in ein Bildbearbeitungsprogramm übertragen.
- Das rechteckige Auswahlwerkzeug verwenden, um die gesamte kortikalen Kolumne umfassen.
- Verwenden Sie das Invert-Werkzeug erstelle ich ein Bild mit Kontrast umgekehrt ähnlich einem Fotonegativ der Spalte.
Hinweis: Umkehrung der Kontrast der Bilder wird durchgeführt, um hohe optische Dichte für hohe synaptische Zinkspiegel und geringe optische Dichtewerte für niedrige synaptischen Zinkspiegel ergeben. Dies ist eine intuitivere Art Plot Profil Grafiken rendern ähnlich wie in Abbildung 5 zu sehen. - Produzieren optische Dichte Profile aus diesen Bildern mit dem Plot Profil Tool um eine zweidimensionale grafische Darstellung der Pixelintensität entlang einer Linie zu erzeugen.
- Einsatz Plotoptionen das Profildiagramm Grundstück in ein vertikales Profil konvertieren und klicken auf Plot Profil einmal mehr.
Hinweis: Die x-Achse repräsentiert Entfernung entlang der Linie und der y-Achse repräsentiert die Pixel-Intensität. Daher jeder Handlung Profilwert spiegelt den durchschnittlichen Grauwert in jeder Tiefe über die Breite der Spalte. - Offenen Grundstück Profilwerte als Textdateien in Tabellenkalkulation, normalisieren und Grundstück als Graphen (siehe Abbildung 5).
Hinweis: Es ist ratsam, die relative Dichte der synaptischen Zink für den Vergleich der quantitativen Messungen zu verwenden, wie Ergebnisse durch Variation in Färbung Gesamtintensität durch unterschiedliche Reaktionszeiten, Stainability Gewebe, sowie anderen verwechselt werden können Variablen. - Relative Zink Dichte berechnen, indem erste Durchführung eines Boxcar-Durchschnitts der Plot Profilwerte um die Daten zu glätten.
Hinweis: Dies geschieht durch Mittelung, z. B. alle aufeinander folgenden 20 oder 30 Pixel (1 Pixel = 2,5 µm) in die Tiefe, und dann auf maximale Intensität für jede Probe normalisieren. Daher spiegelt jeder durchschnittliche Plot Profilwert der durchschnittlichen Grauwert in dieser Tiefe (Graustufen Werte liegen zwischen 0 und 255). Eine unterschiedliche Normalisierung Methode kann von ersten Erwerb von weißen Substanz (WM) optische Dichtewerte aus Probe Regionen verwendet werden, darunter der zugrunde liegenden weißen Substanz in den Bereichen von Interesse. Wählen Sie idealerweise mehrere Regionen, die so leicht wie möglich zu einem Mittelwert WM Wert gefärbt sind. Durchschnittliche optische Dichtewerte werden dann geteilt durch Mittelwerte WM WM normalisierte Werte zu erhalten. - Bestimmen meine optische Dichte-Werte in bestimmten Schichten der Regionen von Interesse für quantitative Vergleiche.
Hinweis: zum Beispiel die mittlere minimale optische Dichtewert in Schicht IV der visuellen kortikalen Arealen des Frettchens richten sich nach umfasst die wenigsten verschmutzten Region von ±5 Pixel. - Mittlere optische Dichte berechnen Werte in den Supragranular und Infragranular Schichten der visuellen kortikalen Arealen des Frettchens durch umfasst die dunkelsten gefärbte Region von ±5 Pixel maximale Mittelwert bestimmen.
- Achten Sie darauf, die optische Dichtewerte bedeuten sind in bestimmten Schichten entnommen.
Hinweis: Es ist zwingend notwendig, um die Grenzen dieser Schichten in den Kontrast invertiert Bildern überprüfen, indem sie im Vergleich zu der ursprünglichen Oberflächenmustern sowie die benachbarten CO-Abschnitt. Dies garantiert, dass man nicht auf angrenzenden Schichten eindringen.
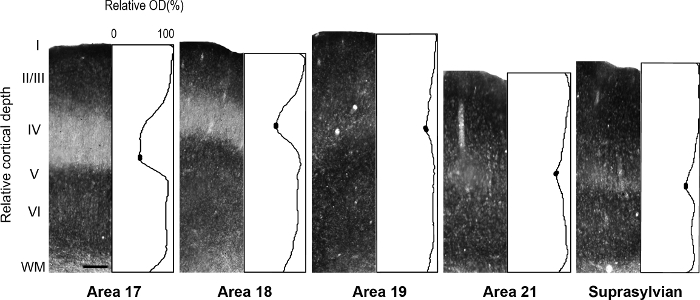
Abbildung 5: flächige Verteilung der synaptischen Zink in verschiedenen visuellen kortikalen Gebiete in das Erwachsene Frettchen. Repräsentative Mikrofotos von Spalten durch alle kortikalen Schichten mit entsprechenden normalisierten optische Dichte Profile bei einem Erwachsenen. Niedriger Zinkspiegel synaptische Dichte in Schicht IV Erwachsene Bereichen 17 und 18 wird durch den Trog in der Profil-Handlung. In jedem Profil Plot geben gefüllten ovale in der Talsohle der Schicht IV die Werte verwendet, um die durchschnittliche minimale Intensität Pixelwert zu bestimmen. Maßstabsleiste = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die wichtigsten Schritte dieses Protokoll zum Gehirn Abschnitte für synaptische Zink Fleck beteiligt werden in Form eines Flussdiagramms in Abbildung 1dargestellt. Das Protokoll kann in drei Phasen unterteilt werden: (1) Perfusion und Gewebe Sammlung, Gewebe (2) Vorbereitung und Färbung und (3) Zink Histochemie. Kurz, in der ersten Phase des Protokolls, das Tier wird betäubt und IP mit der entsprechenden Dosis von Natriumselenit injiziert. Nach einer ausre...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die vorliegende Studie beschäftigt eine histochemische Technik basiert auf einer geänderten Version des Danscher (1982) Methode10, wobei synaptischen Zink Lokalisierung erkannt und im Gehirn sichtbar gemacht werden kann. Diese Methode funktioniert im Wesentlichen durch die Injektion des Tieres mit dem Zink Chelator Natriumselenit (Na2SeO-3) (15 mg/kg). Nach Injektion der Selenit reist zum Gehirn und bindet sich an freie Zink, die zur präsynaptischen Vesikel von Zink mit Ne...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt durch Zuschüsse aus dem National Center für Forschungsmittel (2G12RR03060-26A1); Das National Institute on Minderheit Gesundheit und gesundheitliche Ungleichheiten (8G12MD007603-27) von den National Institutes of Health; Professional Personal Kongress-City University of New York (PSC-CUNY); und Faculty Research Grant (BRD II) American University of Sharjah. Wir danken Vidyasagar Sriramoju für die Einführung von uns, diese Methoden.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Referenzen
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten