É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uso de zinco sináptica histoquímica para revelar as diferentes regiões e lâminas no cérebro em desenvolvimento e adulto
Neste Artigo
Resumo
Descrevemos um procedimento histochemical que revela a característico zinco laminar e areal, coloração de padrões em regiões diferentes do cérebro. O padrão de coloração de zinco pode ser usado em conjunto com outros marcadores anatômicos confiantemente distinguir camadas e regiões no cérebro adulto e em desenvolvimento.
Resumo
Caracterização da organização anatômica e funcional do cérebro e desenvolvimento requer a identificação precisa de circuitos neurais distintos e regiões no cérebro imaturo e adulto. Aqui descrevemos um procedimento coloração histoquímicos zinco que revela diferenças nos padrões de coloração entre diferentes camadas e regiões do cérebro. Outros têm utilizado este procedimento não só revelar a distribuição do zinco-contendo neurônios e circuitos no cérebro, mas também com sucesso delinear fronteiras areal e laminares no cérebro em desenvolvimento e adulto em diversas espécies. Aqui ilustramos este procedimento com imagens de desenvolver a coloração e cérebros adultos furão. Podemos revelar um padrão de zinco de coloração que serve como um marcador anatômico das áreas e camadas e pode ser usados confiantemente distinguir áreas corticais visuais no córtex visual adulto e em desenvolvimento. O objetivo principal do presente protocolo é apresentar um método histoquímico que permite a identificação exata das camadas e regiões no cérebro em desenvolvimento e adulto onde outros métodos não conseguem fazê-lo. Secundariamente, em conjunto com a análise de imagem densitométricos, este método permite avaliar a distribuição do zinco sináptica a revelar potenciais alterações ao longo do desenvolvimento. Este protocolo descreve detalhadamente os reagentes, ferramentas e etapas necessárias para manchar sucessivamente as seções do cérebro congelado. Embora este protocolo é descrito usando tecido cerebral de furão, facilmente pode ser adaptado para uso em roedores, gatos ou macacos, bem como em outras regiões do cérebro.
Introdução
Histológicas manchas tem sido tradicionalmente usadas para auxiliar na identificação de áreas corticais em várias espécies, revelando diferenças de características arquitetônicas. O uso combinado de técnicas histoquímicas como substância de Nissl, reatividade de citocromo oxidase (CO) ou mielina pode provar frutuoso, como revelam os limites areal semelhantes no cérebro adulto. No entanto, estas manchas histochemical não revelam sempre adequadamente limites claros entre áreas corticais e camadas no cérebro imaturo.
No sistema nervoso central, o zinco tem várias funções essenciais que incluem a estabilização da estrutura do DNA, agindo como um cofator de enzimas, participando em inúmeras funções reguladoras e agindo como um neuromodelador através da sua presença em vesículas sinápticas 1. zinco sináptico é único, como isso pode ser visualizado usando métodos histológicos, Considerando que o zinco ligados a proteína não pode ser visualizado2. Esta característica foi explorada para revelar o padrão de zinco sináptica em diferentes regiões corticais e histoquímica sináptica de zinco tem sido utilizada em um número de estudos. Um subconjunto de glutamatérgico neurônios no córtex cerebral contêm zinco nas vesículas pré-sináptica dentro seu axônio terminais3,4. Estudos histoquímicos revelaram uma distribuição heterogênea de zinco sináptica no córtex cerebral5,6,7. Parece haver uma distribuição diferente de areal e laminar de zinco histochemically reativa em diferentes regiões corticais (por exemplo, visual versus córtex somatossensorial), ou camadas (por exemplo, os níveis de zinco no supragranular e infragranular camadas do córtex visual primário são substancialmente superiores à camada de entrada de thalamocortical IV com níveis relativamente baixos de zinco sináptica)5,8,9. A heterogeneidade de zinco sináptico coloração observada no córtex é especialmente vantajosa como ele facilita a identificação de areal e laminar.
Aqui apresentamos uma descrição detalhada de um procedimento histochemical zinco sináptica, que é uma versão modificada do 1982 método10 do Danscher. Este método utiliza Selenito injectado intraperitonealmente (IP) em animais como um agente quelante. O selenite viaja para o cérebro para reagir com piscinas de zinco grátis encontradas em vesículas de um subconjunto de glutamatérgico sinapses no cérebro. Esta reação produz um precipitado que pode ser reforçado posteriormente pelo desenvolvimento prata2,10,11.
Esse procedimento revela padrões laminares e areal de zinco sináptico coloração; densitométricos análise pode ser utilizada para avaliar esses padrões, tanto qualitativa como quantitativamente no cérebro adulto e imaturo para estudar os efeitos de outras intervenções, tais como manipulações sensoriais, ambientais, farmacológicas ou genéticas. Além disso, um pode também querer avaliar possíveis alterações do desenvolvimento na distribuição de zinco sináptica em outras estruturas corticais ou subcorticais em outros sistemas de modelo. As informações quantitativas que análise densitométricos fornece neste método podem ser vantajosas para o desenvolvimento do cérebro seguir ao longo do tempo. Este protocolo fornece um companheiro para outros imuno - histoquímicos marcadores e para revelar os limites laminares e areal.
Access restricted. Please log in or start a trial to view this content.
Protocolo
o seguinte protocolo segue as orientações de cuidados com animais estabelecidas pelo cuidados institucionais do Animal e uso Comité (IACUC) no The City College de Nova York, que estão em conformidade com todos os estado apropriado e diretrizes federais. Anestesia é apropriada para furões e deve ser modificada de acordo com a espécie estudada.
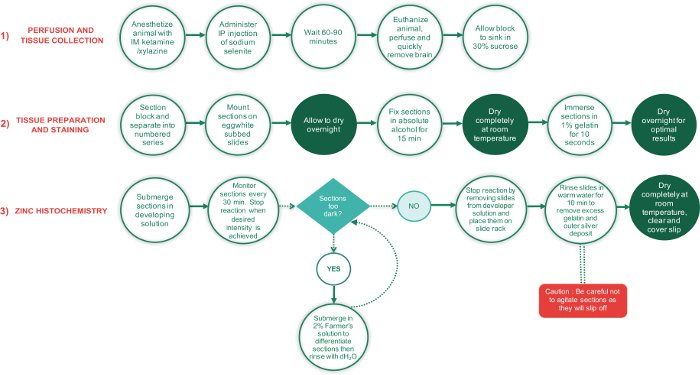
Figura 1: fluxograma descrevendo as principais etapas envolvidas nas 3 fases do presente protocolo e o tempo necessário para concluir cada etapa. Períodos exigindo seções secar completamente são mostrados em círculos de texto verde, enquanto todas as outras etapas são em círculos de texto em branco. A caixa de texto verde em forma de diamante é um ponto de decisão, enquanto o retângulo vermelho é uma etapa crítica e deve ser realizado com cuidado extra. clique aqui para ver uma versão maior desta figura.
1. etapas preparatórias (Slide Subbing e solução fazendo)
- unsubbed slides com um detergente de lavar com água quente e lave várias vezes em água quente, seguida de um enxaguamento de água destilada para remover completamente qualquer sujeira ou detritos. Permitir slides secar à temperatura ambiente ou em estufa a 37 ° C. Camada de
- , uma vez que os slides estão completamente secos, uma camada fina e até mesmo de ovos brancos em cada slide usando os dedos ou um pincel. Deixe-a secar na estufa a 60 ° C durante 20-30 min. Para obter melhores resultados e evitar seções deslizar fora, adicionar uma segunda camada de clara de ovo e deixe para secar mais uma vez na estufa a 60 ° C.
- Preparar uma solução de 1% de gelatina, dissolvendo-se 1 grama de gelatina em 100 mL de água quente (60 ° C) e deixe-a esfriar a temperatura ambiente.
- Preparar 200 mL de solução de desenvolvedor, como descrito abaixo para uso na seção 4.
- Solução de goma arábica Prepare adicionando lentamente 40 g em incrementos de 120 mL de água quente (dissolve-se mais facilmente desta forma). Continue a agitar a solução com um vidro agitando a haste. Uma vez que a solução se dissolva completamente, removê-lo do calor e deixe-a esfriar por alguns minutos e, em seguida, filtrar por 6 a 8 camadas de tecido de gaze em um funil.
- Citrato de preparar amortecedor adicionando 5,04 g ácido cítrico além de 4,7 g de citrato de sódio em 20 mL dH 2 O e dissolver a mistura. Certifique-se de que o pH desta solução é 4.0 em 25 ° C. ajustar o pH se necessário pela adição de hidróxido de sódio ou ácido clorídrico à solução.
- Preparar a solução de hidroquinona aquecendo 30ml dH 2 O dissolver 1,7 g de hidroquinona.
Nota: A aquecer a solução de hidroquinona é essencial para permitir que se dissolvem facilmente na água, como a hidroquinona não é facilmente solúvel em água à temperatura ambiente. Tenha cuidado para manter a temperatura da água abaixo de 60 ° C, caso contrário a hidroquinona pode ser oxidada. Se a solução fica amarela, descartar e preparar outra solução fresca. - Prepare prata lactato solução dissolvendo-se 0,22 g em 30 mL de dH 2 O.
- Misturar as soluções (1.4.1 - 1.4.4) na ordem em que eles são descritos quando estiver pronto para executar as reações (ou seja, após o corte, secagem e fixação) ( Figura 2). Adicione a solução de lactato de prata no final. Certifique-se que essa etapa for concluída rapidamente e a solução do desenvolvedor é colocada no escuro até a hora de reagir as seções como lactato prateado é fotossensível.
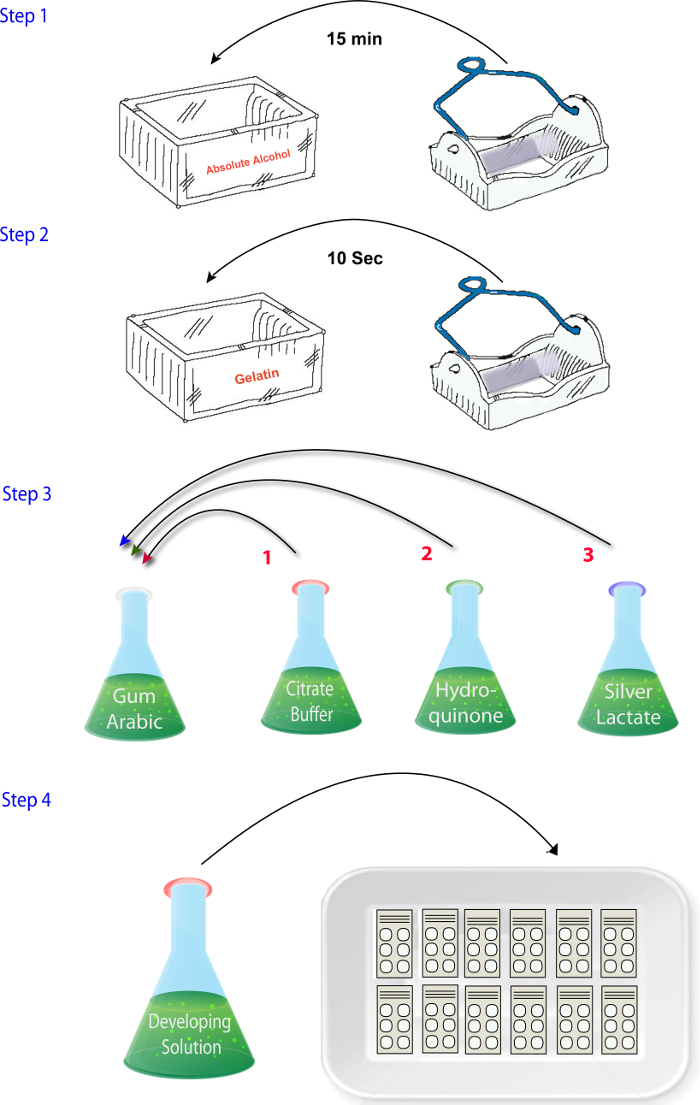
Figura 2: diagrama esquemático ilustrando a sequência de etapas envolvidas na misturar os reagentes na fase de histoquímica de zinco do protocolo. clique aqui para ver uma versão maior desta figura.
2. tratamento do animal e anestesia
- antes de sedar o animal, preparar uma solução de 1% de sódio Selenito (at 2 SeO 3) dissolvendo-se 10 mg de Selenito de sódio em 1 mL dH 2 O.
- Anestesiar o animal com uma injeção intramuscular de cetamina (25 mg/kg) e xilazina (2 mg/kg).
Nota: Certifique-se que um nível adequado de anestesia é alcançado usando a pedal reflexo resposta.
Solução de Selenito de sódio quelante (15 mg/kg) de zinco - Inject intraperitonealmente (IP).
Nota: A toxicidade de Selenito de sódio em idades diferentes ou em outras espécies pode variar. - Permitir que 60 a 90 min para o Selenito de sódio viajar para o cérebro. Durante este período, é imperativo assegurar que o animal está devidamente sedado e não responde, para verificar a profundidade da anestesia cada 5 min.
- Durante o período de selenito, enquanto o animal é anestesiado, certifique-se de que os olhos estão fechados para evitar o ressecamento, ou administrar pomada oftálmica para mantê-los húmida.
3. Preparação do tecido e coloração
- eutanásia do animal através da administração de uma overdose de pentobarbital de sódio (100 mg/kg, IP).
- Executar transcardial perfusão com solução salina normal por 1 min e com paraformaldeído 4% por 20 min. por último, administrar uma solução com 4% paraformaldeído e 10% de sacarose (um período de fixação total de 1h).
- Remover a cabeça usando um par de tesouras grandes.
- Fazer uma incisão usando um bisturi do nariz no pescoço para expor o crânio.
- Cuidadosamente remova o cérebro e separar os hemisférios com uma lâmina.
- Bloco a parte posterior do cérebro e sufixo em paraformaldeído 4% em tampão de fosfato 0,1 M (PB) por várias horas.
- Colocar os blocos em uma solução de sacarose de 30% em 0.1 M PB e permitir que o cérebro a afundar-se.
Nota: Substituir a solução de sacarose de paraformaldeído e 30% de 4% com solução de 30% de sacarose em 0.1 M PB para afundar o cérebro limita o cérebro ' exposição s de paraformaldeído como este pode afetar o tecido coloração qualidade.
Coletores de - uma vez no cérebro, corte semi tangencial 40 µm espessura seções através do córtex visual ou região de interesse em um micrótomo ou criostato congelação, deslizante. Isso pode ser feito colocando o bloco com a medial aplainando suavemente com uma lâmina de vidro e superfície baixo.
- Recolher seções com um pincel e armazenar em uma caixa de ferramentas, contendo tampão fosfato salino (PBS).
- Separar as seções em série numerada separada. Imediatamente montar uma ou duas séries de seções do cérebro sobre ovo subbed slides (secção 1), deixar secar durante a noite à temperatura ambiente e processar seções histochemically para zinco sináptica.
Nota: Outras séries podem ser tratados por outros marcadores para comparação, tais como a mielina 12 ou citocromo oxidase usando o protocolo modificado 13: incubar por 2-8 h a 40 ° C, com 3% de sacarose, citocromo C, de 0,015% 0,015% catalase e 0,02% diaminobenzidina em PB de 0,1 M. Substância de Nissl também pode ser usada como um marcador histológico para distinguir áreas corticais visuais. Estas outras manchas histológicas não exigem que as seções do cérebro são montadas em slides subbed-clara de ovo, assim os slides de gelatina tradicional revestido podem ser usados em vez disso.
4. Sináptica histoquímica de zinco
- corrigir as seções de slides montados em álcool absoluto por 15 min e deixe-a secar completamente em temperatura ambiente por 1 h. < lEu > brevemente mergulhe seções para 10 s em uma solução de 1% de gelatina (seção 1) e deixe-a secar durante a noite em temperatura ambiente.
- Misture as soluções conforme descrito na etapa 1.8, assim como seções estão prontas para ser reagiu.
- Reagir as seções organizar os slides lado a lado em um vidro ou bandeja plástica, e derramando a solução em desenvolvimento sobre as guias. Verifique se slides estão completamente submersos na solução e transferir a bandeja em um espaço escuro ou cobrem com uma caixa.
Nota: Uma bandeja plástica que é aproximadamente 12 polegadas long por 8 polegadas de largura pode ser usado, que se encaixa exatamente 18 slides. Um volume total de 200 mL de solução de desenvolvedor é suficiente para submergir completamente os slides, para garantir que o volume correto é usado para o número de slides para ser reagiu e ajustar de acordo com a receita. Uso de uma bandeja de plástico ou de vidro em vez de usar uma bandeja de metal é recomendável como há algum grau de cruz reatividade entre o lactato prateado na solução de desenvolvedor e o ferro ou outros metais encontrados em bandejas de metal.
- Reagir as seções organizar os slides lado a lado em um vidro ou bandeja plástica, e derramando a solução em desenvolvimento sobre as guias. Verifique se slides estão completamente submersos na solução e transferir a bandeja em um espaço escuro ou cobrem com uma caixa.
- Acompanhar a evolução da reação inspecionando visualmente as seções a cada 30 min. As seções geralmente exigem 120-180 min para desenvolvimento completo.
- Se seções tornam-se overstained (ver Figura 3a), diferenciar-se em 2% agricultor ' s solução (9 peças de tiossulfato de sódio 2% em dH 2 O e 1 parte 2% ferricianeto de potássio em dH 2 O) 1-2 min.
Nota: A seção da amostra que é mal corada é mostrada na Figura 3b. - Uma vez que a intensidade desejada é alcançada, encerrar a reação removendo o slide montadas seções da bandeja e colocando os slides em uma cremalheira de slide.
- Colocar as lâminas em um copo grande mancha prato e lavar as lâminas em morna (40-50 ° C) água corrente por 10 min remover o revestimento de gelatina e o depósito de prata exterior.
Nota: Tenha cuidado para não agitar o porta-lâminas para evitar seções de deslizar fora. A intensidade desejada da seção é alcançada quando suficiente variação laminar é evidente e seções são bastante escuro, mas não exagerei (ver figura 4a). - Permitem que os slides secar à temperatura ambiente e em seguida, desidrata-se em 100% EtOH (5 min), claro em xileno (5 min) e o deslizamento da tampa com um meio de montagem. Como alternativa, coloque os slides em uma série crescente de álcool, em seguida, desidrata-se, claro e lamela.
- Seções de uso de animais sem tratamento prévio de Selenito para servir como um controle negativo. Amplificação de prata dessas seções não deve produzir nenhuma mancha.
Nota: Para obter melhores resultados permitem seções para secar durante a noite. Permitindo que as seções para secar durante a noite rende melhor coloração do tecido.
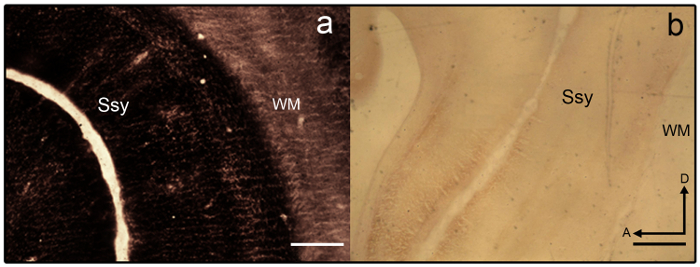
Figura 3: zinco sináptico mancha no cérebro juvenil furão. Fotomicrografias de semi tangenciais seções manchadas de zinco que são um) overstained e b) understained no cérebro juvenil furão. Areal limites são difíceis de discernir como variação laminar é carente. Substância branca é também fortemente corada. Córtex de Ssy Suprasylvian, WM branco importa, um anterior, D dorsal. Barra de escala = 500 µm (a-b). clique aqui para ver uma versão maior desta figura.
5. distinção entre limites de Areal e aquisição de imagens
- uso arquitetônicas características de regiões diferentes do cérebro para identificação de areal e laminar.
Nota: por exemplo, no desenvolvimento rato retrosplenial cortex 14, os autores revelaram uma modularidade transitória caracterizada pela coloração pesado para o zinco, o que não está presente no adulto, mas poderia ser utilizado para descrever cortical organização durante o desenvolvimento nesta espécie. Em outro estudo 15, os autores revelaram especificidade na distribuição do zinco sináptica de núcleos diferentes encontrados na amígdala macaque macaco, que facilitam a identificação destas divisões. Áreas corticais visuais no cérebro em desenvolvimento e adultos furão tem sido descrito anteriormente 16 , 17 , 18, subdivisão arquitetônica do neocórtex em o esquilo-cinzento foram descritos 19. Além disso, zinco histoquímica foi anteriormente usada para distinguir entre áreas no macaco adulto córtex visual 8, desenvolvendo e adulto gato córtex visual 5, desenvolvendo o córtex somatossensorial rato 9 , 20 e rato adulto córtex somatossensorial 6 , 21. Se disponível, compare o padrão de coloração na mielina manchado, citocromo oxidase (CO) manchado e zinco sináptico manchado seções do cérebro, para confirmar os limites de areal no adulto. Nas seções semi tangenciais de furão córtex visual manchado para zinco sináptico, há importantes diferenças entre áreas corticais visuais que facilitam a identificação de areal. Por exemplo, áreas 17 e 18 do furão adulto revelam que zinco sináptico coloração é alta em camadas-III e V. camada VI manchas menos intensamente, enquanto camada IV quase carece de zinco. A evidente falta de coloração na camada IV ou contrastes de áreas 17 e 18, com a banda sombriamente manchada de zinco encontrado na camada que IV em CO manchado seções. No entanto, camada IV da área 17 em CO manchada seções mantém uma borda afiada com camadas III e V, mas camada IV na área 18 é caracterizada por uma sutil diminuição na intensidade de coloração e seu limite superior encontrado na camada III é menos distinguível. - Examinar seções usando microscopia brightfield com um objectivo de baixa potência (2x ou 4x) e fotografar as áreas de interesse.
- Realce de contraste e brilho de fotomicrografias usando software de processamento de imagem. Imagens obtidas por medições de densidade óptica não devem ser alteradas de alguma forma.
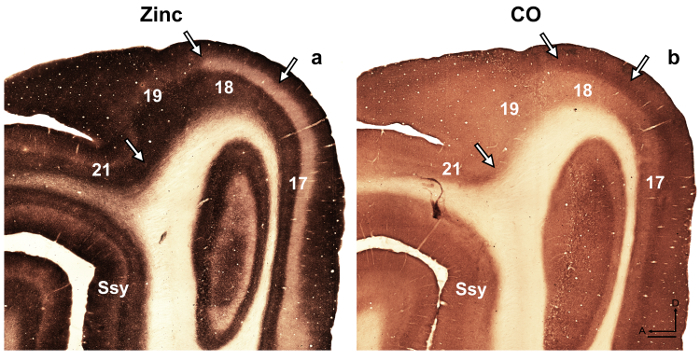
Figura 4: zinco sináptico mancha no cérebro adulto furão distingue diferentes áreas corticais visuais. Fotomicrografias de seções adjacentes de semi tangenciais manchado para (um) sináptica zinco ou (b) citocromo oxidase (CO) no adulto. Setas marcam limites areal. Ssy Suprasylvian córtex, um anterior, D dorsal. Barra de escala = 500 µm. clique aqui para ver uma versão maior desta figura.
6. densitometria (opcional)
Nota: Densitometric análise pode ser utilizada para avaliar a distribuição do zinco sináptica no cérebro através da medição da densidade óptica de zinco representante manchado seções nas regiões de interesse. Esse método também é útil para controlar possíveis alterações nos níveis de zinco sináptica durante todo o desenvolvimento.
- Usando selecionado seções manchadas de zinco, aleatoriamente escolher colunas corticais (colunares fotomicrografias) de largura adequada (uma coluna de largura 450 µm pode ser usada) adquiridas fotomicrografias da região de interesse. Uma coluna cortical é uma região que abrange todas as camadas corticais da superfície pial para a substância branca.
- Escolher um número adequado de colunas de amostra de várias seções do cérebro diferente em cada região de interesse.
- Transferência de imagens de amostra das colunas representativas em uma software de processamento de imagem.
- Usar a ferramenta de seleção retangular para abranger toda a coluna cortical.
- Usar a ferramenta invert para criar uma imagem de contraste invertido semelhante a um negativo fotográfico da coluna.
Nota: Inversão de contraste das imagens é feita para produzir valores de alta densidade óptica para os níveis de zinco sináptica alta e baixa densidade óptica para níveis baixos de zinco sináptica. Esta é uma maneira mais intuitiva para processar gráficos de perfil de enredo similares aos vistos na Figura 5. - Produzir perfis de densidade óptica por essas imagens usando a ferramenta de perfil de trama para gerar um gráfico bidimensional das intensidades pixel ao longo de uma linha.
- Use opções de plotagem para converter o gráfico de perfil de trama para um perfil vertical e clique na trama do perfil uma vez mais.
Nota: Representa a distância do eixo x ao longo da linha e o eixo y representa a intensidade do pixel. Portanto, cada valor de perfil gráfico reflete o valor de escala de cinza médio em cada profundidade em toda a largura da coluna. - Valores de perfil de trama aberta como arquivos de texto na planilha, normalizar e Plotar como gráficos (ver Figura 5).
Nota: É aconselhável usar a densidade relativa de zinco sináptica para comparação das medições quantitativas como os resultados podem ser confundidos pela variação na intensidade de coloração geral como resultado de diferentes tempos de reação, stainability do tecido, bem como outros variáveis. - Calcular a densidade relativa de zinco realizando uma média de vagão dos valores de perfil de trama para suavizar os dados.
Nota: Isso é realizado, em média, por exemplo, todos os pixels de 20 ou 30 sucessivas (1 pixel = 2,5 µm) em profundidade e então normalizando a intensidade máxima para cada amostra. Portanto, cada valor de perfil de gráfico média reflete o valor de escala de cinza médio a essa profundidade (escala de cinza valores variam de 0 a 255). Um método de normalização diferentes pode ser usado pelo primeiro adquirente matéria branca (WM) valores de densidade óptica de regiões da amostra incluem a substância branca subjacente nas áreas de interesse. Idealmente, escolha várias regiões que estão tão levemente coradas quanto possível para obter uma média de valor WM. Valores de densidade óptica média dividem-se em seguida por valores médios de WM para obter valores normalizado de WM. - Determinar quer dizer valores de densidade óptica em camadas específicas de regiões de interesse para comparações quantitativas.
Nota: por exemplo, o valor de densidade óptica mínima média na camada IV de áreas corticais visuais do furão são determinados pela abrangendo a região menos manchada por ± 5 pixels. - Calcular densidade óptica média valores nas camadas supragranular e infragranular de áreas corticais visuais de furão, inserindo a região mais escura manchada por ± 5 pixels para determinar o valor médio máximo.
- Certifique-se que significam valores de densidade óptica é obtidos dentro de camadas particulares.
Nota: É imperativo para verificar os limites dessas camadas nas imagens de contraste invertido, comparando-os com as fotomicrografias originais, bem como a seção de CO adjacente. Isto garante que um não intrometer-se em camadas adjacentes.
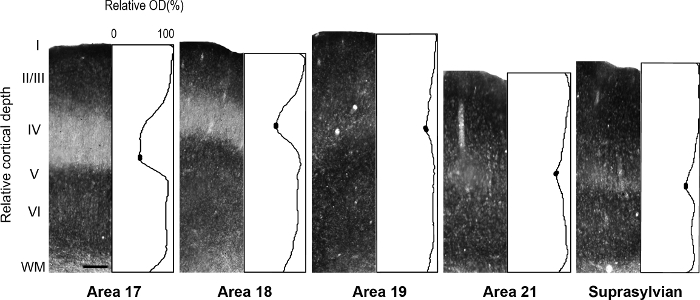
Figura 5: distribuição Laminar de zinco sináptica em diferente visual cortical áreas no furão adulto. Fotomicrografias representativas das colunas através de todas as camadas corticais com perfis de densidade óptica normalizado correspondente em um adulto. Densidade baixa de zinco sináptica na camada IV de adultas áreas 17 e 18 é indicada pela calha na trama do perfil. Em cada perfil do enredo ovais preenchidas na bandeja da camada IV indicam os valores usados para determinar o valor de intensidade média mínima de pixel. Barra de escala = 200 µm. clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
As principais etapas envolvidas neste protocolo para manchar as seções do cérebro para zinco sináptica são apresentadas em um fluxograma na Figura 1. O protocolo pode ser dividido em três fases: 1) perfusão e coleção de tecido, preparação 2) tecido de coloração e histoquímica de zinco 3). Resumidamente, durante a primeira fase do protocolo, o animal é anestesiado e injetados IP com a dose adequada de Selenito de sódio. Após um período de tem...
Access restricted. Please log in or start a trial to view this content.
Discussão
O estudo atual emprega uma técnica histochemical baseada em uma versão modificada do Danscher método (1982)10, pelo qual localização de zinco sináptica pode ser detectada e visualizada no cérebro. Esse método funciona, essencialmente, injetando o animal com o Selenito de sódio quelante de zinco (ND2SeO3) (15 mg/kg). Após a injeção, o selenite viaja para o cérebro e vincula a zinco grátis que está localizado a vesículas pré-sináptica de zinco que contém neur...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado por doações do centro nacional para recursos de pesquisa (2G12RR03060-26A1); O Instituto Nacional sobre saúde de minoria e disparidades de saúde (8G12MD007603-27) dos institutos nacionais de saúde; Profissional pessoal Congresso-City University de Nova York (CUNY-PSC); e faculdade Research Grant (FRG II) Universidade Americana de Sharjah. Agradecemos Vidyasagar Sriramoju por nos apresentar para esses métodos.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Referências
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados