Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de Zinc synaptique histochimie pour révéler les différentes régions et les limbes dans le cerveau en développement et Adult
Dans cet article
Résumé
Nous décrivons une procédure histochimique qui révèle des caractéristique zinc laminaire et areal coloration modèles dans différentes régions du cerveau. Le patron de coloration zinc peut servir en conjonction avec d’autres marqueurs anatomiques à fiable distinguer des couches et des régions du cerveau en développement et les adulte.
Résumé
Caractérisation de l’Organisation anatomique et fonctionnelle du cerveau et le développement nécessite une identification exacte des circuits neurones distincts et des régions dans le cerveau adulte et immature. Nous décrivons ici une méthode de coloration histochimique zinc qui révèle des différences dans les profils de coloration entre les différentes couches et les régions du cerveau. D’autres ont utilisé cette procédure non seulement pour révéler la distribution des neurones contenant du zinc et des circuits dans le cerveau, mais aussi de délimiter avec succès des limites areal et laminaires dans le cerveau en développement et adult dans plusieurs espèces. Ici, nous illustrons cela souillant le procédé avec des images des pays en développement et de la cervelle de furet adulte. Nous révèlent un modèle zinc-coloration qui sert comme un marqueur anatomique des zones et des couches et peut être utilisés de manière fiable pour distinguer les aires corticales visuelles dans le cortex visuel en développement et les adult. Le principal objectif du présent protocole est de présenter une méthode histochimique qui permet l’identification précise des couches et des régions dans le cerveau en développement et adulte où les autres méthodes ne parviennent pas à le faire. Secondairement, en conjonction avec l’analyse densitométrique image, cette méthode permet d’évaluer la distribution de zinc synaptique pour révéler des changements possibles au cours du développement. Ce protocole décrit en détail les réactifs, des outils et démarches nécessaires pour colorer successivement les sections du cerveau gelé. Bien que ce protocole est décrit à l’aide de tissus cérébraux de furet, il peut être facilement adapté pour être utilisé dans les rongeurs, les chats ou les singes ainsi que dans d’autres régions du cerveau.
Introduction
Taches histologiques ont été utilisées traditionnellement pour aider à l’identification des aires corticales chez diverses espèces de révéler des différences dans les caractéristiques architectoniques. L’utilisation combinée des techniques histochimiques telles que pour la substance Nissl, réactivité de la cytochrome oxydase (CO) ou la myéline peut se révéler fructueuse qu’ils révèlent des limites areal semblables dans le cerveau adulte. Cependant, ces taches histochimiques ne révèlent pas toujours bien des limites claires entre les aires corticales et les couches dans le cerveau immature.
Dans le système nerveux central, le zinc a plusieurs fonctions essentielles qui incluent de stabiliser la structure de l’ADN, agissant comme un cofacteur de l’enzyme, participant à nombreuses fonctions de réglementation et agissant comme un neuromodulateur grâce à sa présence dans les vésicules synaptiques 1. zinc synaptique est unique car il peut être visualisé à l’aide des méthodes histologiques, tandis que le zinc protéinique ne peut pas être visualisé2. Cette fonctionnalité a été exploitée pour révéler le modèle zinc synaptique dans différentes régions corticales et histochimie synaptique de zinc a été utilisé dans un certain nombre d’études. Un sous-ensemble des neurones glutamatergiques dans le cortex cérébral contiennent du zinc dans les vésicules présynaptiques dans leur axone bornes3,4. Les études histochimiques ont révélé une distribution hétérogène de zinc synaptique dans le cortex cérébral5,6,7. Il semble y avoir une autre distribution surfacique et laminaire zinc histochimiquement réactif dans différentes régions du cortex (par exemple, visual contre cortex somatosensoriel), ou des couches (p. ex., les niveaux de zinc dans la supragranular et infragranular couches du cortex visuel primaire sont sensiblement plus élevés que dans thalamocortical couche d’entrée IV avec des niveaux relativement faibles de zinc synaptique)5,8,9. L’hétérogénéité en zinc synaptique coloration observées dans le cortex est particulièrement avantageuse, car elle facilite l’identification areal et laminaire.
Nous présentons ici une description détaillée d’une procédure histochimiques zinc synaptique, qui est une version modifiée de 1982 méthode10 de Danscher. Cette méthode utilise le sélénite injecté par voie intrapéritonéale (IP) dans les animaux comme agent chélateur. Le sélénite se rend au cerveau à réagir avec des piscines de zinc gratuit trouvé dans les vésicules d’un sous-ensemble des synapses glutamatergiques dans le cerveau. Cette réaction donne un précipité qui peut être amélioré par la suite en développement argent2,10,11.
Cette procédure révèle des tendances laminaires et surfaciques de zinc synaptique coloration ; analyse densitométrique peut servir à évaluer ces patrons qualitativement et quantitativement dans le cerveau adult et immature pour étudier les effets d’autres interventions, comme les manipulations sensorielles, environnementales, pharmacologiques ou génétiques. En outre, on peut vouloir aussi évaluer d’éventuels changements dans la distribution de zinc synaptique dans d’autres structures corticales ou sous-corticales dans d’autres systèmes de modèle. Les informations quantitatives fournies par analyse densitométrique dans cette méthode peuvent être avantageux pour le développement du cerveau suivant au fil du temps. Ce protocole prévoit un compagnon d’autres immuno - histochimiques marqueurs et pour révéler les limites laminaires et surfaciques.
Access restricted. Please log in or start a trial to view this content.
Protocole
le protocole suivant suit les directives de santé animale institués par l’animalerie institutionnelle et utilisation Comité (IACUC) à The City College of New York, qui sont conformes à tous les état approprié et les lignes directrices fédérales. L’anesthésie est approprié pour les furets et devraient être modifiée en fonction des espèces étudiées.
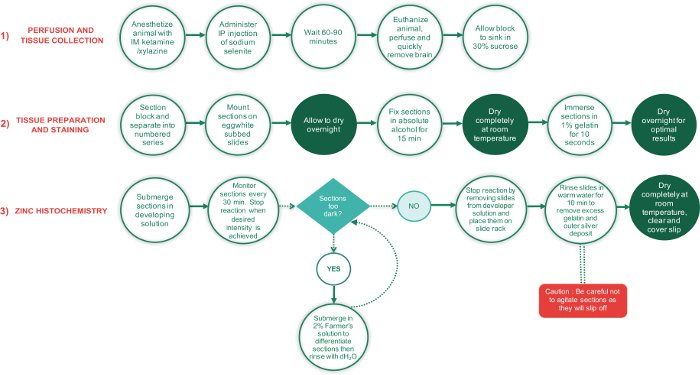
figure 1 : organigramme décrivant les grandes étapes dans les 3 phases du présent protocole et le temps requis pour effectuer chaque étape. Périodes nécessitant des sections à sécher complètement figurent dans les cercles de texte vert, alors que toutes les autres étapes sont dans les cercles de texte blanc. La boîte de texte en forme de losange vert est un point de décision, tandis que le rectangle rouge est une étape cruciale et doit être effectué avec soin supplémentaire. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
1. étapes préparatoires (glisser d’ancrage et en faisant de la Solution)
- les unsubbed lames avec un détergent à l’eau chaude et rincer plusieurs fois à l’eau tiède suivie d’un rinçage à l’eau distillée à complètement éliminer toute saleté ou des débris. Laisser les lames sécher à température ambiante ou dans une étuve à 37 ° C.
- Une fois que les lames soient complètement secs, couche une mince couche uniforme de blanc de œuf sur chaque diapositive à l’aide des doigts ou un pinceau. Laisser pour sécher au four à 60 ° C pendant 20-30 min. Pour des résultats optimaux et d’éviter les sections glissent, ajouter une seconde couche de blanc d’oeuf et laisser pour sécher une fois de plus au four à 60 ° C.
- Préparer une solution de 1 % de gélatine en dissoudre 1 g de gélatine dans 100 mL d’eau chaude (60 ° C) et laisser refroidir à température ambiante.
- Préparer 200 mL de solution de développeur, tel que décrit ci-dessous pour une utilisation dans la section 4.
- Solution de gomme arabique Prepare en ajoutant lentement 40 g par incréments à 120 mL d’eau chaude (il se dissout plus facilement de cette façon). Continuez à remuer la solution avec un verre tige d’agitation. Une fois que la solution est entièrement dissout, retirer du feu et laissez-le refroidir pendant quelques minutes, puis filtrer à travers 6-8 couches de tissu de gaze dans un entonnoir de. Tampon
- citrate de Prepare en ajoutant 5,04 g d’acide citrique plus 4,7 g de citrate de sodium dans 20 mL dH 2 O et dissoudre le mélange. S’assurer que le pH de cette solution est 4.0 à 25 ° C. ajuster le pH si nécessaire par l’ajout d’hydroxyde de sodium ou d’acide chlorhydrique à la solution.
- Préparer la solution de l’Hydroquinone en chauffage 30 mL dH 2 O et dissoudre 1,7 g d’Hydroquinone.
NOTE : Chauffer la solution de l’hydroquinone est essentiel afin qu’il puisse se dissolvent facilement dans l’eau comme l’hydroquinone n’est pas facilement soluble dans l’eau à température ambiante. Veillez à maintenir la température de l’eau inférieure à 60 ° C, sinon l’hydroquinone peut être oxydé. Si la solution vire au jaune, jeter et préparer une autre solution fraîche. - Prepare argent lactate solution en dissolvant 0,22 g dans 30 mL de dH 2 O.
- Mélanger les solutions (1.4.1 - 1.4.4) dans l’ordre dans lequel elles sont décrites lorsque vous êtes prêt à effectuer les réactions (c.-à-d., après la découpe, séchage et fixation) ( Figure 2). Ajouter la solution de lactate de l’argent à la fin. S’assurer que cette étape est effectuée rapidement et la solution de développeur est placée dans l’obscurité jusqu'à ce qu’il est temps de réagir les sections comme argent lactate est photosensible.
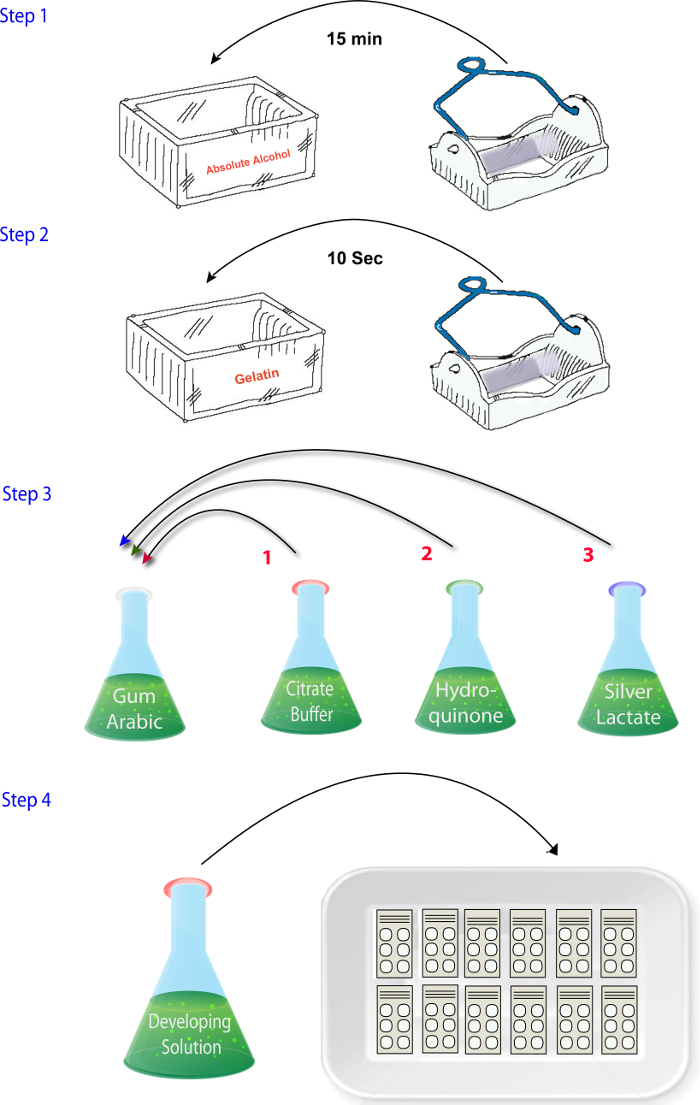
figure 2 : schéma illustrant la séquence des étapes à suivre pour mélanger les réactifs dans la phase d’histochimie zinc du protocole. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
2. traitement de l’animal et l’anesthésie
- avant la sédation de l’animal, préparer une solution de sélénite (Na 2 SeO 3) de sodium à 1 % en dissolvant 10 mg de sélénite de sodium à 1 mL dH 2 O.
- Anesthésier l’animal avec une injection intramusculaire de kétamine (25 mg/kg) et de xylazine (2 mg/kg).
Remarque : Veillez à ce qu’un niveau approprié de l’anesthésie est obtenu en utilisant la réponse réflexe pédale.
Solution de sélénite de sodium chélateur (15 mg/kg) de zinc - injecter par voie intrapéritonéale (IP).
Remarque : La toxicité de sélénite de sodium à des âges différents ou chez d’autres espèces puisse varier. - Permettent de 60 à 90 min pour le sélénite de sodium, se rendre au cerveau. Durant cette période, il est impératif de s’assurer que l’animal est correctement sous sédation et ne répond pas, afin de vérifier la profondeur de l’anesthésie chaque 5 min.
- Pendant la période de sélénite, tandis que l’animal est anesthésié, assurez-vous que les yeux sont fermés pour prévenir le dessèchement ou administrer une pommade ophtalmique pour les garder humides.
3. Préparation du tissu et coloration
- euthanasier l’animal par l’administration d’une surdose de pentobarbital de sodium (100 mg/kg, i.p).
- Perform transcardial perfusion avec une solution saline normale pendant 1 min et paraformaldéhyde à 4 % pendant 20 min. Enfin, administrer une solution contenant 4 % de sucrose paraformaldéhyde et 10 % (une période de fixation totale de 1 h).
- Retirer la tête à l’aide d’une paire de grands ciseaux.
- Faire une incision médiane à l’aide d’un scalpel du nez jusqu’au cou pour exposer le crâne.
- Soigneusement retirer le cerveau et séparer les hémisphères avec une lame de.
- Bloquer la partie postérieure du cerveau et postfix dans paraformaldéhyde à 4 % dans un tampon phosphate 0,1 M (PB) pendant plusieurs heures.
- Placer les blocs dans une solution de saccharose 30 % à 0,1 M PB et permettent au cerveau de couler.
NOTE : Remplacer la solution de saccharose de paraformaldéhyde et 30 % 4 % avec une solution de saccharose 30 % à PB de 0,1 M à couler le cerveau limite le cerveau ' s exposition de paraformaldéhyde car cela peut affecter tissu coloration qualité.
Puits de - une fois le cerveau, coupe semi tangentielle coupes épaisses de 40 µm à travers le cortex visuel ou de la région d’intérêt sur un microtome gel, coulissant ou un cryostat. Ceci peut être accompli en plaçant le bloc avec du côté médial de surface vers le bas et aplatissement doucement avec une lame de verre.
- Recueillir les sections avec un pinceau et les ranger dans une boîte contenant une solution saline tamponnée au phosphate (PBS).
- Séparer les sections en série numérotée séparément. Monter immédiatement une ou deux séries de sections de cerveau sur diapositives subbed blanc de œuf (section 1), laisser sécher jusqu’au lendemain à la température ambiante et traiter les sections histochimiquement pour zinc synaptique.
Remarque : Autres séries peuvent être traitées pour les autres marqueurs à titre de comparaison, tels que la myéline 12 ou cytochrome oxydase en utilisant le protocole mis à jour le 13 : incuber pendant 2 à 8 heures à 40 ° C, avec 3 % de sucrose, 0,015 % Cytochrome C, catalase 0,015 % et 0,02 % diaminobenzidine dans 0,1 M PB. Nissl substance peut également être utilisée comme marqueur histologique permettant de distinguer les aires corticales visuelles. Ces autres colorants histologiques n’exigent pas que sections du cerveau sont montées sur glissières subbed de blanc d’oeuf, ainsi les diapositives de la gélatine traditionnelle enduit peuvent être utilisées à la place.
4. Histochimie synaptique de Zinc
- fixer sections des diapositives montées en alcool absolu pendant 15 min et laisser pour sécher complètement à température ambiante pendant 1 h. < lJ’ai > Plongez brièvement les sections pour 10 s dans une solution de 1 % de gélatine (section 1) et laisser sécher jusqu’au lendemain à la température ambiante.
- Mélanger les solutions tel que décrit à l’étape 1.8, dès que les sections sont prêtes à faire réagir.
- Réagissent les sections en arrangeant les diapositives côte à côte dans un verre ou un plateau en plastique et verser la solution en développement sur les diapositives. Vérifiez que les diapositives sont complètement immergés dans la solution et transférer le plateau dans un espace sombre ou couvrent avec une boîte étanche à la lumière.
Remarque : Un plateau en plastique qui est d’environ 12 pouces de long par 8 pouces de large peut être utilisé, qui s’ajuste exactement 18 diapositives. Un volume total de 200 mL de solution de développeur est suffisant pour submerger complètement les diapositives, afin d’assurer que le volume est utilisé pour le nombre de diapositives pour faire réagir et adapter la recette en conséquence. Utilisation d’un plateau en plastique ou en verre plutôt que d’utiliser un bac en métal est conseillée car il existe un certain degré de croix réactivité entre le fer et le lactate d’argent dans la solution de développeur ou d’autres métaux dans des plateaux métalliques.
- Réagissent les sections en arrangeant les diapositives côte à côte dans un verre ou un plateau en plastique et verser la solution en développement sur les diapositives. Vérifiez que les diapositives sont complètement immergés dans la solution et transférer le plateau dans un espace sombre ou couvrent avec une boîte étanche à la lumière.
- De suivre l’évolution de la réaction en inspectant visuellement les sections toutes les 30 minutes. Les sections requièrent généralement 120-180 min pour un développement complet.
- Si les sections deviennent overstained (voir la Figure 3 a), se différencient dans 2 % agriculteur ' solution s (9 pièces de thiosulfate de Sodium 2 % dH 2 O et 1 partie 2 % ferricyanure de Potassium en dH 2 O) pendant 1-2 min.
NOTE : Section d’échantillon qui est faiblement colorée est montrée dans la Figure 3 b. - Une fois l’intensité désirée est atteinte, mettre fin à la réaction en enlevant la diapositive montée des sections de la barre d’État et en plaçant les diapositives sur une grille coulissante.
- Placer la grille coulissante dans un grand verre plat de coloration et laver les diapositives de chaud (40-50 ° C), l’eau courante pendant 10 min enlever la couche de gélatine et le dépôt d’argent extérieur.
Remarque : Veillez à ne pas agiter la grille coulissante pour empêcher des sections de glisser. L’intensité désirée de la section est atteinte lorsque suffisamment laminaire variation est évidente et sections sont assez foncé mais pas surréagi (voir Figure 4 a). - Laisser les lames sécher à température ambiante, et puis déshydrater dans 100 % EtOH (5 min), clairement dans le xylène (5 min) et la lamelle couvre-objet avec un milieu de montage. Vous pouvez également déposer les lames dans une série ascendante de l’alcool, puis déshydrater, clear et lamelle.
- Sections utilisation d’animaux sans traitement antérieur de sélénite à servir comme témoin négatif. Amplification argentée de ces sections ne devrait donner aucune coloration.
NOTE : Pour des résultats optimaux permettent de sections sécher jusqu’au lendemain. Permettant aux sections sécher pendant la nuit donne meilleure coloration de tissus.
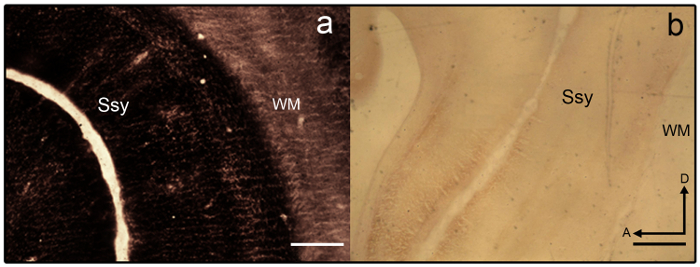
figure 3 : Synaptic zinc coloration dans le cerveau de jeunes furets. Microphotographies de semi tangentielles sections zinc colorés qui sont a) overstained et b) p.falciparum dans le cerveau de jeunes furets. Areal limites sont difficiles à discerner comme variation laminaire fait défaut. La substance blanche est aussi très sale. Ssy Suprasylvian cortex, WM blanc matière, un antérieur, D dorsal. Echelle = 500 µm (a-b). s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
5. distinction entre Areal limites et Acquisition d’images
- utilisation Caractéristiques architectoniques de différentes régions du cerveau pour l’identification areal et laminaire.
NOTE : par exemple, dans les pays en développement retrosplenial du cortex de rat 14, les auteurs ont révélé une modularité transitoire caractérisée par des taches lourdes pour le zinc, qui n’est pas présent chez l’adulte, mais pourrait être utilisé pour décrire la corticale Organisation au cours du développement chez cette espèce. Dans une autre étude 15, les auteurs ont révélé la spécificité dans la distribution de zinc synaptique des différents noyaux trouvés dans l’amygdale de singe macaque, faciliter l’identification de ces divisions. Les aires corticales visuelles dans le cerveau de furet en développement et adultes ont été décrites précédemment 16 , 17 , 18, subdivision architectonique du néocortex dans l’écureuil gris ont été décrits 19. En outre, zinc histochimie précédemment utilisé pour distinguer les zones dans le singe adulte cortex visuel 8, le développement et l’adulte chat cortex visuel 5, développant le cortex somatosensoriel 9 , 20 et souris adulte cortex somatosensory 6 , 21. Le cas échéant, comparez le modèle de coloration dans la myéline Taché, souillé la cytochrome oxydase (CO) et zinc synaptique coupes de cerveau, pour confirmer les limites areal chez l’adulte colorées. Dans les sections semi tangentielles du cortex visuel furet colorées pour zinc synaptique, il y a des différences parmi les aires corticales visuelles qui facilitent l’identification areal. Par exemple, les zones 17 et 18 du furet adult révèlent que coloration de zinc synaptique est élevée dans les couches I à III et V. couche VI se colore moins intensément, tandis que la couche IV n’a presque pas de zinc. L’absence remarquable de coloration dans la couche IV ou contraste de zones 17 et 18 avec la bande sombre teintée de zinc trouvé dans la couche QU'IV en CO coupes colorées. Cependant, couche IV de zone 17 dans CO coupes coloré maintient une frontière nette avec couches III et V, mais couche IV dans la zone 18 est caractérisée par une diminution subtile dans l’intensité de coloration et sa limite supérieure trouvé dans la couche III est moins distinguable. - Examiner les sections microscope à fond clair avec un objectif de faible puissance (2 X ou 4 X grossissement) et de photographier les zones d’intérêt.
- Renforcer contraste et la luminosité de microphotographies en utilisant le logiciel de traitement d’image. Les images obtenues pour le mesurage des densités optiques ne doit pas être modifiés en aucune façon.
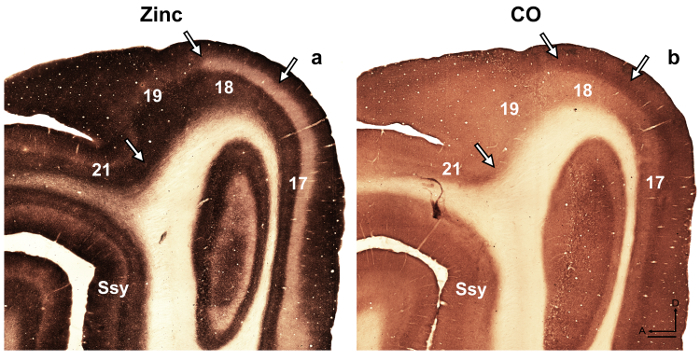
figure 4 : Synaptic zinc coloration dans le cerveau adulte furet distingue différentes aires corticales visuelles. Microphotographies de sections adjacentes de semi tangentielles colorées pour (une) synaptique zinc ou (b) cytochrome oxydase (CO) chez l’adulte. Flèches délimiter areal. Ssy Suprasylvian cortex, un antérieur, D dorsal. Echelle = 500 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
6. densitométrie (facultative)
Remarque : DensitomEtude analyse peut servir à évaluer la distribution de zinc synaptique dans le cerveau en mesurant la densité optique de zinc représentant coupes dans les régions d’intérêt coloré. Cette méthode est également utile pour le suivi des modifications possibles dans les niveaux de zinc synaptique au cours du développement.
Sélectionné à l’aide- -sections de zinc Taché, choisir au hasard des colonnes corticales (photomicrographies colonnaires) de largeur appropriée (une colonne large 450 µm peut être utilisée) de microphotographies acquises de la région d’intérêt. Une colonne corticale est une région qui s’étend de toutes les couches corticales de la pie-mère surface de la matière blanche.
- Choisissez un nombre approprié de colonnes exemple dans plusieurs sections du cerveau différentes dans chaque région d’intérêt.
- Transfert d’images de l’échantillon des colonnes représentant dans une logiciel de traitement d’image.
- Utiliser l’outil de sélection rectangulaire pour englober toute la colonne corticale.
- Utiliser l’outil inverti pour créer une image de contraste inversé semblable à un négatif photographique de la colonne.
NOTE : Inversion de contraste des images est effectuée pour obtenir les valeurs haute densité optique pour les niveaux de zinc synaptique haute et basse densité optique pour les niveaux de zinc synaptique faible. Il s’agit d’une façon plus intuitive pour restituer l’intrigue profil graphiques semblables à ceux observés dans la Figure 5. - Produire des profils de densité optique de ces images à l’aide de l’outil de profil de complot pour générer un graphique bidimensionnel des intensités pixel le long d’une ligne.
- Options de tracé d’utilisation pour convertir le graphique du profil tracé un profil vertical et cliquez sur terrain profil une fois plus.
Remarque : La distance axe de représente le long de la ligne et l’axe y représente l’intensité du pixel. Par conséquent, chaque valeur de profil terrain reflète la valeur d’échelle de gris moyen à chaque profondeur sur toute la largeur de la colonne. - Valeurs de profil terrain ouvert sous forme de fichiers texte dans une feuille de calcul, normaliser et tracer des graphiques (voir Figure 5).
Remarque : Il est conseillé d’utiliser la densité relative de zinc synaptique pour comparaison des mesures quantitatives que les résultats peuvent être confondus par une variation dans l’intensité de coloration globale suite à différents temps de réaction, la colorabilité des tissus, ainsi que d’autres variables. - Calculer la densité relative de zinc d’abord une moyenne de wagon couvert des valeurs profil intrigue pour lisser les données.
NOTE : Ceci est accompli en faisant la moyenne, par exemple, chaque pixel de 20 ou 30 successifs (1 pixel = 2,5 µm) en profondeur et puis normalisant à intensité maximale pour chaque échantillon. Par conséquent, chaque valeur moyenne du profil reflète la valeur d’échelle de gris moyen à cette profondeur (échelle de gris valeurs vont de 0 à 255). Une méthode de normalisation différents peut-être servir de premières valeurs de densité optique de la substance blanche (WM) absorbante provenant de régions d’échantillon incluent la substance blanche sous-jacente dans les domaines d’intérêt. Idéalement, choisissez plusieurs régions qui sont plus légèrement colorées que possible afin d’obtenir une moyenne valeur WM. Les valeurs de densité optique moyenne sont ensuite divisés par les valeurs moyennes de WM pour obtenir des valeurs normalisée de WM. - Déterminer signifie les valeurs de densité optique à des calques spécifiques des régions d’intérêt pour des comparaisons quantitatives.
NOTE : par exemple, la valeur de la densité optique moyenne minimale dans la couche IV des aires corticales visuelles du furet sont déterminés par englobant la région moins tachée par pixels ±5. - Densité optique moyenne de calculer des valeurs dans les couches supragranular et infragranular des aires corticales visuelles du furet par englobant la région plus sombre teintée de ± 5 pixels pour déterminer la valeur maximale moyenne.
- Veiller à ce que les valeurs de densité optique moyennes est obtenues à partir des couches particulières.
Remarque : Il est impératif de vérifier les limites de ces couches dans les images de contraste inversé en les comparant aux photomicrographies originales ainsi que la section adjacente de CO. C’est la garantie que l’un n’empiète pas sur les couches adjacentes.
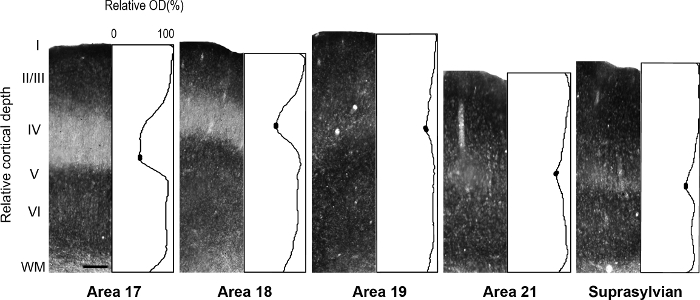
figure 5 : distribution laminaire de zinc synaptique en visuel différent corticale les zones chez le furet adult. Photomicrographies représentant des colonnes dans toutes les couches corticales avec des profils de densité optique normalisée correspondants chez un adulte. Densité de zinc synaptique faible dans la couche IV des adultes zones 17 et 18 est indiquée par la cuvette dans l’intrigue de profil. Dans le profil de chaque parcelle, ovales remplis dans le creux de la couche IV indiquent les valeurs utilisées pour déterminer la valeur d’intensité moyenne minimale de pixels. Echelle = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les grandes étapes de ce protocole pour colorer les sections du cerveau pour le zinc synaptique sont présentés dans un organigramme de la Figure 1. Le protocole peut être divisé en trois phases : 1) Perfusion et prélèvement tissulaire, préparation du tissu 2) et coloration et histochimie Zinc 3). En bref, au cours de la première phase du protocole, l’animal est anesthésié et la dose appropriée de sélénite de sodium injection IP. Après une p?...
Access restricted. Please log in or start a trial to view this content.
Discussion
La présente étude utilise une technique histochimique basée sur une version modifiée de la Danscher méthode (1982)10, auquel cas localisation synaptique de zinc peut-être être détectée et visualisée dans le cerveau. Cette méthode fonctionne essentiellement en injectant l’animal avec le sélénite de sodium chélateur de zinc (Na2SeO3) (15 mg/kg). Après l’injection, la sélénite se rend au cerveau et se lie au zinc gratuit qui est localisé dans les vésicules...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par subventions du National Center for Research Resources (2G12RR03060-26A1) ; L’Institut National sur la santé de minorité et les disparités de santé (8G12MD007603-27) des National Institutes of Health ; Professionnel du personnel Congrès-City University of New York (CUNY-CFP) ; et Faculty Research Grant (FRG II) Université américaine de Sharjah. Nous remercions Vidyasagar Sriramoju pour nous introduire à ces méthodes.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Euthasol (Euthanasia solution) | Henry Schein | 710101 | |
| Sodium selenite | Sigma-Aldrich | 214485 | |
| Ketamine (Ketaved) | Henry Schein | 48858 | 100 mg/ml injectables |
| Xylazine (Anased) | Henry Schein | 33198 | 100 mg/ml injectables |
| Paraformaldehyde | Sigma-Aldrich | F8775 | Dilute to 4% |
| Gum arabic | Sigma-Aldrich | G9752-500G | |
| Citric acid | Sigma-Aldrich | C1909 | |
| Sodium citrate | Sigma-Aldrich | W302600 | |
| Hydroquinone | Sigma-Aldrich | H9003 | |
| Silver lactate | Sigma-Aldrich | 85210 | |
| Fish gelatine | Sigma-Aldrich | G7765 | |
| Cytochrome c | Sigma-Aldrich | C2506 | (Type III, from equine heart) |
| Catalse | Sigma-Aldrich | C10 | |
| Sucrose | Domino | ||
| Xylene | Fisher Scientific | X5P-1GAL | |
| Permount | Fisher Scientific | SP15-500 | |
| 100% Ethanol | Fisher Scientific | A406-20 | Used for dehydration prior to slide mounting |
| Coverslips | Brain Research Laboratories | #3660-1 | |
| Frosted unsubbed slides | Brain Research Laboratories | #3875-FR | |
| Microtome | American Optical Company | 860 | |
| Microscope | Olympus | BX-60 | |
| Adope Photoshop | Adobe Systems, San Jose, CA | To assemble images | |
| ImageJ | Free software can be downloaded at http://rsb.info.nih.gov/ij/ | For densometric measurements | |
| Plastic tray | Any standard plastic tray may be used | to immerse slides in developer solution | |
| Hot plate | Any standard hotplate may be used |
Références
- Nakashima, A., Dyck, R. H. Zinc and cortical plasticity. Brain Res. Rev. 59, 347-373 (2009).
- Frederickson, C. J. Neurobiology of zinc and zinc-containing neurons. Int Rev Neurobiol. 31, 145-238 (1989).
- Beaulieu, C., Dyck, R., Cynader, M. Enrichment of glutamate in zinc-containing terminals of the cat visual cortex. NeuroReport. 3 (10), 861-864 (1992).
- Martinez-Guijarro, F. J., Soriano, E., Del Rio, J. A., Lopez-Garcia, C. Zinc-positive boutons in the cerebral cortex of lizards show glutamate immunoreactivity. J Neurocytol. 20 (10), 834-843 (1991).
- Dyck, R., Beaulieu, C., Cynader, M. Histochemical localization of synaptic zinc in the developing cat visual cortex. J Comp Neurol. 329 (1), 53-67 (1993).
- Garrett, B., Geneser, F. A., Slomianka, L. Distribution of acetylcholinesterase and zinc in the visual cortex of the mouse. Anat Embryol. (Berl). 184 (5), 461-468 (1991).
- Garrett, B., Osterballe, R., Slomianka, L., Geneser, F. A. Cytoarchitecture and staining for acetylcholinesterase and zinc in the visual cortex of the Parma wallaby (Macropus parma). Brain Behav Evol. 43 (3), 162-172 (1994).
- Dyck, R., Cynader, M. An interdigitated columnar mosaic of cytochrome oxidase, zinc, and neurotransmitter-related molecules in cat and monkey visual cortex. Proc. Natl. Acad. Sci. (90), 9066-9069 (1993).
- Land, P. W., Akhtar, N. D. Experience-dependent alteration of synaptic zinc in rat somatosensory barrel cortex. Somatosens Mot Res. 16 (2), 139-150 (1999).
- Danscher, G. Exogenous selenium in the brain: a histochemical technique for light and electron microscopic localization of catalytic selenium bonds. Histochemistry. 76, 281-293 (1982).
- Danscher, G., Howell, G., Perez-Clausell, J., Hertel, N. The dithizone, Timm's sulphide silver and the selenium methods demonstrate a chelatable pool of zinc in CNS: a proton activation (PIXE) analysis of carbon tetrachloride extracts from rat brains and spinal cords intravitall treated with dithizone. Histochemistry. 83, 419-422 (1985).
- Gallyas, F. Silver staining of myelin by means of physical development. Neurol Res. 1 (2), 203-209 (1979).
- Wong-Riley, M. Changes in the visual system of monocularly sutured or enucleated cats demonstrable with cytochrome oxidase histochemistry. Brain Res. 171 (1), 11-28 (1979).
- Miró-Bernié, N., Ichinohe, N., Perez-Clausell, J., Rockland, K. S. Zinc-rich transient vertical modules in the rat retrosplenial cortex during postnatal development. J Neurosci. 138 (2), 523-535 (2006).
- Ichinohe, N., Rockland, K. S. Distribution of synaptic zinc in the macaque monkey amygdala. J Comp Neurol. 489 (2), 135-147 (2005).
- Innocenti, G. M., Manger, P. R., Masiello, I., Colin, I., Tettoni, L. Architecture and callosal connections of visual areas 17, 18, 19 and 21 in the ferret (Mustela putorius). Cereb Cortex. 12 (4), 411-422 (2002).
- Khalil, R., Levitt, J. B. Zinc histochemistry reveals circuit refinement and distinguishes visual areas in the developing ferret cerebral cortex. Brain Struct Funct. 218, 1293-1306 (2013).
- Manger, P. R., Masiello, I., Innocenti, G. M. Areal organization of the posterior parietal cortex of the ferret (Mustela putorius). Cereb Cortex. 12, 1280-1297 (2002).
- Wong, P., Kaas, J. H. Architectonic subdivisions of neocortex in the gray squirrel (Sciurus carolinensis.). The anatomical record. 291, 1301-1333 (2008).
- Land, P. W., Shamalla-Hannah, L. Experience-dependent plasticity of zinc-containing cortical circuits during a critical period of postnatal development. J Comp Neurol. 447 (1), 43-56 (2002).
- Czupryn, A., Skangiel-Kramska, J. Distribution of synaptic zinc in the developing mouse somatosensory barrel cortex. J Comp Neurol. 386, 652-660 (1997).
- Timm, F. Zur Histochemie der Schwermetalle. Das Sulfid-Silber-Verfahren. Dtsch Z ges gerichtl Med. 46, 706-711 (1958).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon