A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في المختبر و في فيفو النهج لتحديد نفاذية الخلايا الظهارية المعوية
* These authors contributed equally
In This Article
Summary
أسلوبي ترد هنا لتحديد وظيفة الحاجز المعوي. مقياس الظهارية (فولت/أوم) يستخدم لقياس المقاومة الكهربائية ترانسيبيثيليال من ابيثيليا مثقف مباشرة في الآبار زراعة الأنسجة. في الفئران، يتم استخدام الأسلوب تزقيمية فيتك-ديكستران لتحديد نفاذية الأمعاء في الجسم الحي.
Abstract
الحاجز المعوي يدافع ضد الكائنات الدقيقة المسببة للأمراض، والسمية الجرثومية. ينظم وظيفتها نفاذية مفرق ضيق وسلامة الخلايا الظهارية، وتعطيل وظيفة جدار الأمعاء يسهم في تطور الأمراض المعدية المعوية والجهازية. أسلوبي بسيط يرد هنا لقياس نفاذية ظهارة الأمعاء. في المختبر، يتم مطلي الخلايا 2BBe كربونات الكالسيوم في الآبار زراعة الأنسجة كأحادي الطبقة والمقاومة الكهربائية ترانسيبيثيليال (ثالثا) يمكن أن تقاس بمقياس الظهارية (فولت/أوم). هذا الأسلوب مقنع بسبب عملية سهلة الاستعمال والتكرار. الفئران الحية، جافاجيد مع 4 كاتشين fluorescein isothiocyanate (فيتك)-يتم قياس تركيزات فيتك-ديكستران ديكستران وفي عينات مصل الدم التي تم جمعها من الفئران لتحديد نفاذية الظهارية. تزقيمية شفوي يقدم جرعة دقيقة، وذلك هو الأسلوب المفضل لقياس النفاذية المعوية في فيفو. أخذت معا، هاتين الطريقتين يمكن قياس النفاذية ظهارة الأمعاء في المختبر و في فيفو، ومن ثم استخدامها لدراسة العلاقة بين الأمراض ووظيفة الحاجز.
Introduction
الخلايا الظهارية المعوية ليست مسؤولة عن امتصاص المواد المغذية فحسب، ولكن أيضا تشكل عائقا هاما الدفاع عن نفسه ضد الكائنات الدقيقة المسببة للأمراض والسموم الميكروبية. وينظم هذه الدالة الحاجز المعوي نفاذية مفرق ضيق والخلايا الظهارية سلامة1،،من23، والخلل الوظيفي لوظيفة الحاجز الظهارية يرتبط مع التهاب الأمعاء المرض (بنك التنمية بين الأمريكتين). خاتم أكتوميوسين بيريجونكشونال (PAMR) تقع داخل الخلية غير متجاورة عن كثب للوصلات ضيق. تقلص PAMR، الذي ينظمه في سلسلة الميوسين الخفيفة (حركة تحرير الكونغو)، أمر حاسم لتنظيم مفرق ضيق نفاذية4،5،6،،من78، 9،10. عامل نخر الورم (تنف) أمر أساسي لفقدان جدار الأمعاء بحركة تحرير الكونغو الظهارية المعوية أوبريجولاتينج كيناز (ملكك) التعبير وحمل أوككلودين استيعاب11،،من1213.
يمكن عبور أيونات مثل Na+ و Cl– الفضاء باراسيلولار ب مسار المسامية أو تسرب14. في ظهارة "راشح"، تعكس التغييرات في تير أساسا مفرق ضيق تغيير النفاذية. قياس مكررا ثانيا نهج الكهربية المستخدمة عادة لقياس النفاذية مفرق ضيق، أساسا إلى نا+ و Cl-، استناداً إلى المقاومة مونولاييرس الخلية. وأبلغ أنواع الخلايا المختلفة، بما في ذلك الخلايا الظهارية المعوية والرئوية الخلايا الظهارية، والخلايا البطانية الوعائية، للقياسات مكررا ثانيا. فوائد هذا الأسلوب هي أن القياسات ثالثا غير الغازية ويمكن استخدامها لرصد خلايا حية في الوقت الحقيقي. وباﻹضافة إلى ذلك، تقنية قياس تير مفيد ل الدراسات السمية المخدرات15.
كربونات الكالسيوم-2BBe الخلايا خلايا غدية القولون الظهارية البشرية مع هيكل ووظيفة مشابهة للخلايا الظهارية المعوية صغيرة متباينة: فعلى سبيل المثال، يكون هذه الخلايا زغيبات والأنزيمات المرتبطة بفرشاة صغيرة في الأمعاء الحدود. ولذلك، ومثقف 2BBe كربونات مونولاييرس تستخدم كنموذج في المختبر لاختبار وظيفة الحاجز.
في الفئران، إحدى الطرق لدراسة نفاذية الأمعاء باراسيلولار بقياس قدرة فيتك-ديكستران على عبور الدم من التجويف. وهكذا، يمكن تقييم نفاذية الأمعاء قبل جافاجينج فيتك-ديكستران مباشرة في الفئران وقياس الأسفار داخل الدم. البروتوكول التالية توضح هذه المقالة طريقتين بسيطة لتقييم نفاذية ظهارة الأمعاء في المختبر و في فيفوعلى حد سواء.
Protocol
واعتمد هذه الدراسة برعاية الحيوان واستخدام بروتوكول من كامبردج-سودا الجينوم مركز الموارد (كام-سو)، جامعة سوشو.
1-طلاء وصيانة 2bbe كربونات الكالسيوم في أغشية البولي المسامية
- تنمو الخلايا في قارورة T75 مع وسائل الإعلام (دميم التي تحتوي على 10% FBS). وينبغي تغذية قوارير بانتظام، اعتماداً على كثافة الخلية.
ملاحظة: لطلاء الأمثل، الخلايا ينبغي تقسيم سرعة وشكل مسطح "قلي البيض"، التي تشير إلى أن الخلايا في مرحلة النمو. - عندما تكون الخلايا روافد 80%، تأخذ قارورة خارج الحاضنة وقم بإزالة الوسائط. شطف أي وسائط الإعلام المتبقية مع 1-2 مل PBS العقيمة (دون Ca2 +). بيبيت 1.5 مل التربسين-يدتا قارورة ولطف روك قارورة؛ ثم، ضع قارورة في الحاضنة 37 درجة مئوية لمدة 20 دقيقة دون هزاز.
- في حين يتم تريبسينيزينج الخلايا، إدراج مكان تحتوي على أغشية البولي المسامية (حجم المسام، 0.4 ميكرومتر؛ المساحة السطحية، 0.33 سم2؛ انظر الجدول للمواد) في لوحات 24-جيدا. إضافة مل 1.0 من وسائط الثقافة في قاعة القاعدية (المسافة الدنيا للغشاء).
- بيبيت 5 مل من وسائل الإعلام في قارورة وشدة بيبيت الخلايا ضد الجانب من قارورة 5-10 مرات لتحقيق الخلايا فضفاضة، فرادى أو الخلية 2-3 كتل.
-
لوحة 0.166 مل خلايا (تحقيق نسبة تخفيف 1:8) في قاعة قمي (الفضاء العلوي للغشاء). احتضان في 37 درجة مئوية لمدة تصل إلى 3 أسابيع.
- تغذية الخلايا ثلاث مرات أسبوعيا بعناية يسفط وسائل الإعلام من حجرة القاعدية لكل جيدا باستخدام مضخة ضغط. بلطف بالتنقيط 1 مل من وسائل الإعلام في الدائرة قمي بكل إدراج.
2-استخدام عداد الظهارية (فولت/أوم) لقياس مكررا ثانيا
ملاحظة: بعد 3 أسابيع ثقافة في أغشية البولي، 2BBe كربونات الخلايا على استعداد لقياس مكررا ثانيا.
- الدراسات سيتوكين، يوم واحد قبل القياس، استبدال الوسائط القاعدية مع الوسائط التي تحتوي على 10 نانوغرام/مل من IFNγ. في يوم التجربة، استبدال الوسائط مع حبس تحتوي على 2.5 أو 7.5 نانوغرام/مليلتر من تنف.
ملاحظة: العلاج IFNγ يزيد من التعبير عن مستقبلات تنف 2 (TNFR2)16. - لتصحيح المقياس، أدخل مسرى التصويب في منفذ الإدخال، واختر الوضع "أوم". ضبط المسمار الصفة R مع مفك براغي حتى المتر بعرض قراءة من 1,000 Ω.
- تعقيم أقطاب كهربائية بوضعها في الإيثانول 70% لمدة 15-30 دقيقة، ومن ثم السماح لهم بالهواء الجاف شطف س. 15 مسرى في وسائل الإعلام ثقافة الخلية التجريبية.
- تشغيل الطاقة، واختيار الوضع "أوم". بعناية وضع نهايات الجسور قطب الطويل في قاعة القاعدية ونهايات قصيرة في قاعة قمي. ضمان أن أقطاب أطول لمس الجزء السفلي من الطبق، مع الحفاظ على الأقطاب أقصر تحت السطح لوسائل الإعلام ولكن أعلاه إدراج زراعة الأنسجة. الاحتفاظ الأقطاب الرأسي.
- قياس المقاومة لإدراج نموذج وإدراج فارغة (أي، إدراج الثقافة دون الخلايا ولكن مع حبس) في 0، 1، 2، 3، 4 ح بعد العلاج سيتوكين. سجل المقاومة.
- ولتحقيق الاتساق عبر لوحة مختلفة الأشكال، حساب ناتج المقاومة ومنطقة الغشاء فعالة:
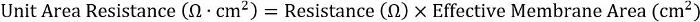
لإدراج 24-جيدا، هي منطقة الغشاء فعالة 0.33 سم2.
3-نموذج مورين ديكستران كبريتات الصوديوم (DSS)-التي يسببها التهاب القولون
- إضافة DSS يعقم الماء إلى تركيز نهائي من 3.5% (wt/المجلد).
- إدارة 3.5 ٪ DSS لذكور الفئران C57BL/6 8 عاماً في الأسبوع لمدة 7 أيام. إعطاء مياه الشرب العادية دون مفاجآت صيف دبي لمكافحة الفئران.
- تبديل الماء DSS المحتوية على مياه الشرب العادية بعد يوم 7.
- وزن الفئران وتقييم عشرات السريرية لكل الماوس كل يوم. تطبيع كل الماوس لوزن الجسم الأولية لها من وزن الجسم. عشرات تتحدد وفقا لشدة المرض بالمعلمات الأربعة: انسدال المستقيم (0-2)، واتساق البراز (0-2)، والنزيف (0-2)، والنشاط (0-2)5. مجموع العشرات من هذه المعلمات للنتيجة نهائية سريرية.
- لتحليل حالة نسيجية أنسجة القولون، euthanize الفئران بالحقن داخل (القائمة) مع 1.2% (المجلد/المجلد) أفيرتين (0.6 مل/10 غرام وزن الجسم) 7 أيام DSS وظيفة العلاج. إعداد مخزون من 100% أفيرتين، خلط 10 غم من 2,2,2-تريبروموثانول مع 10 مل الكحول ثالثي-الأميل. تخزين في الظلام في 4 درجات مئوية. لاستخدام، تضعف الأسهم 100 في المائة إلى 2 في المائة في المياه.
- عزل في القولون والاعور، وقياس طول القولون5.
- قطع شرائح 0.5 سم من القولون القاصي والإصلاح في أنبوب صقر 15 مل تحتوي على 10 مل فورمالين 10% بين عشية وضحاها. تغسل الأنسجة الثابتة مع الإيثانول متدرج (75 و 95 و 100 في المائة) وزيلين نفط. قم بتضمين الأنسجة في البارافين وقطع المقاطع 6 مم الهيماتوكسيلين ويوزين تلطيخ8.
4-قياس نفاذية الحاجز الظهارية في الفئران المستحثة بمفاجآت التهاب القولون
- قياس النفاذية حاجز 7 أيام بعد بدء الإدارة إدارة السلامة والأمن.
- في يوم المقايسة، بسرعة الفئران ح 3.
- اﻷوتوكﻻف تزقيمية مدتها إبرة للتأكد من العقم، ثم تزقيمية الفئران مع 150 ميليلتر 80 ملغ/مل 4 كاتشين فيتك-ديكستران في المياه المعقمة، وإبقاء فيتك-ديكستران غير المستخدمة لقياس المنحنى القياسي بعد جمع المصل. وزن الفئران لحساب النفاذية.
ملاحظة: ينبغي حل فيتك-ديكستران في المياه. - باستخدام مقص، مقطع قطعة 1 سم للذيل، وجمع 100 ميليلتر من الدم من الذيل إلى أنابيب جمع المصل. زيادة ونقصان الدم التي تم جمعها في 10,000 س ز لمدة 10 دقائق في درجة حرارة الغرفة.
- تمييع 1:4 المصل في المياه. جعل معيار المنحنى، وتمييع ديكستران فيتك غير المستخدمة مع الماء في رافعة، 1:1، 000، 1:3، 000، 01:10، 000، 01:30، 000، 1: 100، 000، 1: 300، 000، 1:1، 000، 000، و 1:3، 000، 000. إضافة 100 ميليلتر/جيدا من المصل والعينات المنحنى المعياري في لوحات 96-جيدا.
- قراءة الأسفار في قارئ لوحة مع 485 الإثارة/528 الانبعاثات. حساب قيم النفاذية استناداً إلى المنحنى المعياري، وضرب 4 لتصحيح للتخفيف.
- تقسيم تركيز فيتك-ديكستران من الوزن لتطبيع القيم (وهذا يساعد على تطبيع الفرق في إيصال فيتك-ديكستران إذا الفئران المريضة وقد فقدت الوزن).
النتائج
في الثقافة، وتنمو كأحادي الطبقة خلايا 2BBe كربونات الكالسيوم وتفرق ببطء في النضج انتيروسيتيس الاستيعابية التي لها حدود الفرشاة. في هذا البروتوكول، كانت مطلية 2BBe كربونات الخلايا ذات كثافة عالية في أغشية البولي وخلايا بلغت 100% كونفلوينسي يوم واحد بعد البذر. ومع ذلك، خلايا غ?...
Discussion
وهناك العديد من الخطوات الهامة في البروتوكول. كربونات الكالسيوم-2BBe (فرشاة الحدود-وإذ يعرب عن) خلايا تستخدم دائماً لقياس تير، مختارة من خط خلية كربونات الكالسيوم-2 للتعبير عن البروتينات الفرشاة للحدود. تحتوي الخلايا 2BBe كربونات الكالسيوم من النمط الظاهري الاستيعابية الزوائد عند متباينة تم?...
Disclosures
الكتاب يعلن لا تضارب المصالح المالية.
Acknowledgements
ونحن نشكر الدكتور جيرولد R. تيرنر، من مستشفى بريغهام والنساء، مدرسة هارفارد الطبية، لمساعدته السخية في إتمام هذه الدراسة. هذا العمل معتمد من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 81470804 و 31401229 و 81200620)، ومؤسسة العلوم الطبيعية من جيانغسو (المنحة رقم BK20180838 و BK20140319)، "البحوث الابتكار برنامج" ل خريجي كلية من مقاطعة جيانغسو (رقم المنحة KYLX16-0116)، متقدمة البحث المشاريع من سوشو جامعة (المنحة رقم SDY2015_06)، وكرون والتهاب القولون مؤسسة بحوث جائزة الزمالة (منح رقم 310801).
Materials
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
References
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved