需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
肠上皮细胞通透性的体外及体内测定方法
* 这些作者具有相同的贡献
摘要
本文提出了两种方法来确定肠道屏障功能。在组织培养井中, 使用上皮表 (伏特/欧姆) 直接测量培养的上皮细胞的测定电阻。在小鼠中, 采用 FITC-葡聚糖灌胃法测定体内肠道通透性。
摘要
肠道屏障抵御致病微生物和微生物毒素。其功能由紧密的结通透性和上皮细胞完整性调节, 而肠道屏障功能的破坏有助于胃肠道和系统性疾病的发展。本文介绍了两种简单的方法来测量小肠上皮的通透性。在体外, Caco-2BBe 细胞被镀在组织培养井作为单层和测定电阻 (三) 可以用上皮 (伏/欧姆) 计测量。这种方法是令人信服的, 因为它的用户友好的操作和重复性。在体内,小鼠孕期 4 kDa 荧光素异硫氰酸酯 (FITC)-葡聚糖, 在采集的小鼠血清样本中测定 FITC-葡聚糖浓度, 以确定上皮通透性。口服灌胃提供准确剂量, 因此是测定体内肠道通透性的首选方法。这两种方法可以在体外和体内测量小肠上皮的通透性, 从而用于研究疾病与屏障功能的关系。
引言
肠道上皮细胞不仅负责养分的吸收, 而且是抵御致病微生物和微生物毒素的重要屏障。此肠屏障功能由紧密的结通透性和上皮细胞完整性1、2、3和上皮屏障功能功能障碍与炎症性肠相关调节疾病 (IBD)。perijunctional 肌动球蛋白环 (PAMR) 位于与紧密交汇点紧密相连的细胞内。PAMR 的收缩是由肌球蛋白光链 (MLC) 调节的, 对于紧密接合渗透率4、5、6、7、8的调节至关重要. 9,10。肿瘤坏死因子 (TNF) 是上调肠上皮 MLC 激酶 (拿) 表达和诱导 occludin 内化11、12、13的肠道屏障丢失的中枢。
离子, 如 Na+和 Cl-可以通过孔隙或泄漏通路14跨越旁细胞空间。在 "漏" 上皮中, 三的变化主要反映改变的紧密结通透性。测量是一种常用的电生理学方法, 用于根据细胞膜的阻抗来量化紧密结通透性, 主要是 Na+和 Cl。不同的细胞类型, 包括肠道上皮细胞, 肺上皮细胞和血管内皮细胞, 已经报告了三的测量。这种方法的优点是, 测量是非侵入性的, 可用于实时监测活细胞。此外, 该方法对药物毒性研究15有参考价值。
Caco-2BBe 细胞是人上皮性大肠腺癌细胞, 其结构和功能类似于分化的小肠上皮细胞: 例如, 这些细胞有微绒毛和与小肠刷相关的酶边境。因此, 培养的 Caco-2BBe 单层膜被用作检测屏障功能的体外模型。
在小鼠中, 研究肠道旁细胞通透性的一种方法是通过测量 FITC-葡聚糖从腔内向血液中交叉的能力。因此, 肠道通透性可以通过 gavaging FITC-葡聚糖直接对小鼠进行评估, 并测量血液中的荧光。下面的协议描述了两种简单的方法来评估小肠上皮通透性的体外和体内。
研究方案
本研究获得了苏州大学剑桥-苏达基因组资源中心 (CAM) 动物护理与使用协议的批准。
1. Caco-2bbe 在多孔聚碳酸酯膜上的电镀和维护
- 在带有培养基的 T75 烧瓶中生长细胞 (DMEM 含有 10% FBS)。烧瓶应定期喂养, 具体取决于细胞密度。
注意: 为了获得最佳电镀, 细胞应迅速分裂, 并具有扁平的 "煎蛋" 形状, 这表明细胞处于生长阶段。 - 一旦细胞80% 汇合, 从孵化器中取出烧瓶, 取出介质。用1-2 毫升无菌 PBS (不含 Ca2 +) 冲洗任何残留介质。将1.5 毫升胰蛋白酶-EDTA 导入烧瓶中, 轻轻摇动烧瓶;然后, 将烧瓶放在37摄氏度孵化器中, 20 分钟不摇晃。
- 当细胞为 trypsinizing 时, 放置含有多孔聚碳酸酯膜的插入物 (孔径, 0.4 µm; 表面积, 0.33 厘米2; 见材料表) 进入24孔板。在基底室添加1.0 毫升培养基 (膜的下部空间)。
- 将5毫升的培养基移入烧瓶中, 用力将细胞从烧瓶的一侧移出5-10 次, 以实现松散的单个细胞或2-3 个细胞团簇。
-
板0.166 毫升的细胞 (达到1:8 稀释率) 到顶端室 (膜的上部空间)。在37摄氏度孵育长达3周。
- 饲料细胞每周三次, 通过使用压力泵仔细地从每个井的基底隔间吸取介质。将1毫升的培养基轻轻滴入每个刀片的顶端腔室。
2. 使用上皮表 (伏特/欧姆) 测量之三
注: 经过大约3周的聚碳酸酯膜的培养, Caco-2BBe 细胞可以进行测量。
- 对于细胞因子研究, 在测量前的某一天, 用含有 10 ng/毫升 IFNγ的培养基取代基底介质。在实验当天, 用含有 TNF 2.5 或 7.5 ng/毫升的 HBSS 替换培养基。
注: IFNγ治疗增加 TNF 受体 2 (TNFR2)16的表达。 - 要校正仪表, 请将校正电极插入输入端口, 然后选择 "欧姆" 模式。用螺丝刀调整 R 型螺钉, 直到仪表显示读数为1000Ω。
- 将电极放在70% 乙醇中15-30 分钟, 然后让它们在十五年代风干. 在实验细胞培养培养基中冲洗电极。
- 打开电源, 然后选择 "欧姆" 模式。小心地将电极桥的长末端放入基底室, 并将短末端放入顶端腔室。确保较长的电极接触到盘子的底部, 同时将较短的电极保持在介质表面以下, 但在组织培养刀片上方。保持电极垂直。
- 在细胞因子治疗后, 测量样品插入物和空白刀片 (即,不含细胞但与 HBSS 的培养基插入) 在0、1、2、3、4 h 的电阻。记录阻力。
- 要实现不同板格式的一致性, 请计算电阻和有效膜区域的乘积:
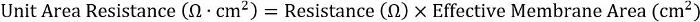
对于24孔刀片, 有效膜面积为 0.33 cm2。
3. 葡聚糖硫酸盐钠 (DSS) 诱导的结肠炎小鼠模型
- 将 DSS 添加到蒸压水中, 最终浓度为 3.5% (wt/vol)。
- 对8周大的雄性 C57BL/6 小鼠进行3.5% 次 DSS 的管理, 共7天。在没有 DSS 控制小鼠的情况下, 给予常规饮水。
- 7天后将含 DSS 的水切换到常规饮用水。
- 称量老鼠, 每天评估每只老鼠的临床分数。将每只鼠标的体重正常化为其初始体重。分数根据疾病的严重性定义四参数: 直肠脱垂 (0-2), 大便一致性 (0-2), 出血 (0-2), 和活动 (0-2)5。将这些参数中的分数与最终临床分数相加。
- 为了分析结肠组织的病理学状况, 安乐死小鼠腹腔 (ip) 注射 1.2% (vol.) Avertin (0.6 mL/10 g 体重) 7 天后 DSS 治疗。准备 100% avertin 的库存, 混合10克 22, 2-三硝基甲苯与10毫升叔戊醇。 在4°c 的黑暗中贮存。使用时, 将100% 的库存稀释到2% 的水中。
- 隔离结肠和盲肠, 并测量冒号5的长度。
- 削减0.5 厘米段从远端结肠和修复在15毫升猎鹰管包含10毫升10% 福尔马林过夜。用分级乙醇 (75、95和 100%) 和二甲苯洗涤固定组织。将组织嵌入石蜡中, 切割6毫米切片, 苏木精 & 伊红染色8。
4. 在 DSS 诱导的结肠炎小鼠中测量上皮屏障通透性
- 在 DSS 管理开始后7天内测量屏障渗透性。
- 在检测的当天, 快速小鼠3小时。
- 高压釜灌胃针, 以确保不育, 然后灌胃小鼠与150µL 80 毫克/毫升 4 kDa FITC-葡聚糖在无菌水中, 并保持未使用的 FITC-葡聚糖测定血清收集后的标准曲线。称量小鼠的渗透性计算。
注: FITC-葡聚糖溶液应在水中进行。 - 使用一把剪刀, 夹1厘米的尾巴, 并收集100µL 的血液从尾巴到血清收集管。在室温下将采集到的血液在 1万 x g 处旋转10分钟。
- 稀释血清1:4 在水中。要使标准曲线, 稀释未使用的 FITC-葡聚糖与水在 1:300, 1:1, 000, 1:3, 000, 1:10,000, 1:30,000, 1:100,000, 1:300,000, 1:1, 000,000, 和 1:3, 000,000。将血清和标准曲线样本的100µL/井添加到96孔板中。
- 阅读 485 excitation/528 发射的平板阅读器中的荧光。根据标准曲线计算渗透率值, 并乘以4以校正稀释。
- 将 FITC-葡聚糖的浓度除以重量以使值正常化 (这有助于正常化 FITC-葡聚糖分娩的差异, 如果老鼠生病并且体重减轻了)。
结果
在培养中, Caco-2BBe 细胞作为单层生长, 慢慢分化为具有画笔边界的成熟吸收 enterocytes。在本协议中, Caco-2BBe 细胞在聚碳酸酯膜上镀上高密度, 细胞在播种后一天达到100% 融合。然而, 细胞在这个阶段是未分化的: 要完全区分细胞, 介质每2-3 天更换3周。细胞被细胞核和 F 肌动蛋白染色, 以显示未分化和分化细胞之间的差异。应力纤维在未分化细胞中明显可见。与未分化细胞相比...
讨论
协议中有几个关键步骤。Caco-2BBe (画笔边框表示) 细胞始终用于测量, 从 Caco-2 细胞系中选择, 用于表达画笔边界蛋白。Caco-2BBe 细胞有一个绒毛吸收表型时完全分化 (经过大约3周的文化后汇合)17。在测量过程中, 必须避免污染, 并对电极进行灭菌。由于该过程是非无菌的, 在大多数情况下, 测量只能在8小时内执行。在测量过程中, 我们确定了刀片内外两点的电阻值。不同部位的电阻测...
披露声明
作者声明没有竞争的经济利益。
致谢
我们感谢哈佛医学院的杨百翰和女子医院的杰罗尔德博士, 他对完成这项研究的慷慨帮助。这项工作由中国国家自然科学基金 (赠款号81470804、31401229和 81200620)、江苏省自然科学基金 (赠款编号 BK20180838 和 BK20140319) 支持, 研究创新计划江苏省大学毕业生 (赠款编号 KYLX16-0116)、东吴大学高级研究项目 (赠款编号 SDY2015_06)、克罗恩 & 结肠炎基金会研究奖学金 (赠款号 310801)。
材料
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
参考文献
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。