È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In Vitro e In Vivo approcci per determinare la permeabilità intestinale delle cellule epiteliali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui sono disponibili due metodi per determinare la funzione di barriera intestinale. Un contatore epiteliale (volt/ohm) è utilizzato per la misurazione della resistenza elettrica transepiteliale del epithelia coltivate direttamente in pozzi di coltura del tessuto. Nei topi, il metodo di alimentazione mediante sonda gastrica FITC-Destrano è utilizzato per determinare la permeabilità intestinale in vivo.
Abstract
La barriera intestinale difende contro i microrganismi patogeni e tossine microbiche. La sua funzione è regolata dalla stretta della giunzione permeabilità e l'integrità delle cellule epiteliali, e rottura della funzione di barriera intestinale contribuisce alla progressione di malattia gastrointestinale e sistematica. Due semplici metodi descritti qui per misurare la permeabilità dell'epitelio intestinale. In vitro, le cellule Caco-2BBe sono placcate in pozzi di coltura del tessuto come uno strato monomolecolare e resistenza elettrica transepiteliale (TER) può essere misurato con un misuratore di epiteliale (volt/ohm). Questo metodo è convincente per la sua facilità di utilizzo e ripetibilità. In vivo, i topi sono gavaged con 4 kDa isotiocianato di fluoresceina (FITC)-destrano e le concentrazioni di FITC-Destrano sono misurati in campioni di siero raccolti da topi per determinare la permeabilità epiteliale. Alimentazione mediante sonda gastrica orale offre una dose precisa e pertanto è il metodo preferito per misurare la permeabilità intestinale in vivo. Presi insieme, questi due metodi in grado di misurare la permeabilità dell'epitelio intestinale in vitro e in vivoe quindi essere usati per studiare la connessione tra malattie e funzione di barriera.
Introduzione
Cellule epiteliali intestinali non sono solo responsabili per l'assorbimento dei nutrienti, ma anche formano una barriera importante per difendere contro microrganismi patogeni e tossine microbiche. Questa funzione di barriera intestinale è regolata da permeabilità stretta della giunzione e delle cellule epiteliali integrità1,2,3, e disfunzione della funzione di barriera epiteliale è associata con infiammatorie intestinali malattia (IBD). L'anello di actomiosina perijunctional (PAMR) si trova all'interno della cellula che è strettamente contigua per giunzioni strette. La contrazione di PAMR, che è regolata dalla catena leggera della miosina (MLC), è cruciale per la regolazione della stretta della giunzione permeabilità4,5,6,7,8, 9,10. Fattore di necrosi tumorale (TNF) è centrale alla perdita della barriera intestinale espressione di chinasi (MLCK) upregulating epiteliale intestinale MLC e inducendo occludina interiorizzazione11,12,13.
Ioni come Na+ e Cl– può attraversare lo spazio paracellulare di poro o perdita via14. In un epitelio "colante", cambiamenti in TER riflettono principalmente permeabilità alterata stretta della giunzione. Misurazione di TER è un approccio elettrofisiologico comunemente utilizzato per quantificare la permeabilità stretta della giunzione, principalmente a Na+ e Cl-, basato sull'impedenza di monostrati di cellule umane. Tipi di cellule diverse, tra cui le cellule epiteliali intestinali, cellule epiteliali polmonari e le cellule endoteliali vascolari, sono stati segnalati per misurazioni di TER. Vantaggi di questo metodo sono che le misurazioni TER sono non-invasivo e possono essere utilizzate per monitorare le cellule vive in tempo reale. Inoltre, la tecnica di misurazione TER è utile per droga tossicità studi15.
Caco-2BBe cellule sono cellule epiteliali umane dell'adenocarcinoma del colon-retto con una struttura e funzione simili a piccole cellule epiteliali intestinali differenziate: ad esempio, queste cellule hanno microvilli ed enzimi connessi con la piccola spazzola intestinale confine. Di conseguenza, coltivate Caco-2BBe monostrati sono utilizzati come un modello in vitro per verificare la funzione della barriera.
Nei topi, un modo per studiare la permeabilità intestinale paracellulare è misurando la capacità di FITC-dextrano di attraversare dal lume nel sangue. Così, la permeabilità intestinale può essere valutata da gavaging FITC-Destrano direttamente in topi e misurare la fluorescenza all'interno del sangue. Il seguente protocollo descrive due semplici metodi per valutare la permeabilità dell'epitelio intestinale sia in vitro che in vivo.
Protocollo
Questo studio è stato approvato dalla cura degli animali e uso protocollo di Cambridge-Suda Genomic Resource Center (CAM-SU), Soochow University.
1. placcatura e la manutenzione di Caco-2bbe sulle membrane porose in policarbonato
- Crescere le cellule in una boccetta di T75 con media (DMEM contenente 10% FBS). Boccette dovrebbero essere alimentati regolarmente, a seconda della densità delle cellule.
Nota: Per la placcatura ottima, cellule dovrebbero dividersi rapidamente e hanno una forma piatta "fritto-uovo", che indica che le cellule sono in fase di crescita. - Una volta che le cellule sono 80% confluenti, prendere il pallone fuori l'incubatrice e rimuovere il supporto. Sciacquare ogni residua media con 1-2 mL di PBS sterile (senza Ca2 +). Pipettare 1,5 mL di tripsina-EDTA nel pallone e delicatamente roccia il pallone; quindi, posizionare il pallone nell'incubatore 37 ° C per 20 min senza a dondolo.
- Mentre le cellule sono trypsinizing, posto inserisce contenente membrane porose in policarbonato (diametro dei pori, 0,4 µm; superficie, 0,33 cm2; Vedi Tabella materiali) in piastre da 24 pozzetti. Aggiungere 1,0 mL di terreno di coltura in aula basale (lo spazio inferiore della membrana).
- Pipettare 5 mL di media nella boccetta e vigorosamente dispensare le cellule contro il lato del pallone di 5 - 10 volte per raggiungere sciolte, singole celle o cella di 2-3 ciuffi.
-
Piastra di 0,166 mL di cellule (raggiungimento di un rapporto di diluizione di 1:8) nella camera di apicale (lo spazio superiore della membrana). Incubare a 37 ° C fino a 3 settimane.
- Alimentazione celle tre volte settimanalmente aspirando attentamente i media dal basale vano di ogni pozzetto usando una pompa a pressione. Delicatamente gocciolare 1ml di media nella camera apicale di ciascun frutto.
2. uso del Meter epiteliale (Volt/Ohm) per la misurazione TER
Nota: Dopo circa 3 settimane di cultura sulle membrane in policarbonato, cellule Caco-2BBe sono pronte per la misurazione di TER.
- Per gli studi di citochina, un giorno prima della misura, sostituire il supporto basale con supporti contenenti 10 ng/mL di IFNγ. Il giorno dell'esperimento, è necessario sostituire il supporto con HBSS contenente 2,5 o 7,5 ng/mL di TNF.
Nota: Trattamento IFNγ aumenta l'espressione del recettore TNF 2 (TNFR2)16. - Per correggere il misuratore, inserire l'elettrodo di correzione nella porta di ingresso e scegliere la modalità "Ohm". Regolare la vite R Adj con un cacciavite fino a quando il misuratore visualizza una lettura di 1.000 Ω.
- Sterilizzare gli elettrodi ponendoli in etanolo al 70% per 15-30 min e poi lasciare li asciugare all'aria per 15 s. Risciacquare l'elettrodo nel mezzo di coltura cellulare sperimentale.
- Accendere l'unità e scegliere la modalità di "Ohm". Posizionare l'estremità lunga dei ponti elettrodo nella camera basale ed il breve finisce nella camera di apicale. Assicurarsi che gli elettrodi più tocchino il fondo del piatto, mantenendo gli elettrodi più brevi sotto la superficie della media, ma soprattutto gli inserti di coltura del tessuto. Mantenere gli elettrodi verticali.
- Misurare la resistenza del campione inserti e inserti in bianco (cioè, la cultura inserisce senza cellule ma con HBSS) a 0, 1, 2, 3, 4 h dopo il trattamento di citochina. Registrare la resistenza.
- Per garantire la coerenza tra piastra diversi formati, è possibile calcolare il prodotto della resistenza e l'area della membrana efficace:
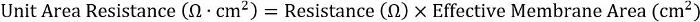
Per inserti 24 pozzetti, l'area della membrana efficace è 0,33 cm2.
3. modello murino di sodio del solfato del dextrano (DSS)-colite indotta
- Aggiungere DSS in autoclave acqua ad una concentrazione finale pari al 3,5% (wt/vol).
- Amministrare il 3,5% DSS ai topi C57BL/6 maschi di 8-settimana-vecchio per un totale di 7 giorni. Dare acqua potabile normale senza DSS ai topi di controllo.
- Passare il DSS-contenenti acqua per acqua potabile normale dopo 7 giorno.
- Topi di pesare e valutare punteggi clinici di ogni mouse ogni giorno. Normalizzare il peso corporeo di ogni topo al suo peso corporeo iniziale. Punteggi sono definiti secondo la severità di malattia da quattro parametri: prolasso rettale (0-2), la consistenza delle feci (0-2), sanguinamento (0-2) e attività (0-2)5. Sommare i punteggi da questi parametri per un punteggio clinico finale.
- Per analizzare la condizione istopatologica del tessuto del colon, eutanasia topi tramite l'iniezione intraperitoneale (i.p.) con trattamento di 1,2% (vol/vol) Avertin (peso corporeo di 0,6 mL/10 g) 7 giorni post-DSS. Per preparare un brodo di 100% avertin, mescolare 10 g di 2,2,2-tribromoethanol con 10 ml di alcool tert-Amilico. Conservare al buio a 4° C. Per utilizzare, diluire cartoncino 100% al 2% in acqua.
- Isolare il colon e intestino cieco e misurare la lunghezza dei due punti5.
- Tagliare segmenti di 0,5 cm dal colon distale e correzione in un tubo falcon da 15 mL contenente 10 mL di formalina al 10% durante la notte. Lavare i tessuti fissi con etanolo graduato (75, 95 e 100%) e xilene. Incorporare i tessuti in paraffina e tagliare sezioni da 6 mm per l'ematossilina ed eosina8.
4. misurare la permeabilità della barriera epiteliale nei topi di colite DSS indotta
- Misurare la permeabilità della barriera 7 giorni dopo l'inizio della somministrazione di DSS.
- Il giorno del test, veloce topi per 3 h.
- Autoclave una sonda gastrica dell'ago per garantire la sterilità, quindi i topi di sonda gastrica con 150 µ l 80 mg/mL 4 kDa FITC-Destrano in acqua sterile e mantenere il FITC-Destrano inutilizzato per misurare la curva standard dopo la raccolta del siero. Pesare i topi per il calcolo di permeabilità.
Nota: La soluzione di FITC-Destrano dovrebbe essere fatto in acqua. - Utilizzando un paio di forbici, un pezzo di 1 cm della coda di clip e raccogliere 100 µ l di sangue dalla coda nelle provette di raccolta del siero. Girare il sangue prelevato a 10.000 x g per 10 min a temperatura ambiente.
- Diluire il siero 1:4 in acqua. Per rendere standard curva, diluire inutilizzato FITC-Destrano con acqua a 1: 300, 1:1, 000, 1:3, 000, 01:10, 000, 01:30, 000, 1: 100, 000, 1: 300, 000, 1:1, 000, 000 e 1:3, 000, 000. Aggiungere 100 µ l/pozzetto del siero e dei campioni di curva standard in piastre da 96 pozzetti.
- Leggere la fluorescenza in un lettore di piastra con 485 eccitazione/528 emissione. Calcolare i valori di permeabilità basati sulla curva standard e moltiplicare per 4 per correggere per la diluizione.
- Dividere la concentrazione di FITC-Destrano per il peso per normalizzare i valori (questo aiuta a normalizzare la differenza nella consegna di FITC-Destrano se topi sono malati e hanno perso peso).
Risultati
In coltura, cellule Caco-2BBe crescono come uno strato monomolecolare e lentamente differenziano in enterociti assorbenti maturi che hanno bordi del pennello. In questo protocollo, le cellule Caco-2BBe sono state placcate con un'alta densità su membrane in policarbonato e celle raggiunto 100% confluency un giorno dopo la semina. Tuttavia, le cellule sono indifferenziate in questa fase: completamente differenziare le cellule, il media è cambiato ogni 2-3 giorni per 3 settimane. Le cellul...
Discussione
Ci sono diversi passaggi critici nel protocollo. Le cellule Caco-2BBe (confine-esprimendo la spazzola) vengono sempre utilizzate per la misurazione di TER, selezionato dalla linea delle cellule Caco-2 per l'espressione delle proteine del spazzola-confine. Le cellule Caco-2BBe hanno un fenotipo assorbente del villo quando completamente differenziato (dopo circa 3 settimane di post-confluenza cultura)17. È necessario per evitare la contaminazione durante la misurazione e per sterilizzare l'elettrod...
Divulgazioni
Gli autori non dichiarano concorrenti interessi finanziari.
Riconoscimenti
Ringraziamo il dottor Jerrold R. Turner, da Brigham and Women Hospital, Harvard Medical School, per il suo generoso aiuto nel completare questo studio. Questo lavoro è sostenuto da Fondazione nazionale di scienze naturali della Cina (concessione numero 81470804, 31401229 e 81200620), il Natural Science Foundation di Jiangsu Province (concessione numero BK20180838 e BK20140319), programma di ricerca dell'innovazione per Collegio laureati della provincia di Jiangsu (concessione numero KYLX16-0116), Advanced Research Progetti di Soochow University (concessione numero SDY2015_06) e di Crohn & colite Foundation Research Fellowship Award (grant numero 310801).
Materiali
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
Riferimenti
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon