Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
In Vitro e In Vivo métodos para determinar la permeabilidad de la célula epitelial Intestinal
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí se presentan dos métodos para determinar la función de barrera intestinal. Un medidor epitelial (voltios/ohmios) se utiliza para la medición de la resistencia eléctrica transepitelial de epitelio cultivado directamente en los pocillos de cultivo de tejidos. En ratones, el método de sonda de FITC-los dextranos se utiliza para determinar la permeabilidad intestinal en vivo.
Resumen
La barrera intestinal defiende contra microorganismos patógenos y toxinas microbianas. Su función está regulada por permeabilidad ensambladura apretada y la integridad de la célula epitelial, y alteración de la función de barrera intestinal contribuye a la progresión de la enfermedad gastrointestinal y sistémica. Aquí se describen dos métodos simples para medir la permeabilidad del epitelio intestinal. In vitro, las células Caco-2BBe se platean en los pocillos de cultivo de tejidos como una monocapa y resistencia eléctrica transepitelial (TER) puede ser medida por un medidor de epitelial (voltios/ohmios). Este método es convincente debido a su utilización y capacidad de repetición. En vivo, los ratones son gavaged con 4 kDa isotiocianato de fluoresceína (FITC)-dextrano y las concentraciones de FITC-los dextranos se miden en las muestras de suero recogidas en ratones para determinar la permeabilidad epitelial. Sonda oral proporciona una dosis precisa y por lo tanto es el método preferido para medir la permeabilidad intestinal en vivo. Tomados juntos, estos dos métodos pueden medir la permeabilidad del epitelio intestinal in vitro e in vivoy por lo tanto ser utilizados para estudiar la conexión entre enfermedades y función de la barrera.
Introducción
Células epiteliales intestinales no sólo son responsables de la absorción de nutrientes, pero también forman una barrera importante para defenderse de los microorganismos patógenos y toxinas microbianas. Esta función de barrera intestinal está regulada por la permeabilidad de la ensambladura apretada y célula epitelial integridad1,2,3, y la disfunción de la función de barrera epitelial se asocia con inflamatoria intestinal enfermedad (EII). El anillo de actomyosin de perijunctional (PAMR) se encuentra dentro de la célula que es estrechamente contigua a las ensambladuras apretadas. La contracción de PAMR, regulado por la cadena ligera de miosina (MLC), es crucial para la regulación de la ensambladura apretada permeabilidad4,5,6,7,8, 9,10. Factor de necrosis tumoral (TNF) es central a la pérdida de la barrera intestinal por regular expresión de cinasa (MLCK) MLC epitelial intestinal e inducir occludin internalización11,12,13.
Iones tales como Na+ y Cl– puede cruzar el espacio paracelular por el poro o fuga vía14. En un epitelio "agujereado", cambios en TER reflejan principalmente la permeabilidad alterada ensambladura apretada. Medición de TER es un enfoque electrofisiológico utilizado para cuantificar la permeabilidad de la ensambladura apretada, sobre todo a Na+ y Cl-, basada en la impedancia de monocapas de células. Tipos de diversas células, incluyendo células epiteliales intestinales, las células epiteliales pulmonares y las células endoteliales vasculares, se han divulgado para mediciones de TER. Ventajas de este método son que las mediciones de TER son no invasivos y pueden utilizarse para supervisar células vivas en tiempo real. Además, la técnica de medición de TER es útil para drogas toxicidad estudios15.
Las células Caco-2BBe son células de adenocarcinoma colorrectal epitelial humano con una estructura y función similar a las células epiteliales intestinales pequeñas diferenciadas: por ejemplo, estas células tienen microvellosidades y enzimas asociadas con pequeño cepillo intestinal frontera. Por lo tanto, monocapas de Caco-2BBe cultivadas se utilizan como modelo para las pruebas de función de la barrera en vitro .
En ratones, una forma de estudio de permeabilidad intestinal paracelular es mediante la medición de la capacidad de FITC-los dextranos para cruzar desde el lumen a la sangre. Por lo tanto, la permeabilidad intestinal puede ser evaluada por gavaging FITC-los dextranos directamente en ratones y medir la fluorescencia dentro de la sangre. El siguiente protocolo describe dos métodos simples para evaluar la permeabilidad del epitelio intestinal in vitro e in vivo.
Protocolo
Este estudio fue aprobado por el cuidado Animal y uso protocolo de Cambridge-Suda genómica Resource Center (CAM-SU), Universidad de Suzhou.
1. revestimiento y mantenimiento de Caco-2bbe en las membranas de policarbonato porosas
- Crecer las células en un frasco de T75 con medios de comunicación (DMEM con 10% FBS). Frascos deben ser alimentados con regularidad, dependiendo de la densidad celular.
Nota: Para planchado óptimo, las células deben dividir rápidamente y tienen forma plana "frito-huevo", que indica que las células están en fase de crecimiento. - Una vez las células confluentes de 80%, quitar la cubeta de la incubadora y sacar los medios de comunicación. Enjuague cualquier restos de medios con 1-2 mL de PBS estéril (sin Ca2 +). Pipetear 1,5 mL de tripsina-EDTA en el matraz y suavemente rock el matraz; Luego, coloque el matraz en la incubadora de 37 ° C por 20 min sin balancearse.
- Mientras que las células son trypsinizing, lugar inserta que contiene membranas de policarbonato porosas (tamaño del poro, μm 0.4; superficie, 0,33 cm2; véase Tabla de materiales) en placas de 24 pocillos. Añadir 1,0 mL de medios de cultivo en el compartimiento basal (el espacio inferior de la membrana).
- Pipeta 5 mL de medio en el matraz y vigorosamente pipetear las células contra el costado del frasco 5 - 10 veces lograr células sueltas, individuales o 2-3 células produce.
-
Placa de 0,166 mL de células (alcanzar una relación de dilución 1:8) en la cámara apical (el espacio superior de la membrana). Incubar a 37 ° C durante 3 semanas.
- Alimentar las células tres veces semanalmente aspirando cuidadosamente los medios de comunicación desde el compartimiento basal de cada bien utilizando una bomba de presión. Suavemente del goteo 1 mL de medios de comunicación en la cámara apical de cada inserto.
2. el uso de metro epitelial (voltios/ohmios) para la medición de TER
Nota: Después de 3 semanas de la cultura en las membranas de policarbonato, las células Caco-2BBe están listas para medición de TER.
- Estudios del cytokine, un día antes de la medición, sustituir el medio basal con los medios de comunicación que contiene 10 ng/mL de IFNγ. En el día del experimento, sustituir los medios de comunicación con HBSS conteniendo 2,5 o 7,5 ng/mL de TNF.
Nota: Tratamiento de IFNγ aumenta la expresión del receptor TNF 2 (TNFR2)16. - Para corregir el medidor, insertar el electrodo de corrección en el puerto de entrada y elija el modo de "Ohm". Ajuste el tornillo de ajuste de R con un destornillador hasta que el medidor muestra una lectura de 1.000 Ω.
- Esterilizar los electrodos colocándolos en etanol al 70% durante 15-30 min y luego déjelos al aire seco para 15 s. Enjuague el electrodo en los medios de cultivo experimental de la célula.
- Encienda y elegir el modo de "Ohm". Coloque con cuidado los extremos largos de los puentes del electrodo en el compartimiento basal y los extremos cortos hacia la cámara apical. Asegurar que los electrodos más toquen el fondo del plato, manteniendo los electrodos más cortos debajo de la superficie de los medios de comunicación, pero por encima de las inserciones de cultivo de tejidos. Mantenga los electrodos verticales.
- Mida la resistencia de la muestra inserciones inserciones en blanco (es decir, la cultura se inserta sin células con HBSS) en 0, 1, 2, 3, 4 h después del tratamiento del cytokine. Expediente de la resistencia.
- Para lograr consistencia en placa diferentes formatos, calcular el producto de la resistencia y el área efectiva de la membrana:
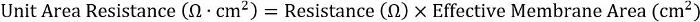
Para insertos de 24 pocillos, el área efectiva de la membrana es de 0,33 cm2.
3. ratón modelo de sodio sulfato de dextrano (DSS)-Colitis inducida
- Añadir DSS para esterilizar agua a una concentración final de 3,5% (peso/vol).
- Administrar 3,5% DSS a ratones C57BL/6 machos de 8 semanas de edad para un total de 7 días. Dar agua potable regular sin DSS a los ratones de control.
- Cambiar el agua que contiene el DSS para regular agua potable después de día 7.
- Pesar ratones y evaluar resultados clínicos de cada ratón cada día. Normalizar el peso de cada ratón a su peso corporal inicial. Puntuaciones se definen según la severidad de la enfermedad por cuatro parámetros: prolapso rectal (0-2), consistencia de las heces (0-2), sangrado (0-2) y actividad (0-2)5. Suma las puntuaciones de estos parámetros para un resultado clínico final.
- Para analizar la condición histopatológica del tejido del colon, eutanasia ratones por inyección intraperitoneal (i.p.) con 1.2% (vol/vol) Avertin (peso corporal de 0.6 mL/10 g) 7 días post-DSS tratamiento. Para preparar un stock de 100% avertin, mezcle 10 g de 2,2,2-tribromoethanol con 10 ml de alcohol tert-amílico. Almacenar en la oscuridad a 4° C. Para usar, Diluya el stock de 100% a 2% en agua.
- Aislar el colon y el ciego y medir la longitud del colon5.
- Cortar segmentos de 0.5 cm de colon distal y el fix en un tubo falcon de 15 mL que contiene 10 mL de formalina al 10% durante la noche. Lavar los tejidos fijos con etanol graduado (75, 95 y 100%) y el xileno. Incrustar los tejidos en parafina y cortar secciones de 6 mm para la hematoxilina & eosina, tinción de8.
4. medición de la permeabilidad de la barrera epitelial en ratones de la Colitis inducida por DSS
- Medir la permeabilidad de la barrera 7 días después del comienzo de la administración de DSS.
- En el día del ensayo, rápido ratones durante 3 horas.
- Autoclave mediante una sonda aguja para garantizar la esterilidad, luego por sonda nasogástrica ratones con 150 μL 80 mg/mL 4 kDa FITC-los dextranos en agua estéril y mantener el FITC-dextrano no utilizado para medir la curva estándar después de la recolección de suero. Peso de los ratones para el cálculo de permeabilidad.
Nota: La solución de FITC-los dextranos debe hacerse en agua. - Con un par de tijeras, clip un trozo de 1 cm de la cola y recoger 100 μl de sangre de la cola en tubos de suero. Centrifugado de la sangre recogida a 10.000 x g por 10 min a temperatura ambiente.
- Diluir el suero 1:4 en agua. Para hacer un estándar de la curva, diluir FITC-dextrano no utilizado con agua en 1:300, 1:1, 000, 1:3, 000, 1:10, 000, 1:30, 000, 1: 100, 000, 1:300, 000, 1:1, 000, 000 y 1:3, 000, 000. Añadir 100 μL/pocillo de suero y las muestras de la curva estándar en placas de 96 pocillos.
- Leer la fluorescencia en un lector de placas con 485 emisión excitación/528. Calcular los valores de permeabilidad basados en la curva estándar y multiplicar por 4 para corregir para la dilución.
- Dividir la concentración de FITC-los dextranos por el peso para normalizar los valores (esto ayuda a normalizar la diferencia en entrega de FITC-los dextranos si ratones están enfermos y han perdido peso).
Resultados
En la cultura, las células Caco-2BBe crecen como una monocapa y lentamente se diferencian en enterocitos absorbentes maduras cepillo bordes. En este protocolo, las células Caco-2BBe fueron plateadas con una alta densidad en las membranas de policarbonato, y las células alcanzaron confluencia 100% un día después de la siembra. Sin embargo, las células son indiferenciadas en esta etapa: distinguir completamente las células, los medios de comunicación se cambiaron cada 2-3 días dura...
Discusión
Hay varios pasos críticos en el protocolo. Las células Caco-2BBe (cepillo expresando de frontera) siempre se utilizan para la medición de la TER, seleccionado a partir de la línea celular Caco-2 expresión de proteínas del borde en cepillo. Las células Caco-2BBe tienen un fenotipo de la vellosidad absortiva cuando totalmente diferenciadas (aproximadamente 3 semanas después de la confluencia de cultura)17. Es necesario para evitar la contaminación durante la medición y para esterilizar el ...
Divulgaciones
Los autores no declaran a intereses financieros en competencia.
Agradecimientos
Agradecemos al Dr. Jerrold R. Turner, del Hospital Brigham y de mujeres, escuela de medicina de Harvard, por su generosa ayuda en la realización de este estudio. Este trabajo es apoyado por la Fundación Nacional de Ciencias naturales de China (número de licencia 81470804, 31401229 y 81200620), la Ciencia Natural Fundación de la provincia de Jiangsu (número BK20180838 y BK20140319), el programa de innovación de investigación para Graduados de Colegio de la provincia de Jiangsu (número de concesión KYLX16-0116), avanzado de investigación proyectos de Suchow Universidad (número SDY2015_06) y de Crohn & Colitis Fundación Premio de beca de investigación (concesión número 310801).
Materiales
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
Referencias
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados