JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생체 외에서 그리고 Vivo에서 접근 장 상피 세포 침투성을 결정 하
* 이 저자들은 동등하게 기여했습니다
요약
두 가지 방법은 여기 장 장벽 기능을 결정 하 되 게 됩니다. 상피 미터 (볼트/옴)의 조직 문화 우물에서 직접 경작된 epithelia의 transepithelial 전기 저항 측정에 사용 됩니다. 쥐, FITC dextran gavage 메서드는 vivo에서창 자 침투성 결정 하 사용 됩니다.
초록
장 방 벽은 병원 성 미생물 및 미생물 독 소에 대 한 방어. 그것의 기능은 꽉 접합 침투성 및 상피 세포 무결성에 의해 규제 됩니다 그리고 위장과 전신 질환의 진행에 기여 하는 장의 장벽 기능 장애. 두 가지 간단한 방법 장 상피의 투과율을 측정 하 여기 설명 되어 있습니다. 생체 외에서Caco 2BBe 세포는 조직 문화 우물에는 단층으로 도금 및 transepithelial 전기 저항 (TER)는 상피 (볼트/옴) 미터에 의해 측정 될 수 있다. 이 메서드는 사용자 친화적인 작동과 반복성 때문에 설득력이 있다. Vivo에서, 마우스는 4 kDa fluorescein isothiocyanate (FITC)와 gavaged-dextran, 그리고 FITC dextran 농도 상피 침투성을 결정 하는 마우스에서 수집 된 혈 청 샘플으로 측정 된다. 구강 정확한 복용량을 제공 하 고 따라서 vivo에서창 자 침투성 측정을 선호 하는 방법 이다. 함께 찍은, 이러한 두 가지 방법을 장 상피 체 외 그리고 vivo에서의 침투성을 측정할 수 있다 하 고 따라서 질병 및 장벽 기능 사이의 연결을 공부 하는 데 사용 될.
서문
장 상피 세포는 영양분의 흡수에 대 한 책임 뿐만 아니라 그러나 또한 병원 성 미생물 및 미생물 독 소에 대 한 중요 한 방 벽을 형성. 이 장의 장벽 기능은 꽉 접합 침투성 및 상피 세포 무결성1,2,3, 통제 되 고 상피 장벽 기능 부전은 염증 성 창 자 연관 질병 (IBD)입니다. Perijunctional actomyosin 반지 (PAMR)는 단단한 접속점에 밀접 하 게 인접 셀 이내에 거짓말. Myosin 빛 사슬 (MLC)에 의해 규제 됩니다, PAMR의 수축은 꽉 접합 침투성4,5,6,7,8, 규제에 대 한 중요 한 9,10. 종양 괴 사 인자 (TNF) upregulating 장 상피 MLC 니 (MLCK) 식과 유도 occludin 국제화11,,1213에 의해 장 방 벽 손실에 중앙 이다.
이온+ Na와 Cl- 기 공 또는 누출 통로14paracellular 공간을 교차 수 있습니다. "새" 상피에서 TER에 변화는 주로 변경된 꽉 접합 침투성을 반영합니다. TER 측정 꽉 접합 침투성,+ Na와 Cl-, 하 셀 monolayers의 임피던스에 따라 계량 하는 일반적으로 사용 되 electrophysiological 접근 이다. 장 상피 세포, 혈관 내 피 세포, 폐 상피 세포 등 다양 한 세포 유형 테 측정을 위해 보고 되었다. 이 방법의 이점은 TER 측정 비 침략 적 이며 실시간 라이브 셀 모니터링에 사용할 수 있습니다. 또한, 테 측정 기술은 약물 독성 연구15에 대 한 유용합니다.
Caco-2BBe 세포는 인간 상피 대 장 선 암 세포 구조와 차별화 된 작은 창 자 상피 세포와 유사한 기능: 예를 들어 이러한 세포는 microvilli 및 작은 창 자 브러시와 관련 된 효소 테두리입니다. 따라서, 교양된 Caco-2BBe monolayers 장벽 기능을 테스트 하기 위한 생체 외에서 모델 활용 됩니다.
쥐, 한 장 paracellular 침투성 공부 방법은 혈액으로 루멘에서 교차 FITC dextran 수를 측정 하 여. 따라서, 창 자 침투성 gavaging FITC dextran 직접 마우스와 혈액 내에서 형광을 측정에 의해 평가 될 수 있다. 다음 프로토콜 설명 장 상피 침투성을 평가 하기 위해 두 가지 간단한 방법 둘 다 생체 외에서 그리고 에 비보.
프로토콜
이 연구는 동물 관리 및 사용 프로토콜의 캠브리지 스 게놈 자원 센터 (캠-수), Soochow 대학에 의해 승인 되었다.
1. 도금 및 Caco-2bbe에 다공성 폴 리 카보 네이트 막의 유지 보수
- 미디어 T75 플라스 크에 세포를 성장 (10% 포함 된 DMEM FBS). 플라스 크는 셀 밀도 따라 정기적으로 먹여야 한다.
참고: 최적의 도금, 셀 해야 빠르게 분할 및 세포 성장 단계에가 평면 "튀김-계란" 모양. - 일단 세포가 80% 합칠, 인큐베이터에서 플라스 크를 걸릴 하 고 미디어를 제거 합니다. 1-2 mL (없이 캘리포니아2 +) 살 균 PBS의 모든 잔여 미디어 린스. 피펫으로 1.5 mL 트립 신-EDTA 플라스 크와 부드럽게 바위 플라스 크; 그런 다음, 락 없이 20 분 동안 37 ° C 배양 기에서 플라스 크를 놓습니다.
- 셀 trypsinizing는 하는 동안 장소 다공성 폴 리 카보 네이트 막 (0.4 µ m 기 공 크기, 표면적, 0.33 c m2; 재료의 표참조)를 포함 하는 24-잘 접시에 삽입 합니다. 기저 챔버 (막의 낮은 공간)에서 문화 미디어 1.0 mL를 추가 합니다.
- 피펫으로 플라스 크와 적극적으로 피펫으로 미디어의 5 mL 플라스 크의 측에 대하여 세포 5-10 회, 개별 셀 또는 2-3 셀을 묶습니다.
-
꼭대기 챔버 (막의 위 공간)로 셀 (1:8 희석 비율 달성) 0.166 mL 접시. 최대 3 주 동안 37 ° C에서 품 어.
- 피드 셀 세 번 매주 신중 하 게 잘 사용 하 여 각 압력 펌프의 기초 구획에서 미디어를 발음으로. 부드럽게 각 삽입의 꼭대기 챔버로 미디어의 1 mL를 똑.
2. 측정 TER 상피 미터 (볼트/옴)의 사용
참고: 약 3 주 후에 폴 리카 보 네이트 막 문화, Caco 2BBe 셀 테 측정을 위해 준비 되어 있다.
- Cytokine 연구, 측정 전에 1 일 IFNγ의 10 ng/mL를 포함 하는 미디어와 기저 미디어를 교체 합니다. 실험 당일, HBSS 2.5 또는 7.5 ng/mL TNF의를 포함 하는 미디어를 바꿉니다.
참고: IFNγ 치료 증가 표현의 TNF 수용 체 2 (TNFR2)16. - 미터를 해결 하기 위해 보정 전극 입력 포트에 삽입 하 고 "옴" 모드를 선택 합니다. 미터 1000 Ω의 읽기 표시 될 때까지 드라이버 R 조정 나사를 조정 합니다.
- 15-30 분, 70% 에탄올에 그들을 배치 하 여 전극을 소독 하 고 있도록 공기 건조 15 미 린스 실험 세포 배양에 전극.
- 켜고 전원, "옴" 모드를 선택 합니다. 신중 하 게 기저 실과 꼭대기 챔버로 짧은 끝에 전극 다리의 긴 끝을 놓습니다. 긴 전극 표면 조직 문화 삽입 낮지만 미디어의 아래 짧은 전극 유지 하면서, 접시의 바닥을 터치를 확인 합니다. 수직 전극 유지.
- 0, 1, 2, 3, 4 h cytokine 치료 후에 샘플 삽입 및 빈 삽입 (즉, 문화 삽입 셀 없이 그러나 HBSS)의 저항을 측정 합니다. 저항을 기록 합니다.
- 다른 판 형식에 걸쳐 일관성을 달성 하기 위해 저항과 유효 막 면적의 계산:
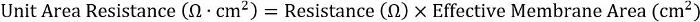
24 잘 삽입에 대 한 효과적인 막 0.33 c m2입니다.
3. murine 모델 Dextran 황산 나트륨 (DSS)-대 장 염을 유발
- 3.5% (wt/vol)의 최종 농도에 압력가 마로 소독 물에 DSS를 추가 합니다.
- 3.5% 관리 7 일 총 8 주 오래 된 남성 C57BL/6 마우스 DSS. DSS 없이 일반 식 수 통제 쥐에 게.
- 스위치 7 일 후 일반 식 수에 DSS-포함 된 물.
- 마우스 무게 및 매일 각 마우스의 임상 점수를 평가. 각 마우스의 초기 몸 무게를의 몸 무게를 정상화. 점수는 질병의 심각도 따라 4 개의 매개 변수에 정의 된: 직장 탈출 (0-2), 대변 일관성 (0-2), 출혈 (0-2), 및 활동 (0-2)5. 최종 임상 점수에 대 한 이러한 매개 변수에서 점수 합계.
- 결 장 조직의 histopathological 상태 분석, 1.2% (vol/vol) Avertin (0.6 mL/10 g 체중) 7 일 게시물-DSS 치료와 복 (i.p.) 주입 하 여 마우스를 안락사. 100 %avertin의 주식, 혼합 준비 2,2,2 tribromoethanol의 10 g tert-산은 알코올의 10 ml로 한다. 4 ° c.에 어둠 속에서 저장 사용 하려면, 물에서 2%로 100% 주식 희석.
- 결 장 및 맹, 분리 하 고 콜론5의 길이 측정.
- 하룻밤 10% 포 르 말린의 10 mL를 포함 하 15 mL 송 골 매 관에 원심 결 장 및 수정에서 0.5 cm 세그먼트를 잘라. 세척 등급된 에탄올과 고정된 조직 (75, 95, 100%) 및 크 실 렌. 파라핀 조직을 포함 하 고 6mm 되며 & 오신8얼룩에 대 한 섹션을 잘라.
4. 측정 DSS 유도 Colitis 쥐에서 상피 장벽 침투성
- 장벽 침투성 DSS 관리의 시작 후에 7 일을 측정 합니다.
- 분석 결과 하루에 3 h에 대 한 마우스를 빨리.
- 압력솥을 gavage 불 임, 150 µ L 80 mg/mL 4 kDa FITC-dextran 살 균 물에와 다음 gavage 쥐 되도록 바늘 하 고 혈 청 수집 후 측정 하는 표준 곡선을 사용 하지 않는 FITC dextran을 유지. 침투성 계산에 대 한 마우스의 무게.
참고: FITC dextran 솔루션은 물에서 여야 한다. - 가 위를 사용 하 여 클립, 꼬리의 1 cm 조각 하 고 혈 청 컬렉션 튜브로 꼬리에서 혈액의 100 µ L를 수집 합니다. 실 온에서 10 분 동안 10000 x g에서 수집 된 혈액을 회전 합니다.
- 희석 혈 청 1: 물에서 4. 표준 곡선, 사용 하지 않는 FITC-dextran 1:300, 1:1, 000, 1:3, 000에서 물으로 희석을 1시 10분, 000, 1:30, 000, 1: 100, 000, 1:300, 000, 1:1, 000, 000과 1:3, 000, 000. 혈 청 및 표준 곡선 샘플 100 µ L/잘 96 잘 접시에 추가 합니다.
- 485 여기/528 방출으로 플레이트 리더에서 형광을 읽기. 표준 곡선에 따라 침투성 값을 계산 하 고 희석에 대 한 해결에 4를 곱하십시오.
- (이 마우스 아픈 하 고 체중을 잃 었 FITC dextran 배달에 차이 정상화를 통해) 값을 정규화 하 무게에 의해 FITC dextran의 농도 나눕니다.
결과
문화, Caco 2BBe 세포를 단층으로 성장 하 고 천천히 테두리 브러시를가지고 성숙한 흡수 성 enterocytes로 분화. 이 프로토콜에서 Caco 2BBe 셀 폴 리 카보 네이트 막에 높은 밀도와 도금 했다 하 고 셀에 도달 100 %confluency 시드 후에 1 일. 그러나 세포는 차별화 된이 단계에서: 완전히 셀 구분, 미디어 3 주 동안 2-3 일 마다 변경 됩니다. 세포 핵으로 물 했다 고 F 걸 미 분화 및 분화 세...
토론
프로토콜에 몇 가지 중요 한 단계가 있다. Caco-2BBe (브러쉬 국경-표현) 셀 테 측정, 브러쉬-테두리 단백질의 표현 위한 Caco-2 셀 라인에서 선택한 항상 사용 됩니다. Caco-2BBe 세포는 모 흡수 형 때 (문화 후 합류의 약 3 주) 후 완전히 분화17. 측정, 동안 오염 방지 하 고 전극 소독이 필요 하다. 절차는 비 살 균, 측정은 최대 8 h 대부분의 경우에만 수행할 수 있습니다. 측정, 동안 우리 두...
공개
저자 아무 경쟁 금융 관심사를 선언합니다.
감사의 말
이 연구를 완료에 그의 관대 한 도움에 감사 박사 제럴드 R. 터너, Brigham와 여자의 병원, 하버드의과 대학에서에서 하 고. 이 작품은 중국 (보조금 번호 81470804, 31401229, 및 81200620)의 국가 자연과학 기초는 자연 과학 재단의 장쑤 성 (보조금 번호 BK20180838, 및 BK20140319)에 의해 지원의 연구 혁신 프로그램 대학 졸업생의 장쑤 성 (보조금 번호 KYLX16-0116), 고급 연구 프로젝트의 Soochow 대학 (보조금 번호 SDY2015_06), 그리고 크 론 및 Colitis 재단 연구 펠로 십 수상 (310801 번호 부여).
자료
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
참고문헌
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유