Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vitro ve In Vivo yaklaşımlar Bağırsak epitel hücre geçirgenliği belirlemek için
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
İki yöntem burada bağırsak bariyer fonksiyonunu belirlemek için sunulmuştur. Bir epitel metre (volt/ohm) doku kültürü kuyu içinde doğrudan kültürlü epiteli transepithelial Elektrik direniş ölçümler için kullanılır. Farelerde, FITC dextran sonda ile besleme yöntemi bağırsak geçirgenliği vivobelirlemek için kullanılır.
Özet
Bağırsak bariyer patojen mikroorganizma ve mikrobiyal toksin karşı savunur. İşlevi sıkı kavşak geçirgenliği ve epitel hücre bütünlük tarafından düzenlenir ve bağırsak bariyer fonksiyonu bozulma gastrointestinal ve sistemik hastalık ilerleme katkıda bulunur. Burada Bağırsak epitel geçirgenliği ölçmek için iki basit yöntem anlatılmaktadır. Vitro, Caco-2BBe hücreleri bir monolayer doku kültürü wells kaplama ve transepithelial elektrik direnci (TER) bir epitel (volt/ohm) metre ile ölçülür. Bu yöntem olan Kullanıcı dostu işlem ve tekrarlanabilirlik nedeniyle ikna edici. İçinde vivo fareler 4 kDa floresein isothiocyanate (FITC) ile gavaged-dextran ve FITC dextran konsantrasyonları epitel geçirgenliği belirlemek için fare üzerinden toplanan serum örneklerinde ölçülen. Oral gavaj doğru bir doz sağlar ve bu nedenle bağırsak geçirgenliği vivoölçmek için tercih edilen yöntemdir. Birlikte ele alındığında, bu iki yöntem bağırsak epitel içinde in vitro ve in vivogeçirgenliği ölçüm yapabilir ve bu nedenle hastalıklar ve bariyer fonksiyonu arasındaki bağlantıyı çalışmaya kullanılması.
Giriş
Bağırsak epitel hücreleri sadece besin emilimi için sorumlu değildir, ama aynı zamanda patojen mikroorganizmaların ve mikrobiyal toksinler karşı savunmak için önemli bir bariyer oluşturmak. Bu bağırsak bariyer fonksiyonu sıkı kavşak geçirgenliği ve epitel hücre bütünlüğü1,2,3tarafından düzenlenir ve epitel bariyer fonksiyonunun disfonksiyon iltihabi bağırsak ile ilişkilidir hastalığı (IBD). Perijunctional actomyosin yüzük (PAMR) sıkı kavşak yakından bitişik hücre içinde yatıyor. Myosin hafif zincir (MLC) tarafından düzenlenir, PAMR daralma sıkı kavşak geçirgenliği4,5,6,7,8düzenlenmesi için önemlidir, 9,10. Tümör nekroz faktör (TNF) bağırsak bariyer kaybı etkinleşmiş Bağırsak epitel MLC kinaz (MICK) ifade ve occludin içselleştirilmesi11,12,13inducing için merkezi bir noktada bulunuyor.
İyonlar Na+ ve Cl- gibi gözenek veya sızıntı yolu14tarafından paracellular alan çapraz. "Sızan" bir epitel içinde TER değişiklikleri öncelikle değişmiş sıkı kavşak geçirgenliği yansıtmak. TER ölçüm hücre monolayers empedans göre sıkı Kavşağı geçirgenliği, Na+ ve-, Cl için öncelikle ölçmek için yaygın olarak kullanılan bir elektrofizyolojik yaklaşımdır. Farklı hücre tipleri, Bağırsak epitel hücreleri, pulmoner epitel hücreleri ve vasküler endotel hücreleri, gibi TER ölçülerini bildirilmiştir. Bu yöntemin avantajları, TER ölçümleri non-invaziv ve canlı hücreleri gerçek zamanlı olarak izlemek için kullanılan vardır. Buna ek olarak, TER ölçüm tekniği uyuşturucu toksisite çalışmaları15için yararlıdır.
Caco-2BBe hücreleri insan epitel kolorektal adenokarsinom hücre yapısı ve farklılaştırılmış küçük bağırsak epitel hücrelere benzer işlev vardır: Örneğin, microvilli ve küçük bağırsak fırça ile ilişkili enzimler bu hücreler var sınır. Bu nedenle, kültürlü Caco-2BBe monolayers bariyer fonksiyonu test etmek için bir vitro model olarak kullanılmaktadır.
Farelerde, kana lümen geçmeye FITC dextran yeteneği ölçerek bağırsak paracellular geçirgenliği çalışmaya yollarından biridir. Böylece, bağırsak geçirgenliği gavaging FITC dextran doğrudan içine fare ve kan içinde floresans ölçme tarafından tespit edilebilir. Aşağıdaki iletişim kuralı Bağırsak epitel geçirgenliği değerlendirmek için iki basit yöntem açıklanır vitro ve içinde vivo.
Protokol
Bu çalışmada hayvan bakım ve kullanım iletişim kuralı, Cambridge-Suda genomik Kaynak Merkezi (CAM-SU), Soochow Üniversitesi tarafından onaylanmıştır.
1. kaplama ve Caco-2bbe gözenekli Polikarbonat membranlar üzerinde bakım
- Bir T75 şişesi ile kitle iletişim araçları içinde hücrelerin büyümesine (% 10 içeren DMEM FBS). Şişeler düzenli olarak, hücre yoğunluğu bağlı olarak beslenmeleri gerekir.
Not: optimum kaplama için hücreleri hızla Böl ve hücre büyüme aşamasında olduğunu gösterir bir düz "kızarmış yumurtalı" şekil var. - Hücrelerin % 80 birleşmesi olduğunda, kuluçka makinesi dışında şişesi ve medya sökün. 1-2 mL steril PBS (olmadan Ca2 +) ile kalan herhangi bir medya durulayın. Damlalıklı 1,5 mL tripsin-EDTA balonun içine ve yavaşça şişeye; kaya o zaman, şişeye 20 dk 37 ° C kuluçka sallanan olmadan yer.
- Hücreleri trypsinizing iken, yer gözenekli Polikarbonat membranlar (gözenek boyutu, 0.4 µm; Malzemeler tablobkz: yüzey alanı, 0,33 cm2;) 24-şey kalıplara içeren ekler. Kültür medya 1.0 mL bazal odası (membran alt boşluk) ekleyin.
- Medya şişesi ve şiddetle damlalıklı 5 mL damlalıklı şişeye tarafına hücreleri 5 - 10 kat gevşek, tek tek hücreler veya 2-3 hücre elde etmek için kümeler.
-
0,166 mL (1:8 seyreltme oranı elde) hücrelerinin apikal odasına (membran üst boşluk) plaka. 37 ° C'de 3 haftaya kadar kuluçkaya.
- Hücreleri üç kez haftalık dikkatle her şey bir basınç pompa kullanarak bazal yuvası ortamdan aspirating tarafından beslenir. Yavaşça medya 1 mL her ekleme apikal odanın içine damla.
2. TER ölçme epitel metre (Volt/Ohm) kullanımı
Not: kültür Polikarbonat membranlar üzerinde yaklaşık 3 hafta sonra Caco-2BBe hücreler TER ölçüm için hazırsınız demektir.
- Sitokin çalışmaları için bir gün önce ölçüm, IFNγ 10 ng/mL içeren medya ile bazal ortamı değiştirin. Deneme günü, ortamı 2.5 veya 7.5 ng/mL TNF içeren HBSS ile değiştirin.
Not: IFNγ tedavi TNF reseptör 2 (TNFR2) ifade artırır16. - Belgili tanımlık ölçme aygıtı düzeltmek için düzeltme elektrot giriş portuna takın ve "Ohm" modunu seçin. 1000 Ω bir okuma metre görüntüleyinceye kadar R Adj vida bir tornavida ile ayarlayın.
- % 70 etanol için 15-30 dakika yerleştirerek elektrotlar sterilize ve onları hava kuru 15 s. durulama için deneysel hücre kültür medya elektrot bekleyin.
- Kapatın ve güç kablosunu ve "Ohm" modunu seçin. Dikkatle bazal odası ve apikal odasına kısa uç elektrot köprüler uzun sonuna yerleştirin. Uzun elektrotlar medya ama doku kültürü ekler yukarıda yüzeyden daha kısa elektrot tutarak çanak alt dokunmak emin olun. Elektrotlar dikey tutun.
- Örnek ekler ve boş ekler (hücre olmadan ama HBSS ile kültür ekleryani ) dayanıklılığını ölçmek, 0, 1, 2, 3, 4 h sitokin tedaviden sonra. Direniş kaydedin.
- Farklı plaka biçimleri arasında tutarlılık sağlamak için ürün direnci ve etkili membran alanı hesaplamak:
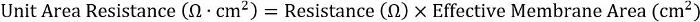
24-şey ekler için 0,33 cm2etkili membran alandır.
3. fare modeli Dextran sülfat sodyum (DSS)-kolit indüklenen
- DSS %3.5 (wt/vol) son bir konsantrasyon autoclaved su ekleyin.
- % 3,5 yönetmek DSS 7 gün olmak üzere toplam 8-hafta-yaşlı erkek C57BL/6 fareler için. Normal içme suyu DSS olmadan kontrol fareler için vermek.
- DSS içeren su normal içme suyu için 7 gün sonra geçin.
- Fareler tartmak ve klinik puanları her fare her gün değerlendirmek. Vücut ağırlığı, ilk vücut ağırlığının her fare ile normalleştirmek. Puanları tarafından dört parametre hastalık şiddeti göre tanımlanır: Rektal prolapsus (0-2), dışkı tutarlılık (0-2), kanama (0-2) ve aktivite (0-2)5. Bu parametreler için bir final klinik skoru gelen puanları toplamak.
- İki nokta üst üste doku histopatolojik durumunu analiz etmek için %1,2 (vol/vol) Avertin (0.6 mL/10 g vücut ağırlığı) 7 gün sonrası-DSS tedavi ile mayi (IP) enjeksiyonla fareler ötenazi. % 100 avertin bir hisse senedi hazırlamak için 2,2,2-tribromoethanol 10 g tert-amil alkol 10 ml ile karıştırın. Karanlıkta 4 ° C'de depolayın Kullanmak için % 100 hisse senedi suda % 2 oranında seyreltin.
- Çekum ve iki nokta üst üste ayırma ve iki nokta üst üste5uzunluğunu ölçmek.
- 0.5 cm kesimleri distal kolon ve düzeltme 15 mL şahin tüp 10 mL % 10 formalin gecede içeren kesti. Kademeli etanol sabit kurcalayarak yıkayın (75, 95 ve % 100) ve Ksilen. Parafin içinde belgili tanımlık doku katıştırmak ve 6 mm bölümleri Hematoksilen ve eozin8boyama için kesti.
4. DSS kaynaklı kolit farelerde epitel bariyer geçirgenliği ölçüm
- Bariyer geçirgenliği DSS yönetim başladıktan sonra 7 gün ölçmek.
- Tahlil günü, fareler 3 h için hızlı.
- Otoklav bir sonda ile besleme kısırlık, sonra sonda ile besleme fareler 150 µL 80 mg/mL 4 kDa FITC-dextran steril su ile emin olmak için iğne ve serum toplandıktan sonra standart eğri ölçmek için kullanılmayan FITC dextran tutmak. Fareler geçirgenliği hesaplama için tartmak.
Not: Suda FITC dextran çözüm yapılmalıdır. - Makas kullanarak, kuyruk 1 cm parçası küçük ve 100 µL kan serum koleksiyonu tüpler içine kuyruk toplamak. 10.000 x g oda sıcaklığında 10 dakika için toplanan kana spin.
- Serum 1:4 su oranında seyreltin. Eğri, 1:300, 1:1, 000, 1:3, 000, su ile kullanılmayan FITC dextran seyreltik bir standart hale getirmek için 1:10, 000, 1:30, 000, 1: 100, 000, 1:300, 000, 1:1, 000, 000 ve 1:3, 000, 000. 100 µL/iyi serum ve standart eğri örnekler 96-şey kalıplara ekleyin.
- Bir plaka okuyucu 485 uyarma/528 emisyon ile floresan okuyun. Standart eğri dayalı geçirgenlik değerleri hesaplamak ve seyreltme için düzeltmek için 4 tarafından çarpın.
- FITC dextran konsantrasyonu (Bu fareler hasta iseniz ve kilo kaybettim FITC dextran teslim farklılığı normale yardımcı olur) değerleri normalize etmek ağırlık tarafından bölün.
Sonuçlar
Kültür, Caco-2BBe hücreleri bir monolayer büyümek ve yavaşça fırça kenarlıklara sahip olgun dinsel enterositler ayırt etmek. Bu iletişim kuralı, Caco-2BBe hücreleri yüksek yoğunluklu Polikarbonat membranlar üzerinde kaplama ve hücrelerin % 100 confluency bir gün tohum sonra ulaştı. Ancak, bu aşamada farklılaşmamış hücreleri olan: tam hücreleri ayırt etmek için medya her 2-3 gün 3 hafta için değiştirilir. Hücre çekirdeği ile lekeli ve farklılaşmamış...
Tartışmalar
Protokolünde çeşitli kritik adımlar vardır. Caco-2BBe (fırça sınır-ifade) hücreler her zaman TER ölçüm, Caco-2 hücre kültürünü ifade sınır ötesi fırça proteinlerin için seçildiği için kullanılır. Caco-2BBe hücreleri villus dinsel fenotip var ne zaman tam-Ayrıştırılan (kültür sonrası izdiham yaklaşık 3 hafta sonra)17. Ölçüm sırasında kontaminasyon ve elektrot sterilize etmek için gereklidir. Yordamı non-steril olduğundan, ölçümleri yalnızca en fazl...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının bildirin.
Teşekkürler
Bu çalışmada tamamlanmasında cömert yardım için Dr Jerrold R. Turner, Brigham ve kadın Hastanesi, Harvard Tıp Okulu, teşekkür ederim. Bu eser desteklenen (grant numarası 81470804, 31401229 ve 81200620) Çin'in ulusal doğal Bilim Vakfı, Doğa Bilimleri Vakfı, Jiangsu Province (grant numarası BK20180838 ve BK20140319), araştırma Innovation programı için Jiangsu Province, üniversite mezunları (grant numarası KYLX16-0116), ileri araştırma projeleri Soochow Üniversitesi (grant sayı SDY2015_06) ve Crohn ve kolit Vakfı Araştırma Bursu Ödülü (sayı 310801 vermek).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
Referanslar
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır