Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In Vitro et In Vivo des approches pour déterminer la perméabilité des cellules épithéliales intestinales
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Deux méthodes sont présentées ici, afin de déterminer la fonction de barrière intestinale. Un compteur épithélial (v/ohm) est utilisé pour la mesure de la résistance transépithéliale des épithéliums cultivées directement dans les puits de culture de tissus. Chez les souris, la méthode de gavage FITC-dextran est utilisée pour déterminer la perméabilité intestinale in vivo.
Résumé
La barrière intestinale défend contre les micro-organismes pathogènes et toxines microbiennes. Sa fonction est réglementée par la perméabilité de la jonction serrée et l’intégrité des cellules épithéliales, et perturbation de la fonction de barrière intestinale contribue à la progression de la maladie gastro-intestinale et systémique. Deux méthodes simples sont décrites ici pour mesurer la perméabilité de l’épithélium intestinal. In vitro, les cellules Caco-2BBe sont plaqués dans les puits de culture de tissu comme une monocouche et résistance électrique transépithéliale (TER) peut être mesurée par un compteur épithéliales (v/ohm). Cette méthode est convaincant en raison de son fonctionnement convivial et la répétabilité. In vivo, souris sont gavés avec 4 kDa isothiocyanate de fluorescéine (FITC)-dextran et les concentrations de FITC-dextran sont mesurées dans des échantillons de sérum prélevés chez des souris pour déterminer la perméabilité épithéliale. Gavage oral apporte une dose précise et par conséquent il est préférable de mesurer la perméabilité intestinale in vivo. Pris ensemble, ces deux méthodes permettant de mesurer la perméabilité de l’épithélium intestinal in vitro et in vivoet donc être utilisées pour étudier le lien entre les maladies et la fonction de barrière.
Introduction
Les cellules épithéliales intestinales ne sont pas seulement responsables de l’absorption des nutriments, mais constituent également un obstacle important pour se défendre contre les micro-organismes pathogènes et des toxines microbiennes. Cette fonction de barrière intestinale est régulée par la perméabilité de la jonction serrée et cellules épithéliales intégrité1,2,3, et le dysfonctionnement de la fonction de barrière épithéliale est associé à inflammatoires de l’intestin maladie (MICI). L’anneau d’actomyosine perijunctional (PAMR) se trouve dans la cellule qui est étroitement accolée à des jonctions serrées. La contraction de la PAMR, qui est régi par la chaîne légère de la myosine (MLC), est cruciale pour le règlement de la jonction serrée perméabilité4,5,6,7,8, 9,10. Facteur de nécrose tumorale (TNF) est au cœur de la perte de la barrière intestinale par cytoprotectrices expression intestinale épithéliale kinase (MLCK) MLC et induisant occludin internalisation11,12,13.
Ions tels que Na+ et Cl– peut traverser l’espace paracellulaire par le pore ou fuite voie14. Dans un épithélium « Baveur », changements de TER reflètent principalement perméabilité altérée de jonction serrée. Mesure de TER est une approche électrophysiologique couramment utilisée pour quantifier la perméabilité de jonction serrée, principalement à Na+ et Cl-, basée sur l’impédance des monocouches de cellules. Types de cellules différentes, y compris les cellules épithéliales intestinales, les cellules épithéliales pulmonaires et les cellules endothéliales vasculaires, ont été signalés pour des mesures de TER. Avantages de cette méthode sont que TER mesures sont non invasif et peuvent être utilisés pour surveiller des cellules vivantes en temps réel. En outre, la technique de mesure de TER est utile pour la drogue toxicité études15.
Caco-2BBe cellules sont des cellules d’adénocarcinome colorectal épithéliales humaines avec une structure et une fonction semblable aux petites cellules épithéliales intestinales différenciées : par exemple, ces cellules ont des microvillosités et enzymes associées à petite brosse intestinale frontière. Par conséquent, cultivées monocouches de Caco-2BBe sont utilisés comme modèle in vitro pour tester la fonction de barrière.
Chez la souris, une façon d’étudier la perméabilité paracellulaire intestinale est en mesurant la capacité du FITC-dextran à traverser de la lumière dans le sang. Ainsi, la perméabilité intestinale peut être évaluée par gavage FITC-dextran directement dans la souris et en mesurant la fluorescence dans le sang. Le protocole suivant décrit deux méthodes simples pour évaluer la perméabilité de l’épithélium intestinal in vitro et in vivo.
Protocole
Cette étude a été approuvée par la protection des animaux et utilisation protocole de Cambridge-Suda génomique Resource Center (CAM-SU), l’Université Soochow.
1. électrodéposition et l’entretien de Caco-2bbe sur les Membranes poreuses en Polycarbonate
- La croissance de cellules dans une fiole de T75 avec les médias (DMEM contenant 10 % FBS). Flacons doivent être nourris régulièrement, en fonction de la densité cellulaire.
Remarque : Pour le placage optimal, cellules devraient se divisent rapidement et ont une forme plate « frit-œuf », qui indique que les cellules sont en phase de croissance. - Une fois que les cellules sont 80 % confluentes, prendre le ballon hors de l’incubateur et retirez le support. Rincer tout média résiduel avec 1 à 2 mL de PBS stérile (sans Ca2 +). Pipeter 1,5 mL trypsine-EDTA dans le ballon et doucement rock la fiole ; Ensuite, placer la fiole dans un incubateur à 37 ° C pendant 20 min sans bascule.
- Alors que les cellules sont trypsinisation, place insère contenant des membranes poreuses en polycarbonate (taille des pores, 0,4 µm ; superficie, 0,33 cm2; voir Table des matières) dans les plaques 24 puits. Ajouter 1,0 mL de milieu de culture dans la chambre basale (l’espace inférieur de la membrane).
- Pipette 5 mL de médias dans la fiole et vigoureusement la pipette les cellules contre le côté du ballon de 5 à 10 fois pour atteindre les cellules desserrées, individuels ou 2 ou 3 cellules des touffes.
-
Plaque de 0,166 mL de cellules (atteindre un taux de dilution de 1:8) dans la chambre apicale (l’espace supérieur de la membrane). Incuber à 37 ° C pendant 3 semaines.
- Nourrir les cellules trois fois par semaine en aspirant soigneusement le support du compartiment basal de chaque bien en utilisant une pompe à pression. Ne versez doucement 1 mL de médias dans la chambre apicale de chaque insertion.
2. utilisation d’épithélial mètre (v/Ohm) pour mesurer les TER
Remarque : Après environ 3 semaines de culture sur la membrane en polycarbonate, cellules Caco-2BBe sont prêts pour la mesure de TER.
- Pour les études de cytokine, un jour avant la mesure, remplacer le milieu de base avec un milieu contenant 10 ng/mL d’IFNγ. Le jour de l’expérience, remplacez les médias HBSS contenant 2,5 ou 7,5 ng/mL de TNF.
Remarque : Le traitement IFNγ augmente l’expression des récepteurs TNF 2 (TNFR2)16. - Pour corriger le compteur, introduire l’électrode de correction dans le port d’entrée et choisissez le mode « Ohm ». Régler la vis de l’Adj R avec un tournevis jusqu'à ce que le compteur affiche une lecture de 1 000 Ω.
- Stériliser les électrodes en les plaçant dans l’éthanol à 70 % pour les 15-30 min et puis laissez-les à l’air sec pour 15 s. Rincer l’électrode dans les milieux de culture de cellule expérimentale.
- Mettre sous tension et choisissez le mode « Ohm ». Placer soigneusement les longues extrémités des ponts électrode dans la chambre basale et les petits bouts dans le compartiment apical. Veiller à ce que les électrodes plus touchent le fond du plat, tout en gardant les électrodes courtes sous la surface des médias mais surtout les inserts de culture cellulaire. Garder les électrodes verticales.
- Mesurer la résistance de l’échantillon insertions et insertions vides (c'est-à-dire, la culture insère sans cellules avec HBSS) à 0, 1, 2, 3, 4 h après le traitement de cytokine. Enregistrement de la résistance.
- Pour assurer l’uniformité dans l’ensemble plaque différents formats, calculer le produit de la résistance et de la zone de la membrane efficace :
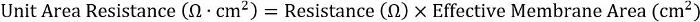
Pour les insertions de 24 puits, la surface de membrane efficace est 0,33 cm2.
3. modèle murin de Dextran Sulfate Sodium (DSS)-induced Colitis
- Ajouter DSS à eau stérilisés à l’autoclave à une concentration finale de 3,5 % (wt/vol).
- Administrer les 3,5 % Mas de souris C57BL/6 mâles de 8 semaines pour un total de 7 jours. Donner régulièrement l’eau potable sans DSS aux souris témoins.
- Passer l’eau contenant du MAS à l’eau potable ordinaire après jour 7.
- Souris de peser et évaluer des scores cliniques de chaque souris tous les jours. Normaliser le poids corporel de chaque souris à son poids corporel initial. Scores sont définis en fonction de la gravité de la maladie par quatre paramètres : prolapsus rectal (0-2), consistance des selles (0-2), saignements (0-2) et activité (0-2)5. Additionner les scores de ces paramètres pour un score final de clinique.
- Pour analyser la condition histopathologique des tissus du côlon, euthanasier souris par injection intrapéritonéale (i.p.) avec traitement de 1,2 % (vol/vol) Avertin (0,6 mL/10 g de poids corporel) 7 jours post-DSS. Pour préparer un stock de 100 % avertin, mélanger 10 g de 2,2,2-tribromoethanol 10 ml d’alcool de tert-amyle. Stocker dans l’obscurité à 4° C. Pour utiliser, diluer 100 % stock à 2 % dans l’eau.
- Isoler le côlon et le caecum et mesurer la longueur du côlon5.
- Couper des segments de 0,5 cm de côlon distal et du fix dans un tube de falcon de 15 mL contenant 10 mL de formol 10 % du jour au lendemain. Laver les tissus fixés à l’éthanol graduée (75, 95 et 100 %) et le xylène. Incorporer les tissus à la paraffine et couper des sections de 6 mm pour l’hématoxyline et éosine coloration8.
4. mesure de la perméabilité de la barrière épithéliale chez les souris de la colite induite par le DSS
- Mesurer la perméabilité de la barrière de 7 jours après le début de l’administration de DSS.
- Le jour du test, rapide souris pendant 3 h.
- Stériliser un gavage aiguille pour assurer la stérilité, puis gavage souris avec 150 µL 80 mg/mL 4 kDa FITC-dextran dans de l’eau stérile et garder le FITC-dextran inutilisé afin de mesurer la courbe d’étalonnage après le prélèvement de sérum. Peser les souris pour le calcul de la perméabilité.
Remarque : La solution FITC-dextran convient dans l’eau. - À l’aide d’une paire de ciseaux, couper un morceau de 1 cm de la queue et prélever 100 µL de sang de la queue dans les tubes de prélèvement de sérum. Faites tourner le sang à 10 000 g pendant 10 min à température ambiante.
- Diluer le sérum 1 / 4 dans l’eau. Pour faire une norme curve, diluer FITC-dextran inutilisé avec de l’eau au 1 : 300, 1 / 1 000, 1:3, 000, 01:10, 000, 01:30, 000, 1/100 000, 1 : 300, 000, 1:1, 000, 000 et 1:3, 000, 000. Ajouter 100 µL/puits de sérum et les échantillons de la courbe d’étalonnage en plaques 96 puits.
- Lire la fluorescence dans un lecteur de plaque avec 485 excitation/528 d’émission. Calculer les valeurs de perméabilité basés sur la courbe d’étalonnage et multipliez par 4 pour corriger pour la dilution.
- Diviser la concentration du FITC-dextran par le poids de normaliser les valeurs (cela permet de normaliser la différence dans la livraison de la FITC-dextran si les souris sont malades et ont perdu du poids).
Résultats
En culture, cellules Caco-2BBe croître comme une monocouche et lentement se différencient en des entérocytes absorption matures qui ont des frontières de la brosse. Dans ce protocole, les cellules Caco-2BBe ont été plaqués avec une forte densité sur la membrane en polycarbonate et cellules atteint 100 % confluence un jour après l’ensemencement. Cependant, les cellules sont indifférenciées, à ce stade : pour bien différencier les cellules, les médias sont changé tous les ...
Discussion
Il y a plusieurs étapes cruciales dans le protocole. Les cellules Caco-2BBe (brosse exprimant frontière) sont toujours utilisés pour la mesure de TER, sélectionnée dans la lignée de cellules Caco-2 pour l’expression des protéines de la bordure en brosse. Les cellules Caco-2BBe ont un phénotype d’absorption de villosités lorsque complètement dissociés (après environ 3 semaines de confluence après culture)17. Il est nécessaire d’éviter toute contamination pendant la mesure et de...
Déclarations de divulgation
Les auteurs déclarent sans intérêts financiers concurrents.
Remerciements
Nous remercions le docteur Jerrold R. Turner, de l’hôpital Brigham et des femmes, Harvard Medical School, pour son aide généreuse dans l’achèvement de cette étude. Ce travail est soutenu par la Fondation nationale des sciences naturelles de Chine (numéro de licence 81470804, 31401229 et 81200620), le Natural Science Foundation de la Province du Jiangsu (numéro de licence BK20180838 et BK20140319), le programme d’Innovation de recherche des Diplômés de collège de la Province du Jiangsu (numéro de licence KYLX16-0116), Advanced Research projets de Soochow University (numéro de licence SDY2015_06) et maladie de Crohn & Colitis Foundation Research Fellowship Award (octroyer le numéro 310801).
matériels
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
Références
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon