A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تشريح مجمعات البروتين متعدد الإشارات بالتكامل Bimolecular انجذاب تطهير (بيكاب)
In This Article
Summary
ويصف هذه المخطوطة البروتوكول "تنقية تقارب التكامل بيموليكولار" (بيكاب). يسهل هذا الأسلوب رواية عزلة محددة وتوصيف البروتين المصب أي اثنين من البروتينات المتفاعلة، بينما استبعاد الأمم المتحدة الرصاصية البروتينات الفردية، فضلا عن مجمعات شكلت مع الشركاء ملزمة المتنافسة.
Abstract
الجمعية العامة من البروتين المجمعات إليه مركزية الكامنة وراء تنظيم العديد من الخلايا مما يشير إلى الممرات. كان تركيز رئيسي لبحوث الطب الأحيائي هو فك رموز كيف تتصرف هذه المجمعات البروتين الحيوي لدمج إشارات من مصادر متعددة من أجل توجيه استجابة بيولوجية معينة، وكيف يصبح حرر هذا في العديد من المرض الإعدادات. على الرغم من أهمية هذه الآلية الرئيسية للكيمياء الحيوية، هناك نقص في التقنيات التجريبية التي يمكن أن تيسر deconvolution محددة وحساسة من هذه المجمعات إشارات متعددة الجزيئية.
هنا هو معالجة هذا القصور من خلال المزيج من مقايسة البروتين التكامل مع نانوبودي الخاصة بالمطابقة، التي كنا قد وصف Bimolecular التكامل انجذاب تطهير (بيكاب). ويسهل هذا الأسلوب رواية عزلة محددة وتوصيف البروتين المتلقين للمعلومات من أي زوج من البروتينات المتفاعلة، باستبعاد الأمم المتحدة الرصاصية البروتينات الفردية والمجمعات التي شكلت مع الشركاء ملزمة المتنافسة.
تقنية بيكاب قابلة للتكيف لمجموعة واسعة من الاختبارات التجريبية المصب، ويسمح درجة عالية من الدقة التي توفرها هذه التقنية أكثر دقة التحقيقات في ميكانيكا الجمعية البروتين المعقدة مما هو ممكن حاليا باستخدام تقنيات تنقية النسب القياسية.
Introduction
الجمعية البروتين المعقدة عملية رئيسية في الحفاظ على خصوصية الزمانية المكانية للتنبيه العديد من مسارات1،2. في حين أن من المسلم به على نطاق واسع الطبيعة الحاسمة لهذا الدور التنظيمي، هناك نقص في التقنيات التجريبية المتاحة للتدقيق في هذه المجمعات. تركز معظم الدراسات إينتيراكتوميكس عند التفاعل مع البروتينات الفردية، أو في إثراء متسلسلة من المكونات الفردية المعقدة. هنا نقدم تقنية لعزل ديمر البروتين محددة بينما استثناء مويتيس الفردية من البروتينات مكون فضلا عن مجمعات شكلت مع تنافس ربط الشركاء3. وطلبنا هذا الأسلوب "تنقية تقارب التكامل بيموليكولار" (بيكاب)، كما أنه مزيج من التكامل البروتين الموجود سابقا جزء مقايسة، "بيموليكولار Fluorescence التكامل" (بيفك)، مع استخدام رواية نانوبودي الخاصة بتكيف المؤتلف نحو التجارة والنقل ومشتقاته (انظر الجدول للمواد)-
مقايسة تكامل يفتت بروتين نموذجي يعتمد على التعبير عن البروتينات "الطعم" و "فريسة" تنصهر لفصل أجزاء من الصحفيين مثل لوسيفراس4، β-جالاكتوسيداسي5أو البروتينات الفلورية الخضراء (بروتينات فلورية خضراء)6 ( الشكل 1A). من خلال تفاعل البروتينات الطعم وفريسة، تشجع تقسيم المجالات مراسل على ريفولد في بنية وظيفية، مما يتيح التفاعل بين الطعم وفريسة البروتينات إلى تصور أو كمياً. بيكاب تم تكييفها من نسخة من هذا الأسلوب الذي استخدم من الشظايا من البديل بروتينات فلورية خضراء فينوس. فحوصات البروتين الفلورسنت التكامل هي طريقة شائعة لتصور تفاعلات البروتين البروتين في خلية حية، ولكن حتى الآن كانت محدودة لهذا وظيفة واحدة7. بيكاب يمثل خطوة هامة إلى الأمام في هذا الصدد، كما أن هذا الأسلوب ليس فقط يسمح للتصور، ولكن أيضا العزلة والاستجواب للتفاعل البروتين البروتين الناتج.
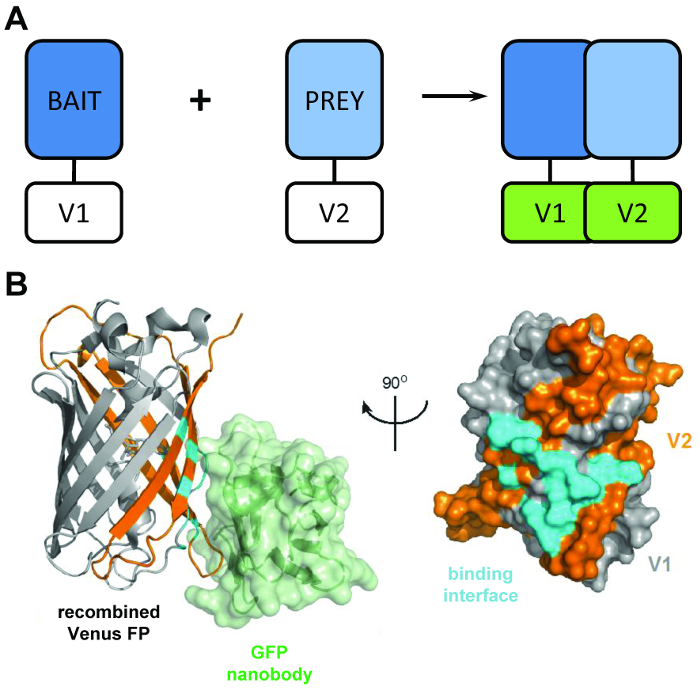
رقم 1: الرئيسية الهيكلية الكامنة وراء هذا الأسلوب بيكاب. (أ) تخطيطي توجز الرئيسي وراء إظهار التكامل bimolecular fluorescence البروتينات 'الطعم' و 'فريسة' المعلمة مع الطرفي ن V1 أو V2 ج-الطرفية أجزاء من البروتين فينوس كاملة الطول. (ب) التحليل الهيكلي (السماوي) واجهة التفاعل بين التجارة والنقل نانوبودي (الأخضر) ومعاد فينوس، وعرض موقف V1 (رمادي) والشظايا V2 (برتقالي) (PDB الانضمام 3OGO). وهذا الرقم هو إعادة نشر فرومكروتشير et al.3 Reprinted بإذن من AAAS. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
بيكاب أسلوب يجعل استخدام اثنين الشظايا غير الفلورية فينوس (المسمى V1 و V2) التي اقترانه بدرجة منخفضة من تقارب ما لم يحدث تفاعل بين شركائها الانصهار. وفي هذه الحالة، ريفولد المجالات تقسيم اثنين في الهيكل بيتا للبرميل الفنية فلوروفوري (الشكل 1B)6. الابتكار الرئيسي من بيكاب يأتي من الأخذ نانوبودي بروتينات فلورية خضراء المؤتلف، الذي يعترف حانمه ثلاثي الأبعاد على β-البرميل للتجارة والنقل (ومتغيرات مثل فينوس) التي فقط موجودة في فلوروفوري بشكل صحيح معاد ومطوية ( الشكل 1B)8. من الأهمية بمكان نانوبودي التجارة والنقل لا يرتبط أي من أجزاء الزهرة الفردية. وهذا يسهل عزل dimers البروتين فقط بعد البروتينات اثنين قد شكلت مجموعة معقدة من بمحض إرادتهم، مما يؤدي إلى نتائج أكثر تمثيلاً من تلك التي اكتسبت من الأساليب التي تجعل استخدام من التفاعلات التي يسببها كيميائيا، والقسري9.
بيكاب هو تقنية قوية أن يركز تحديداً على مجمعات البروتين المتعددة، التي يمكن أن يحتمل أن تكون جنبا إلى جنب مع عدد من التطبيقات المتلقين للمعلومات لتحسين مستوى فهمنا للدور الذي تلعبه هذه المجمعات في توصيل الإشارة . وهو يشمل أيضا ميزة هامة للسماح للتصور لتفاعلات البروتين في الموقع. وحتى الآن، أثبتت بيكاب كوسيلة فعالة لتحليل إينتيراكتومي من مستقبلات التيروزين كيناز (راديو وتلفزيون كوسوفو) dimers3، ولكن قدرة التكيف مع هذا الأسلوب يعني أن يتم اعتماده في سياق التفاعل البروتين تقريبا أي.
Protocol
1-بلازميد الاستنساخ
ملاحظة: لتوليد نواقل بلازميد مع العلامات V1 أو V2 تنصهر تيرمينوس N أو ج-تيرمينوس الجينات للفائدة، بيفك الوجهة ناقلات قد أودعت لدى أدجيني [العلامة الطرفي ن: بديست-V1-ORF (#73635)، بديست-V2-ORF (#73636). ج-محطة العلامة: بديست-ORF-V1 (#73637)، بديست-ORF-V2 (#73638)]. الجين/s لمصلحة ستحتاج إلى يكون في جزئ معين استنساخ متجهات دخول متوافق (أي، pDONR223 أو pENTR221)، دون stop codons، المضي قدما في الاستنساخ. العديد من الحيوانات المستنسخة متوافقة متاحة بالفعل داخل المجموعات بلازميد المتنوعة، بما في ذلك "جمع المجين الثدييات" (https://genecollections.nci.nih.gov/MGC/).
- أداء فعل جزئ لإدراج الجين تضارب المصالح بين المواقع attR ناقل الوجهة بيفك المناسبة:
- في أنبوب 0.2 مل، إضافة 150 نانوغرام دخول ناقلات و 150 نانوغرام بيفك الوجهة المتجهة والمخزن المؤقت TE ميليلتر 8 (pH 8.0).
- إضافة recombinase ميليلتر 2 إنزيم ميكس (انظر الجدول للمواد). يخلط جيدا والطرد المركزي بإيجاز.
- تبني رد فعل ح 1 في درجة حرارة الغرفة أو في 16 درجة مئوية بين عشية وضحاها.
- وقف رد الفعل بإضافة 1 ميليلتر البروتيناز-ك الحل وتفرخ في 37 درجة مئوية لمدة 10 دقائق.
- تحويل خلايا الحرارة-الصدمة-المختصة (انظر الجدول للمواد) مع المنتج رد فعل اليسار إلى اليمين:
ملاحظة: أي سلالة الأساسية يمكن تصور استخدام عند هذه النقطة، ما دام أنه لا يتضمن الترياق ككدب، الذي سيحول دون تحديد معين من البلازميدات المحتوية على الإدراج.- ذوبان الجليد الخلايا المختصة على الجليد ونقل 50 ميليلتر من الخلايا في أنبوب 14 مل البوليبروبيلين القاع المستديرة.
- إضافة 1 ميليلتر من رد الفعل المنتج للخلايا وتخلط بلطف. احتضان لمدة 20 دقيقة على الجليد.
- حرارة صدمة في حوض ماء 42 درجة مئوية ل 45 س. العودة فورا الجليد لمدة 2 دقيقة.
- أضف 1 مل الإعلام رطل واحتضان مع الهز في 37 درجة مئوية ح 1.
- لوحة التحويل على طبق أجار 10 سم تحتوي على الأمبيسلّين (100 ميكروغرام/مل) واحتضان في 37 درجة مئوية بين عشية وضحاها.
- تنقية بلازميد بيفك.
- لتنقية بلازميد من مستعمرة فردية، إضافة 100 مل الإعلام رطل قارورة مخروطية كبيرة وإضافة الأمبيسلّين (100 ميكروغرام/مل). شاشة مستعمرات متعددة، إضافة 5 مل الإعلام رطل إلى 14 مل القاع المستديرة أنابيب البولي بروبيلين وإضافة الأمبيسلّين (100 ميكروغرام/مل).
- استخدام حلقة تطعيم عقيمة، اختيار مستعمرة واحدة من لوحة أجار. مكان الحلقة التطعيم في وسائط الإعلام رطل وخلط بإيجاز.
- يغطي الجزء العلوي من قارورة مخروطية الشكل مع رقائق الألومنيوم واحتضان بين عشية وضحاها في 37 درجة مئوية مع الهز.
- إنتاج تعداء الصف بلازميد الحمض النووي بلازميد قياسي ماكسيبريب أو ميديبريب الحمض النووي باستخدام تنقية كيت (انظر الجدول للمواد)10. تقييم الجودة للحمض النووي بامتصاص الأطياف.
ملاحظة: يجب أن يكون الحمض النووي نسبة A260/A280 > 1.8 ونسبة A260/A230 > 2.0. عند هذه النقطة، من المستحسن للشاشة مستعمرات فردية متعددة للتحقق من كفاءة التعبير إدراج وعلامة.
2-الخلية الثقافة وتعداء
ملاحظة: تعداء موجهات بيفك من المهم لتحقيق الكفاءة العالية، وتعداء متجانسة نسبيا. الناقلات يرجح أن تكون متوافقة مع أي كاشف تعداء القياسية، وينبغي أن يكون الأمثل الشروط تعداء تبعاً لذلك. أداء الكتلي، ونحن عادة ثقافة الخلايا داخل الأطباق 10 سم، وعلى الرغم من أن هذا يمكن أيضا أن يكون التناسب تقليصها إلى أطباق أصغر أو لوحات للتجارب التي تتطلب أقل المواد.
- طبق البذور 1.0 × 106 HEK293T الخلايا في 10 سم مع 10 مل الإعلام دميم، وتستكمل مع 10% FBS والبنسلين/ستربتوميسين (1: 100).
- تمييع 2.5 ميكروغرام لكل ناقل بيفك إلى 500 ميليلتر من تعداء المخزن المؤقت (انظر الجدول للمواد) في أنبوب ميكروسينتريفوجي 1.5 مل.
- إضافة 10 ميليلتر من تعداء كاشف (انظر الجدول للمواد).
- دوامة الخليط ل 10 s، ثم بإيجاز أجهزة الطرد المركزي. احتضان لمدة 10 دقائق في درجة حرارة الغرفة.
- إضافة خليط تعداء الحمض النووي اللوحة، دروبويسي. احتضان الخلايا لمدة كافية من الزمن للبروتينات الانصهار بيفك للتفاعل والزهرة قابلة للطي ونضوج فلوروفوري، عموما ~ 8-24 ح.
ملاحظة: الإثارة الذروة لكوكب الزهرة هو 515 نانومتر، وعن الانبعاثات ذروتها هو 528 شمال البحر الأبيض المتوسط، على الرغم من أن هذا يعتبر سهولة استخدام مجهر فلوري قياسية لتصور الأسفار بروتينات فلورية خضراء.
3-نموذج إعداد
-
حصاد ليساتيس
- قبل جمع ليستي، إعداد "المخزن المؤقت لتحلل الخلية" [50 مم تريس-HCl (درجة الحموضة 7.4)، 150 مم كلوريد الصوديوم، 1 مم يدتا، 1% (v/v) المنظفات غير الأيونية (انظر الجدول للمواد)]. مخزن في 4 درجات مئوية.
- فورا قبل الحصاد، الملحق 10 مل من "المخزن المؤقت لتحلل الخلية" مع مثبط البروتياز ومثبط الفوسفاتيز (انظر الجدول للمواد). الاحتفاظ "المخزن المؤقت لتحلل الخلية" المكملة على الجليد.
- تغسل الخلايا مرتين في برنامج تلفزيوني المثلج. نضح في برنامج تلفزيوني وإضافة 1 مل من "المخزن المؤقت" تستكمل المثلج لتحلل الخلية. ضع الطبق على الجليد، وضمان المنتشرة على كامل مساحة المخزن المؤقت.
- احتضان على الجليد لمدة 5 دقائق تقريبا، ثم استخدم مكشطة خلية (انظر الجدول للمواد) لتتخلص من الخلايا ونقل إلى أنبوب ميكروسينتريفوجي مبردة مسبقاً 1.5 مل.
- إزالة الحطام الخلوية التي سينتريفوجينج جمعها في 18,000 ز × لمدة 5 دقائق في 4 درجات مئوية ونقل مسح المادة طافية في أنابيب ميكروسينتريفوجي الطازجة.
ملاحظة: عند هذه النقطة يمكن استخدامها فورا، أو تخزينها في-80 درجة مئوية. كما يوصي بالحفاظ قاسمة من النفط الخام ليستي بحيث يمكن التحقق من كفاءة تعداء وانجذاب تطهير.
-
انجذاب تطهير
ملاحظة: تتم خطوة العزلة بيكاب باستخدام نانوبودي بروتينات فلورية خضراء مترافق بالخرز [اغروس] (انظر الجدول للمواد).- إعداد الخرز [اغروس] بالغسيل حجم مناسب (20 ميليلتر كل عينة) + 10 ميليلتر الزائدة في 1 مل برنامج تلفزيوني. الطرد المركزي الخرز في 300 x ز وإزالة المادة طافية.
- إضافة 20 ميليلتر لكل عينة ليستي.
- احتضان العينات ح 2 في 4 درجات مئوية مع تناوب نهاية إلى نهاية.
ملاحظة: عند هذه النقطة العينات يمكن أن تعده للحزب الديمقراطي الصربي صفحة والنشاف الغربية، أو تحليل الطيف الكتلي.
-
إعداد الوانت بيكاب النشاف الغربية.
- الطرد المركزي الخرز في 300 × ز ويغسل ثلاث مرات في "المخزن المؤقت لتحلل الخلية".
- ريسوسبيند الخرز غسلها في 50 ميليلتر من العينة على النحو المناسب المخفف المخزن المؤقت (انظر الجدول للمواد) والحرارة في العينات من 95 درجة مئوية لمدة 2-3 دقائق.
ملاحظة: يمكن تخزين العينات أعد بهذه الطريقة في-20 درجة مئوية لعدة أشهر. - أداء الحزب الديمقراطي الصربي صفحة والغربية النشاف11 لكل من العلامة V1 و V2 العلامات (انظر الجدول للمواد)، كالبروتينات الأخرى فضلا عن أية تهم.
-
إعداد الوانت بيكاب الكتلي.
ملاحظة: للتحليل حسب كمية خالية من تسمية الطيف الكتلي (لفق) يوصي بإعداد العينات في على الأقل كوادروبليكاتي لضمان قوة إحصائية قوية.- الطرد المركزي الخرز في 300 × ز ويغسل ست مرات في "المخزن المؤقت لتحلل الخلية" دون المنظفات. وهذا ضروري لإزالة كل البروتين الزائد وأيضا المنظفات التي سوف تتداخل مع تحليل الطيف الكتلي. المضي قدما إلى الخطوة التالية مباشرة، أو تخزين الخرز في-80 درجة مئوية.
- تريبسينيزي الخرز في 60 ميليلتر المخزن المؤقت 1 [اليوريا م 2، 50 مم تريس-HCl (درجة الحموضة 7.5)، 5 ميكروغرام/مل التربسين]. تسمح الخرز لهضم لمدة 30 دقيقة في 27 درجة مئوية في ثيرموميكسير الهز 800 لفة في الدقيقة.
- باختصار الطرد المركزي الخرز، ثم جمع المادة طافية ونقل إلى أنابيب ميكروسينتريفوجي (انظر الجدول للمواد).
- أغسل الخرز في 25 ميليلتر المخزن المؤقت 2 [اليوريا م 2، 50 مم تريس-HCl (درجة الحموضة 7.5)، ديثيوثريتول 1 مم]، بغية الحد من البروتينات المرتبطة.
- تجميع الخرز والمادة طافية في أنبوب ميكروسينتريفوجي واحد. تسمح عملية الهضم تحدث بين عشية وضحاها في درجة حرارة الغرفة.
- الكيلات العينات بإضافة 20 ميليلتر من إيودواسيتاميدي (5 ملغ/مل في الماء عالي النقاوة) لكل عينة واحتضان في الظلام لمدة 30 دقيقة.
- تمنع عملية الهضم بمعاملة كل عينة مع 1 حامض trifluoroacetic ميليلتر (تفا). وسوف أسيديفي هذه الخطوة أيضا العينات في التحضير لمرحلة حاسمة.
- نصائح بناء المرحلة C18 بتراص طبقات 6 مم 1 المرحلة الصلبة استخراج C18 (أوكتاديسيل) أقراص غشاء (انظر الجدول للمواد) في تلميح ميكروبيبيتي 200 ميليلتر. يعد طرف واحد لكل عينة.
- نصائح المرحلة مع الميثانول الرطب، وحجته مع 50 ميليلتر 0.1% (v/v) تريفلورواسيتيك أسيد (تفا)، الاسيتو الانيتريل 80% (v/v).
- أغسل النصائح مع 50 ميليلتر 0.1% (v/v) تفا.
- تحميل الببتيدات المحمضة على نصائح المرحلة وثم الوت استخدام 0.1% (v/v) تفا، الاسيتو الانيتريل 80% (v/v) في خطوتين.
- تتبخر العينات باستخدام مركز فراغ.
- إذا لزم الأمر، بتخزين الببتيدات المجففة في-80 درجة مئوية.
4-الطيف الكتلي.
- ريسوسبيند عينات في 15 ميليلتر من حمض الفورميك 5%، 2% الاسيتو الانيتريل (في الماء عالي النقاوة).
- تحميل ميليلتر 6 إلى لوح LC والمكان بعناية في نظام [هبلك] نانولك (انظر الجدول للمواد).
- حزمة من 20 سم، 75 ميكرون القطر الداخلي العمود مع جزيئات المرحلة ثابتة 1.9 C18 ميكرومتر (انظر الجدول للمواد). تحميل 5 ميليلتر الببتيد على كل عمود.
- الوت الببتيدات استخدام تدرج خطي من الاسيتو الانيتريل في 250 nL/دقيقة أكثر من 140 دقيقة، وإدخال النترون مصيدة خطية (لتق) هجين مطياف شامل بالإضافة إلى النظام [هبلك] نانولك من نانوليكتروسبراي.
- جمع بيانات MS جنبا إلى جنب للايونات العشرة الأكثر وفرة في المسح الضوئي عبر تدرج وقت 140 دقيقة. بطريقة عشوائية بالترتيب لجمع البيانات وتبادل مع جيش صرب البوسنة بتشغيل بين كل عينة للتقليل من التحيز الزمانية.
5-تحليل
- معالجة البيانات الخام من مرض التصلب العصبي المتعدد باستخدام الإعداد الافتراضي داخل ماكسكوانت إصدار برنامج 1.2.7.4 وتحليل ماكسكوانت الإخراج باستخدام نسخة معدلة من التحليل الإحصائي بيرسيوس سير العمل في بيئة البرمجيات ص3.
ملاحظة: يتم تلخيص سير العمل التحليل الإحصائي من هذه النقطة في الشكل 2. بإيجاز، حولت كثافات لفق البروتينات المحددة باستخدام ماكسكوانت وتصفيتها متبوعاً بالتطبيع والإسناد. يتم تحديد البروتينات متفاعلة ديمر أزواج المقارنة مع عنصر تحكم فينوس، لاستبعاد موثقات الخلفية غير محدد، مع اختبار t للطالب وتصحيح هوشبيرغ بينجاميني لمقارنات متعددة. ويؤكد جودة البيانات مقارنات الفرد المدرج الإحصائي، والانحدار المتعدد، وتجميع التسلسل الهرمي.

رقم 2: مخطط سير العمل التحليل الإحصائي- الرسم التخطيطي لتدفق أنابيب التحليل الإحصائي المستخدمة لتحليل كثافة لفق البروتينات المحددة من البيانات الخام الكتلي معالجتها باستخدام ماكسكوانت. الأخضر مربعات: تصفية، مربعات زرقاء: مربعات التحول/تطبيع/القياس، البنى: بيانات مراقبة الجودة، والأصفر مربعات: مربعات التحليل، رمادية شبه كمي الاستبعاد/النسبية: التحليل الإحصائي. وهذا الرقم هو إعادة نشر فرومكروتشير et al.3 Reprinted بإذن من AAAS. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
النتائج
بعد استخدام جزئ الاستنساخ لتوليد من V1 و V2 معلم الجينات للفائدة مع البلازميدات بديست بيفك، تعداء المشارك من اثنين البلازميدات المحتوية على على زوج متفاعلة من البروتينات سيؤدي إلى توليد إشارة نيون فينوس بعد حوالي 8-24 ساعة. نظراً لغياب إشارة إيجابية من الممكن أن التفاعل الب...
Discussion
بيكاب وسيلة قوية لعزل dimers البروتين محددة مع استبعاد العناصر كل على حدة وعن الشركاء ملزمة المتنافسة3. بيكاب يستند على التكيف الأسفار المقايسة التكامل البروتين يسمى بيفك6. الأساليب القائمة، بما في ذلك فحوصات ربط بيفك وقربها، وقد استخدمت على نطاق واسع لوضع تصور وتح?...
Disclosures
الكتاب لا تمت بصلة إلى الكشف عن
Acknowledgements
D.R.C وهو "زميل نيو ساوث ويلز معهد السرطان" و D.N.S كان سابقا "زميل نيو ساوث ويلز معهد السرطان". ومولت نتائج البحوث التي قدمت في هذه المخطوطة سرطان معهد نيو ساوث ويلز (13/فرل/1/02 و 09/الدفاع المدني/2-39)، NHMRC (المشروع منحة GNT1052963)، و "مؤسسة العلوم" أيرلندا (11/رائدا/B2157)، مكتب نيو ساوث ويلز للعلوم والبحوث الطبية، الأسرة ضيف مؤسسة الأسرة اللوردات والزمالات. J.F.H. ور. س. وكانت الجهات المتلقية "منح الدراسات العليا الأسترالية".
Materials
| Name | Company | Catalog Number | Comments |
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid - Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) - 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
References
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved