JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
해 다중 단백질 신호 복합물 분자 보완성 친 화력 정화 (BiCAP)에 의해
요약
이 원고는 분자 보완성 친 화력 정화 (BiCAP)에 대 한 프로토콜을 설명합니다. 이 새로운 방법은 경쟁 바인딩 파트너와 함께 형성 된 복합물 뿐만 아니라 유엔 complexed 개별 단백질을 제외 하는 동안 특정 격리 및 어떤 두 상호 작용 단백질의 다운스트림 proteomic 특성화를 촉진 한다.
초록
단백질 복합물의 조립은 많은 세포 신호 통로의 규칙을 기본 중앙 메커니즘입니다. 어떻게 이러한 동적 단백질 복합물 특정 생물학 응답을 직접 하기 위해 여러 소스 로부터 신호를 통합 하 고 어떻게이 많은 질병 설정에서 폐지 된다 생물 의학 연구의 주요 초점 해독 됩니다. 이 주요 생 화 학적 메커니즘의 중요성에도 불구 하 고이 다 분자 신호 복합물의 구체적이 고 민감한 deconvolution을 촉진할 수 있다 실험적인 기술의 부족이 이다.
여기이 단점 분자 보완성 친 화력 정화 (BiCAP) 불리는 우리 나 란 특정 nanobody는 단백질 보완성 분석 결과의 조합을 통해 해결 됩니다. 이 새로운 기술은 특정 격리 및 유엔 complexed 개별 단백질과 경쟁 바인딩 파트너와 함께 형성 하는 복합물의 배타에 상호 작용 단백질의 어떤 쌍 든 지의 다운스트림 proteomic 특성화를 촉진 한다.
BiCAP 기술은 다양 한 다운스트림 실험적인 분석 실험에 이며이 기술에서 제공 하는 특이성의 고차 수 더 nuanced 조사 단백질 복잡 한 어셈블리의 역학에 현재 가능한 것 보다 사용 하 여 표준 선호도 정화 기술입니다.
서문
단백질 복잡 한 어셈블리 많은 신호 경로1,2의 spatiotemporal 특이성을 유지 하는 핵심 과정 이다. 이 규제 역할의 중요 한 특성은 넓게 인식 된다, 그러나 실험적인 기술이이 단지 유심히 사용할 수의 부족이 이다. 대부분 상호작용체학 연구 개별 단백질, 또는 개별 복잡 한 부품의 순차 농축 상호 작용에 초점. 여기 선물이 특정 단백질 이합체의 고립에 대 한 기술 파트너3바인딩 경쟁 형성 복합물 뿐만 아니라 구성 요소 단백질의 개별 moieties 제외 하는 동안. 우리는이 기술을 라는 분자 보완성 친 화력 정화 (BiCAP), 그것은 기존 단백질 조각 보완성 분석 결과의 분자 형광 보완성 (BiFC), 조합의 소설 사용을 GFP와 그 파생 상품 나 란 특정 재조합 nanobody (참조 테이블의 재료).
전형적인 단백질 조각 보완성 분석 결과 분할 luciferase4, β-galactosidase5, 녹색 형광 단백질 (GFP)6 ( 등 기자 들의 파편을 융합 하는 "미끼" 및 "먹이" 단백질의 표현에 사용 그림 1A). 미끼와 먹이 단백질의 상호 작용을 통해 분할 기자 도메인, 미끼의 상호 작용을 허용 하는 기능 구조로 refold 및 시각에 계량 단백질을 먹이 것이 좋습니다. BiCAP 만든이 기술은의 버전에서 적응 시켰다 GFP 변종 비너스의 조각을 사용. 형광 단백질 보완성 분석 실험은 살아있는 세포에 있는 단백질 단백질 상호 작용을 시각화를 위한 인기 있는 방법 하지만 지금까지이 하나의 함수7로 제한 되었습니다. BiCAP 나타냅니다 중요 한 사전을 이와 관련,이 기술은 뿐만 아니라 시각화, 하지만 또한 격리와 심문 결과 단백질 단백질 상호 작용의 수 있습니다.
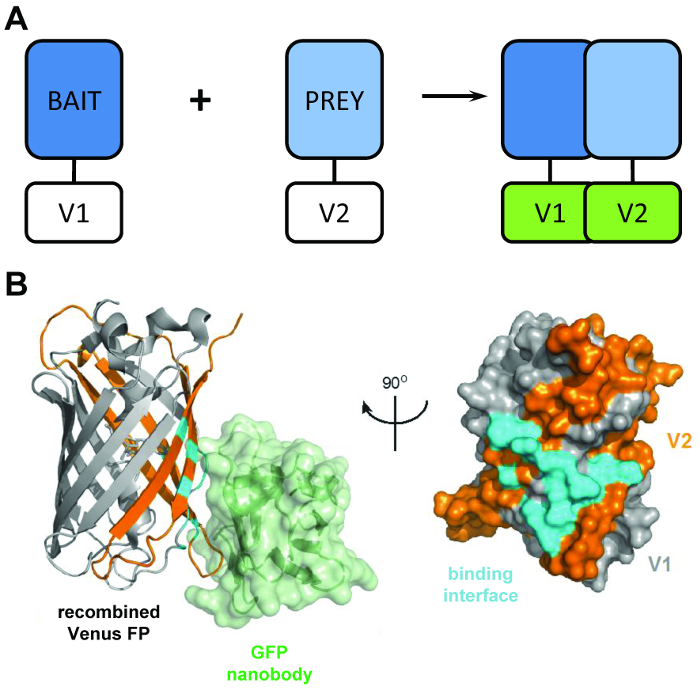
그림 1: BiCAP 기술 뒤에 구조 교장. (A) 회로도 분자 형광 보완성 표시 뒤에 교장 개요 '미끼' 그리고 '먹이' 단백질 태그로 N 맨끝 V1 또는 v 2의 C-터미널 전체 길이 금성 단백질의 파편. GFP nanobody (녹색)과 재결합 금성, (회색) V1 및 V2 (오렌지) 조각 (PDB 취득 3OGO)의 위치를 보여주는 사이 상호 작용 인터페이스 (사이안)의 (B) 구조 분석. 이 그림은 재 fromCroucher 외3 Reprinted AAAS 허가입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
기법 BiCAP 선호도 낮은 수준의 상호 작용 그들의 퓨전 파트너 사이 발생 하지 않는 한 연관 금성 (v 1과 v 2 라는)의 2 개의 비 형광 파편의 사용 합니다. 이 경우 두 개의 분할 도메인 refold fluorophore (그림 1B)6의 기능 β 배럴 구조. BiCAP의 주요 혁신 재조합 GFP nanobody, β-총 신 GFP (금성 같은 변종)의 재결합 올바르고 접힌 fluorophore ( 에만에 3 차원 epitope를 인식의 소개에서 온다 그림 1B)8. 결정적인 GFP nanobody 개별 비너스 조각 중 하나에 바인딩할 하지 않습니다. 이 두 가지 단백질의 그들의 자신의 지, 그 취득 하는 방법에서 화학적으로 유도 된, 강제 상호 작용9의 사용 보다 더 대표적인 결과 복잡 한 형성 후에 단백질 이합체의 분리를 촉진 한다.
BiCAP 다운스트림 응용 프로그램 역할 이러한 단지 신호 변환에서의 우리의 이해의 세분성을 향상 시킬 수와 잠재적으로 결합 될 수 있는 다중 단백질 복합물에 특히 초점을 맞추고 있는 강력한 기술입니다. . 그것은 또한 단백질 상호 작용 제자리의 시각화를 허용의 중요 한 기능을 포함. 날짜 하려면, BiCAP 수용 체 티로신 키 니 아 제 (RTK) 이합체3위하여 분석의 효과적인 방법으로 입증 되었습니다 하지만이 방법의 적응성 거의 모든 단백질 상호 작용의 맥락에서 채택 될 수 있다.
프로토콜
1. 플라스 미드 복제
참고: N-말단 이나 C-말단 관심사의 유전자의 융합 V1 또는 v 2 태그와 플라스 미드 벡터 생성, BiFC 대상 벡터 입금 되었습니다 Addgene와 [N 맨끝 태그: pDEST-V1-ORF (#73635), pDEST-V2-ORF (#73636). 태그 C 터미널: pDEST-ORF-V1 (#73637), pDEST-ORF-V2 (#73638)]. 관심사의 유전자/s 복제 진행 정지 codons 없이 특정 재조합 호환 항목 벡터 (즉, pDONR223 또는 pENTR221), 복제에 있이 필요 합니다. 많은 호환 클론 이미 포유류 게놈 컬렉션 (https://genecollections.nci.nih.gov/MGC/)를 포함 한 다양 한 플라스 미드 컬렉션 내에서 사용할 수 있습니다.
- 적절 한 BiFC 대상 벡터의 attR 사이트 사이 관심사의 유전자를 삽입 하는 재결합 반응을 수행.
- 0.2 mL 튜브에 150 ng 항목 벡터, 150 ng BiFC 대상 벡터, 그리고 8 µ L TE 버퍼 (pH 8.0)를 추가 합니다.
- 2 µ L recombinase 효소 혼합 추가 ( 재료의 표참조). 잘 혼합 하 고 짧게 원심.
- 하룻밤 실 온에서 또는 16 ° C에서 1 시간에 대 한 반응을 품 어.
- 1 µ L 성분을 K 솔루션을 추가 하 고 10 분 동안 37 ° C에서 배양 하 여 반응을 중지.
- 열-충격-유능한 세포 ( 재료의 표참조) LR 반응 제품으로 변환:
참고: 모든 기본 변형 알만 사용할 수 있습니다이 시점에서 Ccdb 항 독 소, 삽입을 포함 하는 플라스 미드의 특정 선택 방지 하는 포함 되어 있지 않습니다.- 얼음에 유능한 세포를 해 동 하 고 14 mL 둥근 바닥의 폴 리 프로필 렌 튜브에 세포의 50 µ L를 전송.
- 셀에 반응 제품의 1 µ L을 추가 하 고 부드럽게 혼합. 얼음에 20 분 동안 품 어.
- 열 충격 45 42 ° C 물 목욕에 미 2 분 동안 얼음에 즉시 반환.
- LB 매체 1 mL을 추가 하 고 1 시간 동안 37 ° C에서 흔들어와 품 어.
- 암 피 실린 포함 하 10 cm 한 천 격판덮개에 변환 접시 (100 µ g/mL)와 하룻밤 37 ° C에서 품 어.
- BiFC 플라스 미드의 정화입니다.
- 개별 식민지에서 플라스 미드 정화, 큰 원뿔 플라스 크를 파운드 미디어의 100 mL를 추가 하 고 추가 암 피 실린 (100 µ g/mL). 여러 식민지에, 14 mL 둥근 바닥 폴 리 프로필 렌 튜브에 파운드 미디어의 5 mL을 추가 하 고 추가 암 피 실린 (100 µ g/mL).
- 살 균 접종 루프를 사용 하 여 한 천 배지에서 단일 식민지 선택. LB 미디어로 접종 루프를 놓고 짧게 혼합 합니다.
- 알루미늄 호 일 원뿔 플라스 크의 상단을 커버 하 고 떨고와 37 ° C에서 밤새 품 어.
- Transfection 학년 플라스 미드 DNA는 표준 maxiprep 또는 midiprep 플라스 미드 DNA를 사용 하 여 생산 정화 키트 ( 재료의 표참조)10. 흡 광도 스펙트럼에 의해 DNA의 품질을 평가 합니다.
참고: DNA는 A260/A280 비율이 있어야 > 1.8와 A260/A230 비 > 2.0. 이 시점에서, 화면 삽입 및 태그의 효율적인 표현에 대 한 검사를 여러 개의 개별 식민지 하는 것이 좋습니다.
2. 세포 배양과 Transfection
참고: BiFC 벡터의 transfection에 대 한 그것은 높은 효율과 비교적 동질적인 transfection를 달성 하는 것이 중요입니다. 벡터 어떤 표준 transfection 시 약, 호환 됩니다 그리고 transfection 조건에 따라 최적화 되어야 합니다. 질량 분석을 수행 하려면 우리가 일반적으로 10cm 요리 내 셀이 수 또한 될 비례 축소 된 작은 요리 또는 더 적은 물자를 필요로 하는 실험에 대 한 번호판을 비록 문화.
- FBS 및 페니실린/스 (1: 100) 씨 1.0 × 106 HEK293T 셀 10 cm에 10% 보충 DMEM 미디어의 10 mL와 함께 요리.
- Transfection 버퍼의 500 µ L로 각 BiFC 벡터의 2.5 µ g을 희석 ( 재료의 표참조) 1.5 mL microcentrifuge 튜브에서.
- 10 µ L transfection 시 약의 추가 ( 재료의 표참조).
- 10 s, 후 간단히 원심 분리기 소용돌이 혼합물. 실 온에서 10 분 동안 품 어.
- 접시에 dropwise DNA transfection 혼합물을 추가 합니다. 시간의 BiFC 퓨전 단백질 상호 작용을 위한 접는 금성, fluorophore 성숙, 일반적으로 8 ~ 24 h에 대 한 충분 한 길이 대 한 셀을 품 어.
참고: 금성에 대 한 피크 여기는 515 nm, 그리고 그것의 피크 방출은 528 nm, 비록이 GFP 형광을 시각화 하도록 설정 표준 형광 현미경을 사용 하 여 볼 쉽게입니다.
3. 샘플 준비
-
Lysates 수확
- Lysate 컬렉션, 사전 준비 세포 세포의 용 해 버퍼 [50 mM Tris HCl (pH 7.4) 150 mM NaCl, 1 mM EDTA, 1% (v/v) 비 이온 세제 ( 재료의 표참조)]. 4 ° c.에 게
- 수확 직전 프로 테아 제 억제 물과 인산 가수분해 효소 억제 물 ( 재료의 표참조) 세포 세포의 용 해 버퍼의 10 mL를 보충. 얼음에 보충된 세포 세포의 용 해 버퍼를 유지 합니다.
- 얼음 처럼 차가운 PBS에 두 번 세척 세포입니다. PBS를 발음 하 고 차가운 보충된 세포 세포의 용 해 버퍼의 1 mL를 추가 합니다. 얼음에 접시를 놓고, 전체 영역에 걸쳐은 버퍼를 확보.
- 약 5 분 동안 얼음에서 알을 품고 다음 셀 스 크레이 퍼를 사용 하 여 ( 재료의 표참조) 세포를 긁어와 미리 냉장된 1.5 mL microcentrifuge 튜브를 전송.
- 수집 centrifuging 세포질 파편 제거 lysate 18000에 4 ° C와 전송 5 분 × g 신선한 microcentrifuge 튜브로 상쾌한을 허가.
참고:이 시점에서 lysate 하거나 사용할 수 있습니다, 즉시-80 ° c.에 저장 그것은 또한 transfection 그리고 친 화력 정화의 효율성 유효성을 검사할 수 있도록 lysate 원유의 약 수를 유지 하 것이 좋습니다.
-
친 화력 정화
참고: BiCAP 격리 단계 ( 재료의 표참조) agarose 구슬에 활용 된 GFP nanobody를 사용 하 여 수행 됩니다.- Agarose 구슬 1 ml PBS (샘플 당 20 µ L) + 10 µ L 초과 적절 한 볼륨을 세척 하 여 준비 합니다. 300 x g에서 구슬 원심 고는 상쾌한을 제거 합니다.
- 각 lysate 샘플 20 µ L를 추가 합니다.
- 엔드-투-엔드 회전 4 ° C에서 2 시간에 대 한 샘플을 품 어.
참고:이 시점에서 샘플 수 준비 SDS 페이지와 서 부 럽, 또는 분석에 대 한 질량 분석에 의해.
-
서쪽에 게 더 럽 히기 위한 BiCAP eluant의 준비입니다.
- 세포 세포의 용 해 버퍼에 세 번 세척 하 고 g x 300에 구슬 원심
- 적절 하 게 희석된 샘플 버퍼의 50 µ L에 씻어 구슬 resuspend ( 재료의 표참조)과 2-3 분 동안 95 ° C에서 샘플을 열.
참고: 샘플 준비를이 방식으로 저장할 수 있습니다-20 ° C에서 몇 달 동안. - SDS 페이지 및 관심의 잘 다른 단백질으로 v 1 태그 및 v 2 태그 ( 재료의 표참조),11 를 더럽혀 서 수행 합니다.
-
질량 분석에 대 한 BiCAP eluant의 준비입니다.
참고: 적어도에서 샘플을 준비 하는 것이 좋습니다 레이블 없는 양적 (LFQ) 질량 분석에 의해 분석을 위한 강력한 통계적 인 힘을 위해 quadruplicate.- 300 x g와 세척 세제 없이 세포 세포의 용 해 버퍼에 6 번에서 구슬을 원심합니다 이것은 모두 과잉 단백질 및 질량 분석 분석을 방해할 것 이다 세제를 제거 하는 데 필요한입니다. 즉시 다음 단계를 진행 하거나 저장-80 ° C. 에서 구슬
- 60 µ L에 구슬 trypsinize 버퍼 1 [2 M 요소, 50 mM Tris HCl (pH 7.5), 5 µ g/mL의 트립 신]. 구슬 800 RPM에서 떨고 thermomixer에서 27 ° C에서 30 분 동안 소화 하실 수 있습니다.
- 짧게 구슬, 원심 다음 상쾌한 및 전송 microcentrifuge 튜브 ( 재료의 표참조)를 수집 합니다.
- 25 µ L에 구슬 워시 버퍼 2 [2 M 요소, 50 mM Tris HCl (pH 7.5), 1 m m dithiothreitol], 바운드 단백질을 줄이기 위해.
- 하나의 microcentrifuge 튜브에 구슬과 상쾌한 수영장. 하룻밤 실 온에서 발생 하는 소화를 허용 합니다.
- 각 샘플을 iodoacetamide (초순에 5 mg/mL)의 20 µ L을 추가 하 여 샘플을 알 고 30 분 동안 어둠 속에서 품 어.
- 각 샘플 1 µ L trifluoroacetic 산 (TFA)를 치료 하 여 소화를 억제 합니다. 이 단계 또한 준비 단계 팁에 대 한 샘플 시 어 지 다 것입니다.
- 구문 C18 무대 누적 6 레이어에 의해 1mm 고체 상 추출 C18 (Octadecyl) 막 디스크 ( 재료의 표참조) 200 µ L micropipette 팁에 팁. 각 샘플에 대 한 하나의 팁을 준비 합니다.
- 메탄올, 함께 무대 팁 습식 및 50 µ L 0.1% (v/v) trifluoroacetic 산 (TFA), 80% (v/v) 이기 equilibrate.
- 50 µ L 0.1% (v/v) TFA 팁 세척.
- 무대 끝에 acidified 펩 티 드를 로드 하 고 elute 0.1% (v/v) TFA, 80% (v/v) 이기에 두 단계를 사용 하 여.
- 진공 집중 장치를 사용 하 여 샘플을 증발.
- 필요한 경우, 저장-80 ° c.에 건조 펩 티 드
4. 질량 분석입니다.
- 5% 포 름 산, (초순)에서 2% 이기의 15 µ L에서 샘플을 resuspend.
- 신중 하 게 nanoLC HPLC 시스템에는 LC 접시 및 장소에 6 µ L 로드 ( 재료의 표참조).
- 팩을 20 cm, 75 µ M 내부 직경 열 1.9 µ m C18 고정 단계 입자 ( 재료의 표참조). 각 열에 5 µ L 펩타이드를 로드 합니다.
- Elute 펩 티 드 분 250 nL/140 분 이상 이기의 선형 그라디언트를 사용 하 고 nanoelectrospray에 의해 nanoLC HPLC 시스템에 결합 된 선형 트랩 Quadropole (LTQ) 하이브리드 질량 분석기로 소개.
- 140 분 시간 그라데이션을 통해 스캔 당 톱 10 가장 풍부한 이온에 대 한 협동 MS 데이터를 수집 합니다. 일시적인 바이어스를 최소화 하기 위해 각 샘플 사이의 실행 하는 BSA와 데이터 수집 및 교환 순서를 무작위.
5입니다. 분석
- MaxQuant 소프트웨어 버전 1.2.7.4에서 기본 설정을 사용 하 여 원시 MS 데이터를 처리 하 고 MaxQuant R 소프트웨어 환경3에서 수정 된 버전의 페르세우스 통계 분석 워크플로 사용 하 여 출력을 분석.
참고:이 시점에서 통계 분석 워크플로 그림 2에 요약. 간단히, LFQ 농도 MaxQuant를 사용 하 여 식별 하는 단백질의 변형 되며 정규화와 돌리기 뒤 필터링. 상호 작용 단백질 이합체 쌍의 학생의 t 시험 및 Benjamini Hochberg 보정 여러 비교에 대 한 일반적인 배경 바인더 제외, 금성 컨트롤 비교해보면 식별 됩니다. 데이터 품질은 개별 히스토그램, 다중 회귀, 그리고 계층적 클러스터링의 비교에 의해 확인 됩니다.

그림 2: 통계 분석 워크플로 개요. MaxQuant를 사용 하 여 처리 하는 원시 질량 분석 데이터에서 확인 된 단백질의 LFQ 농도 분석 하는 데 사용 하는 통계 분석 파이프라인의 흐름 다이어그램. 녹색 상자: 필터링, 파란색 상자: 변환/정상화/스케일링, 갈색 상자: 데이터 품질 관리, 노란색 상자: 반 정량 제외/비교 분석, 회색 상자: 통계 분석. 이 그림은 재 fromCroucher 외3 Reprinted AAAS 허가입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
결과
재결합 v 1과 v 2의 생성을 복제의 사용에 따라 BiFC pDEST 플라스 미드를 가진 관심사의 유전자, 단백질의 상호 작용 쌍을 포함 하는 두 개의 플라스 미드의 공동 transfection 후 금성 형광 신호 생성 될 수 약 8-24 시간입니다. 수에서 단백질 상호 작용 셀 라인의 선택으로 인해 발생 될 수 있습니다 긍정적인 신호가 없을 경우에는 낮은 transfection 효율 또는 BiFC 태그의 방향을 하지 ...
토론
BiCAP 개별 구성 요소와 그들의 경쟁 바인딩 파트너3을 제외 하는 동안 특정 단백질 이합체를 격리 하기 위한 강력한 방법입니다. BiCAP은 BiFC6라는 형광 단백질 보완성 분석 결과의 적응을 기반으로 합니다. BiFC와 근접 결 찰 분석을 포함 하 여 기존 방법 시각화 하 고 라이브 셀7상호 작용 단백질 정량에 광범위 하 게 사용 되었습니다 하지만 격리...
공개
저자 공개할 게 없다
감사의 말
D.R.C 암 연구소 NSW 동료 이며 D.N.S 이전 암 연구소 NSW 동료 이었다. 이 원고에 제시 하는 연구 결과 암 연구소 NSW (13/FRL/1-02과 09/CDF/2-39), NHMRC (프로젝트 그랜트 GNT1052963), 과학 재단 아일랜드 (11/SIRG/B2157), 뉴 사우스 웨일즈 과학 및 의료 연구, 이용 가족에 의해 투자 되었다 친목 그리고 모스 틴 가족 재단입니다. J.F.H.와 텍 오스트레일리아 대학원 포상의 수령인 이었다.
자료
| Name | Company | Catalog Number | Comments |
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid - Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) - 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
참고문헌
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유