Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bimolecular tamamlayıcı benzeşme arıtma (BiCAP) tarafından parçalanmış çok protein sinyal kompleksleri
Bu Makalede
Özet
Bu el yazması Bimolecular uluslara benzeşme arıtma (BiCAP) protokolünü açıklar. BM complexed bireysel proteinler hem de konut projeleri hariç rakip bağlama ortaklarıyla oluşan iken bu roman yöntemi belirli yalıtım ve aşağı akım proteomik karakterizasyonu herhangi bir iki etkileşen proteinlerin kolaylaştırır.
Özet
Protein kompleksleri Meclisi birçok hücre yolları sinyal düzenlenmesi temel merkezi bir mekanizmadır. Biyomedikal araştırma önemli bir odak noktası bu dinamik protein kompleksleri sinyalleri birden fazla kaynaktan doğrudan belirli bir biyolojik tepki için entegre hareket nasıl ve ne kadar bu birçok hastalığın ayarlarında kuralsız olur deşifre. Bu anahtar biyokimyasal mekanizması önem rağmen bu çok moleküler sinyal kompleksleri Özel ve hassas deconvolution kolaylaştırabilir Deneysel teknikler eksikliği vardır.
Burada bu eksiklik bir protein uluslara tahlil Bimolecular uluslara benzeşme arıtma (BiCAP) olarak adlandırdığı bir uyum özel nanobody ile birleşimi yoluyla ele alınmaktadır. Bu roman tekniği etkileşen proteinler, BM complexed bireysel proteinler ve rakip bağlama ortakları ile oluşturduğu kompleksler hariç herhangi bir çiftin malzemelerin belirli yalıtım ve aşağı akım proteomik kolaylaştırır.
BiCAP teknik aşağı akım deneysel deneyleri geniş bir dizi için uyarlanabilir ve bu tekniği ile tanınan özgüllüğü yüksek derecede Şu anda mümkün olduğundan daha farklı yaklaşımlar içeren soruşturmalar protein kompleksi derleme mekaniği sağlar kullanarak Standart benzeşme arıtma teknikleri.
Giriş
Protein kompleksi derleme birçok sinyal verme yolları1,2kronolojik zamanmekansal özgüllük korumada önemli bir süreçtir. Bu düzenleyici rol kritik doğası tanınmış ise Deneysel teknikler bu komplekslerin ince eleyip sık dokumak kullanılabilir bir eksikliği. En interactomics çalışmaları bireysel proteinler veya karmaşık bileşenleri tek tek sıralı zenginleştirme ile etkileşimleri üzerine odaklanır. Burada bireysel moieties bileşen proteinler hem de konut projeleri hariç ortakları3bağlama rekabet ile oluşan iken bir teknik belirli protein dimer yalıtım için mevcut. Biz bu teknik çağrıda bulundular Bimolecular uluslara benzeşme arıtma (BiCAP), olduğu gibi bir arada bir önceden varolan protein parçası uluslara testin, Bimolecular floresan uluslara (BiFC), roman kullanımı ile bir GFP ve türevleri doğru biçimi özgü rekombinant nanobody (bkz: malzemeler tablo).
Luciferase4, β-galaktozidaz5veya yeşil flüoresan protein (GFP)6 ( gibi gazetecilere parçaları bölmek erimiş "yem" ve "av" proteinlerin ifade tipik protein-fragment uluslara tahlil dayanan Şekil 1A). Yem ve av protein etkileşimi, split muhabir etki alanları yem etkileşim sağlayan bir işlev yapısı içinde refold ve proteinler görüntülenir veya sayısal için av için teşvik edilir. BiCAP yapılan bu teknik bir sürümünden adapte GFP değişken Venüs parçaları kullanın. Floresan protein uluslara deneyleri canlı hücrede protein-protein etkileşimleri görselleştirmek için popüler bir yöntemdir, ancak şimdiye kadar bu bir işlev7' ye sınırlı olmuştur. Bu teknik sadece görselleştirme, ama aynı zamanda yalıtım ve sorgulama elde edilen protein-protein etkileşim sağlar gibi BiCAP bu bağlamda, önemli bir ilerleme temsil eder.
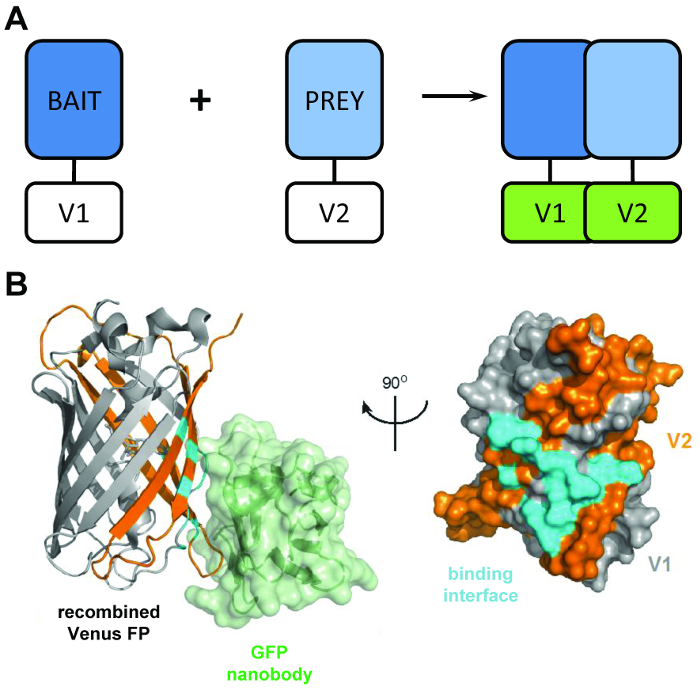
Şekil 1: BiCAP teknik arkasında yapısal müdür. (A) bimolecular floresan uluslara gösteren arkasında asıl özetleyen bir şematik 'yem' ve 'av' proteinler N-terminal V1 veya C-terminal V2 ile tam uzunlukta Venüs protein parçaları öğesini. (B) yapısal analizi GFP nanobody (yeşil) ve (gri) V1 ve V2 (turuncu) parçaları (PDB katılım 3OGO) konumunu gösteren recombined Venüs arasındaki etkileşim arayüzü (Camgöbeği). Bu rakam yayımlanamaz fromCroucher vd3 Reprinted AAAS izniyle olduğunu. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Füzyon eşleri arasında bir etkileşim oluşur sürece benzeşme düşük bir derece ile ilişkilendirmek iki floresan sigara parçaları (V1 ve V2 olarak adlandırılır) Venüs'ün Kullanım tekniği yapar BiCAP. Bu durumda, iki bölünmüş etki alanı fluorophore (Şekil 1B)6fonksiyonel β-varil yapısına refold. BiCAP anahtar yenilik β-sadece düzgün recombined ve katlanmış fluorophore ( üzerinde mevcut olan varil üzerinde GFP (ve Venüs gibi varyantların) üç boyutlu epitope tanır rekombinant GFP nanobody getirilmesi gelir Şekil 1B)8. En önemlisi, GFP nanobody ya bireysel Venüs parçaları bağlanmaz. Sadece iki protein o yapmak metotlarından alınan kimyasal kaynaklı, zorla etkileşim9/ kullanma daha fazla temsilcisi sonuç için önde gelen kendi iradesiyle bir kompleks oluşmuş sonra bu protein dimer yalıtım kolaylaştırır.
BiCAP özellikle potansiyel taneciklik'Bu komplekslerin sinyal iletimi içinde oynadıkları rolü anlayışımızı geliştirmek için aşağı akım uygulamaları bir dizi ile birlikte çok protein kompleksleri üzerinde duruluyor güçlü bir tekniktir . Ayrıca protein etkileşimler içinde in situgörselleştirme sağlayan önemli bir özelliği kapsar. Bugüne kadar BiCAP reseptör Tirozin kinaz (RTK) dimer3interactome analiz etkili bir yöntem gösterilmiştir, ama bu yöntemin uyum yeteneği hemen hemen her protein etkileşimi bağlamında kabul edilmesi anlamına gelir.
Protokol
1. plazmid klonlama
Not: N-terminus veya C-terminus gen ilgi için erimiş V1 veya V2 Tags plazmid vektörel çizimler oluşturmak için BiFC hedef vektörel çizimler Addgene ile yatırılan [N-terminal etiket: pDEST-V1-ORF (#73635), pDEST-V2-ORF (#73636). C-terminal etiket: pDEST-ORF-V1 (#73637), pDEST-ORF-V2 (#73638)]. Gen/s ilgi belirli rekombinasyon uyumlu giriş vektörel çizimler (Örneğin, pDONR223 veya pENTR221), klonlama klonlama ile devam etmek için stop kodon olarak olmadan olması gerekecektir. Pek çok uyumlu klon zaten memeli genom koleksiyonu (https://genecollections.nci.nih.gov/MGC/) de dahil olmak üzere çeşitli plazmid koleksiyonları içinde mevcuttur.
- Gen uygun BiFC hedef vektör attR siteler arasında ilgi eklemek için Rekombinasyon tepkimesi gerçekleştirin:
- 0.2 mL tüp içinde 150 ng giriş vektör, 150 ng BiFC hedef vektör ve 8 µL TE arabellek (pH 8.0) ekleyin.
- 2 µL recombinase enzim karışımı ekleyin ( Tablo malzemelerigörmek). Mix iyi ve kısa bir süre santrifüj kapasitesi.
- Gecede tepki 1s oda sıcaklığında veya 16 ° c için kuluçkaya.
- 1 µL İndinavir-K çözüm ekleyip 10 dakika 37 ° C'de kuluçka tepki bırak.
- (Bkz. Tablo reçetesi) LR reaksiyon ürünü Isı şok yetkili hücrelerle dönüşümü:
Not: o does değil içermek plazmid INSERT içeren özel seçimi önleyecek Ccdb antitoksin sürece herhangi bir temel yük bu noktada makulen kullanılabilir.- Yetkili hücreler buz çözme ve hücre 50 µL 14 mL yuvarlak popolu polipropilen boru aktarın.
- Reaksiyon ürünü 1 µL hücrelere ekleyin ve karışımı yavaşça. Buz üzerinde 20 dk için kuluçkaya.
- Isı şok 42 ° C su banyosunda 45 için s. 2 min için buz hemen dönüş.
- 1 mL LB medya ekleyin ve 1 h için 37 ° C'de sallayarak ile kuluçkaya.
- Dönüşümün ampisilin içeren 10 cm agar plaka üzerine plaka (100 µg/mL) ve 37 ° C'de gecede kuluçkaya.
- BiFC plazmid arıtma.
- Plazmid bireysel bir kolonisi gelen arındırmak için büyük bir konik şişesi 100 mL LB medya ekleyin ve ampisilin ekleyin (100 µg/mL). Birden çok kolonileri ekran için 14 mL yuvarlak popolu polipropilen borular için 5 mL LB medya ekleyin ve ampisilin ekleyin (100 µg/mL).
- Steril aşılama döngü kullanarak, bir koloni agar plaka almak. Aşı döngü LB ortamı yerleştirin ve kısa bir süre karıştırın.
- Konik şişeye alüminyum folyo ile üst kapak ve gecede 37 ° C'de sallayarak ile kuluçkaya.
- Transfection sınıf plazmid DNA bir standart maxiprep veya midiprep plazmid DNA kullanarak üretmek arıtma kiti (bakınız Tablo reçetesi)10. DNA kalitesi absorbans spectra ile değerlendirmek.
Not: DNA A260/A280 oranı olması gerekir > 1.8 ve bir A260/A230 oranı > 2.0. Bu noktada, bu verimli ifade Ekle ve etiket için kontrol etmek için birden fazla bireysel kolonileri ekran için tavsiye edilir.
2. hücre kültür ve Transfection
Not: BiFC vektörler transfection için bu yüksek verimlilik ve nispeten homojen transfection elde etmek önemlidir. Vektörler-ecek beğenmek var olmak herhangi bir standart transfection reaktif ile uyumlu ve transfection koşulları buna göre optimize edilmelidir. Her ne kadar bu da orantılı olarak daha küçük yemekler veya tabak daha az malzeme gerektirir deneyler için ölçeklendirilebilir kütle spektrometresi gerçekleştirmek için biz genellikle 10 cm yemekleri, içindeki hücreler kültür.
- Tohum 1,0 × 106 HEK293T hücreleri 10 cm ile 10 mL % 10 ile desteklenmiş DMEM medyanın FBS ve penisilin/streptomisin (1: 100) çanağı.
- Her BiFC vektör 2,5 µg transfection arabellek 500 µL seyreltik ( Tablo malzemelerigörmek) 1.5 mL microcentrifuge tüp içinde.
- Transfection reaktif 10 µL ekleyin ( Tablo malzemelerigörmek).
- Girdap karışımı 10 s, daha sonra kısaca santrifüj için. Oda sıcaklığında 10 dakika için kuluçkaya.
- DNA transfection karışımı dropwise plaka için ekleyin. Hücreler bir yeterli süreyi etkileşimine BiFC füzyon protein ve katlama Venüs ve fluorophore olgunlaşma, genellikle ~ 8-24 h için kuluçkaya.
Not: Venüs için en yüksek uyarma 515 olduğunu nm ve onun en yüksek emisyon olduğunu 528 nm, her ne kadar bu kolayca GFP floresans görselleştirmek için ayarlanan standart floresan mikroskop kullanarak görülüyor.
3. numune hazırlama
-
Lysates hasat
- Lysate koleksiyonu önce hücre lizis arabellek hazırlamak [50 mM Tris-HCl (pH 7,4), 150 mM NaCl, 1 mM EDTA, %1 (v/v) non-iyonik deterjan ( Tablo malzemelerigörmek)]. 4 ° C'de mağaza
- Hemen hasat öncesinde, hücre lizis arabellek 10 mL proteaz inhibitörü ve fosfataz inhibitörü ( Tablo malzemelerigörmek) ile ek. İlave hücre lizis arabellek buz üzerinde tutun.
- Buz gibi PBS hücrelerde iki kez yıkayın. PBS Aspire edin ve buz gibi ilave hücre lizis arabellek 1 mL ekleyin. Arabellek tüm yüzey alana yayılmış sağlanması buzda çanak yerleştirin.
- Buz yaklaşık 5 min için kuluçkaya sonra hücre kazıyıcı kullanın (görmek Malzemeler tablohücreleri scrape ve önceden soğutulmuş 1.5 mL microcentrifuge tüp aktarmak için).
- Toplanan centrifuging tarafından hücresel enkaz kaldırmak, 18.000 lysate × g 4 ° C ve transfer 5 min için temizlenmiş süpernatant taze microcentrifuge tüpler içine.
Not: Bu noktada lysate edilebilir hemen kullanılan, veya-80 ° C'de depolanan Ayrıca transfection ve benzeşme arıtma verimliliğini doğrulanabilir bir aliquot ham lysate tutmak için önerilir.
-
Benzeşme arıtma
Not: BiCAP yalıtım adım ( Tablo malzemelerigörmek) özel boncuk Birleşik GFP nanobody kullanılarak gerçekleştirilir.- Özel boncuk 1 mL PBS uygun bir birim (örnek başına 20 µL) + 10 µL aşırı yıkayarak hazırlayın. 300 x g de boncuk santrifüj kapasitesi ve süpernatant kaldırın.
- 20 µL lysate her örnek için ekleyin.
- Örnekler uçtan uca rotasyon ile 4 ° C'de 2 h için kuluçkaya.
Not: Bu noktada örnekleri SDS-sayfa ve western Blot veya çözümleme için kütle spektrometresi tarafından hazırlanmış olabilir.
-
Batı kurutma için hazırlık BiCAP eluant.
- Boncuk vasıl 300 x g ve yıkama üç kez içinde hücre lizis tampon santrifüj kapasitesi.
- Uygun şekilde seyreltilmiş örnek arabellek 50 µL içinde yıkanmış boncuk resuspend ( Tablo malzemelerigörmek) ve örnekleri için 2-3 dk 95 ° c ısı.
Not: Bu şekilde hazırlanan örnekleri birkaç ay için-20 ° C'de muhafaza edilebilir. - SDS-sayfa ve11 V1 etiketi ve V2 etiketleri ( malzemelerin tabloyabakın), faiz de karakterleri diğer proteinler kurutma Batı gerçekleştirin.
-
Kütle spektrometresi için BiCAP eluant hazırlanması.
Not: sağlam istatistiksel güç sağlamak için bu örnekleri en az hazırlamak için önerilir analizi için etiket içermeyen nicel (LFQ) kütle spektrometresi ile quadruplicate.- Boncuk vasıl 300 x g ve yıkama altı kez içinde hücre lizis tampon deterjan olmadan santrifüj kapasitesi. Bu hem aşırı protein ve kütle spektrometresi analizi ile müdahale edecek deterjan kaldırmak gereklidir. Hemen bir sonraki adıma geçin veya-80 ° C'de. boncuk depolamak
- 60 µL boncuklar trypsinize tampon 1 [2 M üre, 50 mM Tris-HCl (pH 7.5), 5 µg/mL tripsin]. 800 RPM'de sallayarak bir thermomixer 27 ° C'de 30 dk için sindirimi boncuk izin.
- Kısaca boncuk santrifüj kapasitesi sonra süpernatant ve transfer microcentrifuge tüpler ( Tablo malzemelerigörmek) toplamak.
- Boncuk 25 µL yıkama tampon ilişkili proteinler azaltmak için 2 [2 M üre, 50 mM Tris-HCl (pH 7.5), 1 mM dithiothreitol],.
- Boncuk ve süpernatant bir microcentrifuge tüpüne Havuzu. Gecede oda sıcaklığında gerçekleşmesi sindirim sağlar.
- Her örnek için iodoacetamide (Ultrasaf Su 5 mg/mL) 20 µL ekleyerek örnekleri alkylate ve 30 dakika için karanlıkta kuluçkaya.
- Sindirim her örnek 1 µL trifluoroacetic asitle (TFA) tedavisi ile inhibe. Bu adımı da örnekleri devrilme aşaması için hazırlık acidify.
- Yapı C18 sahne yığın 6 kat 1 mm katı faz ekstraksiyon C18 tarafından (Octadecyl) ( Tablo malzemelerigörmek) membran diskler 200 µL micropipette bahşiş ipuçları. Tek bir ipucu her örnek için hazırlayın.
- Metanol ile sahne ipuçları ıslak ve 50 µL % 0,1 (v/v) trifluoroacetic asit ile (TFA), % 80'i (v/v) Asetonitril equilibrate.
- İpuçları 50 µL % 0,1 (v/v) TFA ile yıkayın.
- Acidified peptidler sahne ipuçları üzerine yük ve %0,1 (v/v) TFA, % 80'i (v/v) Asetonitril iki adımda kullanarak elute.
- Vakum yoğunlaştırıcı kullanarak örnekleri buharlaşır.
- Gerekirse, kurutulmuş peptidler-80 ° C'de depolayın
4. kütle spektrometresi.
- Örnekleri 15 µL %5 formik asit, %2 Asetonitril (içinde Ultrasaf Su) resuspend.
- Dikkatle 6 µL üzerine bir LC plaka ve yer bir nanoLC HPLC sistemi içine yük ( Tablo malzemelerigörmek).
- Paketi bir 20 cm, 75 µM iç çap sütun 1.9 µm C18 durağan faz parçacıklar ( Tablo malzemelerigörmek) ile. 5 µL peptid her sütuna yerleştirin.
- Peptidler Asetonitril doğrusal bir gradyan 250 nL/dk az 140 dk kullanarak elute ve nanoelectrospray tarafından bir doğrusal tuzak Quadropole (LTQ) hibrid kütle spektrometre nanoLC HPLC sistemi için birleştiğinde içine tanıtmak.
- Tandem MS veri oranı en iyi 10 en bol iyonları için 140 dakikalık zaman degrade toplamak. Zamansal önyargı en aza indirmek için her örneği arasında çalıştırmak BSA ile veri toplama ve değişim sırasını rastgele.
5. analiz
- MaxQuant yazılım sürümü 1.2.7.4 içinde varsayılan ayarı kullanarak ham MS verileri işlemek ve değiştirilmiş sürümünü Perseus istatistiksel analiz iş akışı içinde R yazılım ortamı3kullanarak çıkış MaxQuant analiz.
Not: Bu noktadan istatistiksel analiz iş akışı Şekil 2' de özetlenmiştir. Kısaca, LFQ yoğunluklarını MaxQuant kullanarak tanımlanan proteinlerin değiştirdi ve normalleştirme ve itham tarafından izlenen filtre. Dimer çiftlerinin etkileşen proteinler ile öğrencinin t testi ve Benjamini-Hochberg düzeltme birden fazla karşılaştırmalar için spesifik olmayan arka plan bağlayıcı dışlamak için bir Venüs denetim yasland tanımlanır. Veri kalitesi karşılaştırmalar bireysel çubuk grafikler, çoklu regresyon ve hiyerarşik kümeleme tarafından onaylanır.

Şekil 2: anahat istatistiksel analiz iş akışının. Akış diyagramı LFQ yoğunluklarını MaxQuant kullanarak işlenmiş ham kütle spektrometresi verilerden tespit proteinlerin çözümlemek için kullanılan istatistiksel analiz boru hattı. Yeşil kutuları: filtreleme, mavi kutu: dönüşüm/Danimarkalıların/ölçekleme, kahverengi kutular: veri kalite kontrol, sarı kutuları: yarı kantitatif dışlama/karşılaştırmalı analizi, gri kutular: istatistiksel analiz. Bu rakam yayımlanamaz fromCroucher vd3 Reprinted AAAS izniyle olduğunu. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Sonuçlar
Rekombinasyon V1 ve V2 oluşturmak için klonlama kullanımını takip genlerin BiFC pDEST Plasmid'ler ile ilgi öğesini, iki plazmid proteinler etkileşen bir çifti içeren ortak transfection bir Venüs floresan sinyalden sonra nesil neden olur yaklaşık 8-24 saat. Bir olumlu sinyal protein etkileşim hücre kültürünü seçim nedeniyle meydana olabilir değil ki mümkün olmaması durumunda, düşük transfection verimlilik veya bu BiFC Etiketler yönünü en uygun değil. Bu senar...
Tartışmalar
BiCAP ise tek tek bileşenleri ve onların rakip bağlama ortaklar3hariç belirli protein dimer izole için güçlü bir yöntemdir. BiCAP BiFC6adı verilen bir floresan protein uluslara tahlil adaptasyonu üzerinde temel alır. Tüp ligasyonu deneyleri, BiFC ve yakınlık da dahil olmak üzere mevcut yöntemler görselleştirmek ve protein etkileşimleri canlı hücreleri7ölçmek için kapsamlı bir şekilde kullanılmış ama yalıtma ve oluşmuş...
Açıklamalar
Yazarlar ifşa yoktur
Teşekkürler
D.R.C Kanser Enstitüsü NSW adam ve D.N.S daha önce Kanser Enstitüsü NSW bursu aldı. Bu el yazması sunulan araştırma bulguları Kanser Enstitüsü NSW (13/FRL/1-02 ve 09/CDF/2-39), NHMRC (proje Grant GNT1052963), Bilim Vakfı İrlanda (11/SIRG/B2157), NSW Office Bilim ve tıbbi araştırma, Konuk aile tarafından finanse edilmiştir Arkadaş grubu ve Mostyn Aile Vakfı. J.F.H. ve R.S. alıcılar bir Avustralya yüksek lisans Ödülü...
Malzemeler
| Name | Company | Catalog Number | Comments |
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid - Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) - 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
Referanslar
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır