Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dissection multi-signalisation Complexes protéiques par Purification d’affinité de complémentation bimoléculaire (BiCAP)
Dans cet article
Résumé
Cet article décrit le protocole pour la Purification d’affinité de complémentation bimoléculaire (BiCAP). Cette nouvelle méthode facilite l’isolement spécifique et la caractérisation de la protéomique en aval de toute deux protéines qui interagissent, tandis que hors ONU complexée protéines individuelles ainsi que des complexes formés avec des partenaires de liaison concurrentes.
Résumé
L’Assemblée de complexes protéiques est un mécanisme central qui sous-tendent le règlement de nombreuses voies de signalisation de cellulaire. Un objectif majeur de la recherche biomédicale est déchiffrer comment ces complexes de protéine dynamique agissent pour intégrer les signaux provenant de plusieurs sources afin de diriger une réponse biologique spécifique, et comment cela devient déréglementé dans bien des cas de maladie. Malgré l’importance de ce mécanisme biochimique essentiel, il y a un manque de techniques expérimentales qui peuvent faciliter la déconvolution spécifique et sensible de ces complexes de signalisation moléculaires multiples.
Ici, cette lacune est adressée par la combinaison d’un dosage de complémentation protéique avec une conformation spécifique nanobody, que nous avons appelé bimoléculaire Purification d’affinité de complémentation (BiCAP). Cette nouvelle technique facilite l’isolation spécifique et la caractérisation de la protéomique en aval de n’importe quelle paire de protéines qui interagissent, à l’exclusion des protéines individuelles ONU complexée et complexes qui se forment avec des partenaires de liaison concurrentes.
La technique de BiCAP s’adapte à un large éventail d’essais expérimentaux en aval, et le haut degré de spécificité offerte par cette technique permet plus nuancées enquêtes sur la mécanique de l’assemblage complexe de protéine est actuellement possible à l’aide techniques de purification d’affinité standard.
Introduction
Assemblage complexe de protéine est un processus clé dans le maintien de la spécificité spatio-temporelle de nombreuses signalisation des voies1,2. Bien que la nature essentielle de ce rôle réglementaire est largement reconnue, il y a un manque de techniques expérimentales disponibles à scruter ces complexes. La plupart des études interactomique mettre l’accent sur les interactions avec les protéines individuelles, ou l’enrichissement séquentiel des composants complexes. Nous présentons ici une technique pour l’isolation d’un dimère de protéine spécifique tout en excluant les portions individuelles de la protéines composant, mais aussi les complexes formés avec liant les partenaires3en compétition. Nous avons appelé cette technique bimoléculaire Purification d’affinité de complémentation (BiCAP), telle qu’elle est une combinaison d’un dosage de complémentation de fragment protéique déjà existantes, bimoléculaire complémentation de Fluorescence (BiFC), avec la nouvelle utilisation d’un conformation spécifique nanobody recombinante vers GFP et de ses dérivés (voir Table des matières).
Une analyse de complémentation de fragment de protéine typique se fonde sur l’expression des protéines « appât » et « proie » fusionnés pour fractionner des fragments de reporters comme luciférase,4,5de la β-galactosidase ou protéine fluorescente verte (GFP)6 ( Figure 1 a). Par le biais de l’interaction des protéines appât et proies, les domaines de journaliste de split sont encouragés à replier dans une structure fonctionnelle, qui permet l’interaction de l’appât et de protéines pour être visualisées ou quantifié la proie. BiCAP a été adapté d’une version de cette technique qui fait utiliser des fragments de la variante GFP Venus. Protéine fluorescente complémentation dosages sont une méthode populaire pour la visualisation des interactions protéines-protéines dans une cellule en direct, mais jusqu'à présent ont été limitées à cette un fonction7. BiCAP représente une avancée significative à cet égard, car cette technique permet non seulement pour la visualisation, mais aussi l’isolement et l’interrogatoire de l’interaction protéine-protéine qui en résulte.
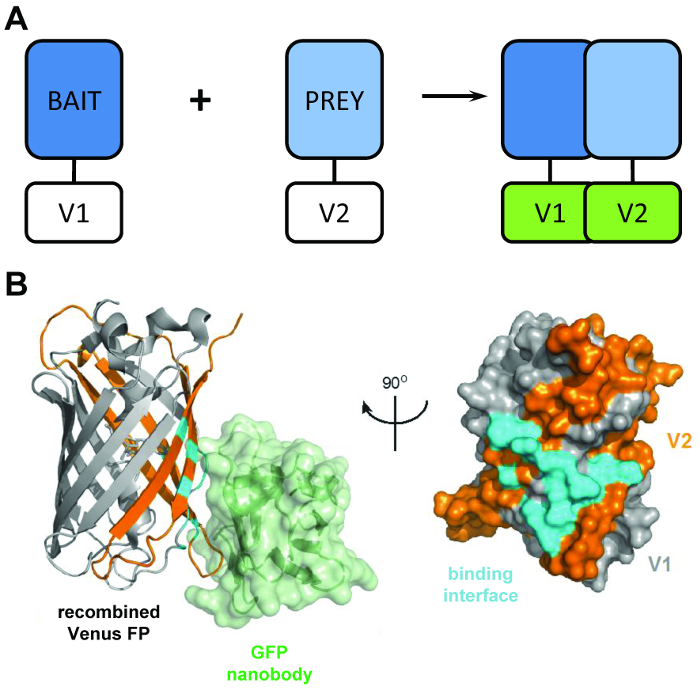
Figure 1 : le capital structurel derrière la technique BiCAP. (A) un schéma décrivant l’entité de sécurité derrière l’affichage de complémentation de fluorescence bimoléculaire les protéines « appât » et « proie » marquées par le N-terminal V1 ou V2 C-terminal des fragments de la protéine pleine longueur de Vénus. (B) analyse structurale de l’interface d’interaction (cyan) entre la GFP nanobody (vert) et Vénus recombinée, montrant la position de la V1 (gris) et des fragments de V2 (orange) (APB adhésion 3OGO). Ce chiffre est republié fromCroucher Al3 reproduit avec la permission de l’AAAS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Le BiCAP technique fait usage de deux fragments non fluorescent de Vénus (nommé V1 et V2), qui associent avec un faible degré d’affinité, à moins qu’une interaction se produit entre leurs partenaires en matière de fusion. Dans ce cas, les domaines deux split replier dans la structure fonctionnelle de la β-baril du fluorophore (Figure 1 b)6. L’innovation majeure de BiCAP provient de l’introduction de la recombinaison nanobody GFP, qui reconnaît un épitope en trois dimensions sur le β-Canon de GFP (et des variantes telles que Vénus) qui n’est présent que sur le fluorophore recombiné et correctement plié ( Figure 1 b)8. Fondamentalement, la GFP nanobody ne lie pas à un des fragments individuels Venus. Ceci facilite l’isolement des dimères de protéine qu’après que les deux protéines ont formé un complexe de leur propre gré, conduisant à des résultats plus représentatives que celles acquises des méthodes qui rendent l’utilisation de chimiquement induite, forcé les interactions9.
BiCAP est une technique puissante qui se concentre spécifiquement sur les complexes de protéines multiples, qui peuvent potentiellement être combinées avec un certain nombre d’applications en aval afin d’améliorer la granularité de notre compréhension du rôle à jouer ces complexes dans la transduction du signal . Elle englobe également la caractéristique importante de ce qui permet la visualisation des interactions de protéine in situ. A ce jour, BiCAP a été démontrée comme une méthode efficace d’analyse de l’interactome des récepteurs tyrosine kinase (RTK) dimères3, mais la capacité d’adaptation de cette méthode signifie qu’il pourra être adopté dans presque n’importe quel contexte d’interaction de protéine.
Protocole
1. plasmide clonage
NOTE : Pour générer des vecteurs de plasmide avec les balises V1 ou V2 fusionnées à l’extrémité N-terminale ou l’extrémité C-terminale du gène d’intérêt, les vecteurs de destination BiFC ont été déposés avec Addgene [tag N-terminale : pDEST-V1-ORF (#73635), pDEST-V2-ORF (#73636). C-terminal balise : pDEST-ORF-V1 (#73637), pDEST-ORF-V2 (#73638)]. Le gène/s d’intérêt devront être dans le clonage des vecteurs d’entrée compatible (par exemple, pDONR223 ou pENTR221), de recombinaison spécifique sans les codons stop, de procéder avec le clonage. Plusieurs clones compatibles sont déjà disponibles dans les différentes collections de plasmide, y compris la collecte de génome mammifère (https://genecollections.nci.nih.gov/MGC/).
- Effectuez une réaction de recombinaison pour insérer le gène d’intérêt entre les sites attR du vecteur BiFC destination approprié :
- Dans un tube de 0,2 mL, ajouter 150 ng entrée vecteur, vecteur de destination 150 ng BiFC et 8 µL de tampon de TE (pH 8,0).
- Ajoutez 2 µL recombinase enzyme mix (voir Table des matières). Bien mélanger et centrifuger brièvement.
- Incubez la réaction pendant 1 h à température ambiante ou à 16 ° C durant la nuit.
- Arrêter la réaction en ajoutant 1 µL de solution de protéinase-K et incuber à 37 ° C pendant 10 min.
- Transformer des cellules chaleur-choc-compétent (voir Table des matières) avec le produit de réaction de LR :
Remarque : N’importe quelle contrainte de base en théorie permet à ce stade, tant qu’il ne contient pas l’antitoxine CCETT, qui empêcherait la sélection spécifique des plasmides contenant l’insert.- Décongeler les cellules compétentes sur la glace et transférer 50 µL de cellules dans un tube en polypropylène à fond rond 14 mL.
- Ajouter 1 µL du produit de réaction aux cellules et mélanger doucement. Incuber pendant 20 min sur la glace.
- Chauffer un choc dans le bain-marie à 42 ° C pendant 45 s. retour immédiatement en glace pendant 2 min.
- Ajouter 1 mL de médias LB et incuber avec agitation à 37 ° C pendant 1 h.
- Plaque de la transformation sur une gélose de 10 cm contenant l’ampicilline (100 µg/mL) et incuber à 37 ° C pendant la nuit.
- Purification de plasmides BiFC.
- Pour purifier le plasmide d’une colonie individuelle, ajouter 100 mL de médias LB dans une fiole conique de grande et ampicilline (100 µg/mL). Pour plusieurs colonies de l’écran, ajouter 5 mL de médias LB à tubes en polypropylène à fond rond de 14 mL et ajouter l’ampicilline (100 µg/mL).
- À l’aide d’une anse à inoculation stérile, choisir une seule colonie de la gélose. Placez la boucle de l’inoculation dans les milieux LB et mélangez brièvement.
- Couvrez le dessus de la fiole conique avec du papier aluminium et incuber une nuit à 37 ° C sous agitation.
- Produire l’ADN plasmidique de grade transfection utilisant un standard maxiprep ou midiprep ADN plasmidique purification kit (voir Table des matières)10. Évaluer la qualité de l’ADN de spectres d’absorbance.
Remarque : L’ADN devrait avoir un ratio A260/A280 > 1.8 et un ratio A260/A230 > 2.0. À ce stade, il est recommandé d’éliminer plusieurs colonies individuelles pour rechercher une expression efficace de l’insert et la balise.
2. Culture et Transfection des cellules
Remarque : Pour la transfection des vecteurs BiFC, il est important d’atteindre une grande efficacité et une transfection relativement homogène. Les vecteurs sera probablement compatibles avec n’importe quel réactif de transfection standard, et les conditions de transfection doivent être optimisées en conséquence. Pour effectuer la spectrométrie de masse, nous culture habituellement des cellules à l’intérieur des plats de 10 cm, bien que cela peut aussi être proportionnellement réduit à petits plats ou plaques pour des expériences qui nécessitent moins de matériel.
- FBS et pénicilline/streptomycine (1/100), les cellules6 HEK293T semences 1,0 × 10 en 10 cm plat avec 10 mL de milieu DMEM, avec 10 %.
- Diluer 2,5 µg de chaque vecteur BiFC dans 500 µL de tampon de transfection (voir Table des matières) dans un tube de microtubes de 1,5 mL.
- Ajouter 10 µL de réactif de transfection (voir Table des matières).
- Mélange de Vortex pendant 10 s, puis brièvement centrifugeuse. Incuber pendant 10 min à température ambiante.
- Ajouter le mélange de transfection d’ADN à la plaque, goutte à goutte. Incuber les cellules pour une durée suffisante pour les protéines de fusion BiFC interagir et Vénus pliage et maturation fluorophore, généralement ~ 8 à 24 heures.
Remarque : L’excitation de pic pour Vénus est de 515 nm et son émission de crête est 528 nm, même si cela est facilement lus à l’aide d’un microscope à fluorescence standard mis en place pour visualiser la fluorescence GFP.
3. préparation des échantillons
-
Récolte des lysats
- Ayant précédé le prélèvement de lysat, préparer le tampon de lyse cellulaire [50 mM Tris-HCl (pH 7,4), 150 mM NaCl, 1 mM EDTA, 1 % (v/v) de détergent non ionique (voir Table des matières)]. Conserver à 4 ° C.
- Immédiatement avant leur récolte, Supplément 10 mL de tampon de lyse cellulaire avec inhibiteur de protéase et inhibiteur de la phosphatase (voir Table des matières). Garder le tampon de lyse cellulaire complétée sur la glace.
- Laver les cellules deux fois dans du PBS glacée. Aspirer le PBS et ajouter 1 mL de glacee supplémenté tampon de lyse cellulaire. Placer le plat sur la glace, assurant que la mémoire tampon est réparti sur toute la surface.
- Incuber sur glace pendant environ 5 min, puis utilisez un grattoir de cellules (voir Table des matières) pour gratter les cellules et transférer dans un tube de microcentrifuge préalablement réfrigérées 1,5 mL.
- Enlever les débris cellulaires en centrifugeant la collecte lysat à 18 000 x g pendant 5 min à 4 ° C et le transfert autorisé surnageant dans des tubes de microcentrifuge fraîches.
Remarque : À ce stade le lysat peut être utilisé immédiatement, ou conservé à-80 ° C. Il est également recommandé de garder une partie aliquote du brut lysat afin que l’efficacité de transfection et la purification d’affinité peut être validée.
-
Purification d’affinité
Remarque : L’étape d’isolement BiCAP est effectuée à l’aide de la GFP nanobody conjugué à l’agarose perles (voir Table des matières).- Préparer les perles d’agarose en lavant un volume approprié (20 µL par exemple) + excédent 10 µL dans 1 mL de PBS. Centrifuger les perles à 300 x g et éliminer le surnageant.
- Ajouter 20 µL de chaque échantillon lysat.
- Incuber les échantillons pendant 2 h à 4 ° C, avec rotation de bout en bout.
Remarque : en tant qu’à ce stade les échantillons peuvent être préparés pour SDS-PAGE et éponger occidental ou analyse par spectrométrie de masse.
-
Préparation d’éluant BiCAP pour éponger occidental.
- Centrifuger les perles à 300 x g et laver trois fois dans le tampon de lyse cellulaire.
- Remettre en suspension les perles lavées dans 50 µL de tampon échantillon convenablement dilué (voir Table des matières) et chauffer les échantillons à 95 ° C pendant 2-3 min.
Remarque : Les échantillons préparés de cette manière peuvent être stockés à-20 ° C pendant plusieurs mois. - Effectuer le SDS-PAGE et western blot11 pour le tag V1 et V2 de balises (voir Table des matières), ainsi que les autres protéines d’intérêt.
-
Préparation d’éluant BiCAP pour la spectrométrie de masse.
Remarque : Pour l’analyse par spectrométrie de masse (LFQ) exempte d’étiquette quantitative, il est conseillé de préparer les échantillons au moins quatre pour s’assurer une puissance statistique robuste.- Centrifuger les perles à 300 x g et lavage six fois dans le tampon de lyse cellulaire sans détergent. Cela est nécessaire pour retirer l’excès de protéines et également le détergent qui pourraient interférer avec l’analyse par spectrométrie de masse. Passez à l’étape suivante immédiatement, ou stocker les perles à-80 ° C.
- Trypsinize perles dans 60 µL tampon 1 [urée 2 M, 50 mM Tris-HCl (pH 7,5), la trypsine 5 µg/mL]. Laisser les billes à digérer pendant 30 min à 27 ° C dans un thermomixer secouant à 800 tr/min.
- Brièvement centrifuger les perles, puis recueillir le surnageant et le transfert aux tubes de microcentrifuge (voir Table des matières).
- Laver les billes à 25 µL tampon 2 [2 M urée, 50 mM Tris-HCl (pH 7,5), 1 mM dithiothréitol], afin de réduire les protéines liées.
- Centraliser les perles et le surnageant dans un microcentrifuge tube. Laisser la digestion se produire du jour au lendemain à la température ambiante.
- Alkylat les échantillons en ajoutant 20 µL d’iodoacétamide (5 mg/mL dans l’eau ultrapure) pour chaque échantillon et incuber dans l’obscurité pendant 30 min.
- Inhibent la digestion en traitant chaque échantillon avec l’acide trifluoroacétique 1 µL (TFA). Cette étape sera également acidifier les échantillons en vue de la phase de basculement.
- Construct C18 phase conseils par empilage à 6 couches d’extraction en phase solide 1 mm C18 (octadécyl) disques de membrane (voir Table des matières) dans un embout de micropipette 200 µL. Préparer une astuce simple pour chaque échantillon.
- Mouiller les extrémités de la scène avec du méthanol et équilibrer avec 50 µL 0,1 % (v/v) d’acide trifluoroacétique (TFA), 80 % (v/v) d’acétonitrile.
- Lavez les pointes avec 50 µL 0,1 % (v/v) TFA.
- Chargez les peptides acidifiés sur les conseils de la scène et éluer ensuite à l’aide de 0,1 % (v/v) TFA, 80 % (v/v) d’acétonitrile dans deux étapes.
- Évaporer les échantillons à l’aide d’une pompe à vide.
- Le cas échéant, stocker des peptides séchées à-80 ° C.
4. microanalyse.
- Remettre en suspension les échantillons dans 15 µL d’acide formique à 5 %, 2 % d’acétonitrile (dans l’eau ultrapure).
- Soigneusement charger 6 µL sur une plaque de la LC et les placer dans un système de CLHP nanoLC (voir Table des matières).
- Emballer un 20 cm, la colonne de diamètre intérieur de 75 µM avec 1,9 µm C18 phase stationnaire des particules (voir la Table des matières). Charger 5 peptide µL sur chaque colonne.
- Éluer les peptides utilisant un gradient linéaire d’acétonitrile à 250 nL/min plus de 140 min et introduire par SPECTROMETRIE dans un spectromètre de masse hybride linéaire piège quadripolaire (LTQ) couplé au système de CLHP nanoLC.
- Collecter les données de MS en tandem pour ions les plus abondants de top 10 par balayage sur un gradient de 140 minutes temps. Randomiser l’ordre de collecte de données et échange avec BSA circulent entre chaque échantillon à minimiser le biais temporel.
5. analyse
- Traiter des données brutes de MS en utilisant le paramètre par défaut dans MaxQuant version du logiciel 1.2.7.4 et d’analyser les MaxQuant sortie en utilisant une version modifiée du flux d’analyse statistique de Persée dans l’environnement de logiciel R3.
NOTE : Le flux de travail de l’analyse statistique de ce point est résumée dans la Figure 2. Brièvement, intensités LFQ des protéines identifiées à l’aide de MaxQuant sont transformées et filtrées suivies de normalisation et d’imputation. Les protéines qui interagissent de paires dimères sont identifiés par rapport à un contrôle de Vénus, d’exclure les liants de fond non spécifique, avec des étudiants test t et Benjamini-Hochberg correction pour les comparaisons multiples. Qualité des données est confirmée par la comparaison des histogrammes individuels, régression multiple et hiérarchique.

Figure 2 : schéma du flux de l’analyse statistique. Diagramme de flux d’analyses statistiques pipeline utilisé pour analyser les intensités LFQ des protéines identifiées à partir des données de spectrométrie de masse brute transformées à l’aide de MaxQuant. Vert de boîtes : filtrage, boîtes bleues : boîtes de transformation/normaliser/graduation, bruns : boîtes de jaune, contrôle de la qualité des données : boîtes analyse, gris semiquantitative exclusion/comparatif : analyse statistique. Ce chiffre est republié fromCroucher Al3 reproduit avec la permission de l’AAAS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Résultats
Suite à l’utilisation du clonage de recombinaison pour générer de V1 et V2 tag des gènes d’intérêt avec les plasmides de pDEST BiFC, co transfection des deux plasmides contenant une paire d’interaction des protéines se traduira par la génération d’un signal fluorescent Venus après environ 8 à 24 heures. En l’absence d’un signal positif, qu'il est possible que l’interaction de la protéine ne peut-être pas se produire grâce au choix d’une lignée cellulaire, un...
Discussion
BiCAP est une méthode puissante pour isoler les dimères de protéine spécifique tout en excluant les composants individuels et leurs concurrents de partenaires de liaison3. BiCAP repose sur l’adaptation d’un dosage de complémentation protéique de fluorescence appelé BiFC6. Les méthodes existantes, y compris les essais de ligature BiFC et de proximité, ont été largement utilisés pour visualiser et quantifier les interactions de protéine dans des cellules viva...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer
Remerciements
Entiereté est un camarade de NSW Institut du Cancer et D.N.S était auparavant un Cancer Institute NSW Fellow. Les résultats de la recherche présentées dans ce manuscrit ont été financés par le Cancer Institute NSW (13/RSF/1-02 et 09/CDF/2-39), NHMRC (projet Grant GNT1052963), Science Foundation Ireland (11/GSS/B2157), NSW Office of Science et recherche médicale, les famille Bourse et Mostyn Family Foundation. J.F.H. et R.S. ont été destinataires d’une sentence Postgraduate australien.
matériels
| Name | Company | Catalog Number | Comments |
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid - Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) - 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
Références
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon