A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير الخلايا الحية لفصل الكروموسومات أثناء الانقسام
In This Article
Summary
ويصف هذا البروتوكول طريقة سهلة ومريحة التسمية ووضع تصور للكروموزومات الحية في الخلايا الانقسامية باستخدام تسمية 2.0 باكمام Histone2B-التجارة والنقل ونظام الفحص المجهري [كنفوكل] قرص غزل.
Abstract
الكروموسومات يجب موثوق بها وموحدة عزلهم في خلايا ابنه أثناء انقسام الخلية الانقسامية. ويسيطر الإخلاص لفصل الكروموسومات الآليات المتعددة التي تشمل تفتيش الجمعية المغزل (SAC). الكيس هو جزء من نظام التغذية المرتدة المعقدة التي المسؤولة عن منع تقدم الخلية عن طريق الانقسام ما لم تعلق جميع كينيتوتشوريس الصبغية على مغزل microtubules. الصبغية متخلفة وكروموسوم الشاذ العزل مؤشرا من نقاط التفتيش لمراقبة دورة الخلية المفككة، ويمكن استخدامها لقياس استقرار الجينوم تقسيم الخلايا. يمكن أن يؤدي إلغاء الضوابط التنظيمية للكيس في تحول الخلية العادية إلى خلية خبيثة من خلال تراكم الأخطاء أثناء فصل الكروموسومات. تنفيذ الكيس وتشكيل kinetochore معقدة محكم وينظم التفاعلات بين مؤنزم والفوسفاتيز مثل 2A "الفوسفاتيز البروتين" (PP2A). ويصف هذا البروتوكول تصوير الخلية الحية المتخلفة الكروموسومات في الخلايا الليفية الجنينية الماوس المعزولة من الفئران التي كانت بالضربة قاضية فرعية تنظيمية PP2A-B56γ. هذا الأسلوب ويتغلب على أوجه القصور في دورة الخلية تحكم التصوير تقنيات أخرى مثل التدفق الخلوي أو إيمونوسيتوتشيميستري التي لا توفر سوى لقطة مركز سيتوكينيسيس الخلية، بدلاً من تصور الزمانية المكانية دينامية من الكروموسومات وخلال الانقسام.
Introduction
في بروتوكول التالية، ويصف لنا طريقة ملائمة لتصور فصل الكروموسومات والانقسامية التقدم خلال دورة الخلية في الخلايا الليفية الجنينية الماوس استخدام هيستون 2B-التجارة والنقل، ووسم باكمام 2.0 وتصوير الخلايا الحية.
رصد الفصل كروموسوم نقاط التفتيش لمراقبة دورة الخلية وتلعب دوراً هاما في الحفاظ على سلامة الوراثية من الخلية2،،من 13. تراكم الكروموسومات سوء منفصلة يمكن أن تؤدي إلى انيوبلويدي، ومن السمات مميزة ل الأورام الأكثر صلابة 4. ومن ثم، يمكن استخدام الكشف المتخلفة الكروموسومات كأسلوب لدراسة كروموسومية عدم الاستقرار.
فلوريسسينتلي المسمى البروتينات يمكن استخدامها لتصور العزل كروموسوم يعيش وصبغية متخلفة لكن توليد مشري معلم أو البروتين بروتينات فلورية خضراء H2B معلم يتطلب معرفة كبيرة بالجينات التسليم والبيولوجيا الجزيئية 5. هنا يصف لنا استخدام كاشف سلليت Histone2B-التجارة والنقل باكمام 2.0، يشار إلى ريجنت CL-غبطة، توخياً للبساطة. هذا الكاشف يمكن استخدامها فورا وهكذا يزيل المخاوف من ناقلات جودة وسلامة. وبالإضافة إلى ذلك، لا يتطلب هذا الكاشف استخدام العلاجات يمكن أن تكون ضارة أو الدهون وصبغ-تحميل المواد الكيميائية. خلافا لتسميات الفلورسنت التقليدية، البقع ريجنت CL-غبطة مستقلة عن وظيفة (أي.، غشاء المحتملة). يمكن ببساطة إضافة إلى الخلايا ريجنت CL-غبطة والمحتضنة بين عشية وضحاها للتعبير البروتين. ريجنت CL-غبطة لا النسخ المتماثل في خلايا الثدييات، ويمكن استخدامها في إعدادات المختبر 1 (BSL) مستوى السلامة الأحيائية. أيضا، يمكن الكشف عن هذه تعداء عابرة بعد الحضانة بين عشية وضحاها ليصل إلى 5 أيام، ما يكفي من الوقت القيام بالتحاليل الخلوية الأكثر دينامية.
وبدلاً من ذلك، يمكن دراسة التشوهات الصبغية بتقنيات مختلفة مثل التدفق الخلوي أو إيمونوهيستوتشيميستري أو الأسفار في الموقع التهجين (الأسماك) 6. يمكن استخدام التدفق الخلوي لدراسة انيوبلويدي، التي يمكن أن تقاس على أساس محتوى الحمض النووي والمرحلة من الخلايا في دورة الخلية. على الرغم من أن يمكن استخدام التدفق الخلوي لقياس انيوبلويدي، لا تقديم معلومات عن العزل سوء الكروموسومات. استخدام تقنيات الأسماك و immunohistochemistry المسابير الفلورسنت لربط الحمض النووي أو الكروموسومات. في حين أن هذه التقنيات توفر لمحة سريعة عن حالة سكان خلايا، أنها لا تسمح خلية يعيش التصوير مما يؤدي إلى ضياع أي معلومات تم الحصول عليها من خلال التصور الزمانية المكانية سيتوكينيسيس في خلايا معينة اتبعت على مدى فترة من الزمن.
وكان استخدام هذا البروتوكول لدراسة الكروموسومات متخلفة أو العزل سوء كروموسومية في نوكودازولي معاملة الماوس الليفية الجنينية (ميفس) المعزولة من PP2A-B56γ-الفئران. بالإضافة إلى أعلاه التطبيق، يوفر هذا البروتوكول أداة بسيطة التسمية ووضع تصور للعزل كروموسومية في مختلف أنواع الخلايا التي يمكن استخدامها لدراسة تنظيم دورة الخلية أو عدم استقرار الكروموسومات في الخلايا السرطانية. وبالإضافة إلى ذلك، يمكن أيضا استخدامه لدراسة كروموسومية عدم الاستقرار الناجم عن العلاج بالعقاقير المختلفة أو لدراسة آثار ضرب الجينات أدى إلى فصل سوء الصبغية.
Protocol
أجريت جميع التجارب التي أجريت في هذه الدراسات وفقا للبروتوكولات التي وافقت عليها لجنة رعاية الحيوان المؤسسية واستخدام مرفق بحوث الغذاء والدواء (FDA).
1-العزلة وثقافة الليفية الجنينية الماوس (ميفس)
- عزل الماوس الليفية الجنينية (ميفس) من سلالة PP2A-B56γ-ماوس ونوع البرية ليتيرماتيس عن طريق بروتوكول قياسي 7،،من89.
- اكسباندميفس للممرات 3، تجميد وتخزين حتى حاجة لتجارب 8.
2-تثقيف Mefs في الزجاج غطاء غرف 2-جيدا للعيش التصوير
- إعداد 500 مل وسائط النمو MEF تتضمن "دولبيكو تعديل النسر المتوسطة" (DMEM/F12) مع 10% مصل بقرى الجنين (FBS) ولام الجلوتامين (200 ملم) والمضادات الحيوية البنسلين X/ستربتوميسين 1 1 × الأحماض الأمينية غير الأساسية (نيا) في زجاجة 500 مل وسائط الإعلام.
- ذوبان الجليد القنينات المجمدة ميفس من نوع البرية والفئران-PP2A-B56γ في مرور 3 في حمام مياه دافئة مسبقاً عند 37 درجة مئوية.
- نقل MEFs المذابة إلى أنابيب 15 مل وإضافة dropwise 20 مل من DMEM/F12 وسائل الإعلام ببطء إلى أنابيب 15 مل باستخدام ماصة 10 مل.
- نقل MEFs جنبا إلى جنب مع 20 مل وسائط النمو DMEM/F12 في قوارير T75 وتوسيعها حتى يتم روافد 70% من الخلايا. ويقدر كونفلوينسي باستخدام مجهر معكوس 4 x أو 10 x التكبير.
- أسبيراتي المتوسطة النمو مراعي زجاج باستخدام "الماصة؛" يعلق على نظام فراغ في غطاء محرك السيارة وأضف 3 مل من 0.25% التربسين/يدتا واحتضان في 37 درجة مئوية للحد الأدنى 5 إضافة 3 مل من DMEM/F12 النمو المتوسط لوقف رد الفعل.
- الطرد المركزي الخلايا في السرعة المنخفضة (300 x ز) لمدة 5 دقائق في درجة حرارة الغرفة. بعناية إزالة المادة طافية وإعادة تعليق بيليه الخلية في 1 مل من DMEM/F12 النمو المتوسطة استعد مسبقاً عند 37 درجة مئوية في حمام مائي.
- تعداد الخلايا باستخدام الأسلوب تريبان الأزرق الاستبعاد أو الخلية الملائمة الأخرى عد الأسلوب 8.
- البذور تقريبا من 20,000 MEFs/بئر في زجاج غطاء غرف 2-جيدا. إضافة 200 ميليلتر/بئر DMEM/F12 النمو المتوسطة والسماح بإرفاق التي تفرخ منها بين عشية وضحاها في 37 درجة مئوية و 5% CO2في الخلايا.
3-تزامن
- مزامنة MEFs في مرحلة G0/G1 بحضانة الخلايا في وسائط النمو DMEM/F12 يحتوي على 0.1% FBS ح 24، للحصول على الحد أقصى لعدد الخلايا في مرحلة G0/G1.
ملاحظة: على الرغم من أن المجاعة المصل استخدمت كأسلوب للتفضيل، يمكن استخدام مختلف الأساليب الأخرى حسب المرحلة الانقسامية التي تلزم خلايا أن يكون اعتقل 10.
4-وضع العلامات
- إعداد 1.5 ملغ/مل الحل الأسهم من نوكودازولي في [دمس]. الاعتقالات نوكودازولي الخلايا في المرحلة G2/M بتثبيط microtubule تشكيل 10.
- ثلاثة أيام بعد المزامنة، إضافة 200 ميليلتر متوسط النمو (مع السفح 10 ٪)، 200 نانوغرام/مل نوكودازولي وغبطة CL ريجنت (هيستون 2B-التجارة والنقل باكمام 2.0).
- حساب ريجنت CL-غبطة الجسيمات لكل خلية (النقرة) المراد إضافتها إلى الخلايا كما يلي:
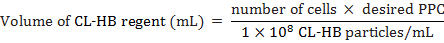
حيث عدد الخلايا يقدر العدد الإجمالي للخلايا في وقت وضع العلامات، قدرة شرائية هو عدد "الجزيئات في الخلية"، و 1 × 108 هو عدد الجسيمات الواحد مل الكاشف. على سبيل المثال، لتسمية 20,000 الخلايا مع قدرة شرائية 30
ملاحظة: ريجنت CL-غبطة يعمل جيدا مع معظم أنواع الخلايا بين 10 و 50 من قدرة شرائية. ومع ذلك، عملت 30 قدرة شرائية أفضل لهذه الدراسة. - احتضان MEFs ح 18 شركة 37 درجة مئوية و 5%2.
ملاحظة: في التجربة الحالية، حدث تصور الكروموسومات في الخلايا الانقسامية الهروب من الحاجز الجمعية المغزل ح 18 بعد اعتقال خلية دورة مع نوكودازولي.
5-التصور المتخلفة الكروموسومات
- تصور الماوس الليفية الجنينية (ميفس) باستخدام نظام مجهر [كنفوكل] قرص غزل مزودة دائرة البيئة وغمر نفط، عدسة الهدف x 63.
- استخدام الإثارة الطول الموجي 488 نانومتر والانبعاثات الطول الموجي 450 نانومتر للحصول على الصور قناة التجارة والنقل.
- استخدام قرص نظام غزل مجهر [كنفوكل] مع القدرة على مراحل المسح المزودة بمحركات، إدراج Z-بيزو، أعلى مرحلة الحضانة والانتعاش fluorescence مباشرة بعد تبييض الصورة لهذا الأسلوب.
- يوم واحد قبل التصوير، بدوره على السلطة الدائرة البيئية والاحماء قاعة كاملة عند 37 درجة مئوية بين عشية وضحاها.
- تشغيل الطاقة الاحتياطية المجهر، الكاميرا، وحدة القرص الغزل، إضاءة، ليزر الأرجون، الكمبيوتر والمرحلة يجهز.
- السماح للنظام بالحارة ل 3 دقيقة؛ بدء تشغيل ليزر الأرجون بتشغيل مفتاح الإشعال. تبديل مفتاح تبديل لليزر الأرجون من وضع "الاستعداد" الليزر "تشغيل".
- إطلاق برنامج اقتناء وتجهيز البيانات.
- بدء وحدة تحكم2 CO للحاضنة المرحلة الأعلى وتعيين تركيز CO2 في 5%. يجب أن يتم ذلك قبل بدء التصوير.
- إزالة الزجاج غطاء غرف من الحاضنة ومكانه على الساحة للتصور. تصور الخلايا عن طريق نفط غمر 63 x هدف عدسة (NA1.4).
- عرض من خلال عدسات العين والتركيز الصورة وتحديد خلية في مرحلة انهيار (نيبد) المغلف النووية.
- بدء الليزر المناسبة (488 نانومتر الأرجون ليزر، تصور Histone2B-التجارة والنقل).
- فتح نافذة التحكم الحصول على وتعيين وقت التعرض لقناة التجارة والنقل. تحديد خلية موجودة في نيبد.
- يدوياً تحديد الأعلى الخلية الهدف وأسفل المستوى البؤري، وأدخل من xyz الضوئية تمزيقها الإعدادات.
- الاحتفال به لمدة 20 دقيقة؛ إذا لم تشرع الخلية عن طريق انقسام الخلية، التوقف عن اقتناء الصورة بعد 20 دقيقة والانتقال إلى الخلية التالية في نيبد.
- ح 1 تقريبا كل خلية يلزم صورة متخلفة عن الكروموسومات خلال الانقسام في PP2A-B56γ-الخلايا التي هرب من الكيس. للحصول على بيانات لأحد الأفلام، التقاط صور كل 3 دقائق.
ملاحظة: الخلايا نوع البرية القبض وعدم التقدم في الماضي نيبد عندما تعامل مع نوكودازولي. - حفظ الصور بتنسيق ملف زفي لمزيد من التحليل.
6-معالجة وتحليل الصور
ملاحظة: إجراء تحليل لاستخدام أي برنامج متاح مثل أكسيوفيسيون الإصدار 4.8.2 أو إيماريس الإصدار 8.2 ومعالجة الصور ثلاثية الأبعاد. واستخدمت لهذه الدراسة ImageJ البرمجيات.
- فتح تسلسل الصور. إذا كانت الصور بالفعل في شكل مكدس، تابع إلى الخطوة التالية. إذا لم يكن كذلك، دمج جميع الصور ذات الصلة باستخدام مكدس 'الصورة > رصات > الصور إلى مكدس' في شريط القوائم.
- إجراء أي تعديلات حسب الاقتضاء للسطوع/التباين والمستويات.
- لإضافة طابع زمني للفيلم:
- انتقل إلى 'الصورة > رصات > التسمية...' في شريط القوائم.
- حدد الشكل المناسب وقيمة وقت البدء، والفاصل الزمني بين كل صورة.
- تحقق من مربع 'معاينة' وضبط إعدادات الموقع وتنسيق. اضغط 'موافق' لتطبيق الطابع الزمني.
- لإضافة شريط مقياس للفيلم:
- تعيين حجم إطار الصورة و 'تحليل >"ضبط مقياس"' في شريط القوائم.
- في الحقل 'المسافة بالبكسل'، أدخل عدد وحدات البكسل التي يعرف فيها المسافة، وأدخل في الحقل 'المسافة المعروفة باسم' المسافة. تعيين وحدة الصحيح لطول المسافة، مثلاً، في ميكرومتر. اضغط 'موافق' لتطبيق المقياس على المكدس.
- انتقل إلى 'تحليل > أدوات > حجم شريط...' لإضافة شريط مقياس. تعيين حجم الشريط 'عرض في ميكرومتر'، وضبط المتبقية تنسيق الخيارات حسب الاقتضاء. تحقق من مربع 'تسمية كل الشرائح' لإضافة شريط حجم مكدس كامل.
- معاينة الفيلم بالنقر على زر التشغيل الثلاثي في أسفل اليسار حافة إطار الصورة. ضبط معدل الإطار باستخدام 'الصورة > رصات > الرسوم المتحركة >"خيارات الرسوم المتحركة" في شريط القوائم.
- تصدير ملف الفيلم بواسطة تحديد 'ملف >"حفظ باسم"> أفي...'، وحدد معدل الإطار والضغط.
- اضغط 'موافق' لاختيار الحفظ الموقع واسم الملف. اضغط على 'حفظ' لحفظ ملف الفيلم.
النتائج
ميفس من نوع البرية والفئران--PP2A--B56γ المصنفة في زجاج غطاء دائرة 2-جيدا ويسمح بإرفاق. في اليوم الثاني، كانت متزامنة MEFs استخدام 0.1% FBS ح 24. في يوم 3، ميفس في وسائل الإعلام مع 200 نانوغرام/مل نوكودازولي و 30 "قدرة شرائية" CL-غبطة ريجينتويري المحتضنة ح 18 في 37درجة مئوية و 5% CO2....
Discussion
نقاط التفتيش لمراقبة دورة الخلية التي تضمن الفصل كروموسوم دقيق منع انيوبلويدي وخلية التحول 1،،من23. في هذه الدراسة، وجدنا أن المنظمة من PP2A-B56γ أدت إلى نقطة تفتيش الجمعية مغزل ضعف. تصوير الخلايا الحية سمح لنا بمراقبة العزل سوء الصبغية خلال ?...
Disclosures
الكتاب يعلن أن لديهم لا تضارب المصالح المالية.
Acknowledgements
ونود أن نشكر الدكتور كيوان قوة هونغ والدكتور بهاراتكومار جوشي على التعليقات القيمة التي تحسن المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
References
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved